表面活性剂强化油菜-微生物联合修复滴滴涕污染农田土壤研究
吕良禾,张鸿龄①,陈宗聪,孙家君,孙丽娜②,王晓旭
(1.沈阳大学污染环境的生态修复与资源化技术教育部重点实验室,辽宁 沈阳 110044;2.北京桑德环境工程有限公司,北京 100000)

表面活性剂强化油菜-微生物联合修复滴滴涕污染农田土壤研究
吕良禾1,张鸿龄1①,陈宗聪1,孙家君2,孙丽娜1②,王晓旭1
(1.沈阳大学污染环境的生态修复与资源化技术教育部重点实验室,辽宁 沈阳 110044;2.北京桑德环境工程有限公司,北京 100000)
为了提高设施农业滴滴涕(DDTs)污染土壤的修复效果,通过田间实验研究不同浓度的混合化学表面活性剂(SDBS-TW80)和生物表面活性剂鼠李糖脂(RL)对油菜和甲基营养型芽孢杆菌(Bacillusmethylotrophicus)联合去除设施农业土壤中DDTs的强化作用。结果表明,1个月后,单种油菜处理、接种降解菌和油菜-降解菌联合处理土壤中DDTs降解率分别为12.0%、38.2%和43.1%,显著高于对照处理。SDBS-TW80和RL均能不同程度地强化油菜-微生物对土壤中滴滴涕的去除效果。SDBS-TW80施加量为40 mg·kg-1时设施农业土壤中滴滴涕降解率最高(56.5%),RL施加量为5 mg·kg-1时降解率最高(65.7%),RL比SDBS-TW80更有利于提高DDTs污染土壤的生物修复效果。此外,当RL施加量为5 mg·kg-1时对于毒性较强的p,p′-DDE也具有较好的降解效果,降解率高达69.5%。结果证实利用表面活性剂强化油菜联合甲基营养型芽孢杆菌现场修复DDTs污染土壤是可行的。考虑到修复效率和毒害作用,实际应用中应优先选用5 mg·kg-1RL组合。
滴滴涕;表面活性剂;甲基营养型芽孢杆菌;油菜;污染农田土壤
滴滴涕(dichloro diphenyl trichloroethane,DDT)是首批受控的持久性有机污染物(persistent organic pollutants,POPs)之一[1]。是我国最早大面积使用的农药之一,尽管从20世纪80年代初实行农药登记制度以来,就已停止生产和使用DDT、氯丹和七氯等农药,但由于其持久性、半挥发性和难生物降解性等特点,在各地土壤中DDTs的检出率仍很高[2],造成的严重污染在短期内仍然难以消除[3-4]。
微生物修复DDTs有机污染土壤是目前研究最多、应用也最为广泛的一种生物修复方法[5-6]。但该方法也存在一些不利因素,如微生物对环境变化的响应比较强烈,环境条件的改变能极大影响微生物的修复效果;加入到修复现场中的微生物可能会与土著菌株竞争或难以适应环境从而导致现场作用结果与实验结果有较大出入。植物修复亦是治理土壤污染经济、有效的途径之一,因其具有成本低、无二次污染和适用于大面积场地修复等特点而备受关注。然而由于植物的生长周期较短,对气候的依赖性较强且土壤中DDTs类污染物的生物利用性低等问题,植物修复的效率相对较低[7]。针对上述问题,在利用植物进行污染土壤修复的同时,向土壤中接种具有高效降解能力的专性降解菌,可以明显提高DDTs的修复效果。同时,为解决DDTs极易被土壤固相吸附,从而导致生物利用率低的问题,常用表面活性剂增溶修复技术将DDTs从土壤颗粒上解吸附下来,增加DDTs的生物可利用性[8]。因此,采用化学强化植物-微生物联合修复可有效提高滴滴涕污染土壤修复效果。
笔者在前期实验[9]的基础上,选用混合表面活性剂〔m(十二烷基苯磺酸钠)∶m(吐温80)=2∶3〕和生物表面活性剂鼠李糖脂(RL),对前期研究筛选出的DDTs高效降解菌甲基营养型芽孢杆菌(Bacillusmethylotrophicus)及经济作物油菜(Brassicacampestris)进行强化。已有的研究大多在实验室进行[10],而田间应用表面活性剂强化植物-微生物修复的研究报道尚鲜见。由于设施农业污染现场自然条件的复杂性和土壤环境的异质性,结果与室内实验往往差异较大。因此,在实际污染农田中开展研究,可以使研究结果更贴近修复工程实际情况,有利于修复技术的推广示范。
1 材料与方法
1.1 设施农业实验区
农业实验区位于沈阳市沈北新区一处设施农业大棚内(42°05′02.62″ N,123°31′42.79″ E),经测定土壤类型为粉砂质黏土,黏粒、粉粒和砂粒的比例分别为26.11%、72.82%和1.07%,土壤基本理化性质:w(有机质)为54.37 g·kg-1,土壤容重1 220 kg·m-3,土壤含水率约60%,pH值7.17,阳离子交换量13.09 cmol·kg-1,w(p,p′-DDE)、w(p,p′-DDD)、w(o,p′-DDT)、w(p,p′-DDT)和w(DDTs)分别为13.19、3.37、4.04、29.85和50.45 μg·kg-1。
1.2 实验材料
生物表面活性剂选用鼠李糖脂(RL,纯度w约90%,购于湖州紫金生物科技有限公司),化学表面活性剂选用失水山梨醇单油酸酯聚氧乙烯醚(TW80,购于国药集团化学试剂有限公司)和十二烷基苯磺酸钠(SDBS,购于国药集团化学试剂有限公司)。p,p′-DDE,p,p′-DDD,o,p′-DDT,p,p′-DDT 标准样品(100 μg·mL-1,购于百灵威试剂公司)。供试植物为油菜(购于沈阳农业大学种子商店)。
1.3 实验菌株及菌株培养
高效降解菌为甲基营养型芽孢杆菌,由课题组从DDTs污染农田土壤中筛选、分离而来,分离方法参照FANG等[11]。实验前,将保存于4 ℃斜面的甲基营养型芽孢杆菌接种在LB培养基(Luria-Bertani培养基)上,待菌长满整个LB培养基表面后,将菌体刮下接种到无菌水中制成菌悬液,于 4 ℃条件下保存待用。取w=1%的菌悬液接入500 mL的LB培养基中,于160 r·min-1、30 ℃条件下培养,定期用血球计数板计数,待菌数(以CFU计)达109mL-1即可进行降解实验。
1.4 实验设计
共设置9种修复处理,实验设计详见表1,并设置空白对照,每个处理5次重复。
表1 实验设计
Table 1 The experiment design
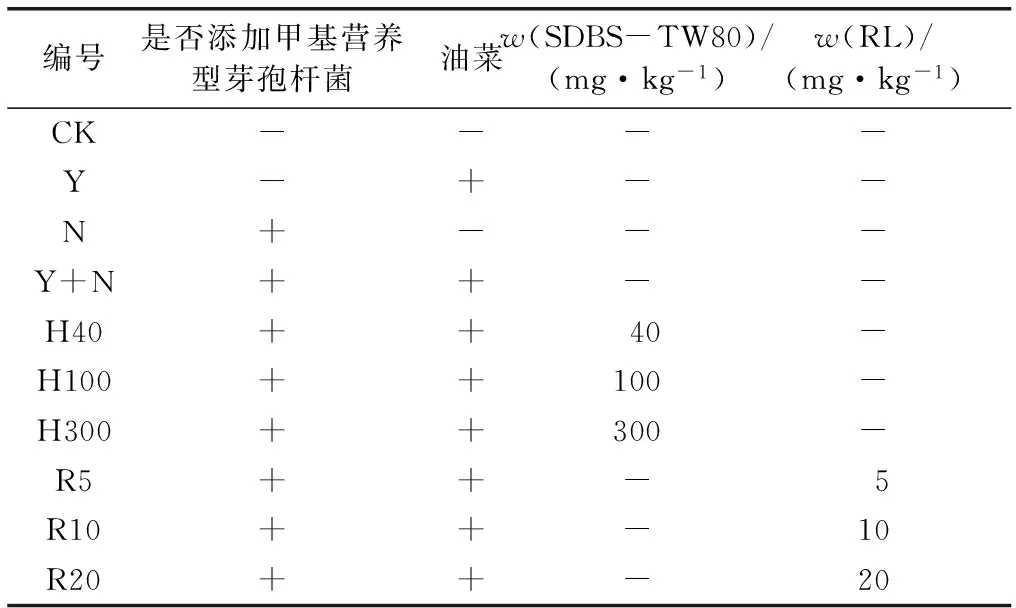
编号是否添加甲基营养型芽孢杆菌油菜w(SDBS-TW80)/(mg·kg-1)w(RL)/(mg·kg-1)CK----Y-+--N+---Y+N++--H40++40-H100++100-H300++300-R5++-5R10++-10R20++-20
CK为空白处理;Y为仅添加油菜处理;N为仅添加甲基营养型芽孢杆菌处理;H为混合表面活性剂加油菜加甲基营养型芽孢杆菌处理;R为生物表面活性剂加油菜加甲基营养型芽孢杆菌处理。+为添加处理;-为未添加处理。
将各个处理划分为1.0 m×1.0 m的修复单元,相邻修复单元间隔约1.0 m,将500 mL菌液和表面活性剂溶液用手动喷雾器均匀喷施于田间各土壤样方中,未接菌或表面活性剂的处理喷撒无菌水作对照,在0~40 cm深度范围内均匀混合,并保持样方含水率w约 60%。其中,接种的甲基营养型芽孢杆菌菌液浓度(以CFU计)为1.0×109mL-1,生物表面活性剂选用RL,化学表面活性剂在前期实验的基础上选用阴-非离子混合表面活性剂SDBS-TW80。种植适量油菜,定期浇水,于实验前1 d采用梅花取样法采集土壤样品,30 d后收割油菜地上部,并采用梅花取样法采集土壤样品,去除根茎、败叶、碎石等杂物,待土壤样品混匀、自然风干后,过0.3 mm孔径筛低温避光保存于密封袋中。
1.5 DDTs提取与测定
采用加速溶剂萃取法提取土壤中DDTs[12],将纤维滤膜放于萃取池底部,称取5.00 g 待测土壤样品与适量硅藻土均匀混合,置于萃取池中,而后用加速溶剂萃取仪(ASE30,美国Dionex公司)进行萃取。萃取条件:萃取剂为分析纯,V(正己烷)∶V(丙酮)=1∶1,预热平衡时间 5 min,静态萃取时间5 min,压力10 342.5 kPa,静态萃取温度 100 ℃,淋洗体积为萃取池体积的60%,100 s载气(高纯氮气)吹脱,2次静态萃取。收集萃取液并将其转移至鸡心瓶中,用旋转蒸发仪(RE-52AA,上海亚荣生化仪器有限公司)旋转蒸发至近干,2.0 mL正己烷定容后移至聚四氟乙烯分液漏斗中。
样品净化参照GB/T 14550—2003《土壤中六六六和滴滴涕测定的气相色谱法》[13],将 5.0 mL 浓硫酸加入分液漏斗中进行磺化,待静置至上下液面分层后,弃去下层废液,重复上述操作直至下层酸液无色。再取5.0 mLw=10%的NaCl 溶液进行洗脱,上述操作重复2次。最后,用无水硫酸钠对样品进行脱水处理,后旋转蒸发至近干,用1.0 mL 色谱纯正己烷定容并转移至气相小瓶中,待测。
DDTs测定采用气相色谱仪(CP-3800,美国Varian公司)检测,用色谱纯正己烷配制p,p′-DDE、p,p′-DDD、o,p′-DDT和p,p′-DDT标准样品,制作20、40、60、80和100 ng·g-15个浓度的标准曲线,DDT根据标准物质保留时间匹配确定,利用标准物质的峰高计算 DDT 含量。土壤和植物样品中DDT的加标回收率分别为89.2%~107.1% 和84.9%~110.6%。
土壤中DDTs降解率=1-修复后土壤中DDTs残留量/修复土壤中DDTs残留量。
1.6 数据处理
采用Origin 7.5和SPSS 12.5软件进行数据处理,采用单因素方差分析及多重比较(LSD)方法进行数据分析,差异显著水平α为0.05。
2 结果与讨论
2.1 油菜、高效降解菌对土壤中DDTs的降解效果
在田间实验中,自然条件下DDTs极难降解(图1),1个月后降解率仅为2.3%。单独种植油菜处理,土壤中DDTs降解率达12.0%,比对照显著提高。植物主要通过植物吸收、植物释放根系分泌物降解污染物及植物强化根际微生物降解污染物等途径对DDTs污染土壤进行修复。
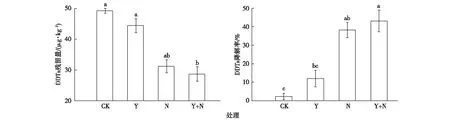
CK、Y、N和Y+N处理的释义见表1。同一幅图中直方柱上方英文小写字母不同表示不同处理间某指标差异显著(P<0.05)。
该研究中油菜植物体内未检测到DDTs,表明油菜并非以吸收途径降解设施土壤中DDTs,土壤中DDTs的损失可能是土壤中土著微生物参与降解DDTs的结果。也有报道指出,植物释放到根际区的有机分泌物和酶能有效降解农药及其他有机物[14]。一方面,根系释放的分泌物增加了土壤阳离子交换容量且竞争土壤中DDTs污染物的结合位点,使得结合于土壤的DDTs减少;另一方面,根际释放的分泌物具有表面活性剂作用,可降低DDTs的界面表面张力,增加其在土壤间隙水中的溶解度。但由于设施农业土壤的现实性和复杂性[15],单独使用油菜的降解效果并不显著。
GLICK等[16]研究指出,DDT降解菌在实验室纯培养条件下可以达到高效降解有机污染物的效果,但无法在实际应用中达到同样的效果。实验室中甲基营养型芽孢杆菌对DDTs的去除率高于60%。田间实验中,单独添加甲基营养型芽孢杆菌和油菜-甲基营养型芽孢杆菌的处理,菌株对土壤DDTs的去除率仅为38.2%和43.1%。这可能是由于设施农业土壤环境比较复杂,DDTs在土中的水溶性较低,导致生物可利用率较低,微生物在代谢DDTs时缺少碳源和营养物质,导致DDTs难以生物降解。
为了提高DDTs的降解率,选用表面活性剂强化油菜和甲基营养型芽孢杆菌的降解作用,以期达到较好的修复效果。
2.2 混合表面活性剂强化油菜-微生物降解土壤中DDTs的效果
2.2.1 对土壤中DDTs总量的影响
在田间实验中,不同施加量SDBS-TW80强化油菜-甲基营养型芽孢杆菌对农田土壤DDTs的降解情况见图2。当添加SDBS-TW80对植物-微生物进行强化后,DDTs降解率显著提升,在SDBS-TW80施加量为40 mg·kg-1时,降解率达最高(56.5%),提升效果显著。一方面,因为植物生长时,根系为微生物的繁殖提供了最佳场所。微生物的繁殖又增强了其对DDTs的降解,减轻了DDTs对植物的毒性,使植物有更加优越的生长空间,增强了植物根系旺盛的代谢活动,这样的植物-微生物联合体系能促进有机污染物的快速降解、矿化。另一方面,DDTs溶解度低,水溶性差,在土壤环境中极易吸附于土壤颗粒、土壤有机质上,表面活性剂可以增溶土壤中的DDTs,将DDTs从土壤中淋洗出来,并提高其生物可降解性,促进生物降解。
随着SDBS-TW80施加量的增加,DDTs降解率反呈降低趋势。当SDBS-TW80施加量为100和300 mg·kg-1时,土壤中DDTs降解率分别为52.0%和45.0%。原因可能是作为化学表面活性剂,高浓度SDBS-TW80具有一定毒性,随着SDBS-TW80施加量的升高,毒性亦增大,抑制了菌株的生长与降解活性。肖鹏飞等[17]研究TW60和SDS强化白腐真菌降解DDTs的结果中也出现了类似情况。
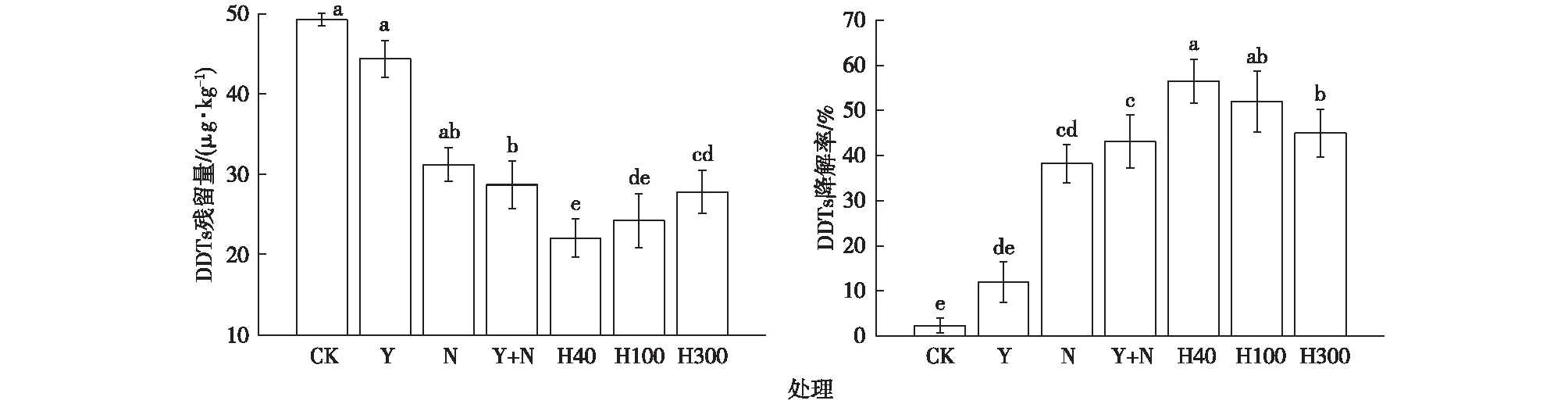
CK、Y、N、Y+N、H40、H100和H300处理的释义见表1。同一幅图中直方柱上方英文小写字母不同表示不同处理间某指标差异显著(P<0.05)。
2.2.2 对土壤中DDTs不同衍生物的影响
不同施加量鼠李糖脂强化油菜-降解菌去除设施土壤中p,p′-DDE、p,p′-DDD、o,p′-DDT和p,p′-DDT 的效果如图3所示。自然状态下,土壤中DDT的4种衍生物降解率极低。在添加表面活性剂后,各个处理p,p′-DDE、p,p′-DDD、o,p′-DDT和p,p′-DDT降解率显著升高。其中,当SDBS-TW80施加量为40 mg·kg-1时,p,p′-DDE、o,p′-DDT和p,p′-DDT降解率达到最高,分别为53.4%、56.8%和56.0%。而后,随着SDBS-TW80施加量的增高而降低。当SDBS-TW80施加量为300 mg·kg-1时,土壤中p,p′-DDE、p,p′-DDT、p,p′-DDD和o,p′-DDT 降解率均呈下降趋势,与单独施加降解菌甲基营养型芽孢杆菌的效果相近,表明此时表面活性剂对植物-微生物联合修复的强化效果已不明显,可能是由于SDBS-TW80具有一定毒性,其浓度升高,毒性增大,导致菌株的生长和降解活性受到抑制,使降解率不增反减。因此,当SDBS-TW80施加量为40 mg·kg-1时其对油菜-甲基营养型芽孢杆菌的强化效果更为明显。
p,p′-DDD降解率在表面活性剂浓度为100 mg·kg-1时更高,可能是由于p,p′-DDD的产生有2种途径:其一,可以在好氧条件下由p,p′-DDT降解转化为p,p′-DDE,再由p,p′-DDE转化为p,p′-DDD;其二,可以在厌氧条件下直接通过土壤中微生物降解转化产生p,p′-DDD,所以p,p′-DDD来源相对复杂[18]。当SDBS-TW80施加量为100 mg·kg-1时,毒害作用增大,抑制甲基营养型芽孢杆菌的生长,导致其厌氧反应增多,p,p′-DDD降解率也随之提高,这与赵炳梓等[19]的研究结果相符。
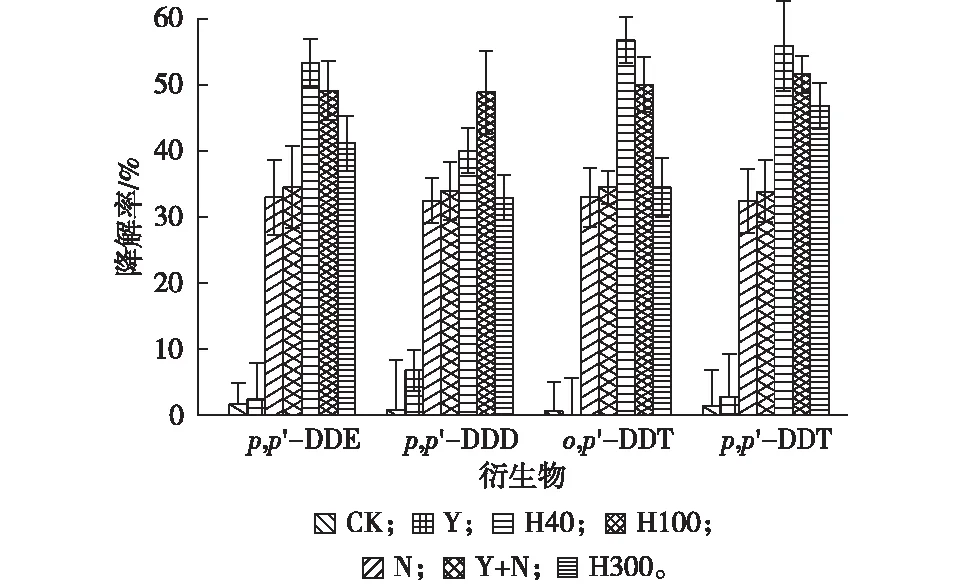
CK、Y、N、Y+N、H40、H100和H300处理的释义见表1。
2.3 生物表面活性剂强化油菜-微生物降解农田土壤中DDTs的效果
2.3.1 对土壤中DDTs总量的影响

CK、Y、N、Y+N、R5、R10和R20处理的释义见表1。同一幅图中直方柱上方英文小写字母不同表示不同处理间某指标差异显著(P<0.05)。
2.3.2 对土壤中DDTs各衍生物的影响
不同施加量RL强化油菜-降解菌去除设施土壤中p,p′-DDE、p,p′-DDD、o,p′-DDT、p,p′-DDT的效果如图5所示。对照组中,各衍生物自然降解率均不高于2%,单独种植植物或施用微生物降解菌对DDTs进行修复,DDT各衍生物降解率不显著。施加了RL强化后,各处理对土壤中不同衍生物DDT的降解率显著增加,p,p′-DDE、p,p′-DDD、o,p′-DDT和p,p′-DDT降解率较对照衍生物别提高了67.9%、49.9%、40.2%和62.7%。表明RL的增溶作用可以有效提升滴滴涕在水相中的表观溶解度,增大甲基营养型芽孢杆菌的亲水性、促进油菜的菌根效应。
添加RL的处理中,DDTs各衍生物的降解率随RL浓度的变化而呈现出一定的规律,其降解率从高到低依次为p,p′-DDE、p,p′-DDT、p,p′-DDD和o,p′-DDT。p,p′-DDE、p,p′-DDD、o,p′-DDT和p,p′-DDT均可对人体产生毒害作用,且毒性最强的是环境激素类物质p,p′-DDE[23],因此p,p′-DDE的去除是DDTs修复工程中的一项重要指标。不同浓度的RL处理中p,p′-DDE的降解率均高于p,p′-DDD、o,p′-DDT和p,p′-DDT,表明RL强化植物-微生物修复对毒性最强的p,p′-DDE修复效果较好。
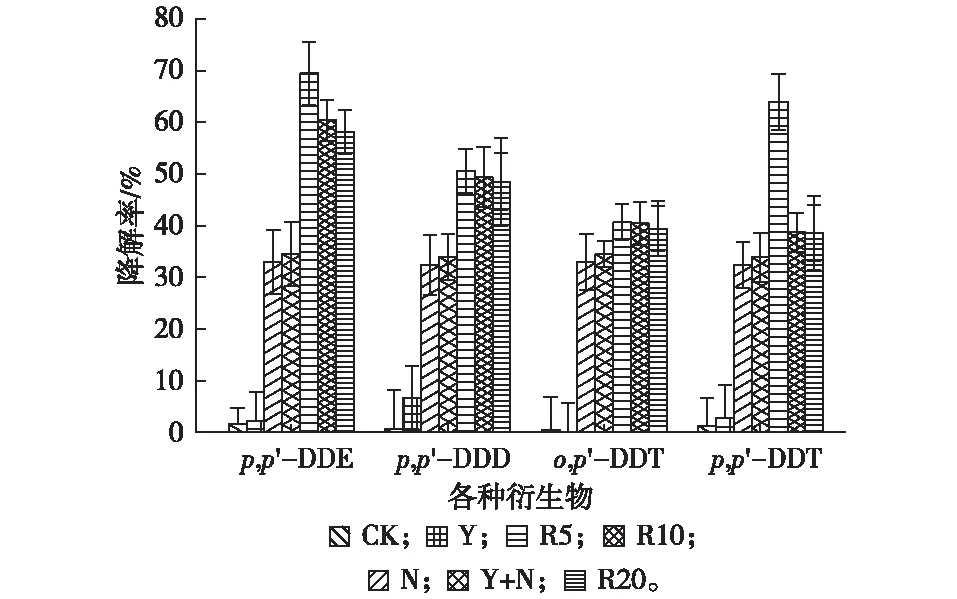
CK、Y、N、Y+N、R5、R10和R20处理的释义见表1。直方柱上方英文小写字母不同表示不同处理间某指标差异显著(P<0.05)。
3 结论
(1)在BS-TW80施加量为40 mg·kg-1时,SDBS-TW80强化油菜-降解菌联合去除设施农田土壤中DDTs效果最好,DDTs降解率高达56.5%。而后,随着SDBS-TW80施加量的增加呈下降趋势。
(2)在RL施加量为5 mg·kg-1时,其对油菜联合甲基营养型芽孢杆菌降解DDTs增溶作用最强,DDTs降解率高达65.7%,而后,降解率随RL施加量的增高而降低,表现为增溶作用随RL施加量的增高而降低。
(3)添加不同浓度SDBS-TW80和RL均能不同程度地促进DDTs各衍生物p,p′-DDE,p,p′-DDD、o,p′-DDT 和p,p′-DDT的降解,且降解率随着SDBS-TW80和RL浓度的升高出现降低现象,BS-TW80和RL施加量分别为40和5 mg·kg-1时对毒性最强的p,p′-DDE降解效果较好。
(4)在表面活性剂强化油菜-微生物的修复中,SDBS-TW80降解效果在施加量为40 mg·kg-1时达到最高,为56.5%;RL在施加量为5 mg·kg-1时达到最高,为65.7%,RL的降解效果明显优于SDBS-TW80。化学表面活性剂SDBS-TW80对自然环境的毒性远高于生物表面活性剂RL,而且易导致二次污染。因此,在设施农业土壤修复中,使用生物表面活性剂RL强化植物-微生物对DDTs进行修复较为合适。
[1] 吴鹏.机械化学法处理高浓度滴滴涕污染土壤的初步研究[D].天津:天津大学,2014.[WU Peng.Preliminary Study on Mechanochemical Treatment of Soil Heavily Contaminated With DDT[D].Tianjin:Tianjin University,2014.]
[2] HU W Y,LU Y L,WANG T Y,etal.Spatial Variability and Temporal Trends of HCH and DDT in Soils Around Beijing Guanting Reservoir,China[J].Environmental Geochemistry and Health,2010,32(5):441-449.
[3] SUDHARSHAN S,NAIDU R,MALLAVARAPU M,etal.DDT Remediation in Contaminated Soils:A Review of Recent Studies[J].Biodegradation,2012,23(6):851-863.
[4] 陈丽蓉,严志辉,陈小罗,等.农药DDT在土壤中迁移转化研究[J].科技创新导报,2011,32:123,125.[CHEN Li-rong,YAN Zhi-hui,CHEN Xiao-luo,etal.Pesticide DDT Migration Transformation in the Soil[J].Science and Technology Innovation Herald,2011,32:123,125.]
[5] LIMA T M S,PROCPIO L C,BRANDO F D,etal.Biodegradability of Bacterial Surfactants[J].Biodegradation,2011,22(3):585-592.
[6] 刘文斌.DDTs好氧降解菌株的筛选及其降解特性研究[D].大连:大连理工大学,2009.[LIU Wen-bin.Isolation,Identification and Characterization of a DDTs-Degrading Bacterium[D].Dalian:Dalian University of Technology,2009.]
[7] GURSKA J,WANG W X,KAREN E G,etal.Three Year Field Test of a Plant Growth Promoting Rhizobacteria Enhanced Phytoremediation System at a Land Farm for Treatment of Hydrocarbon Waste[J].Environmental Science & Technology,2009,43(12):4472-4479.
[8] 陈伟伟.表面活性剂对污染场地土壤中DDTs的增溶洗脱作用研究[D].南京:南京农业大学,2009.[CHEN Wei-wei.Solubilization and Washing of DDTs From Contaminated Site Soil With Surfactant[D].Nanjing:Nanjing Agricultural University,2009.]
[9] 李登宇.表面活性剂强化微生物修复DDT污染土壤研究[D].沈阳:沈阳大学,2016.[LI Deng-yu.Study on Enhancing Microbe Remediation of DDT Contaminated Soil by Surfactants[D].Shengyang:Shenyang University,2016.]
[10]肖鹏飞,秦必达,李玉文.非离子表面活性剂强化白腐菌及其粗酶液对有机氯农药的降解[J].应用与环境生物学报,2015,21(1):22-28.[XIAO Peng-fei,XIN Bi-da,LI Yu-wen.Effects of Nonionic Surfactants on Degradation of Organochlorine Pesticides by White Rot Fungus and Its Enzyme[J].Chinese Journal of Applied Environmental Biology,2015,21(1):22-28.]
[11]FANG H,DONG B,YAN H,etal.Characterization of a Bacterial Strain Capable of Degrading DDT Congeners and Its Use in Bioremediation of Contaminated Soil[J].Journal of Hazardous Materials,2010,184(1/2/3):281-289.
[12]张岩,张景发,陈艳梅,等.加速溶剂萃取-气相色谱法测定土壤中有机氯农药和多氯联苯[J].岩矿测试,2010,29(5):491-496.[ZHANG Yan,ZHANG Jing-fa,CHEN Yan-mei,etal.Determination of Organochlorine Pesticides and Polychlorinated Biphenyls in Soils by Gas Chromatography With Accelerated Solvent Extraction[J].Rock and Mineral Analysis,2010,29(5):491-496.]
[13]GB/T 14550—2003,土壤中六六六和滴滴涕测定的气相色谱法[S].[GB/T 14550-2003,Method of Gas Chromatographic for Determination of BHC and DDT in Soil[S].]
[14]安凤春,莫汉宏,郑明辉,等.DDT及其主要降解产物污染土壤的植物修复[J].环境化学,2003,22(1):19-25.[AN Feng-chun,MO Han-hong,ZHENG Ming-hui,etal.Phytoremediation of DDT and Its Main Degradation Product-Contaminated Soil Using Grass[J].Environmental Chemistry,2003,22(1):19-25.]
[15]朱白澍,梁涛.我国设施农业土壤障碍现状[J].磷肥与复合肥,2010,25(3):73-75.[ZHU Bai-shu,LIANG Tao.Status of Soil Obstacle of Facility Agriculture in China[J].Phosphate & Compound Fertilizer,2010,25(3):73-75.]
[16]GLICK B,WHATLEY S.The Effect ofo,p-DDD in the Chicken[J].Experientia,1966,22(3):179-180.
[17]肖鹏飞,李玉文,KONDO R.Tween 60和SDS强化白腐真菌修复DDT污染土壤[J].中国环境科学,2015,35(12):3737-3743.[XIAO Peng-fei,LI Yu-wen,KONDO R.Enhancement of Tween 60 and SDS for Bioremediation of DDT-Contaminated Soil by White Rot Fungus[J].China Environmental Science,2015,35(12):3737-3743.]
[18]LIANG Qi,LEI Mei,CHEN Tong-bin,etal.Application of Sewage Sludge and Intermittent Aeration Strategy to the Bioremediation of DDT- and HCH-Contaminated Soil[J].Journal of Environmental Sciences,2014,26(8):1673-1680.
[19]赵炳梓,张佳宝,周凌云,等.黄淮海地区典型农业土壤中六六六(HCH)和滴滴涕(DDT)的残留量研究Ⅰ:表层残留量及其异构体组成[J].土壤学报,2005,42(5):59-66.[ZHAO Bing-zi,ZHANG Jia-bao,ZHOU Ling-yun,etal.Residues of HCH and DDT in Typical Agricultural Soils of Huang-Huai-Hai Plain,CHINAⅠ:Residues in Surface Soils and Thier Isomeric Composition[J].Acta Pedologica Sinica,2005,42(5):59-66.]
[21]沈薇.生物修复环境污染的微生物筛选及其性能研究[D].南京:南京理工大学,2006.[SHEN Wei.Bioremediation of Microbial Screening of Environmental Pollution and Its Performance Study[D].Nanjing:Nanjing University of Science and Technology,2006.]
[22]李果,毛华军,巩宗强,等.几种表面活性剂对柴油及多环芳烃的增溶作用[J].环境科学研究,2011,24(7):775-780.[LI Guo,MAO Hua-jun,GONG Zong-qiang,etal.Solubilization of Diesel and Polycyclic Aromatic Hydrocarbons by Certain Kinds of Surfactants[J].Research of Environmental Sciences,2011,24(7):775-780.]
[23]龚丽芬,蔡建秀,谢晓兰.Y-TiO2光催化降解高效氟氯氰菊酯和p,p′-DDE[J].宁德师范学院学报(自然科学版),2013,25(4):353-355.[GONG Li-fen,CAI Jian-xiu,XIE Xiao-lan.Photocatalytic Degradation of the Cyfluthrin andp,p′-DDE by Y-TiO2[J].Journal of Ningde Normal University (Natural Science),2013,25(4):353-355.]
(责任编辑: 陈 昕)
Surfactants Strengthen Cole-Microorganism for the Remediation of DDTs Contaminated Farmland Soils.
LÜLiang-he1,ZHANGHong-ling1,CHENZong-cong1,SUNJia-jun2,SUNLi-na1,WANGXiao-xu1
(1.Key Laboratory of Regional Environment and Eco-remediation(Shenyang University), Ministry of Education, Shenyang 110044, China;2.Beijing Sander Environmental Engineering Co. Ltd., Beijing 100000, China)
In order to improve the remedial effects of DDTs contaminated soils in facility agriculture,a field experiment was conducted to enhance different concentrations of SDBS-TW80 and RL for bioremediation of DDTs contaminated soils by combining with cole andBacillusmethylotrophicus. The results show that the degradation rate of DDTs in soils by cole, degrading and cole-microorganism bacteria after one month were 12.0%, 38.2% and 43.1%, respectively, which was significantly higher than that in control treatment. SDBS-TW80 and RL could enhance the degradation rate of DDTs contaminated farmland soils byBacillusmethylotrophicusand cole. The highest degration rates of DDTs in farmland soils were 56.5% and 65.7%, respectively, when the concentration of SDBS-TW80 and RL was applied at 40 and 5 mg·kg-1, respectively. RL showed higher degradation activity of DDTs than SDBS-TW80. Moreover, highest degradation rate ofp,p′-DDE (the most toxic component) was about 69.5%, when the concentration of RL was applied at 5 mg·kg-1. The results confirmed the workability of surfactants augmented remediation of DDT-contaminated soil by cole andBacillusmethylotrophicus. Considering the remediation efficiency and toxicity, RL was the best choice in practical application.
DDTs; surfactant;Bacillusmethylotrophicus; cole; contaminated farmland soil
2016-08-11
沈阳市科技计划(F14-133-9-00);国家重点基础研究计划(2014CB441106);辽宁省青年学者成长计划(LJQ2014134)
X53
A
1673-4831(2017)08-0755-07
10.11934/j.issn.1673-4831.2017.08.012
吕良禾(1991—),男,辽宁沈阳人,硕士生,主要从事土壤有机污染修复研究。E-mail: 1435277042@qq.com
① 通信作者E-mail: zhl19792002@163.com
② 共同通信作者E-mail: Sln629@163.com

