柞蚕免疫蛹粉在凡纳滨对虾健康养殖中的应用研究
孙永欣,马淑慧,米锐,孟楠,温志新,李学军,李亚洁,都兴范,李树英
水产养殖
柞蚕免疫蛹粉在凡纳滨对虾健康养殖中的应用研究
孙永欣,马淑慧,米锐,孟楠,温志新,李学军,李亚洁,都兴范,李树英*
(辽宁省农业科学院大连生物技术研究所,辽宁大连116024)
本文采用体外诱导法制备含有抗菌活性物质的柞蚕蛹粉(IPP),将其以不同比例(0、0.5%、1.0%)添加到凡纳滨对虾(体重约8.3 g/尾)基础饲料中,喂养5周后测定其增重率、肌肉组成成分、成活率和免疫力,喂养试验结束后进行10 d的水浴攻毒(哈维氏弧菌108/mL),研究饲喂IPP对凡纳滨对虾免疫保护率的影响。结果表明:饲喂IPP组对虾体增重率均高于对照组,其中1.0%剂量组比对照组提高35.15%,达到显著水平(P<0.05);0.5%和1.0%组成活率分别比对照组提高7.73%和10.60%(P<0.05);肌肉成分检测表明,1.0%试验组粗脂肪含量显著高于对照组(P<0.05);饲喂IPP组对虾血清超氧化物歧化酶(SOD)、酸性磷酸酶(ACP)、碱性磷酸酶(ALP)和多酚氧化酶(PPO)都显著高于对照组(P<0.05),最多分别比对照组提高11.65%、50.07%、66.55%和7.30%。饲喂IPP组致病菌的免疫保护率也显著高于对照组(P<0.05)。综上,柞蚕免疫蛹粉可显著提高凡纳滨对虾增重率和抗病力,并且其适宜添加量为1.0%。
凡纳滨对虾;蛹粉;生长;免疫
凡纳滨对虾又称南美白对虾,是目前我国养殖产量最高的对虾品种。近年来其养殖产量和占比不断递增,2013年凡纳滨对虾养殖总产量为142.99万t,占全国虾养殖总产量的51.4%(中国渔业统计年鉴,2014),2014年达到157.7万t,占全国虾养殖总产量的90.24%(中国渔业统计年鉴,2015)。然而,病毒和弧菌疾病给对虾养殖带来的危害越来越严重(Ballamoole等,2014;Escobedo,2011;Austin,2010)。抗生素被广泛用于对虾等水产动物的疾病防治,但易产生病原菌的耐药性以及药物残留问题,严重影响了水产养殖业的可持续发展(Boyd和Massaut,1999;许兵等,1993)。
为了寻求安全有效的养殖方式,科研工作者开发出多种免疫增强剂,以替代抗生素应用于水产养殖中,并取得了较好效果(王晓琳等,2016;汤菊芬等,2015;谭崇桂等,2013;宋理平等,2010)。研究表明,体外生物诱导制备的含有抗菌活性物质(包括抗菌蛋白、抗菌肽、溶菌酶和凝集素等)的柞蚕免疫蛹粉(IPP),在海参养殖中表现出显著的免疫增强效果和抗病力效果(孙永欣等,2016),鉴于对虾免疫系统和海参相似,本文将IPP用于凡纳滨对虾养殖中,通过研究其对凡纳滨对虾生长和免疫力的影响拓展柞蚕资源综合利用,并为开发新型免疫增强剂提供参考。
1 材料与方法
1.1 试验饲料制备柞蚕免疫诱导蛹粉(IPP)由体外生物诱导法制备。基础饲料(对照组)为广东恒兴饲料,试验原料以鱼粉、面粉、豆粕等为主要成分,营养指标如表1所示。在基础饲料中分别添加0(对照组)、0.5%、1.0%的IPP,混合均匀后,用喷雾器把饲料打湿搅拌后直接投喂。

表1 基础饲料营养成分%
1.2 试验用虾与饲养管理饲养试验在中国水产科学研究院营口水产增殖实验站进行,试验用虾购自广州利洋水产科技股份有限公司。试验开始时,挑选起始规格一致对虾(约8.3 g/尾)分别在8个水泥养殖池(规格为4m×6m×1.2m,水深0.8 m)中进行,其中4个养殖池作对照组,0.5组和1.0组各用2个养殖池。每个养殖池大约放7000尾共120斤对虾(养殖密度为6.25斤/m3),试验周期为5周。期间每日投喂6次(2∶00、6∶00、10∶00、14∶00、18∶00、22∶00),每次投饵量为体重的3%~5%,根据水温和水质情况适当微调,保证各组基本一致,不间断充气,每天上午10∶00前各养殖池换水1/4~1/3,试验用水采用砂滤天然海水。整个养殖期间,水温28~32℃,pH 7.8~8.2,盐度为30‰~32‰,溶氧不低于6.0 mg/L。
1.3 生长指标测定在试验结束后测定各养殖池所有试验虾终末体重,计算相对增重率和成活率。
相对增重率=(末体重/g—初始体重/g)/(初始体重)×100。
1.4 肌肉常规营养成分水分采用105℃恒重法(GB/T6435-86);粗蛋白质采用凯氏定氮法(GB/T6432-94);粗脂肪采用氯仿-甲醇抽提法(GB/T6433-94);粗灰分采用550℃灰化法(GB/ T6438-92)进行测定。
1.5 对虾免疫指标测定饲养结束后,从各养殖池中随机取10~15尾对虾(每组30尾),用一次性无菌注射器(1 mL)从对虾围心腔内抽取血淋巴,注入无菌的1.5 mL离心管中,4℃冰箱过夜,次日用无菌针头划破血凝块,析出血清用于免疫指标的测定(Garriques和Arevalo,1995)。
对虾血清超氧化物歧化酶(SOD)、酸性磷酸酶(ACP)、碱性磷酸酶(ALP)采用南京建成生物工程研究所生产试剂盒测定,多酚氧化物酶(PPO)使用苏州科铭生物技术有限公司试剂盒测定。
酶活性定义:血清SOD酶活性单位定义为每mL体腔液中SOD抑制率达到50%时对应的SOD量为一个酶活性单位(U);ACP酶活性单位定义为100 mL体腔液在37℃与基质作用30 min产生1 mg酚为1个活力单位;ALP定义为100 mL血清在37℃与基质作用15 min产生1 mg酚为1个金氏单位;PPO酶活性单位定义为每分钟每mL血清在每mL反应体系中吸光值变化0.01为一个酶活力单位。
1.6 攻毒试验参照朱学芝等(2007)方法,在养殖试验结束后,每组随机抽取对虾45尾(每个池均匀取样),用含有哈维氏弧菌(Vibrio harveyi)的水浸泡凡纳滨对虾,水体中的哈维氏弧菌维持在1×108个/mL,观察10 d内对虾的死亡情况,计算免疫保护率(宋理平等,2010)。
免疫保护率/%=(1-试验组死亡率/对照组死亡率)×100。
1.7 数据分析试验数据以“平均值±标准差”表示。采用SPSS17.0进行单因素方差分析,用Dun can’s多重法比较各组间平均值的差异显著性,P<0.05为差异显著。
2 结果
2.1 柞蚕免疫蛹粉对凡纳滨对虾生长的影响由表2可知,饲养结束后,对虾的增重率和成活率以1.0%组最高,两项指标都显著高于对照组(P<0.05),增重率提高了35.15%,成活率提高了10.60%;0.5%添加组增重率也高于对照组,未达到显著差异水平,但成活率显著高于对照组(P<0.05)。
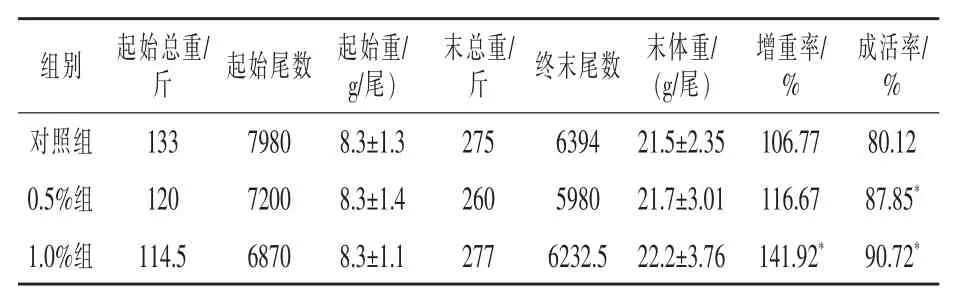
表2 柞蚕免疫蛹粉对凡纳滨对虾生长的影响
2.2 柞蚕免疫蛹粉对凡纳滨对虾肌肉成分的影响由表3可见,各处理组粗蛋白质和粗灰分含量较对照组差异不显著,但1.0%组粗脂肪含量较对照组显著提高(P<0.05)。

表3 柞蚕免疫蛹粉对凡纳滨对虾肌肉成分的影响%
2.3 柞蚕免疫蛹粉对凡纳滨对虾血清免疫指标的影响由表4可见,饲料中添加0.5%和1.0% IPP能显著提高对虾血清中SOD、ACP、ALP和PPO酶活性(P<0.05),其中0.5%组SOD和PPO活性最高,1.0%组ACP和ALP活性最高。

表4 柞蚕免疫蛹粉对凡纳滨对虾血清免疫指标的影响
2.4 柞蚕免疫蛹粉对凡纳滨对虾抗病力影响由表5可知,饲喂IPP对虾的抗哈维氏弧菌能力得到明显提高。随着攻毒试验进行(0~10 d),各组存活率都在下降,但IPP组对虾存活率和免疫保护率始终高于对照组,且达到显著(P<0.05),对比0.5%和1.0%组发现,1.0%剂量组免疫保护率比0.5%组更高。
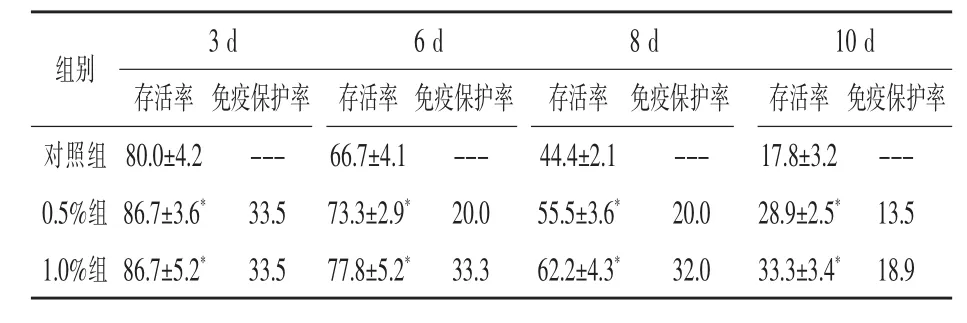
表5 凡纳滨对虾抗病力试验结果%
3 讨论
柞蚕免疫蛹粉(IPP)被诱导出的抗菌蛋白、抗菌肽、溶菌酶和凝集素等活性物质,统称为生物抗菌素(吕贵仁等,2011)。已有研究证实,IPP对海珍品生长促进作用明显(孙永欣等,2016;都兴范等,2000),本试验在对虾养殖中也得到了同样结论。本研究采用的柞蚕免疫蛹粉是在柞蚕蛹基础上诱导出抗菌活性物质,其主要成分是蛹粉。研究表明,柞蚕蛹粉能提高虾夷马粪海胆、鲶鱼仔鱼等水产品增重率并有效降低饵料系数(Kurbanov等,2015;朱斐等,2009;Habib等,1994),并认为柞蚕蛹粉中的营养物质可以改善饲料品质,从而提高饲料利用率、促进动物生长。在本试验中,IPP添加剂量最高只有1%,改善饲料品质作用可能不是很明显。有研究表明,蚕蛹对鲤鱼具有强烈的诱食作用,并认为是蚕蛹含有的17种氨基酸的效果,但这种诱食效果并非仅来自于氨基酸,因为随后的试验发现,用这17种氨基酸配制出的混合物诱食作用较蚕蛹提取物作用弱(Tsushima和Ina,1978),这种诱食性对于鲶鱼仔鱼同样有效(Akiyama等,1984)。柞蚕蛹中含有的呈味脂肪酸等风味物质可能对凡纳滨对虾也具有诱食效果,因此,饲料品质改善和诱食效果综合作用提高了对虾增重率,且对凡纳滨对虾体组分有一定改善作用,体现在体蛋白质和脂肪含量增加,且1.0%组体脂肪含量显著提高,这可能与对虾个体大小有关。随着个体增大,肌肉蛋白质和脂肪含量增加,从而提高了对虾品质。
本研究中饲喂IPP的对虾免疫指标、成活率和免疫保护率均得到明显提高,这与很多报道结果类似(李林等,2015;柴仙琦等,2012;宋理平等,2010)。对虾免疫系统属先天性免疫,由模式识别受体对病原微生物识别后激发(Lin等,2008;Sun等,2008)。对虾体液中含有血细胞、凝集素、抗菌肽、溶菌酶、超氧化物歧化酶、酸性磷酸酶、碱性磷酸酶以及血细胞释放的酚氧化物酶系统等免疫因子,构成虾类的免疫防御体系(宋理平等,2005),因而这些酶的活性反映了机体免疫的强弱。对虾体内存在多种抗菌肽,这些抗菌肽作为效应因子在免疫系统发挥关键作用(Bachère等,2004)。目前,在对虾中已发现的8种抗菌肽大多存在于血淋巴细胞(Zhao和Wang,2008),并推测当机体受到刺激时血淋巴细胞中的抗菌肽可释放到血液中参与免疫防御(Martin等,1998;Toh等,1991)。而抗菌肽摄入时,可使细胞质颗粒和体液循环系统中储存的抗菌肽含量提高,机体受到外源微生物侵入可激发血淋巴细胞释放更多抗菌肽对外来病原菌杀伤。以此推测,对虾摄食含有抗菌肽的IPP后,会诱发血淋巴细胞进一步释放体内抗菌肽,从而增强机体对哈维氏弧菌的抗病力;其次,抗菌肽作为模式识别中的效应因子,可启动对虾体内免疫反应,表现在SOD、ACP、ALP和PPO免疫指标的提高。此外,研究表明,海参摄食IPP(0.5%~2.0%)后,肠道菌群结构得到优化,乳酸菌属和芽孢杆菌属均明显高于对照组,且弧菌属显著降低(Ma等,2017),因此我们推测,IPP也可能通过改善对虾肠道菌群结构,从而提高肠道免疫和健康程度,增强机体免疫力和抗病力,这需要下一步试验进行验证。
4 结论
本试验结果表明,饲料中添加0.5%和1.0%柞蚕免疫蛹粉能明显提高凡纳滨对虾增重率、成活率和抗病力,对实际养殖增收增产效果明显,并建议在饲料中实际添加量最好不超过1.0%。
[1]柴仙琦,冷向军,李小勤,等.抗菌肽对凡纳滨对虾生长和血清非特异性免疫指标的影响[J].淡水渔业,2012,42(4):59~62.
[2]都兴范,李树英,石理鑫,等.柞蚕免疫活性物质对海珍品生长发育的研究[J].饲料研究,2012,12:58~61.
[3]李林,孙育平,黄燕华.家蝇抗菌肽的提取及其对凡纳滨对虾抗病力的影响[J].广东农业科学,2015,9:120~125.
[4]吕贵仁,刘隽彦,陈丹.柞蚕抗菌素稳定性的研究[J].北方蚕业,2011,32(1):25~26.
[5]宋理平,胡斌,王爱英,等.抗菌肽对凡纳滨对虾生长和机体免疫的影响[J].广东海洋大学学报,2010,30(3):28~32.
[6]宋理平,宋晓亮,董文,等.虾类免疫系统及其免疫增强剂的研究[J].饲料工业,2005,26(22):48~55.
[7]孙永欣,温志新,米锐,等.柞蚕免疫蛹粉在刺参健康养殖中的应用研究[J].中国饲料,2016,15:19~23,27.
[8]谭崇桂,冷向军,李小勤,等.多糖、寡糖、蛋白酶对凡纳滨对虾生长、消化酶活性及血清非特异性免疫的影响[J].上海海洋大学学报,2013,22(1):93~99.
[9]汤菊芬,黄瑜,蔡佳,等.中草药复合益生菌制剂对凡纳滨对虾生长、抗病力及水质的影响[J].广东海洋大学学报,2015,35(6):47~52.
[10]王晓琳,马甡,单洪伟.两株潜在的益生菌安全性评价及其对凡纳滨对虾免疫力和抗WSSV能力影响[J].中国海洋大学学报,2016,46(10):39~47.
[11]许兵,纪伟尚,张鹏,等.对虾病原菌抑菌药物的研究[J].青岛海洋大学学报,1993,23(2):43~51.
[12]朱斐,王吉桥,张剑诚.几种饲料添加剂对虾夷马粪海胆生长指标的影响[J].水产科技情报,2009,2:53~55.
[13]朱学芝,郑石轩,潘庆军,等.芽孢杆菌对凡纳滨对虾免疫和生化指标的影响[J].饲料研究,2007(4):56~59.
[14]Akiyama T,Murai T,Hirasawa Y,et al.Supplementation of various meals to fish meal diet for chum Salmon fry[J].Aquaculture,1984,37(3):217~222.
[15]Austin B.Vibrios as causal agents of zoonoses[J].Veterinary Microbiology,2010,140(3~4):310~317.
[16]Bachère E,Gueguen Y,Gonzalez M,et al.Insights into the antimicrobial defense of marine invertebrates:The penaeid shrimps and the oyster Crassostrea gigas[J].Immunology Reviews,2004,198:149~168.
[17]Ballamoole K K,Vijaya K D,Juliet R M R,et al.Diversity of Vibrio parahaemolyticus associated with disease outbreak among cultured Litopenaeus vannamei(Pacific white shrimp)in India[J].Aquaculture,2014,433:247~251.
[18]Boyd C E,Massaut L.Risks associated with the use of chemical in pond aquaculture[J].Aquaculture Engineering,1999,20(2):113~132.
[19]Escobedo-Bonilla C M.Application of RNA interference(RNAi)against viral infections in shrimp:a review[J].Antivirals&Antiretrovirals,2011,9:2.
[20]Garriques D,Arevalo G.An evaluation of the production and use of a live bacterial isolate to manipulate the microbial flora in commercial production of Penaeus vannamei postlarvae in Ecuador[A].Browdy C L,Hopkins J S(Eds.),Swimming through Troubled Water.Proceedings of the Special Session on Prawn Farming,Aquaculture'95.World Aquaculture Society[C].1995.53~59.
[21]Habib M A B,Hasan M R,Akand A M,et al.Evaluation of silkworm pupae meal as a dietary protein source for Clarias batrachus fingerlings[J]. Aquaculture,1994,124(1~4):61~66.
[22]Kurbanov A R,Milusheva R Y,Rashidova S S,et al.Effect of replacement of fish meal with silkworm(Bombyx mori)pupa protein on the growth of Clarias gariepinus fingerling[J].International Journal of Fisheries and Aquatic Studies,2015:2(6):25~27.
[23]Lin Y C,Vaseeharan B,Chen JC.Identification and phylogenetic analysis on lipopolysaccharide and beta-1,3-glucan binding protein(LGBP)of kuruma shrimp Marsupenaeus japonicas[J].Developmental&Comparative Immunology,2008,32:1260~1269.
[24]Ma S H,Sun Y X,Wang F Q,et al.Effects of tussah immunoreactive substances on growth,immunity,disease resistance against Vibrio splendidus and gut microbiota profile of Apostichopus japonicas[J].Fish&Shellfish Immunology,2017,63:471~479.
[25]Martin G G,Kay J,Poole D,et al.In vitro nodule formation in the ridgeback prawn,Sycionia ingentis,and the American lobster,Homarus americanus [J].Journalof Invertebrate Pathology,1998,117:155~168.
[26]Sun Y D,Fu L D,Jia Y P,et al.A hepatopancreas specific C-type lectin from the Chinese shrimp Fenneropenaeus chinensis exhibits antimicrobial activity[J].Molecular Immunology,2008,45:348~361.
[27]Toh Y,Mizutani A,Tokunaga F,et al.Morphology of the granular hemocytes of the Japanese horseshoe crab Tachypleus tridentatus and immunocytochemical localization of clotting factors and antimicrobial substances[J]. Cell&Tissue Research,1991,266:137~147.
[28]Tsushima J,Ina K.Survey of feeding stimulants for carp,Cyprinus carpio(studies of feeding stimulants for fishes,Partш)[J].Journal of the Agricultural Chemical Society of Japan,1978,52(6):225~229.
[29]Zhao X F,Wang J X.The antimicrobial peptides of the immune response of shrimp[J].Invertebrate Survival Journal,2008,5:162~179.■
Immunity induced pupae of Antheraea Pernyi powder(IPP)was supplemented into basic diets of Penaeus vannamei(average weight about 8.3 g/individual)with the different levels(0,0.5%and 1.0%).After 5 weeks feeding experiment.The growth,muscle composition,survival rate and immunity of Penaeus vannamei were determined.At the end of the feeding trail,immunoprotective rate was investigated after the shrimp in challenge with Vibrio harveyi(108CFU/mL)for 10 days.The results showed that the weight gain rate of the IPP group was significantly higher than that in the control group,moreover,the 0.1%group increased by 35.15%(P<0.05).In addition,the survival rate of 0.5%and 1.0%IPP groups increased by 7.73%and 10.60%respectively compared with the control group(P<0.05).Muscle composition test showed that the shrimp fed with 1.0%IPP exhibited significant increase of lipid contents compared with the control group(P<0.05).Dietary supplementation of IPP significantly increased the activities of serum superoxide dismutase(SOD),acid phosphatase(ACP),alkaline phosphatase(ALP),polyphenol oxidase(PPO),the maximum value were increased by 11.65%,50.07%,66.55%,7.30%respectively.The immunoprotective rate against the infectious bacteria was also significant higher than that in the control group(P<0.05).In conclusion,IPP in diet could significantly increased the weight gain and the pathogen resistance of Penaeus vannamei,and its suitable addition was 1%.
Penaeus vannamei;powder;growth;immunity
S963
A
1004-3314(2017)15-0020-04
10.15906/j.cnki.cn11-2975/s.20171505
现代农业产业技术体系建设专项(CARS-22);辽宁省重大科技攻关项目(2014209001)
*通讯作者

