同一患者不同部位分离耐碳青霉烯类肺炎克雷伯菌耐药机制研究及同源性分析
胡咏梅,邹明祥,李军,豆清娅,王海晨,晏群,刘文恩
(中南大学湘雅医院a.检验科,b.医院感染控制中心,长沙 410008)
·临床实验研究·
同一患者不同部位分离耐碳青霉烯类肺炎克雷伯菌耐药机制研究及同源性分析
胡咏梅a,邹明祥a,李军a,豆清娅b,王海晨a,晏群a,刘文恩a
(中南大学湘雅医院a.检验科,b.医院感染控制中心,长沙 410008)
目的 对临床分离自同一患者不同部位的3株耐碳青霉烯类肺炎克雷伯菌进行耐药机制研究及同源性分析。方法 对某严重烧伤患者的股静脉导管尖端、创面分泌物及痰液标本中分离到的3株耐碳青霉烯类肺炎克雷伯菌,采用改良Hodge试验检测碳青霉烯酶,双纸片协同及增效试验检测金属β-内酰胺酶;PCR筛查耐药基因;肠杆菌科基因间重复序列-聚合酶链反应(ERIC-PCR)进行同源性分析,多位点序列分型技术(MLST)对肺炎克雷伯菌进行分子生物学分型。结果 3株耐碳青霉烯类肺炎克雷伯菌的改良Hodge试验均为阴性,双纸片协同及增效试验均为阳性;3株菌均检出blaNDM-1基因,而未检出blaKPC、blaGES、blaIMP、blaSPM、blaVIM、blaGIM及blaOXA-48等耐药基因;ERIC-PCR显示3株菌为同一型别,MLST分型结果显示3株菌均属于ST17型。结论 3株肺炎克雷伯菌对碳青霉烯类抗生素耐药的主要机制为携带blaNDM-1基因,且这3株菌为同一克隆。
多部位感染;肺炎克雷伯菌;新德里金属β-内酰胺酶Ⅰ型;多位点序列分型
近年来,碳青霉烯类耐药肠杆菌科细菌不断出现,尤其是耐碳青霉烯类肺炎克雷伯菌在全球出现并广泛流行,使临床抗感染治疗面临极大的挑战。本研究收集2014年从1例严重烧伤患者的股静脉导管尖端、创面分泌物及痰液3种标本中分离到的3株耐碳青霉烯类肺炎克雷伯菌,对其耐药机制和同源性进行分析,以期为临床抗感染治疗以及预防其传播提供实验依据。现将结果报告如下。
1 材料与方法
1.1 菌株来源 2014年从我院烧伤科1例严重烧伤患者的股静脉导管尖端、创面分泌物及痰液3种标本中分离到3株对亚胺培南耐药的肺炎克雷伯菌,检出时间分别为3月8日、3月17日及4月1日,按照时间序列分别标记为KP1、KP2和 KP3。质控菌株为大肠埃希菌ATCC 25922及肺炎克雷伯菌ATCC BAA-1705/1706。
1.2 主要试剂与仪器 药敏纸片(英国Oxoid公司),亚胺培南、美罗培南及氨曲南的E-test试剂条
(郑州安图生物公司),引物及5×TBE电泳缓冲液(上海生工公司),DNA marker D2000(大连宝生物公司),2×Taq PCR Master Mix试剂(北京百泰克公司);Vitek 2 Compact(法国生物梅里埃公司),ABI 2720 PCR扩增仪(美国ABI公司),高速冷冻离心机(德国Eppendorf公司),Hoefer PS2A200水平电泳仪(美国Hoefer公司),InGenius凝胶成像分析系统(英国Syngene公司)。
1.3 药敏试验 用K-B法测定10种抗菌药物的抑菌圈直径;E-test法测定亚胺培南、美罗培南和氨曲南的最小抑菌浓度(MIC),结果根据美国临床和实验室标准化协会(CLSI)2016版标准进行判断。
1.4 改良Hodge试验筛查碳青霉烯酶 按照CLSI 2016版操作规程进行试验。若待测菌划线与抑菌圈边缘交叉处有矢状生长则为阳性。分别以肺炎克雷伯菌ATCC BAA-1705/1706作为阳性和阴性质控菌株。
1.5 双纸片协同试验及双纸片增效试验检测金属β-内酰胺酶 将0.5麦氏浊度单位的待测菌菌液涂布于M-H平板,分别粘贴EDTA纸片(0.5 mol/L EDTA 5 μL)、亚胺培南纸片(10 μg)和亚胺培南纸片(10 μg)+EDTA(0.5 mol/L EDTA 5 μL)组合纸片,35 ℃过夜培养[1]。若亚胺培南抑菌圈在靠近EDTA侧出现匙孔或抑菌圈明显扩大(双纸片协同试验)或组合纸片与亚胺培南纸片的抑菌圈直径相差≥6 mm(双纸片增效试验)则为阳性。
1.6 耐药基因筛查 根据文献[1-3]设计引物,引物序列见表1。PCR反应体系为25 μL,包括2×Taq PCR Master Mix 12.5 μL,10 μmol/L上、下游引物各1 μL,DNA模板2 μL,无菌双蒸水8.5 μL。 PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,退火温度(见表1)30 s,72 ℃延伸30 s,共30个循环;最后再72 ℃延伸5 min。扩增产物送上海铂尚公司测序,序列经BLAST数据库进行比对分析。

表1 碳青霉烯酶基因检测所用引物
1.7 ERIC-PCR DNA指纹图谱分析 根据文献[4]设计引物,ERIC-2:5′-AAGTAAGTGACTGGGGT
GAGCG-3′。PCR反应体系为25 μL,包括2×Taq PCR Master Mix 12.5 μL、10 μmol/L引物1 μL、DNA模板2 μL、无菌双蒸水9.5 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃再延伸3 min。扩增产物进行琼脂糖凝胶电泳,用凝胶成像系统进行观察及拍照分析。凡条带数目和位置完全相同者,则判为同一克隆型。
1.8 多位点序列分型(multilocus sequence typing, MLST) 选取7个管家基因(gapA、mdh、pgi、phoE、infB、rpoB、tonB)构建肺炎克雷伯菌的MLST研究方案,管家基因的引物序列及PCR反应条件参照http://bigsdb.web.pasteur.fr/klebsiella/primers_used.html,PCR反应体系见1.6。扩增产物送上海铂尚公司测序,将测序后结果与MLST数据库(http://bigsdb.web.pasteur.fr/)进行比对得出序列型别。
2 结果
2.1 药敏试验结果 结果显示,3株细菌对哌拉西林/他唑巴坦、头孢曲松、头孢他啶、头孢吡肟、环丙沙星、左氧氟沙星和复方磺胺甲噁唑均耐药,但是其中KP1菌株对庆大霉素、妥布霉素及阿米卡星敏感,而KP2和KP3对庆大霉素和妥布霉素耐药,仅对阿米卡星敏感;3株菌对亚胺培南、美罗培南及氨曲南均耐药。
2.2 碳青霉烯酶筛查及金属酶表型结果 3株肺炎克雷伯菌经改良Hodge试验检测碳青霉烯酶,结果均为阴性;双纸片协同及增效试验检测金属β-内酰胺酶,结果均为阳性。
2.3 耐药基因检测 3株细菌均携带blaNDM-1基因,未检出blaKPC、blaGES、blaIMP、blaSPM、blaVIM、blaGIM及blaOXA-487种耐药基因。见图1。
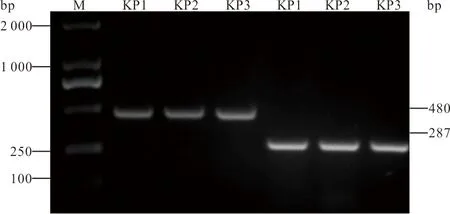
注:M,DNA marker;KP1~KP3,待测菌株。
图1 3株肺炎克雷伯菌blaNDM-1基因的PCR电泳
2.4 ERIC-PCR指纹图谱 ERIC-PCR结果显示,KP1、KP2和KP3具有完全相同的DNA指纹图谱,属于同一克隆型。见图2。
2.5 多位点序列分析结果 通过对7个管家基因进行PCR扩增及测序,将测序结果与MLST数据库内已有的标准序列进行比对,结果显示:3株肺炎克雷伯菌均为ST17型。
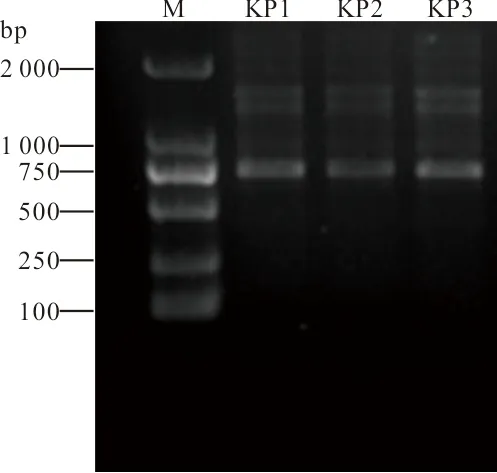
注:M,DNA marker;KP1~KP3,待测菌株。
图2 3株肺炎克雷伯菌的ERIC-PCR指纹图谱
3 讨论
细菌对碳青霉烯类抗生素耐药是多种机制共同参与的结果,其中最主要的原因是产碳青霉烯酶。本研究对某患者不同部位分离的3株碳青霉烯类耐药肺炎克雷伯菌进行8种碳青霉烯酶基因检测,结果发现3株待测菌均携带blaNDM-1基因,而其他7种耐药基因包括肺炎克雷伯菌中最常见的blaKPC基因均未检出,说明产NDM-1型碳青霉烯酶是这3株细菌对碳青霉烯类抗生素耐药最主要的机制。从病史资料来看,患者全身总烧伤面积达97%,机体免疫力低下,且全身存在多处插管,可引起患者全身多处感染。有学者认为,抗生素的使用尤其是不合理使用是NDM-1酶出现的首要原因。该患者自入院以来,长期使用多种抗生素,包括左氧氟沙星、头孢他啶、美罗培南、亚胺培南、阿米卡星、万古霉素、替加环素及各种抗真菌药等,在抗生素选择压力下可能筛选出该耐药菌株。现有研究表明,NDM-1一般不水解氨曲南等单环β-内酰胺类抗生素,然而超过80%的产NDM-1的细菌同时携带其他可以水解氨曲南的耐药基因,如CTX-M或CMY类ESBLs,从而导致其对氨曲南耐药[5]。本研究中的3株菌对氨曲南均耐药,可能与这一机制相关。另外,比较这3株菌的药敏结果,发现庆大霉素和妥布霉素从开始的敏感变为耐药,查阅病史资料,发现患者从入院开始到检出KP1之间间断使用氨基糖苷类抗生素抗感染,推测其耐药原因可能是抗生素使用导致,具体机制有待进一步研究。有资料显示,相比于阿米卡星,庆大霉素及妥布霉素更易出现耐药[6]。
这3株携带blaNDM-1基因细菌的金属酶表型筛查均为阳性,但是改良Hodge试验均为阴性。文献报道,改良Hodge试验对KPC和OXA-48型碳青霉烯酶检测敏感性高,但对NDM型酶的检测敏感性低,从而易出现假阴性[7]。这可能是本研究中改良Hodge试验均为阴性的原因。
通过ERIC-PCR分型技术对3株细菌的同源性进行分析,发现3株菌属于同一型别,表明该患者是全身多部位的产NDM-1酶肺炎克雷伯菌感染。同时,将本研究的测序结果与MLST数据库内已建立的标准序列进行比对分析,3株肺炎克雷伯菌均为ST17,进一步证实3株菌属于同一克隆型,说明该患者3个不同部位分离的肺炎克雷伯菌具有相同的同源性。由于该类菌株具有严重的耐药性和传播能力,应引起临床高度重视。做好细菌耐药及院内感染防控工作,提高抗生素合理使用水平,加强携带blaNDM-1基因细菌的监测,一旦发现疑似或确诊产NDM-1酶细菌感染或定植患者应予以隔离,以预防耐药菌广泛传播。
[1]邹明祥, 邬靖敏, 李军, 等. 产NDM-1肺炎克雷伯菌中国分离株的初步研究[J]. 中国当代儿科杂志, 2012, 14(8):616-621.
[2]陈茶, 林冬玲, 张妮, 等. 耐亚胺培南铜绿假单胞菌的耐药机制及亲缘性研究[J]. 中华医院感染学杂志, 2012, 22(15): 3201-3205.
[3]安淑娟, 姚立琼, 金凤玲, 等. 产NDM-1型碳青霉烯酶肠杆菌科细菌的耐药性及同源性分析[J]. 临床检验杂志, 2014, 32(8):621-623.
[4]王艳艳, 刘红, 杜昕, 等. 泛耐药肺炎克雷伯菌的医院内流行特性的研究[J]. 中华微生物学和免疫学杂志, 2011, 17(7):761-763.
[5]Nordmann P, Poirel L, Walsh TR,etal. The emerging NDM carbapenemases[J]. Trends Microbiol, 2011, 19(12): 588-595.
[6]Yu FY, Yao D, Pan JY,etal. High prevalence of plasmid-mediated 16S rRNA methylase genermtBamongEscherichiacoliclinical isolates from a Chinese teaching hospital[J]. BMC Infect Dis, 2010, 10: 184.
[7]Girlich D, Poirel L, Nordmann P. Value of the modified Hodge test for detection of emerging carbapenemases in Enterobacteriaceae[J]. J Clin Microbiol, 2012, 50(2):477-479.
(本文编辑:周万青,刘群)
Drug resistant mechanism and homology analysis of carbapenem-resistantKlebsiellapneumoniaeisolated from different sites of one patient
HUYong-meia,ZOUMing-xianga,LIJuna,DOUQing-yab,WANGHai-chena,YANQuna,LIUWen-ena
(a.DepartmentofClinicalLaboratory,b.InfectionControlCenter,XiangyaHospital,CentralSouthUniversity,Changsha410008,Hunan,China)
Objective To investigate the drug resistant mechanism and homology of three strains of carbapenem-resistantKlebsiellapneumoniae(K.pneumoniae) isolated from different sites of one patient. Methods Three strains of carbapenem-resistantK.pneumoniaewere isolated from femoral vein catheter tip, wound secretions and sputum of a patient with severe burns, respectively. Their carbapenemase, metallo-β-lactamase (MBL) and drug resistance genes were detected by modified Hodge test, double-disk synergy test and combination disk diffusion and PCR, respectively, and homology and biological typing were analyzed by enterobacterial repetitive intergenic consensus-PCR (ERIC-PCR) assay and multilocus sequence typing (MLST) technology, respectively. Results The carbapenemase and MBL of three strains of carbapenem-resistantK.pneumoniaewere negative and positive, respectively. TheblaNDM-1gene was identified from the three strains, but other drug resistance genes such asblaKPC,blaGES,blaIMP,blaSPM,blaVIM,blaGIMandblaOXA-48were not detected. ERIC-PCR showed that three isolates belonged to the same genotype, and MLST showed that they were type ST17. Conclusion CarringblaNDM-1gene is the main cause leading to the drug resistance of three strains of carbapenem-resistantK.pneumoniae, and they belong to the same genotype.
multiple-site infection;Klebsiellapneumoniae; New Delhi metallo-β-lactamase-1; multilocus sequence typing
10.13602/j.cnki.jcls.2017.07.08
湖南省发改委(湘发改高技[2012]1493号;湘发改投资[2014]658号);湖南省自然科学基金(14JJ7003)。
胡咏梅,1989年生,女,技师,硕士,主要从事细菌耐药检测及耐药机制研究。
邹明祥,主任技师,硕士研究生导师,E-mail:zoumingxiang@126.com。
R446.5
A
2017-05-20)

