PCR-反向点杂交法在外阴阴道念珠菌病诊断及白念珠菌耐药基因突变检测中的应用
刘秀卿,王革非,李卓成,黄磊
(1.汕头大学医学院微生物学与免疫学教研室,广东汕头 515041;2.深圳市第二人民医院检验科,广东深圳 518035)
·临床检验技术研究·
PCR-反向点杂交法在外阴阴道念珠菌病诊断及白念珠菌耐药基因突变检测中的应用
刘秀卿1,2,王革非1,李卓成2,黄磊2
(1.汕头大学医学院微生物学与免疫学教研室,广东汕头 515041;2.深圳市第二人民医院检验科,广东深圳 518035)
目的 评价PCR-反向点杂交法用于念珠菌菌种鉴定及白念珠菌耐药基因突变检测的应用价值。方法 收集念珠菌性阴道炎患者及体检健康妇女分泌物各285份和50份。用生物梅里埃酵母菌鉴定卡进行菌种鉴定,用最低抑菌浓度(MIC)法(郑州安图真菌快速培养鉴定药敏试剂)进行药敏试验;采用PCR-反向点杂交法(深圳亚能念珠菌菌种鉴定及白念珠菌耐药基因突变检测试剂)进行菌种鉴定和耐药基因突变检测;采用PCR及测序方法进行耐药基因的检测。分别以培养鉴定法、MIC法、核酸序列测定法为对比方法,评价PCR-反向点杂交法念珠菌菌种鉴定及白念珠菌耐药基因突变检测的敏感性、特异性及准确性。结果 与培养鉴定法相比,PCR-反向点杂交法检测6种念珠菌菌种的敏感性、特异性、阳性预测值、阴性预测值和总符合率分别为95%、96%、96%、98%、97%以上,2种方法检测6种念珠菌(白念珠菌、光滑念珠菌、热带念珠菌、近平滑念珠菌、克柔念珠菌和季也蒙念珠菌)结果的差异无统计学意义(χ2值分别为0.44、0、0、0、0和0,P均>0.05),一致性较好(Kappa均>0.9)。与MIC法相比,PCR-反向点杂交法检测白念珠菌耐药的敏感性、特异性、阳性预测值、阴性预测值和总符合率分别为98%、88%、98%、88%和96%,2种方法检测结果的差异无统计学意义(χ2=0.17,P>0.05),一致性较好(Kappa>0.8)。PCR-反向点杂交法与核酸序列测定法相比,对6种白念珠菌耐药基因突变位点的检测结果完全一致。结论 PCR-反向点杂交法在念珠菌菌种鉴定及白念珠菌耐药基因突变检测上与培养鉴定法以及核酸序列测定法的一致性高,比传统检测方法更早期更快速,可应用于外阴阴道念珠菌病(VVC)的辅助诊断。
外阴阴道念珠菌病;白念珠菌;PCR-反向点杂交法;ERG11点突变
由念珠菌感染引起的外阴阴道念珠菌病(vulvovaginal candidiasis,VVC)在各年龄段育龄妇女中普遍存在,约75%以上的女性一生中患过一次[1-2]。其病原菌主要包括白念珠菌、光滑念珠菌、热带念珠菌、近平滑念珠菌、克柔念珠菌和季也蒙念珠菌。不同念珠菌对抗真菌药物的敏感性相差甚远[3-4]。随着唑类药物的普及使用,白念珠菌对唑类药物的耐药率呈逐年升高趋势[3-4]。目前念珠菌菌种鉴定和白念珠菌的耐药检测方法均在念珠菌纯培养的基础上进行,耗时较长。因此,临床急需建立一种简便、快速、敏感、特异的早期诊断、鉴别念珠菌种及获得耐药信息的方法。亚能公司采用PCR-反向点杂交法,将PCR扩增产物与包含探针阵列的膜条进行分子杂交,通过膜条显色来判断念珠菌种类及与白念珠菌耐药相关ERG11基因6个位点的突变。通过设立内控(internal control,IC)及UNG酶防污染体系,消除可能的假阴性和假阳性。本研究以培养鉴定法为金标准,评价PCR-反向点杂交法在菌种鉴定的敏感性和特异性;以最低抑菌浓度(minimum inhibitory concentration, MIC)法及核酸序列测定法为对比方法,评估其检测白念珠菌耐药基因突变的敏感性、特异性及准确性。
1 材料和方法
1.1 标本来源 收集2015年9至11月深圳市第二人民医院妇科门诊285例念珠菌性外阴阴道炎患者和50例体检健康妇女阴道分泌物,年龄18~59岁,平均年龄33岁。VVC诊断依据[5]:外阴潮红瘙痒、水肿疼痛、凝乳样或豆腐渣样的异常阴道分泌物增多;白带常规镜检检出霉菌。需在月经来潮5 d后取样,取样前2天内不作阴道冲洗,不用避孕药膏等阴道内用药物,性生活后、因仪器或人为因素导致无法完成整个试验过程的样本剔除。阴道分泌物样本在室温放置不超过8 h,2~8 ℃保存不超过1周,-20 ℃以下保存不超过3个月。本研究经深圳市第二人民医院伦理委员会批准。
1.2 主要试剂和仪器 核酸提取试剂盒、YN-H16杂交仪、念珠菌菌种鉴定及白念珠菌耐药基因突变检测试剂盒(深圳亚能生物公司);Vitek 2全自动微生物鉴定仪及配套酵母菌鉴定卡(法国生物梅里埃公司);真菌快速培养鉴定药敏试剂盒(MIC法,郑州安图生物公司);HeMa9600核酸扩增仪(珠海黑马公司);沙氏琼脂培养基(广东环凯微生物公司)。
1.3 念珠菌培养鉴定及药敏试验 将分泌物接种沙氏琼脂培养基,采用Vitek 2全自动细菌鉴定仪及配套酵母菌鉴定卡进行鉴定;采用真菌快速培养鉴定药敏试剂盒进行药敏测定,药物种类包括克霉唑、氟康唑、酮康唑、伊曲康唑、制霉菌素、5-氟胞嘧啶、伏立康唑、益康唑、咪康唑、两性霉素B。参照CLSI M27-A3判断标准[6]:克霉唑≥8 μg/mL、氟康唑≥64 μg/mL、酮康唑≥8 μg/mL、伊曲康唑≥1 μg/mL、制霉菌素≥8 μg/mL、5-氟胞嘧啶≥32 μg/mL、伏立康唑≥4 μg/mL、益康唑≥8 μg/mL、咪康唑≥8 μg/mL、两性霉素B≥2 μg/mL为耐药(R)。以上操作均参照仪器及试剂说明书进行。
1.4 PCR-反向点杂交法 将分泌物样本按核酸提取试剂盒说明,用柱提法直接提取DNA,-20 ℃保存备用。取待测样本DNA 4 μL,分别加入配制好的扩增反应液中,PCR扩增反应条件如下:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min。反向点杂交:将包被特异性探针的杂交膜放入杂交仪中,通过反向点杂交检测扩增变性产物,采用辣根过氧化物酶标显色。膜条上各位点代表的念珠菌种类有白念珠菌(CA)、光滑念珠菌(CG)、热带念珠菌(CT)、近平滑念珠菌(CP)、克柔念珠菌(CK)和季也蒙念珠菌(Cgu);白念珠菌野生型探针132W、405W、467W、471W、464/465W,突变型探针Y132H、S405F、R467K、I471T、G464S、G465S;IC为膜条内控点。结果判断:检测结果阳性点呈蓝色,当只有IC位点显色,表明被检样本中无念珠菌DNA或者样本中待检测的念珠菌DNA含量在本试剂的检测范围之外(试剂检测下限为1.0×104copies/mL)。
1.5 PCR测序法 采用Primer Premier 5.0软件,依据132~471位点全野生序列(GenBank: KM881482.1)设计2对引物。405~471位点对应的引物为ERG-F1(5′-TATGACGGTTTATTTAGGTC- 3′)、ERG-R1(5′-GCCAATGTTATGAAAACTC-3′),片段大小为446 bp;132位点对应的引物为ERG-F2(5′-CTCTTAGAATGCATATGCCA-3′)、ERG-R2(5′-TGCCTGACCCTGATTATAG-3′),片段大小为211 bp。引物由英潍捷基(上海)公司合成。取1.4中提取的样本DNA作为模板。PCR反应体系50 μL:ddH2O 29.9 μL,10×PCR buffer 5 μL,MgCl2(25 mmol/L)4 μL,dN(U)TP(25 mmol/L)0.4 μL,dUTP(100 mmol/L)0.1 μL,上、下游引物(100 μmol/L)各0.2 μL,UNG(1 U/μL)0.2 μL,Taq酶(5 U/μL)2 μL,DNA模板8 μL。PCR扩增反应条件与PCR-反向点杂交法相同。扩增后产物由英潍捷基(上海)公司进行序列测定。与全野生序列在DNAMAN软件中进行比对,并确定突变位点信息。
1.6 统计学分析 用SPSS 17.0软件进行。采用四格表进行分析,与培养鉴定及药敏试验相比,评价PCR-反向点杂交法的敏感性、特异性、总符合率、阳性预测值、阴性预测值并进行配对卡方(χ2)检验与Kappa检验;评价PCR-反向点杂交法与核酸序列测定法的阳性符合率、阴性符合率、总符合率并进行配对卡方(χ2)检验与Kappa检验。以P<0.05为差异有统计学意义,以Kappa>0.8说明2种方法检测结果的一致性程度高。
2 结果
2.1 PCR-反向点杂交法中菌种鉴定与培养鉴定法
结果比较 培养鉴定法检出285例念珠菌,以白念珠菌为主,为178株(62.46%),其次为光滑念珠菌28株(9.82%),热带念珠菌23株(8.07%),季也蒙念珠菌11株(3.86%),克柔念珠菌和近平滑念珠菌各10株(3.51%),其他念珠菌25株(8.77%)。PCR-反向点杂交法检测出262例念珠菌,菌种分布为白念珠菌181例,光滑念珠菌28例,热带念珠菌22例,季也蒙念珠菌11例,克柔念珠菌和近平滑念珠菌各10例。其中有9例白念珠菌鉴定2种方法不相符,见表1。另有1例培养鉴定为热带念珠菌,而PCR-反向点杂交法检测阴性。50例体检健康妇女标本培养鉴定法和PCR-反向点杂交法的检测结果均为阴性。PCR-反向点杂交法对6种念珠菌菌种鉴定的敏感性、特异性、阳性预测值、阴性预测值和总符合率均为95%以上,见表2。2种检测方法在6种念珠菌(CA、CT、CP、CK、CG和Cgu)菌种鉴定上差异无统计学意义(χ2分别为0.44、0、0、0、0和0,P均>0.05);Kappa值分别为0.946、0.976、1.0、1.0、1.0和1.0。
表1 PCR-反向点杂交法和培养鉴定法在白念珠菌菌种鉴定结果比较

PCR⁃反向点杂交法 培养鉴定法 阳性阴性合计阳性1756181阴性3151154合计178157335

表2 PCR-反向点杂交法与培养鉴定法比较的菌种鉴定效能分析
2.2 PCR-反向点杂交法检测白念珠菌耐药突变与白念珠菌药敏结果比较 在培养鉴定法的检出178例白念珠菌感染临床样本中,PCR-反向点杂交法检出152例有耐药突变基因;MIC法检出152例对唑类药物耐药(白念珠菌对氟康唑、酮康唑、伊曲康唑、伏立康唑、益康唑、咪康唑的耐药率分别为8.6%、2.5%、50.6%、9.9%、76.0%、70.5%,一种唑类药物耐药即统计为耐药样本)。其中有6例2种方法的结果不相符,见表3。PCR-反向点杂交法检测白念珠菌耐药突变的敏感性、特异性、阳性预测值、阴性预测值和总符合率分别为98.0%、88.5%、98.0%、88.5%、96.6%,2种检测方法在白念珠菌耐药性检测上差异无统计学意义(χ2=0.17,P=1.0);Kappa值为0.865。
表3 PCR-反向点杂交法检测白念珠菌耐药突变基因与药敏结果比较
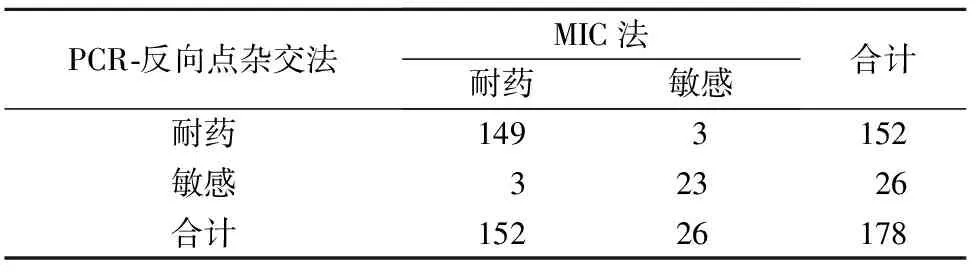
PCR⁃反向点杂交法MIC法耐药敏感合计耐药1493152敏感32326合计15226178
2.3 PCR-反向点杂交法在白念珠菌耐药突变基因检测与核酸序列测定的结果比较 335例临床样本经PCR-反向点杂交法共检出156例白念珠菌耐药基因突变样本,包括Y132H突变107例,S405F突变11例,G464S突变15例,G465S突变24例,R467K突变12例,I471T突变11例,其中包含24例双耐药基因突变样本。核酸序列测定结果与PCR-反向点杂交法的结果完全一致。50例健康体检妇女标本核酸序列测定和PCR-反向点杂交法均未检出耐药突变基因。6种白念珠菌耐药基因突变位点检测的总符合率为100%。
3 讨论
在培养法检出285株念珠菌中白念珠菌占比最高(62.46%),表明白念珠菌仍然是VVC中最常见的病原菌。唑类药物是治疗白念珠菌感染的主要药物,其作用靶酶是羊毛甾醇14α-去甲基化酶,该酶由ERG11基因编码,是麦角甾醇合成通路中关键靶酶。与唑类耐药相关的突变类型主要是Y132H、S405F、G464S、G465S、R467K和I471T[7]。本次药敏结果显示白念珠菌对益康唑、咪康唑的耐药率高达70%以上,显著高于国内外的报道[3-4],可能与选取的标本类型、唑类抗真菌药的经验性用药及患者预防性使用药物有关。与生物梅里埃酵母菌鉴定卡菌种鉴定结果相比,PCR-反向点杂交法在6种念珠菌菌种鉴定的敏感性、特异性均达95%以上。2种念珠菌菌种检测试剂检出率无明显差别(Kappa均大于0.9),一致性较好。其中3例培养鉴定为白念珠菌和1例培养鉴定为热带念珠菌,而PCR-反向点杂交法鉴定均为阴性,可能因为杂交探针覆盖的范围存在碱基多态性;还有6例PCR-反向点杂交法鉴定白念珠菌,而培养鉴定阴性,可能因为PCR-反向点杂交法的灵敏度高于培养,或者患者近期使用过抗真菌药物而产生干扰,又或者取样的菌为死菌故培养不出。
PCR-反向点杂交法与真菌快速培养鉴定药敏试剂(MIC法)药敏检测结果相比,敏感性、特异性、阳性预测值、阴性预测值和总符合率均达到88%以上,2种试剂盒检测结果一致性较好(Kappa>0.8)。PCR-反向点杂交法检测出白念珠菌耐药突变基因以Y132H为主。178例白念珠菌中有3例PCR-反向点杂交法检出耐药突变基因,而MIC法敏感,可能由于方法学差异导致;另外3例MIC法耐药,而PCR-反向点杂交法未检出耐药突变基因,可能耐药杂交探针覆盖的范围存在碱基多态性,也可能由于造成菌株耐药非麦角甾醇合成通路中关键靶酶改变引起,抑或由于编码药物外排泵基因表达增加或是生物被膜形成导致。基因检测与MIC法的符合率达到96%,表明耐药突变基因检测与唑类耐药表型检测具有较好的相关性。由于检测出双耐药突变基因的例数较少,无法分析双耐药突变基因导致的耐药性是否比单耐药突变基因强,有待扩大样本量的研究。PCR-反向点杂交法与核酸序列测定检测结果完全一致,验证了PCR-反向点杂交法在白念珠菌耐药突变基因检测的高度准确性。
PCR-反向点杂交法从DNA提取到PCR产物杂交直至出报告,仅需5 h。与传统检测方法相比,本方法具有敏感性及特异度高、不易受干扰、检测耗时少等特点。但该方法只能鉴定6种常见念珠菌以及检测白念珠菌耐药基因突变。由于念珠菌属于女性阴道内的条件致病菌,只有当大量繁殖才会导致VVC,如果无临床症状只是培养阳性并不能诊断为VVC,故试剂检测下限为1.0×104copies/mL,菌量少时检测不出,可避免不必要的用药。
[1]Mahmoudi Rad M, Zafarghandi S, Abbasabadi B,etal. The epidemiology ofCandidaspecies associated with vulvovaginal candidiasis in an Iranian patient population[J]. Eur J Obstet Gynecol Reprod Biol, 2011, 55(2): 199-203.
[2]Saporiti AM, Gomez D, Levalle S,etal. Vaginal candidiasis: etiology and sensitivity profile to antifungal agents in clinical use[J].Rev Argent Microbiol, 2011, 33(4): 217-222.
[3]李德东, 单文治, 胡静, 等. 国内临床常见致病真菌及其对唑类药物的敏感性分析[J]. 中国药物应用与监测, 2016, 13(2): 121-124.
[4]Pfaller MA, Diekema DJ, Gibbs DL,etal. Results from the ARTEMIS DISK global antifungal surveillance study, 1997 to 2005: an 8.5-year analysis of susceptibilities ofCandidaspecies and other yeast species to fluconazole and voriconazole determined by CLSI standardized disk diffusion testing[J]. J Clin Microbiol, 2007, 45(6): 1735-1745.
[5]赵继芳, 贾铮. 念珠菌性阴道炎及抗菌药物的研究进展[J]. 中外医学研究, 2013, 11(2): 152-154.
[6]Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of yeasts; approved standard-third edition. CLSI document M27-A3[S]. Wayne, PA: CLSI, 2008.
[7]章磊, 许夕海, 胡立芬, 等. 白色念珠菌对唑类抗真菌药物耐药的研究进展[J]. 中华传染病杂志, 2013, 31(5): 314-316.
(本文编辑:周万青,刘群)
Application of PCR-reverse dot blot hybridization in the diagnosis of vulvovaginal candidiasis and the detection ofCandidaalbicansdrug-resistant genes
LIUXiu-qing1,2,WANGGe-fei1,LIZhuo-cheng2,HUANGLei2
(1.DepartmentofMicrobiologyandImmunology,MedicalCollegeofShantouUniversity,Shantou515041,Guangdong; 2.DepartmentofLaboratoryMedicine,theSecondPeople′sHospitalofShenzhen,Shenzhen518035,Guangdong,China)
Objective To evaluate the application value of PCR-reverse dot blot hybridization in the identification ofCandidaand the detection ofCandidaalbicansdrug-resistant genes. Methods The vaginal secretion samples from 285 patients with candidal vaginitis and 50 healthy women were collected. The identification ofCandidaspecies and their drug susceptibility were detected by the bioMérieux Yeast identification cards and MIC method(Zhengzhou Antu kit), respectively. The identification ofCandidaspecies and the mutation ofCandidaalbicans, drug-resistant genes were also detected by the Shenzheng Yaneng test kit(PCR-reverse dot blot hybridization). The drug-resistant genes were also identified by PCR and nucleic acid sequencing. Based on the culture identification, MIC method and nucleic acid sequencing as the contrast methods, the sensitivity, specificity and accuracy of PCR-reverse dot blot hybridization in the identification ofCandidaspecies and the mutation detection ofCandidaalbicansdrug-resistant genes were evaluated. Results Compared with the bioMérieux Yeast identification method, the sensitivity, specificity, positive predictive value, negative predictive value and total coincidence rate of PCR-reverse dot blot hybridization for detecting six kinds ofCandidaspecies, includingCandidaalbicans,Candidaglabrata,Candidatropicalis,Candidaparapsilosis,CandidakruseiandCandidaguilliermondii, were above 95%, 96%, 96%, 98% and 97%, respectively. There was no significant difference in detecting six kinds ofCandidaspecies between the two methods(χ2=0.44, 0, 0, 0, 0 and 0, respectively,P>0.05), and there was good consistency between them(Kappa>0.9). Compared with the MIC method, the sensitivity, specificity, positive predictive value, negative predictive value and total coincidence rate of PCR-reverse dot blot hybridization for detecting the drug resistance ofCandidaalbicanswere 98%, 88%, 98%, 88% and 96%, respectively. There was no significant difference in detecting the drug resistance ofCandidaalbicansbetween the two methods(χ2=0.17,P>0.05), and there was good consistency between them(Kappa>0.8). The results of PCR-reverse dot blot hybridization in detecting the mutation sites of six kinds ofCandidaalbicansdrug-resistant genes were 100% of coincidence with that of the nucleic acid sequencing method. Conclusion The PCR-reverse dot blot hybridization has high consistency with the culture method and the nucleic acid sequencing method in the identification ofCandidaspecies and the mutation detection ofCandidaalbicansdrug-resistant genes, which is more early and rapid than the traditional detection methods, and may be applied to the auxiliary diagnosis of vulvovaginal candidiasis(VVC).
vulvovaginal candidiasis;Candidaalbicans; PCR-reverse dot blot hybridization; ERG11 mutation
10.13602/j.cnki.jcls.2017.07.04
刘秀卿,1981年生,女,主管技师,大学本科,主要从事分子生物学临床研究。
王革非,博士,教授,硕士研究生导师, E-mail: gefeiwang@stu.edu.cn。
R446.5
A
2017-03-31)

