普朗尼克P85修饰的苯妥英钠纳米粒对颞叶内侧癫痫大鼠模型的脑靶向作用
方子妍郭彩凤吴逢春秦家明宁玉萍周列民
·论 著·
普朗尼克P85修饰的苯妥英钠纳米粒对颞叶内侧癫痫大鼠模型的脑靶向作用
方子妍*郭彩凤*吴逢春*秦家明△宁玉萍*周列民△
目的观察普朗尼克P85修饰的聚氰基丙烯酸正丁酯构建的苯妥英钠纳米粒能否避开颞叶内侧癫痫大鼠模型脑中P糖蛋白(P-glycoprotein,Pgp)的外排作用将苯妥英钠靶向输送到脑组织中。方法锂-匹罗卡品诱导大鼠形成慢性颞叶内侧癫痫模型。免疫组化检测脑组织中Pgp的表达水平。界面聚合法制备苯妥英钠纳米粒,与普通苯妥英钠比较,观察两组不同给药的模型鼠(苯妥英钠纳米粒组6只,普通苯妥英钠组7只)在给药后30、60、120、180、240、300 min时其脑组织中苯妥英钠的药物分布情况。采用立体定向活体微透析技术采集脑微透析液,高效液相色谱法检测待测标本中苯妥英钠的药物浓度。结果两组不同给药的模型鼠的脑/血浆的时间药物浓度曲线的曲线下面积比值差异有统计学意义[即苯妥英钠纳米粒组(0.37±0.10,n=6)明显高于普通苯妥英钠组(0.19±0.06,n=7),P<0.05]。与正常大鼠相比,模型鼠海马CA1、CA3及DG区Pgp表达上调。结论普朗尼克P85修饰的聚氰基丙烯酸正丁酯纳米粒可显著地提高抗癫痫药物苯妥英钠靶向进入Pgp高表达的颞叶内侧癫痫模型鼠脑中的浓度。
纳米粒 颞叶癫痫 P糖蛋白 苯妥英钠 靶向
癫痫是中枢神经系统的第二大常见病。尽管近年来癫痫在治疗方法上已取得了长足的进步,但合理、规则地服用抗癫痫药物(antiepileptic drugs,AEDs)仍是治疗癫痫的主要手段。虽经正规的AEDs治疗,仍有约30%的癫痫患者其发作无法控制,即耐药性癫痫[1-3]。而临床上耐药性癫痫以颞叶内侧癫痫 (mesial temporal lobe epilepsy,MTLE)为多见。虽耐药性癫痫的病理生理机制存在多种假说,但一个非常重要的特性就是该类癫痫对多种AEDs产生耐药,尽管这些AEDs具有不同的作用机制[4]。因此更多的指向于多药转运体过度表达学说。研究发现耐药性癫痫患者手术切除的脑组织中Pgp(多药转运体之一)过度表达,而几乎所有的AEDs都是Pgp的底物。动物实验也进一步证实脑中Pgp过度表达导致了药物耐受[5]。因此如何规避Pgp过度表达导致的耐药,保证AEDs靶向进入癫痫灶是耐药性癫痫治疗领域的研究热点。近年来,纳米及相关材料技术飞速发展,在生物医学领域得到了广泛的研究与应用。有研究发现聚氰基丙烯酸正丁酯纳米粒是目前少数可通过血脑屏障的纳米微粒之一[6]。而普朗尼克P85是一种具有药理活性的多功能药用辅料,在药物穿越血脑屏障的过程中起着重要作用,此外,普朗尼克P85还具有Pgp抑制作用[7-9]。因此,本研究采用聚氰基丙烯酸正丁酯作为苯妥英钠的载药材料,添加普朗尼克P85作为纳米粒的表面修饰,制作成苯妥英钠纳米粒,以考察其在MTLE大鼠模型中的脑靶向输送苯妥英钠的效用。
1 材料与方法
1.1 实验动物32只雌性6~8周SD大鼠,体重160~180 g,由广东省实验动物研究所提供。
1.2 MTLE模型的构建
1.2.1匹罗卡品诱导大鼠出现MTLE 32只大鼠腹腔注射氯化锂 (127.2 mg/kg)(Sigma L9650-100G);18~24 h后腹腔注射东莨菪碱 (1 mg/kg)(Sigma S8502-1G);之后30 min,腹腔注射匹罗卡品 (30 mg/kg)(Sigma P6503-10G);当大鼠出现RacineⅣ/Ⅴ发作后开始计时,等待发作持续90 min后再腹腔注射地西泮注射液 (10 mg/kg)终止发作;存活的大鼠饲养出现慢性反复自发性发作(即MTLE)。并记录相关视频脑电资料。
1.2.2大鼠癫痫发作评估按Racine标准[10]进行分级 Ⅰ级:面部阵挛;Ⅱ级:面部阵挛+节律点头;Ⅲ级:面部阵挛+节律点头+前肢阵挛;Ⅳ级:面部阵挛+节律点头+前肢阵挛+后肢站立;Ⅴ级:面部阵挛+节律点头+前肢阵挛+后肢站立+跌倒+竖尾。
1.2.3脑电图描记 大鼠用10%水合氯醛麻醉后固定。电极插入大鼠头顶部双侧外耳门连线内外1/3位点处头皮下固定于颅骨内,对照电极插入后颈部皮下,描记脑电活动。
1.3 Pgp表达水平检测脑组织切片以非免疫性动物血清封闭,采用单克隆小鼠抗大鼠Mdr C-19抗体(sc-1517,Santa Cruz Biotechnology,USA)混合稀释孵育,最后免疫组化试剂盒 Dako K5007(DAB+CHROMOGEN×50,5 mL)染色[11]。
1.4 苯妥英钠纳米粒的制备及检测
1.4.1纳米粒的制备 将α-BCA(1%,v/v)(氰基丙烯酸正丁酯单体,1 mL,广州白云医用胶公司)溶于 15 mL丙酮,Dextran-70(1%,w/v)(Sigma-Aldrich,Inc.St.Louis,Missouri,USA)及125 mg苯妥英钠溶于15 mL超纯水,将有机相缓慢滴加入水相,800 rpm搅拌3 h,减压蒸馏去除丙酮,添加1%普朗尼克P85[12],0.45 μm膜过滤后4℃保存。
1.4.2物理性征检测 利用投射电镜、粒度仪(英国马尔文)、zeta电位仪检测纳米粒的粒径、粒径分布及zeta电位。
1.4.3载药量和包封率的测定 采用SephadexG75凝胶柱纯化苯妥英钠纳米粒,HPLC测定苯妥英钠浓度。计算载药量和包封率。
1.4.4纳米粒的体外释放 苯妥英钠纳米粒0.5 mL于透析袋中 (截留分子量7000),40 mL生理盐水为释放介质,置于37℃恒温摇床中70 rpm旋转,于15 min、30 min、1 h、2 h、3 h、4 h、5 h、6 h、8 h、12 h、36 h、48 h取样 1 mL,HPLC测定苯妥英钠浓度,计算各时间点累积释放度。
1.5 苯妥英钠纳米粒在MTLE模型鼠上的应用
1.5.1微透析探针局部立体定位[12]13只MTLE模型鼠颈静脉置管后固定在立体定位仪上。坐标位置为:前囟后5.2 mm,左侧5.0 mm,探针置入前囟下7.5 mm。
1.5.2微透析步骤 微透析探针 (CMA/12,3-mm polycarbonate membrane,cut off 20 kD,Carnegie Medicine,Sweden)置入后稳定2 h,普通苯妥英钠组(n=7)及苯妥英钠纳米粒组(n=6)分别一次性静脉予苯妥英钠及苯妥英钠纳米粒 (35 mg/kg)。于 30 min、60 min、120 min、180 min、240 min和300 min取全血300 μL,12000 rpm离心4 min取上清,-20℃保存。同时收集0~30 min、30~60 min、60~120 min、120~180 min、180~240 min和 240~300 min的微透析液,-20℃保存。微透析实验后取脑做切片验证探针针道位置。
1.5.3HPLC检测苯妥英钠浓度[12]取待测样品90μL,加入内标卡马西平标准工作液10 μL,乙酸乙酯萃取。真空干燥箱挥干后流动相复溶。HPLC色谱柱为Waters XTerra MS C18 column(5 μm,4.6×150 mm,Waters,Milford,USA),流动相为10 mmol/L磷酸盐缓冲液/乙腈 (65/35,V/V,pH 5.0),流速1.0 mL/min,检测波长UV 205 nm,进样体积10 μL,分析时间7 min。
1.6 统计学方法采用 SPSS 20.0 (SPSS Inc.,Chicago,IL,USA)进行统计学分析。数据资料以(±s)表示,比较采用t检验 (或Wilcoxon秩和检验)。检验水准α=0.05,双侧检验。
2 结果
2.1 锂-匹罗卡品诱导的MTLE大鼠模型的构建
2.1.1MTLE大鼠模型构建 锂-匹罗卡品化学诱导大鼠急性期出现持续状态的成功率为93.75%(30/32),大鼠持续状态死亡率为10.0%(3/30)。MTLE建模成功率为48.14%(13/27)。
2.1.2免疫组化检测脑中Pgp表达 模型鼠在海马CA1、CA3及DG区上Pgp的表达较正常大鼠增高(图1)。
2.2 苯妥英钠纳米粒的物理特性
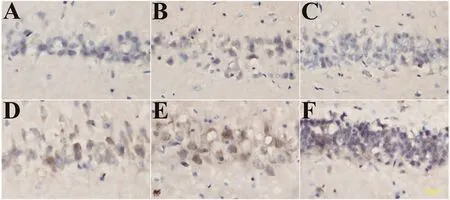
图1 海马CA1,CA3及DG区中Pgp的表达情况(高倍镜400×)棕褐色着色颗粒为Pgp的表达水平。A、B、C分别为正常大鼠海马CA1、CA3、DG区,D、E、F分别为MTLE模型鼠海马CA1、CA3、DG区
2.2.1苯妥英钠纳米粒的性征 电镜下,纳米药物为200 nm左右的圆形粒子,大小均一,分散均匀。粒径为(268.00±2.54)nm,分散系数为0.19±0.01。zeta电位为(-36.60±0.45)mv。包封率为96.63%± 5.53%。载药量为22.00%±3.95%。
2.2.2苯妥英钠纳米粒的体外缓释能力 本研究制备的苯妥英钠纳米粒在1 h内具有突释现象,之后开始缓慢释放,经60 h累积释放度超过80%,具有缓释效果。
2.3 苯妥英钠纳米粒应用于MTLE模型鼠的药代动力学结果
2.3.1脑微透析液中药物浓度 (如图2)两组模型鼠于一次给药后60 min普通苯妥英钠组脑微透析液中药物浓度为最高,之后逐渐下降。而苯妥英钠纳米粒组脑微透析液中药物浓度于120 min时为最高,之后逐渐下降,并且下降较前者稍迅速。两组在每个时间点,其脑微透析液中药物浓度差异均有统计学意义(P<0.05),即苯妥英钠纳米粒组显著高于普通苯妥英钠组 (30 min:4.97±0.94与2.14±0.16;60 min:5.14±0.95与2.93±0.58;120 min:5.32±1.42与 2.52±0.71;180 min:4.48±1.00与2.19±0.74;240 min:3.36±1.06与 1.90±0.71;300 min:3.20±0.49与1.83±0.65)。
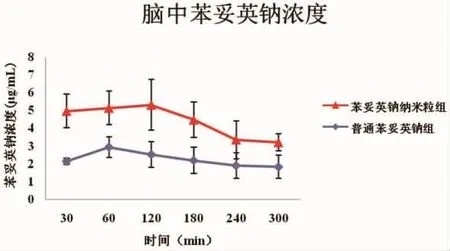
图2 两组模型鼠脑微透析液药物浓度比较
2.3.2血浆中药物浓度 如图3,两组模型鼠于一次给药后30 min均为最高,之后逐渐下降,而苯妥英钠纳米粒组药物浓度下降速度较快。两组在60 min、120 min、180 min、240 min及300 min其外周血中药物浓度差异均无统计学意义 (P>0.05)(60 min:19.15±5.07 与 14.67±2.54;120 min:12.71±3.51与 12.46±3.22;180 min:9.12±2.86与 9.50±3.26;240 min:6.46±2.53与 9.50±3.26;300 min:4.96±2.57与 8.60±3.04),而在 30 min,苯妥英钠纳米粒组药物浓度高于普通苯妥英钠组,具有统计学差异 (P<0.05)(30 min:21.51±1.55与18.82±2.00)。
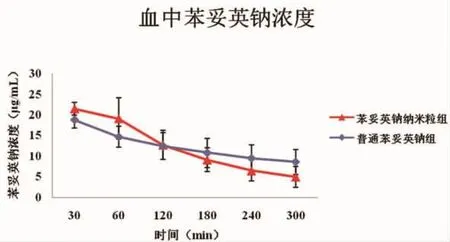
图3 两组模型鼠血浆药物浓度比较
2.3.3脑中药物分布 如图4,两组模型鼠的脑/血浆的时间药物浓度曲线的AUC比值之间差异有统计学意义(P<0.05),即药物在脑中的分布情况为苯妥英钠纳米粒组显著高于普通苯妥英钠组)(0.37±0.10与0.1±0.06)。
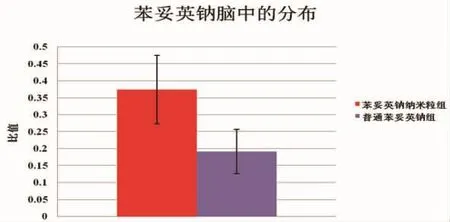
图4 海马组织ECF/血浆的时间药物浓度曲线的曲线下面积比值的比较
3 讨论
本研究证实在海马锥体细胞层的神经元上可见免疫组化阳性染色表达,这种棕褐色阳性染色在MTLE模型鼠海马的CA1、CA3、DG区更多,即Pgp蛋白表达增高。近来研究证实,在杏仁核电刺激点燃模型鼠中,特别是在苯妥英钠耐药模型鼠的杏仁核点燃同侧脑组织,相对于苯妥英钠药物反应模型鼠,其脑组织中Pgp的表达存在着显著性的差异,Pgp阳性..表达的标记区域也增高将近2倍[13]。除此之外,LöO SCHER等[5]提出杏仁核电点燃模型鼠中,苯巴比妥耐药模型鼠的脑中Pgp表达水平也高于苯巴比妥反应组。这些研究结果均表明耐药模型鼠脑中Pgp表达增高,给多药转运体与癫痫耐药的假说提供了支持理论[13]。由此推测在MTLE模型中由于痫性发作诱导了Pgp过度表达,而Pgp的过度表达将使其作用即药物主动外向转运增强,使到达药物作用靶点即致痫灶的药物浓度下降,导致癫痫发作不能控制,最终耐药性癫痫形成。
研究发现,P85修饰的氰基丙烯酸正丁酯合成的纳米药物能显著地增加苯妥英钠在脑组织中的分布,使脑/血的时间药物浓度曲线下AUC的比增高至正常药物的近两倍水平。一次性静脉给药后,普通苯妥英钠给药的模型鼠的海马组织ECF的药物浓度于60 min时为最高,之后随着时间下降,而给予苯妥英钠纳米粒的模型组的药物浓度则于120 min时为最高,之后再随着时间下降。而药物浓度在达到最高值后,苯妥英钠纳米粒组的海马组织ECF及血浆中的苯妥英钠浓度的下降速度均快于普通苯妥英钠给药的模型组。在血浆中,从给药后120 min开始,苯妥英钠浓度逐渐明显的低于普通苯妥英钠组,但在相同时间点,苯妥英钠纳米粒组的海马组织ECF的药物浓度却仍显著地高于普通苯妥英钠组的水平。由此可见,本课题构建的载药纳米粒具有较明显的脑靶向作用。虽然结果中已经证明苯妥英钠纳米粒具有较好的体外缓释效果,但是相比于传统苯妥英钠,在血循环中其药物浓度下降更为迅速,可能与循环中单核吞噬细胞系统清除纳米粒有关[14],鉴于此,可以进一步优化苯妥英钠纳米粒物理性征来减少其清除率。
纳米载体介导药物通过血脑屏障的机制目前尚未完全阐述清楚。近年来一些新的机制陆续被提出并证实[15]。据研究,经过聚山梨醇酯80修饰的聚氰基丙烯酸正丁酯载药纳米粒在进入外周血循环后吸附血液中的载脂蛋白ApoE和ApoB,而聚山梨醇酯80做为结合脂蛋白和纳米粒的链接点[16]。其中,ApoE在低密度脂蛋白的脑转运中有重要作用[17-19]。而普朗尼克P85是否起到与聚山梨醇酯80类似作用,使苯妥英钠纳米粒模仿低密度脂蛋白与脑中毛细血管内皮细胞相互作用,最终将药物通过受体介导的细胞内吞方式而进入脑组织中。进一步的研究提出,通过抗生物素蛋白的方式将载脂蛋白ApoE与包裹人类血清蛋白的纳米粒相连接,再包裹左旋多巴,能证明载脂蛋白ApoE在脑给药转运中具有呈剂量依赖性的作用。近来也有研究其它载脂蛋白ApoE3、B-100和A-I在脑靶向给药系统中所起的作用[20-21]。但关于该研究中的聚氰基丙烯酸正丁酯包裹的苯妥英钠纳米粒的脑靶向的作用机制尚需进一步的研究证实,并且在本研究的基础上将苯妥英钠纳米粒进一步优化,为耐药性癫痫寻找一个切实有效的治疗方法。
[1]ARROYO S,BRODIE MJ,AVANZINI G,et al.Is refractory epilepsy preventable[J].Epilepsia,2002,43(4):437-444.
[2]KWAN P,BRODIE MJ.Early identification of refractory epilepsy[J].N Engl J Med,2000,342(5):314-319.
[3]KWAN P,BRODIE MJ.Definition of refractory epilepsy:defining the indefinable[J].Lancet Neurol,2010,9(1):27-29.
[4]REGESTA G and TANGANELLI P.Clinical aspects and biological bases of drug-resistant epilepsies[J].Epilepsy Res,1999,34(2-3):109-122.
[5]VOLK HA,LOSCHER W.Multidrug resistance in epilepsy:rats with drug-resistant seizures exhibit enhanced brain expression of P-glycoprotein compared with rats with drug-responsive seizures[J].Brain,2005,128(Pt 6):1358-1368.
[6]OLIVIER JC.Drug transport to brain with targeted nanoparticles [J].NeuroRx,2005,2(1):108-119.
[7]ZHANG X,ALAKHOVA DY,BATRAKOVA EV,et al.Effect of pluronic p85 on amino acid transport in bovine brain microvessel endothelial cells[J].J Neuroimmune Pharmacol,2009,4(1): 35-46.
[8]MINKO T,BATRAKOVA EV,LI S,et al.Pluronic block copolymers alter apoptotic signal transduction of doxorubicin in drug-resistant cancer cells[J].J Control Release,2005,105(3): 269-278.
[9]BATRAKOVA EV,LI S,BRYNSKIKH AM,et al.Effects of pluronic and doxorubicin on drug uptake,cellular metabolism, apoptosis and tumor inhibition in animal models of MDR cancers[J].J Control Release,2010,143(3):290-301.
[10]RACINE RJ.Modification of seizure activity by electrical stimu-lation.II.Motor seizure[J].Electroencephalogr Clin Neurophysiol,1972,32(3):281-294.
[11]SHUDA,CHEN,JUEQIAN,et al.Dynamic expression of P-glycoprotein in the CA1,CA3 and dentate gyrus of the rat hippocampus following lithium-pilocarpine-induced status epilepticus[J].Neural Regeneration Research(中国神经再生研究(英文版)),2010,05(24):1851-1857.
[12]FANG ZY,CHEN SD,CHEN YS,et al.Pluronic P85 Enhances the Delivery of Phenytoin to the Brain Versus Verapamil In Vivo [J].Latin American Journal of Pharmacy,2014,33(5):812-818.
[13]POTSCHKA H,VOLK HA and LOSCHER W.Pharmacoresistance and expression of multidrug transporter P-glycoprotein in kindled rats[J].Neuroreport,2004,15(10):1657-1661.
[14]YOKOYAMA M.Drug targeting with nano-sized carrier systems [J].J Artif Organs,2005,8(2):77-84.
[15]LI X,TSIBOUKLIS J,WENG T,et al.Nano carriers for drug transport across the blood-brain barrier[J].J Drug Target,2016: 1-12.
[16]KREUTER J.Mechanism of polymeric nanoparticle-based drug transport across the blood-brain barrier(BBB)[J].J Microencapsul,2013,30(1):49-54.
[17]KREUTER J,SHAMENKOV D,PETROV V,et al.Apolipoprotein-mediated transport of nanoparticle-bound drugs across the blood-brain barrier[J].J Drug Target,2002,10(4):317-325.
[18]ZENSI A,BEGLEY D,PONTIKIS C,et al.Albumin nanoparticles targeted with Apo E enter the CNS by transcytosis and are delivered to neurones[J].J Control Release,2009,137(1):78-86.
[19]RE F,CAMBIANICA I,SESANA S,et al.Functionalization with ApoE-derived peptides enhances the interaction with brain capillary endothelial cells of nanoliposomes binding amyloidbeta peptide[J].J Biotechnol,2011,156(4):341-346.
[20]ZENSI A,BEGLEY D,PONTIKIS C,et al.Human serum albumin nanoparticles modified with apolipoprotein A-I cross the blood-brain barrier and enter the rodent brain[J].J Drug Target, 2010,18(10):842-848.
[21]KRATZER I,WERNIG K,PANZENBOECK U,et al.Apolipoprotein A-I coating of protamine-oligonucleotide nanoparticles increases particle uptake and transcytosis in an in vitro model of the blood-brain barrier[J].J Control Release,2007,117(3): 301-311.
The study on the construction of Pluronic P85 coated poly(butylcyanoacrylate)nanoparticles and its braintarget effect on a rat model of mesial temporal lobe epilepsy.
FANG Ziyan,GUO Caifeng,WU Fengchun,QINJiaming,NING Yuping*,ZHOU Liemin.Department of Neurology,The Affiliated Brain Hospital of Guangzhou Medical University (Guangzhou Huiai Hospital),36th Mingxin Road,Guangzhou,510370.Department of Neurology,The First Affiliated Hospital of Sun Yat-sen University,58thZhongshan 2ndRoad,Guangzhou 510080,China.Tel:020-81268212
ObjectiveIn order to evaluate that whether Pluronic P85 coated poly(butylcyanoacrylate)nanoparticles was able to deliver antiepileptic drug phenytoin into the brain va bypassing mesial temporal lobe epilepsy(MTLE) -induced Pgp in a rat model of MTLE.MethodsThe rat model of MTLE,induced by li-pilocarpine,was divided into two groups(6 for nanoparticle drug group and 7 for PHT drug group).Immunohistochemistry assay was performed to detect Pgp expression at the hippocampus.Nanoparticles were prepared by interfacial polymerization method.Dialysate samples of brain were collected at 30,60,120,180,240 and 300 min after drug administration by microdialysis technology.Samples were analyzed by high performance liquid chromatography(HPLC).ResultsThe area under the curve (AUC)ratio of brain/plasma in Nanoparticle drug group was 0.37 0.10 which was significantly higher compared with0.19 0.06 in conventional PHT drug group (P<0.05).The Pgp immunopositive area,as assessed by analysis of labeled surface area,was higher in the DG,CA3 and CA1 sector in the hippocampus of MTLE rats when compared to the normal rats.ConclusionsPluronic P85 coated PBCA nanoparticles can significantly deliver PHT into brain via bypassing MTLE-induced Pgp in a rat model of MTLE.
Nanoparticles Temporal lobe epilepsy P-glycoprotein Phenytoin Targeting
R742.1
A
2016-12-22)
(责任编辑:李立)
10.3969/j.issn.1002-0152.2017.06.008
☆国家自然科学基金面上项目(编号:81071050,81571333);广州市医药卫生科技项目(编号:20171A011268,20161A011036);广州市科技计划科技型中小企业创新-初创项目(编号:2017010160496);广州市脑科医院广州市医学重点学科建设项目子项目(编号:GBH2014-QN03)
* 广州医科大学附属脑科医院(广州市惠爱医院)(广州510370)
△中山大学附属第一医院(广州510080)

