放牧对冷蒿根际微生物区系及土壤酶活性的影响
张洪芹,臧晓琳,蔡宙霏,程路芸,马元丹,宝音陶格涛,张汝民,高 岩
(1.浙江农林大学 省 部共建亚热带森林培育国家重点实验室,浙江 临 安 3 11300;2.内蒙古大学 生 命科学学院,内蒙古呼和浩特010021)
放牧对冷蒿根际微生物区系及土壤酶活性的影响
张洪芹1,臧晓琳1,蔡宙霏1,程路芸1,马元丹1,宝音陶格涛2,张汝民1,高 岩1
(1.浙江农林大学 省 部共建亚热带森林培育国家重点实验室,浙江 临 安 3 11300;2.内蒙古大学 生 命科学学院,内蒙古呼和浩特010021)
为了揭示放牧对退化草原冷蒿Artemisia frigida群落阻击草场进一步退化的机制,以小区控制放牧试验(不放牧、轻度放牧、重度放牧)冷蒿根际与非根际土壤为对象,研究了不同程度放牧干扰对冷蒿根际土壤微生物数量、类群和酶活性的影响及其相互关系。结果表明:各放牧区土壤微生物数量均表现为细菌>放线菌>真菌;各处理之间冷蒿根际土壤微生物细菌、放线菌、真菌数量均显著高于非冷蒿根际土壤(P<0.05)。冷蒿根际土壤氨化细菌和好氧纤维素分解菌数量高于非冷蒿根际土壤;轻度放牧区冷蒿根际土壤氨化细菌和好氧纤维素分解菌数量显著增加(P<0.05)。冷蒿根际土壤轻度放牧后碱性磷酸酶、脱氢酶、淀粉酶、转化酶、脲酶、硝酸还原酶活性明显高于对照和重度放牧;各放牧区冷蒿根际土壤7种酶活性显著高于非冷蒿根际土壤(P<0.05)。相关分析表明,氨化细菌与碱性磷酸酶、脱氢酶、淀粉酶、转化酶、硝酸还原酶活性存在极显著正相关关系(P<0.01),好氧纤维素分解菌与酶活性存在正相关(P<0.05)。重度放牧后土壤中微生物数量减少,酶活性降低,轻度放牧使冷蒿根际土壤微生物数量和酶活性显著增加,改善土壤微生态环境。合理放牧有助于冷蒿阻击草原进一步退化。图1表3参33
土壤学;放牧;冷蒿;根际微生物;土壤酶活性
放牧是草地利用的主要方式之一。过度放牧会导致草地发生不同程度的退化[1]。土壤微环境的退化伴随着不同程度的土壤微生物数量的减少和酶活性的下降[2]。土壤微生物和酶是土壤养分转化和循环的动力,参与有机质分解和腐殖质的形成等各个生化过程,能敏感地反映土壤中各种微环境的变化[3-5]。根际是植物根系、土壤、微生物形成的动态微域。植被的生长能有效维持土壤生态系统的动态平衡[6-7]。研究表明:根际土壤微生物数量普遍高于非根际土壤[8]。随放牧强度的增加,土壤中纤维素酶、多酚氧化酶、脲酶、蛋白酶、碱性磷酸酶和蔗糖酶活性逐渐降低[9];土壤微生物量碳、氮等与脲酶活性呈负相关,与蔗糖酶和碱性磷酸酶活性呈正相关[10];目前,关于放牧对根际土壤微生物及酶活性的影响研究较少,多集中在放牧对土壤养分、土壤微生物功能及遗传多样性的影响等方面[11-12]。内蒙古典型草原是中国西北地区重要的生态屏障,其功能的正常发挥对维持全球及区域性生态系统平衡具有极其重要的作用。由于长期过度放牧和刈割等人类活动的强烈干扰,草原生态环境恶化,退化现象日趋严重[13]。冷蒿Artemisia frigida是菊科Asteraceae蒿属Artemisia多年生草本植物,广布于草原带或荒漠草原带,具有耐旱耐寒、耐践踏、耐土壤贫瘠,生根萌蘖的再生生长能力强等特性[14-15],特别在重度放牧时,即使经过家畜强烈啃食后,仍然能够继续更新繁殖使植株丛扩大,保持一定的生产力水平[16],是过度放牧引起草原退化的指示植物,伴随着草原退化演替的各个阶段。目前,对于冷蒿繁殖特性、构件变化[17-18],及其挥发物和浸提液对牧草的影响等已有相关报道[19],然而关于放牧对其根际土壤微生物数量及酶活性的影响研究还鲜见报道。本研究通过小区控制放牧试验对锡林浩特毛登牧场不同放牧强度处理下冷蒿根际土壤与非根际土壤微生物区系和酶活性进行研究,探讨草原生态系统冷蒿根际土壤微生物和酶活性对放牧扰动的响应机制,为研究冷蒿阻击草原进一步退化的机理提供土壤学方面的理论基础和参考依据。
1 材料与方法
1.1 试验地区概况
研究区位于内蒙古锡林浩特市毛登牧场,其地理位置为116°28′56.8″N,44°10′02.4″E,海拔1 160 m。属于半干旱大陆性气候,冬季寒冷干燥,夏季在一定程度上受海洋季风气候影响。全年平均气温为2.6℃,最冷月(1月)平均气温-22.3℃,最热月(7月)平均气温18.8℃,≥0℃年积温为2 410.0℃,≥10℃积温为1 597.9℃,无霜期91.0 d,全年植物生长期为150 d左右。全年平均降水量为365.6mm,集中于6-9月,占年降水量的80%左右。研究区植物主要有羊草Leymus chinensis,糙隐子草Cleistogenes squarrosa,克氏针茅Stipa krylovii,大针茅S.grandis,防风Saposhnikovia divaricata,冷蒿,瓣蕊唐松草Thalictrum petaloideum,阿尔泰狗哇花Heteropappus altaicus等。土壤为栗钙土。
1.2 试验设计
2012年5月至2014年9月连续2 a对草场进行不同放牧强度处理,每年放牧时间为5-9月。试验按照放牧强度不同设置3个处理,对照处理(ck):不放牧;轻度放牧(light grazing,LG):5月、7月每月21日放牧1 d,全年利用2次;重度放牧(heavy grazing,HG):连续放牧,5-9月每月21日放牧1 d;受天气因素的影响,每次放牧时间延后,分别设置重复3个·处理-1,共9个小区,各个重复小区面积为33.3m×33.3m。试验用羊为当年生乌珠穆沁羊Caprahircus ujumqin,各放牧季节羊放牧率为6只·小区-1。
1.3 土壤样品的采集与保存
土壤样品采集于2014年7月冷蒿生长高峰期,采用五点取样法,随即选取4~5丛冷蒿,以冷蒿株丛为中心,用铁铲将冷蒿植株丛完整挖起(0~10 cm),用抖落法取冷蒿根际土壤,仔细去除附着的大块土,将根系粘着的土壤抖入无菌塑料封口袋中,剔除石块、植物根系等杂物带回实验室,把5个点的土壤混匀作为此样地的土样。设重复3个·小区-1。带回的土样按四分法取一部分,过2mm筛用于土壤酶活性的测定;另一部分保存在4℃条件下供土壤微生物数量和类群的测定。
1.4 测定方法
1.4.1 土壤微生物数量的测定 细菌、真菌、放线菌计数采用稀释涂抹平板法[20]。细菌培养采用葡萄糖牛肉膏蛋白胨培养基,真菌采用马丁孟加拉红培养基,放线菌采用淀粉硝酸钾培养基(高氏1号)。微生物数量以每克样品的菌数表示。每克样品的菌数=同一个稀释度几次重复的菌落平均数×5×稀释倍数。
1.4.2 土壤微生物生理类群的测定 氨化细菌、氨氧化细菌、硝化细菌、反硝化细菌、好氧纤维素分解菌均采用特化液培养基进行培养,用最大或然数计数法(MPN)进行测定,根据试管中菌生长的情况由最大或然数计表查出近似值,计算每克土中所含的活菌数[20]。
1.4.3 土壤酶活性的测定 参照关松荫[21]的方法测定。碱性磷酸酶用磷酸苯二钠比色法,酶活性以酚mg·g-1·h-1干土表示;脱氢酶用三苯基四氮唑氯化物(TTC)比色法,酶活性以氢体积μL·g-1·h-1干土表示;淀粉酶用3,5-二硝基水杨酸比色法,酶活性以葡萄糖 mg·g-1·h-1干土表示;转化酶用3,5-二硝基水杨酸比色法,酶活性以葡萄糖mg·g-1·h-1干土表示;蛋白酶用茚三酮比色法,酶活性以氨基酸μg·g-1·h-1干土表示;脲酶用苯酚钠比色法,酶活性以NH3-N的mg·g-1·h-1干土表示;硝酸还原酶用酚二磺酸比色法,酶活性以NO3--N的mg·g-1·h-1干土表示。土壤酶活性的测定均设无基质和无土壤对照。
1.5 数据分析
所有数据均被分为2组进行统计分析:一组为冷蒿根际土壤,另一组为非冷蒿根际土壤。每一组的数据均利用Origin 8软件(美国Origin Lab公司)进行统计分析和作图。统计方法采用单因素方差分析进行检验,并进行Fisher最小显著差法多重比较(P<0.05)。每个变量数值表示为平均值±标准误差。采用双因素方差分析进行评估土壤类型×放牧相互作用的影响。相关性分析采用SPSS 19.0统计软件的Pearson相关分析法。
2 结果分析
2.1 放牧对冷蒿根际土壤微生物数量的影响
图1显示:土壤类型与放牧及其交互作用对细菌、放线菌、真菌的影响均呈极显著差异。冷蒿根际土壤细菌数量随放牧强度增加先增加后减少,轻度放牧后细菌数量为22.78×106菌落形成单位·g-1显著高于对照和重度放牧,分别高22.0%和37.0%;轻度、重度放牧后非冷蒿根际土壤细菌数量分别比对照降低45.7%和55.7%;各处理均表现为冷蒿根际土壤细菌数量极显著高于非冷蒿根际土壤(图1A)。轻度放牧和对照冷蒿根际土壤放线菌数量分别为17.74×105菌落形成单位·g-1和17.32×105菌落形成单位·g-1显著高于重度放牧,分别高72.5%和76.7%,且极显著高于非冷蒿根际土壤;各处理间非冷蒿根际土壤放线菌数量变化不明显 (图1B)。冷蒿根际土壤真菌数量随放牧强度增加先增加后减少,轻度放牧后真菌数量为17.30×103菌落形成单位·g-1,显著高于对照和重度放牧,分别高60.3%和29.4%;轻度放牧、重度放牧后非冷蒿根际土壤真菌数量分别比对照降低47.3%和44.2%;除对照外,轻度放牧、重度放牧冷蒿根际土壤真菌数量均极显著高于非冷蒿根际土壤,分别高2.5倍和1.5倍(图1C)。
2.2 放牧对冷蒿根际土壤微生物类群的影响
放牧对土壤中5种微生物生理类群数量变化的影响差异极显著(表1);土壤类型对硝化细菌数量变化的影响不明显,对反硝化细菌数量变化的影响差异显著,而对其他3种菌数量变化的影响差异极显著;放牧和土壤类型的交互作用除对氨化细菌、反硝化细菌数量的变化无明显影响外,对其他3种菌数量变化的影响差异极显著。冷蒿根际土壤轻度放牧后,除反硝化细菌、好氧纤维素分解菌数量与对照差异不明显外,氨氧化细菌、硝化细菌数量与对照相比显著降低,分别降低56.5%和41.0%,而氨化细菌数量与对照相比显著增加了1.1倍;重度放牧后,除氨氧化细菌数量与对照差异不显著外,氨化细菌、反硝化细菌数量与对照相比显著增加,分别增加69.0%和46.8%,而硝化细菌、好氧纤维素分解菌数量与对照相比显著降低,分别降低37.5%和57.5%。非冷蒿根际土壤轻度放牧后,除反硝化细菌数量与对照相比差异不显著外,氨化细菌、硝化细菌数量与对照相比增加显著,分别增加1.32和1.54倍,氨氧化细菌、好氧纤维素分解菌数量与对照相比显著降低,分别降低112.0%和64.3%;重度放牧后,除了好氧纤维素分解菌数量与对照相比显著降低了82.0%外,其他4种菌数量与对照相比均显著增加,分别增加101.5%,32.8%,468.1%和54.2%。
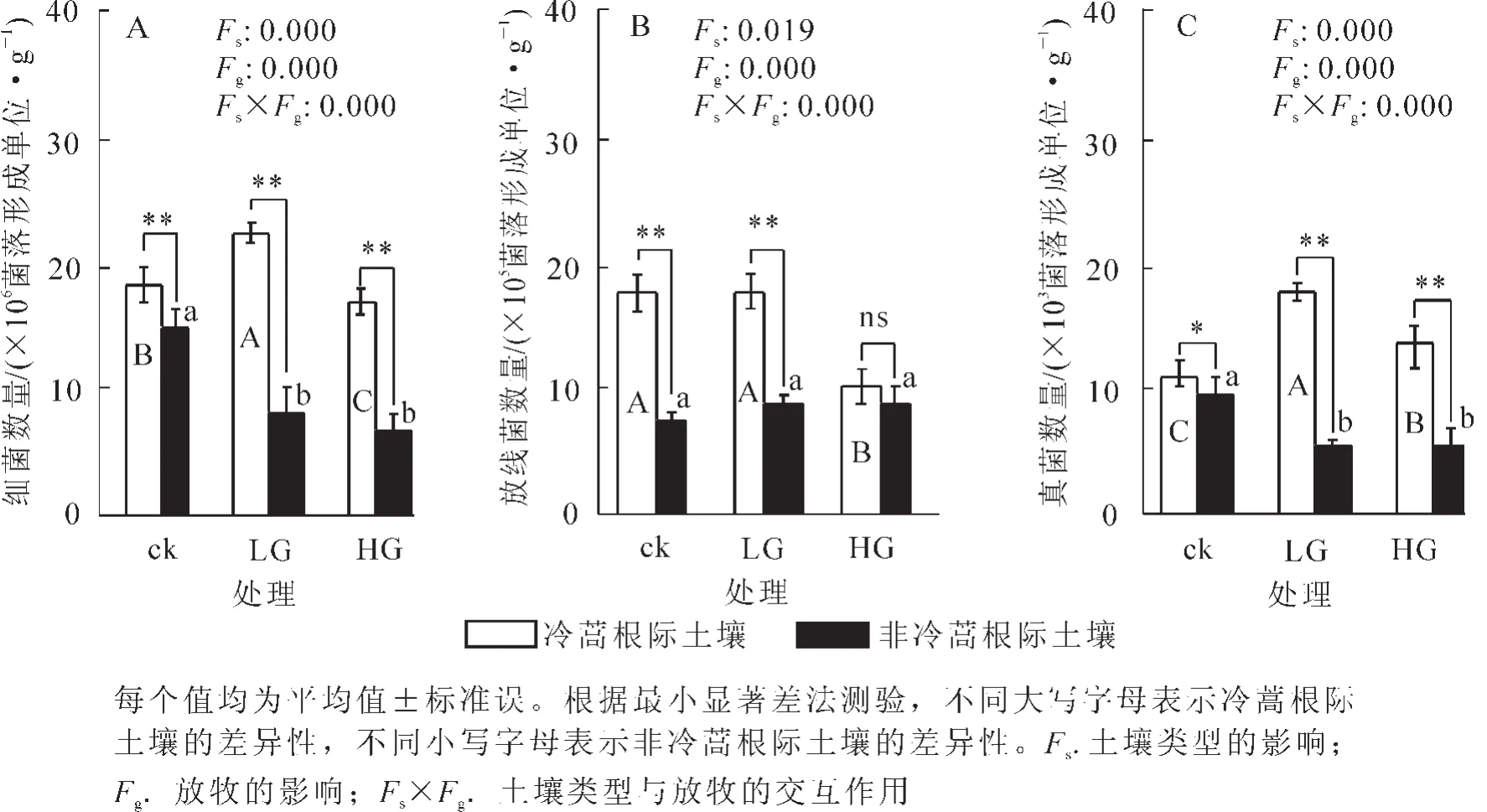
图1 不同放牧强度下冷蒿根际土壤微生物数量的变化Figure 1 Variation ofmicroorganism of Artemisia frigida rhizosphere under grazing
2.3 放牧对冷蒿根际土壤酶活的影响
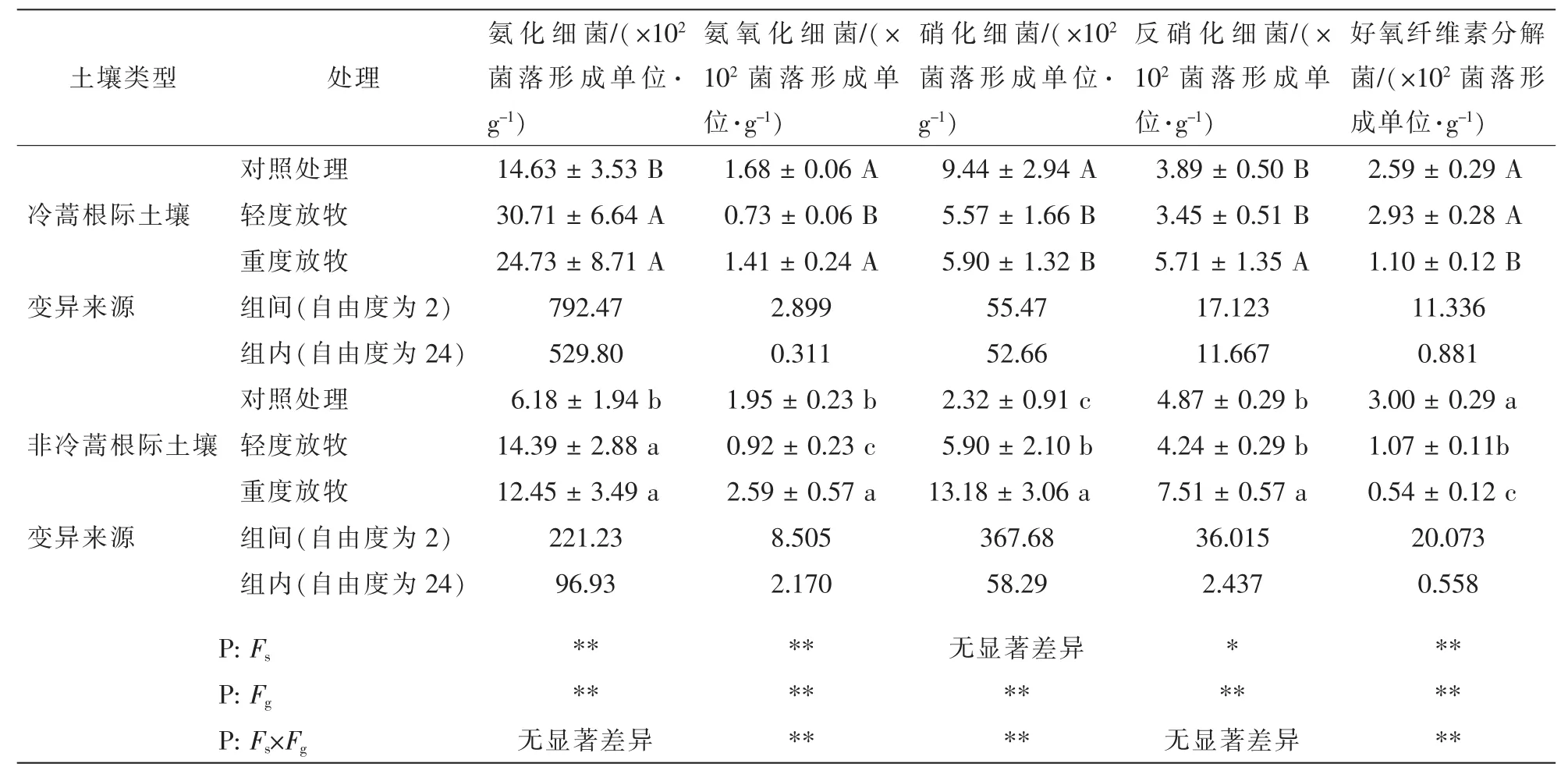
表1 不同放牧强度下冷蒿根际土壤微生物类群变化Table 1 Variation of soilmicrobial population of A.frigida rhizosphere under different grazing intensity
由表2可知:与对照相比放牧后7种酶活性的变化均表现为冷蒿根际土壤高于非冷蒿根际土壤。土壤类型及其与放牧的交互作用对土壤酶活性的影响差异极显著;放牧除对淀粉酶、转化酶、蛋白酶活性的影响差异显著外,对其他4种酶活性的影响差异极显著。冷蒿根际土壤酶活性在不同放牧强度之间有显著差异;蛋白酶对照区较高,重牧区较低;硝酸还原酶、淀粉酶、转化酶活性对照区较低,放牧区较高;碱性磷酸酶、脱氢酶、脲酶活性轻牧区较高(表2)。非冷蒿根际土壤酶活性在不同放牧强度之间有显著差异;淀粉酶、蛋白酶活性均表现出对照区较高,重牧区较低;转化酶、脲酶活性轻牧区较低;碱性磷酸酶、脱氢酶、硝酸还原酶活性放牧区较高。
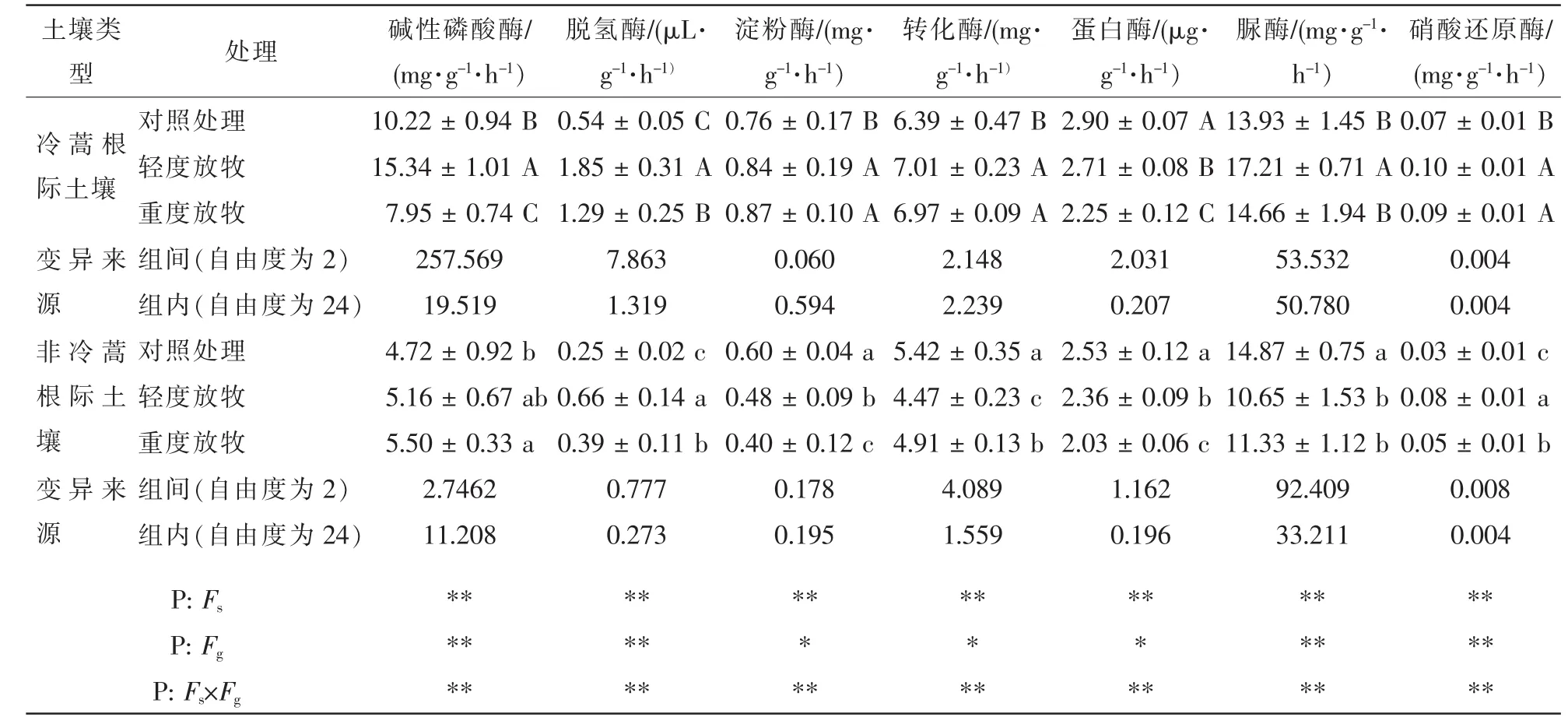
表2 不同放牧强度对冷蒿根际土壤酶活性的影响Table 2 Effects of soil enzyme activities of Artemisia frigida rhizosphere under different grazing intensity
2.4 冷蒿根际微生物数量与土壤酶活性的关系
表3显示:放牧扰动下氨化细菌与碱性磷酸酶、脱氢酶、淀粉酶、转化酶、硝酸还原酶活性呈极显著正相关(P<0.01),与脲酶活性呈显著正相关(P<0.05);氨氧化细菌与土壤脱氢酶、硝酸还原酶活性呈极显著负相关(P<0.01),与碱性磷酸酶、淀粉酶活性呈显著负相关(P<0.05);反硝化细菌与蛋白酶活性呈极显著负相关(P<0.01),与碱性磷酸酶、淀粉酶活性呈显著负相关(P<0.05);好氧纤维素分解菌与蛋白酶、脲酶呈极显著正相关(P<0.01),与碱性磷酸酶、淀粉酶呈显著正相关(P<0.05);真菌与硝酸还原酶活性呈极显著正相关(P<0.01),与脱氢酶、淀粉酶活性呈显著正相关(P<0.05)。
3 讨论与结论
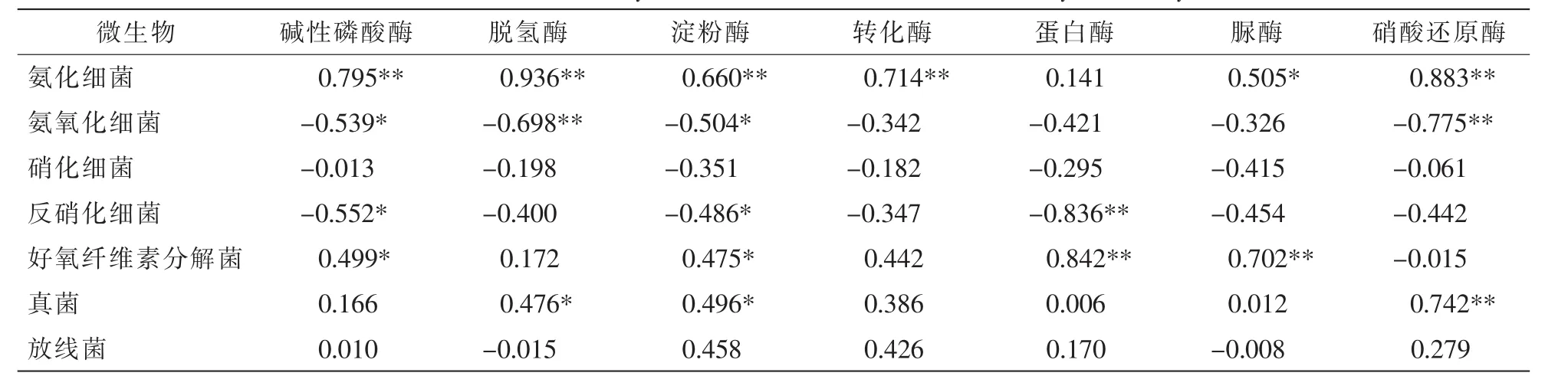
表3 土壤微生物与土壤酶活性的相关性分析Table 3 Correlation analysis between soilmicrobial and soil enzyme activity
一般来说,土壤微生物是草地生态系统的重要组成部分,其活力强弱与植被类型、放牧干扰强度、土壤养分状况等密切相关[22]。土壤中细菌、真菌、放线菌直接参与土壤碳、氮、磷等营养元素的循环和土壤矿物质的矿化过程,在土壤—植物—根际微生物组成的微生态环境中对有机物质转化和能量流动起重要作用;土壤中细菌占三大微生物类群的主要部分,而真菌在不同环境中的数量变化较大[23]。在割草和放牧干扰下,大针茅根际土壤有机碳、全氮等养分含量和生物的数量均有不同程度的减少[24]。对内蒙古草原典型植物土壤微生物群落的研究中发现,根际土壤中的细菌、真菌数量普遍高于非根际土壤。本研究发现,不同放牧强度下细菌、真菌、放线菌数量均表现为冷蒿根际土壤显著高于非冷蒿根际土壤,原因可能是随放牧强度的增加改变地表植被类型、植被覆盖度降低,冷蒿种群迅速匍匐蔓延,根系扩大,形成盘状,大量的冷蒿根系分泌物可使根际微生物的活性增强;重度放牧后非冷蒿根际土壤细菌、放线菌数量明显降低,可能是重度放牧后,家畜的强烈啃食及踩踏使草地生产力下降,土壤养分含量减少,土壤结构遭到破坏,从而影响土壤微生物的生存与繁殖。这与文都日乐等[25]研究结果一致。不同放牧强度下土壤微生物细菌数量最多,放线菌次之,真菌最少,可能与细菌类群组成的多样性及冷蒿生长高峰期根系产生大量分泌物创造更为适合细菌生长繁殖的土壤环境有关。这与闫瑞瑞等[26]研究草甸草原土壤微生物数量变化结果相吻合。
氨化细菌、硝化细菌、氨氧化细菌及好氧纤维素分解菌等都是参与土壤氮素、碳素循环的有益微生物类群,在物质转化中具有特定的功能[10]。研究表明:长期连作造成土壤微生物区系变化,根际正常的微生物群落及其结构被打破,使微生物多样性降低,有益的微生物类群减少和不利微生物的增加,使连作植物正常的生长发育过程受到影响。化感水稻PI312777对氨化细菌、亚硝酸细菌、硝酸细菌、好气性固氮菌、好气性纤维素分解菌等的生长具有促进作用,而对反硫化细菌、反硝化细菌生长有抑制作用[27]。从本试验结果来看,氨化细菌、硝化细菌及好氧纤维素分解菌在冷蒿根际土壤高于非冷蒿根际土壤,轻度放牧处理后,含量达到最高,表明冷蒿根际有利于这些菌的生长,加强了土壤的氨化作用、硝化作用和纤维素的分解,从而加速土壤氮素和碳素等营养元素的代谢、循环和利用。
土壤酶是土壤中生化反应的生物催化剂,通过土壤微生物代谢活动参与物质循环和能量流动[28]。土壤碱性磷酸酶活性在一定程度上反映土壤中磷素的丰缺度[29],促进土壤磷素的循环,提高土壤磷素有效性,增加可以被植物利用的磷含量;土壤脱氢酶能催化有机物质脱氢,增加氧化还原能力;土壤淀粉酶、转化酶在土壤碳循环中起着重要作用[30],可以增加土壤中还原糖和可溶性糖;土壤脲酶、蛋白酶及硝酸还原酶参与土壤中氮素的循环[6],其可以增加土壤中NH3、氨基酸和氨。研究发现轻度放牧土壤酶活性增加,重度放牧土壤酶活性降低[31]。轻度放牧增加蛋白酶活性,脲酶活性降低,重度放牧土壤脲酶活性增加,蛋白酶活性降低[32]。也有研究表明土壤酶活性随放牧压力增加而下降[11]。本研究表明:冷蒿根际土壤中的碱性磷酸酶、脱氢酶、淀粉酶、转化酶、蛋白酶、脲酶、硝酸还原酶活性均显著高于非冷蒿根际土壤,表明在这些酶的作用下,冷蒿根际土壤中形成了大量可以被微生物吸收、利用的营养物质,冷高根际土壤的营养物质转化、代谢高于非冷蒿根际土壤;随着放牧强度的增加,轻度放牧后冷蒿根际土壤除蛋白酶外,其他6种酶活性均达到最大值,标志着适当放牧处理,能增强土壤酶的活性,促进微生物分解作用,加快营养物质转化[33],促进微生物代谢活动参与物质循环和能量流动。
从冷蒿根际土壤微生物类群变化可知,氨化细菌含量最高,从微生物数量与土壤酶活性相关性分析可以看出,氨化细菌与6种酶活性呈显著和极显著正相关(除蛋白酶),表明,大量的氨化细菌作用,将土壤中的有机氮转化为氨,为合成各种酶所需的氨基酸提供了氨,氨化细菌贡献最大。好氧纤维素分解菌与碱性磷酸酶、脱氢酶、淀粉酶、转化酶、蛋白酶、脲酶呈正相关、显著和极显著正相关,表明好氧纤维素分解菌可以加强碳素的分解,增加这7种酶作用的底物,同时能激活土壤中的这些酶活性。土壤功能微生物和酶的相互作用,促进营养物质的转化和循环,增加了土壤的稳定性。
本研究认为:一方面放牧后冷蒿根际有益微生物活性增强,根际土壤碱性磷酸酶、淀粉酶、蔗糖酶、脲酶等活性提高,使根际微环境形成了在化学及生物特性等方面与土壤主体不同的微域,从而保证冷蒿根际土壤中碳、氮、磷等营养元素的转化与循环。另一方面土壤微生物数量、生理类群和土壤酶活性均随着放牧强度的增加呈现先增加后降低的趋势,冷蒿根际土壤有益微生物数量、种类、土壤酶活性均高于非冷蒿根际,说明不同强度的放牧干扰改变了土壤环境及其养分平衡,特别是冷蒿能够改善根际土壤微生态环境,减少放牧对其产生的干扰,使冷蒿种群能够阻击草原的进一步退化。
[1] LIANG Yan,HAN Guodong,ZHOU He,et al.Grazing intensity on vegetation dynamics of a typical steppe in northeast Inner Mongolia[J].Rangeland Ecol Manage,2009,62(4):328-336.
[2] LIJinhua,LIZhenqing,REN Jizhou.The effects of grazing on grassland plants[J].Acta Pratacul Sin,2002,11(1):4-11.
[3] MAKOI JH,NDAKIDEMIP A.Selected soil enzymes:examples of their potential roles in the ecosystem[J].Afr J Biotechnol,2008,7(3):181-191.
[4] CIARKOWSKA K,SOŁEK-PODWIKA K,WIECZOREK J.Enzyme activity as an indicator of soil-rehabilitation processes at a zinc and lead oremining and processing area[J].JEnviron Manage,2014,132(132C):250-256.
[5] LIJunjian,ZHOU Xiaomei,YAN Junxia,et al.Effects of regenerating vegetation on soil enzyme activity and microbial structure in reclaimed soils on a surface coalmine site[J].Appl Soil Ecol,2015,87:56-62.
[6] 马月婷,张丽静,杜明新,等.不同种植年限白沙蒿对根际土壤营养元素的影响[J].草业科学,2014,31(2):224-231.
MA Yueting,ZHANG Lijing,DU Mingxin,et al.Effects of different ages Artemisia sphaerocephala on the content of nutrient elements in rhizosohere soil[J].Pratac Sci,2014,31(2):224-231.
[7] ZHANG Xiangqian,HUANG Guoqin,BIAN Xinmin,et al.Effects of nitrogen fertilization and root interaction on the agronomic traits of intercropped maize,and the quantity ofmicroorganisms and activity of enzymes in the rhizosphere[J].Plant Soil,2013,368(1/2):407-417.
[8] BADRID V,WEIR T L,van der LELIE D,et al.Rhizosphere chemical dialogues:plant-microbe interactions[J]. Curr Opin Biotechnol,2009,20(6):642-650.
[9] 王启兰,曹广民,王长庭.放牧对小嵩草草甸土壤酶活性及土壤环境因素的影响[J].植物营养与肥料学报, 2007,13(5):856-864.
WANG Qilan,CAO Guangmin,WANG Changting.The impact of grazing on the activities of soil enzymes and soil environmental factors in alpine Kobresia pygmaea meadow[J].Plant Nut Fertil Sci,2007,13(5):856-864.
[10] 牛得草,江世高,秦燕,等.围封与放牧对土壤微生物和酶活性的影响[J].草业科学,2013,30(4):528-534.
NIU Decao,JIANG Shigao,QIN Yan,et al.Effects of grazing and fencing on soilmicroorganisms and enzymes activities[J].Pratac Sci,2013,30(4):528-534.
[11] HAN Guodong,HAO Xiying,ZHAOMengli,et al.Effect of grazing intensity on carbon and nitrogen in soil and vegetation in ameadow steppe in Inner Mongolia[J].Agric Ecosyst Environ,2007,125(1):21-32.
[12] ESCH E H,HERNÁNDEZ D L,PASARIJR,et al.Response of soilmicrobial activity to grazing,nitrogen deposition,and exotic cover in a serpentine grassland[J].Plant Soil,2013,366(1/2):671-682.
[13] 侯扶江,杨中艺.放牧对草地的作用[J].生态学报,2006,26(1):244-264.
HOU Fujiang,YANG Zhongyi.Effects of grazing of livestock on grassland[J].Acta Ecol Sin,2006,26(01):244-264.
[14] 王静,杨持.冷蒿抗寒生理特性的研究[J].内蒙古大学学报(自然科学版),2002,33(6):673-676.
WANG Jing,YANG Chi.A study of cold resistance physiology characteristic of Artemisia frigida[J].Acta Sci Nat Univ Neimongol,2002,33(6):673-676.
[15] 周海燕.中国东北科尔沁沙地2种建群植物的抗旱机理[J].植物研究,2002,22(1):51-55.
ZHOU Haiyan.Drought-resistantmechanism of two edificatos in Horqin sandy land of northeast China[J].Bull Bot Res,2002,22(1):51-55.
[16] 孙英杰,李衍青,赵爱芬,等.科尔沁沙地沙漠化恢复过程中冷蒿种群的扩散对策研究[J].草业学报,2014,23(1):3-11.
SUN Yingjie,LIYanqing,ZHAO Aifen,et al.Research on the spread strategy of Artemisia frigida populations during the desertification recovery process in Horqin sandy land[J].Acta Pratac Sin,2014,23(1):3-11.
[17] 王静,杨持,尹俊,等.冷蒿种群在放牧干扰下遗传多样性的变化[J].生态学报,2004,24(11):2465-2471.
WANG Jing,YANG Chi,YIN Jun,et al.Changes of the genetic diversity of Artemisia frigida population under the disturbance of grazing[J].Acta Ecol Sin,2004,24(11):2465-2471.
[18] 王静,杨持,王铁娟.冷蒿(Artemisia frigida)种群在放牧干扰下构件的变化[J].生态学报,2006,26(3):960-965.
WANG Jing,YANG Chi,WANG Tiejuan.Changes ofmodel of Artemisia frigida populations under the disturbance of grazing[J].Acta Ecol Sin,2006,26(3):960-965.
[19] ZHANG Rumin,ZUO Zhaojiang,GAO Peijun,et al.Allelopathic effects of VOCs of Artemisia frigida Willd.on the regeneration of pasture grasses in Inner Mongolia[J].JArid Environ,2012,87:212-218.
[20] 林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010.
[21] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1987.
[22] SICILIANO S D,PALMER A S,WINSLEY T,et al.Soil fertility is associated with fungal and bacterial richness, whereas pH is associated with community composition in polar soilmicrobial communities[J].Soil Biol Biochem, 2014,78(6):10-20.
[23] BACH E M,BAER SG,MEYER C K,et al.Soil texture affects soilmicrobial and structural recovery during grassland restoration[J].Soil Biol Biochem,2010,42(12):2182-2219.
[24] 胡静,侯向阳,王珍,等.割草和放牧对大针茅根际与非根际土壤养分和微生物数量的影响[J].应用生态学报, 2015,26(11):3482-3488.
HU Jing,HOU Xiangyang,WANG Zhen,et al.Effects ofmowing and grazing on soil nutrients and soilmicrobes in rhizosphere and bulk soil of Stipa grandis in a typical steppe[J].Chin JAppl Ecol,2015,26(11):3482-3488.
[25] 文都日乐,张静妮,李刚,等.放牧干扰对贝加尔针茅草原土壤微生物与土壤酶活性的影响[J].草地学报, 2010,18(4):517-522.
WENDU Rile,ZHANG Jingni,LIGang,et al.Effect of grazing disturbance on soilmicroorganisms and soil enzyme activities of Stipa baicalensis Rosev.Steppe[J].Acta Agrect Sin,2010,18(4):517-522.
[26] 闫瑞瑞,闫玉春,辛晓平,等.不同放牧梯度下草甸草原土壤微生物和酶活性研究[J].生态环境学报,2011,20(2):259-265.
YAN Ruirui,YAN Yuchun,XIN Xiaoping,et al.Changes in microorganisms and enzyme activities in soil under different grazing intensities inmeadow steppe,Inner Mongolia[J].Ecol Environ Sci,2011,20(2):259-265.
[27] 胡开辉,罗庆国,汪世华,等.化感水稻根际微生物类群及酶活性变化[J].应用生态学报,2006,17(6):1060-1064.
HU Kaihui,LUO Qingguo,WANG Shihua,et al.Effects of allelopathic rice on rhizospheren microbial flora and enzyme activity[J].Chin JAppl Ecol,2006,17(6):1060-1064.
[28] SCHALLER K.Soil enzymes-valuable indicators of soil fertility and environmental impacts[J].Bull Univ Agric Sci VetMed Clujn Hortic,2009,66(2):911-916.
[29] FINKENBEIN P,KRETSCHMER K,KUKA K,et al.Soil enzyme activities as bioindicators for substrate quality in revegetation of a subtropical coalmining dump[J].Soil Biol Biochem,2013,56:87-89.
[30] 孙瑞莲,赵秉强,朱鲁生,等.长期定位施肥对土壤酶活性的影响及其调控土壤肥力的作用[J].植物营养与肥料学报,2003,9(4):406-410.
SUN Ruilian,ZHAO Bingqiang,ZHU Lusheng,et al.Effects of long-term fertilization on soil enzyme activities and its role in adjusting-controlling soil fertility[J].Plant Nut Fertil Sci,2003,9(4):406-410.
[31] 向泽宇,王长庭,宋文彪,等.草地生态系统土壤酶活性研究进展[J].草业科学,2011,28(10):1801-1806.
XIANG Zeyu,WANG Changting,SONGWenbiao,et al.Advances on soil enzymatic activities in grassland ecosystem[J].Pratac Sci,2011,28(10):1801-1806.
[32] 高雪峰,韩国栋,张功,等.荒漠草原不同放牧强度下土壤酶活性及养分含量的动态研究[J].草业科学,2007, 24(2):10-13.
GAO Xuefeng,HAN Guodong,ZHANG Gong,et al.Study on dynamics of soil enzyme activity and nutrient of desert steppe under different grazing intensities[J].Pratac Sci,2007,24(2):10-13.
[33] ANDREONIV,CAVALCA L,RAO M A,et al.Bacterial communities and enzyme activities of PAHs polluted soils[J].Chemosphere,2004,57(5):401-412.
Effects of grazing intensity on soilmicrobial flora and soil enzyme activities in the Artemisia frigida rhizosphere
ZHANG Hongqin1,ZANG Xiaolin1,CAIZhoufei1,CHENG Luyun1,MA Yuandan1, Baoyintaogetao2,ZHANG Rumin1,GAO Yan1
(1.State Key Laboratory of Subtropical Silviculture,Zhejiang A&F University,Lin’an 311300,Zhejiang,China;2. College of Life Science,Inner Mongolia University,Hohhot010021,Inner Mongolia,China)
To reveal how Artemisia frigida growing in degraded grasslands resisted further degradation,the effects of grazing disturbance at varying degrees (no grazing,the control;light grazing;and heavy grazing) to microorganism quantity,physiological groups,and enzyme activities of soil microbes in the A.frigida rhizosphere,along with the interrelationships among them,were studied.Results showed that the number ofmicroorganisms in different grazing areaswas:bacteria>actinomyces>fungus.The counts of bacteria,actinomyces, and fungi in the A.frigida rhizosphere were significantly higher than in the non-rhizosphere (P<0.05).The count of ammonifying bacteria and aerobic cellulose decomposers in the rhizosphere were also significantly higher(P<0.05)than that in non-rhizosphere;under light grazing,ammonifying bacteria and aerobic cellulose decomposers in the rhizosphere were significantly higher (P<0.05).Compared to the control and the heavy grazing treatment,activities of soil alkaline phosphatase,dehydrogenase amylase,invertase,urease,and nitrate reductase in the rhizosphere with the light grazing treatmentwere higher(P<0.05).In each grazing area,sev-en kinds of soil enzyme activities in the rhizosphere of A.frigida were significantly higher than those in the non-rhizosphere (P<0.05).The correlation analysis indicated a highly significant positive correlation between ammonifying bacteria and activities of soil alkaline phosphatase,dehydrogenase,amylase,invertase,and nitrate reductase (P<0.01);aerobic cellulose decomposers also had a positive correlation with soil enzyme activities(P<0.05).After heavy grazing,the number ofmicroorganisms in the soil decreased,and soil enzyme activities decreased both in the A.frigida rhizosphere and non-rhizosphere.Thus,the number of soilmicroorganisms and soil enzyme activities in the A.frigida rhizosphere increased with light grazing and improved the soil ecological environmentmeaning reasonable grazing could help the A.frigida population in degraded grasslands to further resist degradation.[Ch,1 fig.3 tab.33 ref.]
soil science;grazing;Artemisia frigida;rhizospheremicrobe;soil enzyme activity
S154
A
2095-0756(2017)04-0679-08
10.11833/j.issn.2095-0756.2017.04.014
2016-03-02;
2016-05-24
国家自然科学基金资助项目(31270756,31470704); “十二五”国家科技支撑计划项目(2011BAC07B01);国家重点基础研究发展计划(“973”计划)项目(2014CB138805)
张洪芹,从事森林生态学研究。E-mail:893097171@qq.com。通信作者:高岩,教授,博士,从事植物化学和植物发育生理学等研究。E-mail:gaoyan1960@sohu.com

