纤维素酶/稀酸处理法分离毛竹木质素
王 健,张秀梅,周亚男
(浙江理工大学, a.材料与纺织学院;b.生态染整技术教育部工程研究中心, 杭州 310018)
纤维素酶/稀酸处理法分离毛竹木质素
王 健,张秀梅,周亚男
(浙江理工大学, a.材料与纺织学院;b.生态染整技术教育部工程研究中心, 杭州 310018)
采用纤维素酶/稀酸处理法从浙江产天然毛竹中分离木质素。优化毛竹酶解的反应条件,并考察不同pH值对木质素产率的影响,确定分离木质素的最佳反应条件。最佳反应条件为:酶解反应时,控制酶/底物比1∶8,底物浓度为0.025 g/mL,反应温度50 ℃下反应48 h;稀酸处理时,pH值为0.82。用红外光谱(Fourier Transform Infrared Spectroscopy, FT-IR)和核磁共振氢谱(1H Nuclear Magnetic Resonance Spectra,1H-NMR)对优化条件下分离的精炼木质素样品进行表征分析,结果表明:精炼木质素具有典型的紫丁香基和愈创木基特征峰,而纤维素、半纤维素及碳水化合物的特征峰含量很小。精炼木质素进行了化学成分分析的结果表明:纤维素酶/稀酸处理法分离的木质素与传统的磨木木质素法相比方法相比,纯度和产率具有较大提升。
毛竹;木质素;酶解;温和酸解
0 引 言
木质素是纤维原料中的主要成分之一,在自然界中含量仅少于纤维素;木质素虽然具有储量高、纯天然和可再生等优点,但绝大多数未被充分利用,因此研究木质素的化学组成与结构有利于木质素资源的合理开发与利用。木质素资源的利用需要原料中的木质素高产率、高纯度地分离出来,同时不破坏木质素的原始结构,然而到目前为止,绝大多数方法都无法在高产率的基础上保持结构完整的木质素。
纵观木质素分离技术的发展历史,目前常用的方法主要有以下几种︰克拉森法、碱法、有机溶剂法、磨木木质素法和纤维素酶解法等[1-2]。其中克拉森法、碱法以及多数有机溶剂法均在一定程度导致木质素结构变化,只能用于对底物中的木质素做定量分析。Holtman[3]发现磨木木质素法大多只能获得来自植物包间层的木质素产物,因此只能部分代表木质素的原始结构,且其产物中往往含有一些碳水化合物杂质。酶解木质素虽然较好地保留木质素的原始结构,但其产物中往往含有一些其他纤维化合物和糖类化合物杂质[4]。Luca等[5]采用酶解/温和酸解的方法得到高纯度和高产率的木质素产品,得到较高的产率,且去除了产物中大多数纤维素和糖类化合物杂质。
本文参考文献[6]中的方法,采用纤维素酶/稀酸处理法,探索用该方法从浙江产天然毛竹中分离木质素的最佳反应方案;分析毛竹粉经纤维素酶处理的最佳反应条件,优化酶解后的毛竹原料被稀酸处理的反应条件;进一步用FT-IR和1H-NMR对最终产物木质素样品进行结构表征分析。
1 实 验
1.1 试剂与仪器
原料:浙江产天然毛竹。
试剂:纤维素酶(参考文献[7]测定酶活为6827.53 U/g),麦克林试剂有限公司;1,4二氧六环(分析纯)、冰醋酸(分析纯)、醋酸钠(分析纯)、正己烷(色谱级),杭州米克化工有限公司。
仪器:行星式球磨机(QM-QX型,南京莱步科技实业有限公司),热点式恒温摇床(YS-100B型,上海姚氏仪器设备厂),集热式恒温加热搅拌器(DF-101S型,巩义市予华仪器有限责任公司),旋转蒸发仪(RF-02型,上海普渡生化科技有限公司),傅立叶红外光谱仪(Nicolet 5700型,美国热电公司) ,核磁共振波谱仪(AVANCE AV400MH型,瑞士BRUKER公司)。
1.2 实验方法
1.2.1 毛竹原料预处理
将毛竹原料切成小段并去节,经植物粉碎机粉碎至40目以下后,将样品经丙酮溶剂抽提除去其中的脂肪族化合物,具体方法参考文献[7]。抽提6 h后,再用行星式球磨机球磨72 h备用。
1.2.2 纤维素酶酶解
使用纤维素酶在一定条件下处理1.2.1制得的毛竹样品,改变酶与毛竹原料的质量比,加入不同pH值醋酸盐缓冲溶液,放入恒温摇床,恒温反应一段时间。分析不同原料/酶配比、反应时间及反应温度等对酶解效率的影响。酶水解处理后,用砂芯过滤器过滤得到酶解后的产物,用经盐酸调节的pH值为2的酸性水溶液洗涤酶解后的毛竹样品2~3次。然后冷冻干燥36 h,即制备得到酶解处理后的产物。通过计算反应前后毛竹样品的质量比,计算酶解率。
1.2.3 温和稀酸水解
称取5 g的酶解处理后产物并置于150 mL三口烧瓶中,加入100 mL体积比为4∶1的二氧六环/蒸馏溶液,采用6 mol/L盐酸溶液调节将酶解产物至不同pH值,并用含盐酸的酸性二氧六环/蒸馏溶液对酶解产物进行温和酸处理。反应时整个装置置于封闭的充满氮气的环境下,在油浴锅中91 ℃反应2 h。反应结束后,反复过滤反应残渣直至滤液澄清,收集滤液用碳酸氢钠调节至中性,并将滤液转入旋转蒸发仪,蒸发溶剂至5 mL后将剩余液体放入2 L pH值为2的酸性蒸馏水溶液。酸析约10 h后,经离心、过滤后,收集木质素残渣,冷冻干燥,既得最终的纤维素酶/稀酸处理法分离木质素。
1.2.4 红外光谱(FTIR)分析
由于酶解木质素和最终的精炼木质素均以固体粉末的形式存在,因此针对酶解木质素和精炼木质素的红外光谱分析均采用KBr压片法进行制样,测试时选用仪器为NICOLET5700傅式红外光谱分析仪,仪器分辨率为0.09 cm-1,取450~3500 cm-1为谱图的扫描范围。
1.2.5 核磁氢谱(1H-NMR)分析
测试选用经优化后的酶解/温和酸解法分离的精炼木质素进行核磁氢谱分析(1H-NMR)。测试前,将50 mg样品溶于0.5 mL 氘代二甲基亚砜(DMSO-d6)中,测试时用到的仪器是AVANCE AV400MH型核磁共振波谱仪,测试条件为扫描频率为400 Hz,氘代二甲基亚砜(DMSO-d6)作为溶剂,四甲基硅烷(TMS)为外表物,整个测试在室温下进行。
1.2.6 精炼木质素的化学成分分析
酸不溶木素(克拉森木素)含量的测定参考GB/T 2677.8-1994。酸溶木素的测定参考GB/T 10337-1989。而酸溶木质素和酸不溶木质素的质量和与精炼木质素的质量比即为所得木质素的纯度。用型号为Vario MICRO Cube型的有机元素分析仪对精炼木质素进行元素分析,测试前将精炼木质素真空干燥,用电子天平争取约5 mg的样品在锡箔纸上进行有机元素分析测试,统计C、H、S、N元素含量百分比。测试时选用氧气为燃气,氦气为载气,流速分别控制在25 mL/min和200 mL/min。测试温度为1100℃。
2 结果与讨论
2.1 反应条件优化及产率分析
2.1.1 纤维素酶处理毛竹的反应条件优化
2.1.1.1 反应时间对酶解效率的影响
表1为底物浓度0.025 g/mL、酶/底物比1∶8、反应温度50 ℃时不同反应时间对酶解率的影响。表1数据表明,随时间增加酶解率增加;当时间超过2 d后,酶解率变化不大,说明反应2 d后,基本达到最佳的酶解效果。以下实验均在酶解时间2 d条件下进行,进一步分析其它反应条件对酶解效率的影响。

表1 反应时间酶处理效率的影响
2.1.1.2 酶/底物比对酶解效率的影响
图1为底物浓度0.025 g/mL、反应时间2 d、反应温度50 ℃下不同酶/底物比对酶解率的影响。由图1可以看出,随着酶用量的增加,酶解率呈上升趋势,但进一步增加酶用量,酶解率开始降低,其原因可能是反应后未被降解的产物附着在原料表面,使酶和原料中的纤维素无法接触反应而造成的[8],因此较佳的酶用量为酶/底物比1∶8。

图1 不同酶 /底物质量比对酶解率的影响
2.1.1.3 温度及底物浓度对酶解效率的影响
图2为底物浓度0.025 g/mL、反应时间2 d、酶/底物比1∶10条件下,不同反应温度对酶解率的影响。由图2可以看出,在低于50 ℃时,随反应温度增加,酶解率略有波动但当温度达到50 ℃左右时酶解率达到最高,这表明50 ℃是该酶在反应体系中活性最高。图3为反应时间2 d、酶/底物比1∶10、反应温度50 ℃下不同底物浓度对酶解率的影响。由图3可以看出,反应物浓度达到0.025 g/mL左右时酶解率最高,但进一步增加反应物浓度酶解率没有增加,反而有所下降。上述结果表明,底物浓度需要控制在0.026 g/mL以下,才能得到较高的产率。

图2 酶解率在不同温度下的变化趋势
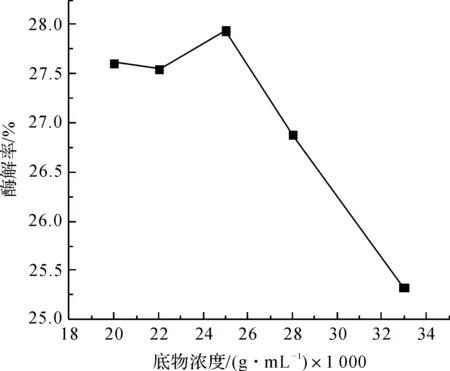
图3 酶解率随底物浓度的变化趋势
通过以上实验结果表明毛竹原料酶解的最佳条件为:毛竹原料和酶的质量比8∶1,底物浓度为0.025 g/mL,反应温度 50 ℃,时间控制在48 h。
2.1.2 稀酸处理酶解后的毛竹样品的反应条件优化
采用上述最佳酶解条件所获得酶解木质素进行温和酸解实验,探究酸解过程中pH值对木质素得率的影响,确定最佳反应pH值。图4是pH值对得到的产物木质素得率的关系曲线。从图4中可以看出,随着pH值降低,产物得率有所提高,最佳pH值为0.82,此条件下木质素得率最高(26.64%)。但随着pH值降低,产物得率下降,其原因可能是在强酸性的条件下,有木质素衍生物生成,但在后续的过滤、旋转蒸法及提纯过程木质素衍生物无法保留在产物中[9]。
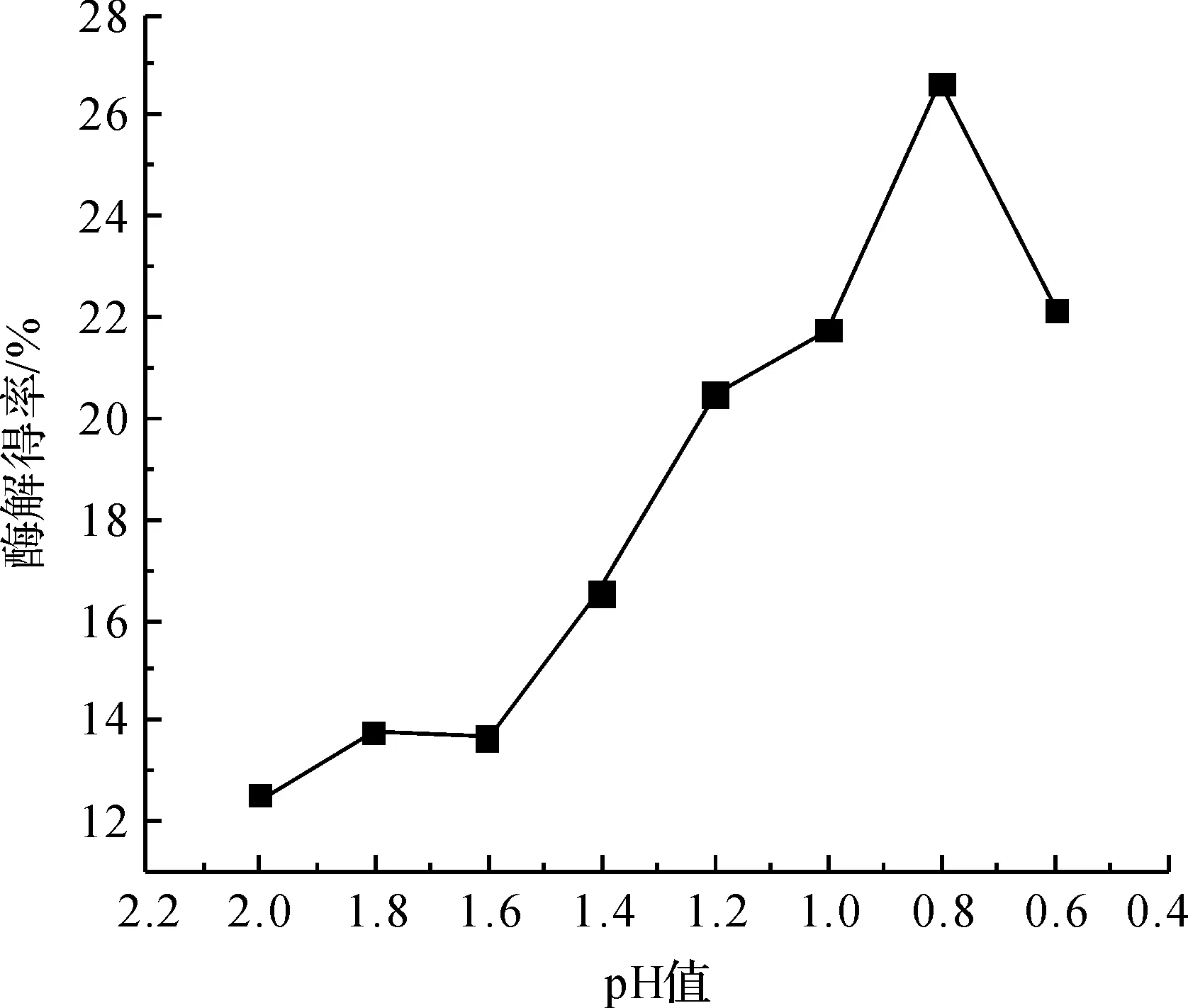
图4 pH值对稀酸处理后分离得到的木质素得率的影响
2.2 产物表征与分析
2.2.1 FT-IR法对酶解及酸解后的产物结构分析
分别对酶解后的毛竹样品和稀酸处理后得到的木质素样品进行红外光谱分析,获得两种产物的红外吸收光谱图(图5)。酶解处理后的毛竹样品有芳香环骨架的特征峰(1613.4、506.4 cm-1),甲基、亚甲基和次甲基 C-H 伸缩振动的特征峰(2920.4 cm-1),羟基O-H的伸缩振动峰(3405.7 cm-1),紫丁香基环中 C=O 伸缩振动(1327.5 cm-1)。与酶解处理后的毛竹样品相比,纤维素酶/稀酸处理法得到的木质素样品除具有芳香环骨架的特征峰1599.2、1508.6 cm-1和1262.0 cm-1,羟基O-H的伸缩振动峰3425.2 cm-1,甲基、亚甲基和次甲基 C-H 伸缩振动的特征峰2930.9 cm-1和2849.4 cm-1,紫丁香基中 C=O 伸缩振动峰(1329.4 cm-1)和共轭羰基中 C-H 变形振动峰(1123.0 cm-1),以及愈创木基特征峰1329.4、1033.5、832.1 cm-1[10],从图5中看出,较强的紫丁香基和愈创木基结构单元的特征吸收峰。上述结果显示本纤维素酶/稀酸处理法获得木质素样品较好地保留毛竹原料的原始结构。

a.酶解后毛竹样品; b.酸处理后的精炼木质素图5 经酶解及稀酸处理后样品的红外光谱图
2.2.21H-NMR法对稀酸处理后木质素产物结构的分析
纤维素酶/稀酸处理法得到的木质素样品的1H-NMR谱图如图6所示,图中,δ=2.5 ppm为溶剂(DMSO-d6)的溶剂峰,δ=0.7~1.8 ppm为脂肪族质子峰,δ=3.71 ppm为甲氧基的质子峰,脂肪族质子和质子谱峰最大,其在整个分离的木质素中含量最高。愈疮木基单元和紫丁香基单元苯环上质子的吸收峰分别体现在图6中δ=6.92 ppm和δ=7.75 ppm处,这表明木质素主要以甲氧基和愈疮木基组成,同时含有紫丁香基结构单元,木质素结构得到很好的保留。而δ=0.98 ppm为纤维素和半纤维素及一些碳水化合物的特征峰,其峰面积很小,因此该方法分离的木质素纯度很高。

图6 精炼木质素的1H-NMR谱图
2.2.3 精炼木质素的化学成分分析
将精制木质素的纯度和元素分析结果与常用的磨木木质素的相应成分进行对比,结果见表2。由表2可知,用纤维素酶/稀酸处理法所得的精炼木质素纯度和得率均有较大提高,其原因为用该方法分离的木质素,既可以在保证整个实验条件温和的条件下不破坏木质素的原始结构,又可以通过纤维素酶处理有效的去除木质素与纤维素、半纤维素和碳水化合物的结构连接,进而提高木质素的纯度和产率。元素分析可以显示:用纤维素酶/稀酸处理法所得的精炼木质素的氮含量相对较高,但含量保持在0.5 %以下,并不会影响对其化学结构的分析。

表2 精炼木质素的化学成分 %
3 结 论
a)在选用酶活为6827.53 U/g的纤维素酶作为酶解剂、pH值为4.5的醋酸盐缓冲液的条件下,酶和原料竹粉的质量比为1∶8,底物浓度为0.025 g/mL,在50 ℃下恒温摇床中反应48 h,此时的酶解率最高,为27.94 %。
b)在对酶解木质素进行温和酸解的过程中,反应最佳pH值为0.82,此条件下木质素得率最高,为26.64 %。
c)对精炼木质素进行FT-IR和1H-NMR分析,发现该毛竹木质素具有典型的紫丁香基和愈创木基,甲氧基等木质素结构中的特征峰,纤维素,半纤维素及碳水化合物的含量很少,说明用本试验方法分离的毛竹精炼木质素较好地保持原有毛竹原料的原始结构。
d)对精炼木质素进行化学成分分析,发现相较于传统的磨木木质素,纤维素酶/稀酸处理法所得的精炼木质素纯度和得率均有较大提高。虽然元素分析显示精炼木质素中的氮含量相对较高,但并不会影响对其化学结构的分析。
[1] YANG L, WANG D, ZHOU D, et al. Effect of different isolation methods on structure and properties of lignin from valonea of Quercus variabilis[J]. International Journal of Biological Macromolecules,2016,85(4):417-424.
[2] 蒋挺大.木质素[M].北京:化学工业出版社,2008:15-20.
[3] HOLTMAN L T. Printer with a reel for supplying an endless web of a recording medium: US, EP1661724[P].2006-04-25.
[4] AI M Q, WANG F F, HUANG F. Purification and characterization of a thermostable laccase from Trametes trogii and its ability in modification of kraft lignin[J]. Journal of Microbiology & Biotechnology,2015,25(8):56-75.
[5] LUCA Z, MARCO O, ARGYROPOULOS D S. Microwave-assisted lignin isolation using the enzymatic mild acidolysis (EMAL) protocol[J]. Journal of Agricultural & Food Chemistry,2008,56(21):10115-22.
[6] 武书彬,李梦实.麦草酶解-温和酸解木质素的化学结构特性研究[J].林产化学与工业,2006,26(1):104-108.
[7] 周慧敏,李亚鹏,赵妍,等.草菇纤维素酶活力测定条件确定及应用分析[J].上海农业学报,2014,30(4):89-92.
[8] GUSAKOVAV, SALANOVICH T N, ANTONOV A I, et al. Construction of highly efficient cellulase compositions for enzymatic hydrolysis of cellulose: US, US 8673618 B2[P].2014-04-14.
[9] 王少光,武书彬,郭伊丽,等.EMAL的分离及其特性[J].华南理工大学学报:自然科学版,2006,34(12):101-104.
[10] LEI M, ZHANG H, ZHENG H, et al. Characterization of lignins isolated from alkali treated prehydrolysate of corn stover[J]. Chinese Journal of Chemical Engineering,2013,21(4):427-433.
(责任编辑: 廖乾生)
Isolation of Lignin from Bamboo by the Method of Cellulase/Hydrolysis-Mild Acidolysis
WANGJian,ZHANGXiume,ZHOUYanan
(a. College of Materials and Textiles; b. Engineering Research Center for Eco-Dyeing & Finishing of Textiles,Ministry of Education, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Lignin from Zhejiang bamboo was isolated by the method of cellulose/hydrolysis-mild acidolysis. The reaction conditions of enzymatic hydrolysis process were optimized, and the effect of different pH on the lignin yield was also investigated. Finally, the best experiment condition was acquired, namely reaction temperature 50℃, the ratio of enzyme to substrate 1:8, substrate concentration 0.025 g/mL, reaction time 48h, pH 0.82. The lignin samples were characterized by FT-IR spectroscopy and1H-NMR analysis. The results show that bamboo lignin contained has typical characteristic peaks of syringyl and guaiacyl, while the characteristic peaks of cellulose, hemicellulose and carbohydrates are seldom seen. The chemical constituents of lignin separated by this method were analyzed. The results show that compared with traditional method MWL (milled wood lignin), the lignin isolated by the method of cellulose/hydrolysis-mild acidolysis has higher purity and yield.
bamboo; lignin; enzymatic hydrolysis; mild acidolysis
10.3969/j.issn.1673-3851.2017.05.011
2016-09-27 网络出版日期: 2017-03-28
浙江省自然科学基金项目(LY14C16004)
王 健(1990-),黑龙江鹤岗人,男,硕士研究生,主要从事木质素的分离、降解及其结构方面的研究。
张秀梅,E-mail:xiumei@zstu.edu.cn
O636.2
A
1673- 3851 (2017) 03- 0371- 05

