直喷离子化质谱简单快速鉴别关木通
张朝辉+谷陟欣+刘婧靖+陈应庄+陈波+马铭

摘 要 采用直喷离子化质谱技术,通过对关木通的敞开式质谱轮廓分析,对关木通和其它两种木通(木通、川木通)进行了快速鉴别,建立了关木通中木兰花碱的快速测定方法。结果表明,可以利用标志性成分木兰花碱对马兜铃科关木通进行鉴别; 同时,在正离子模式下,以荷叶碱为内标,木兰花碱与内标的信号强度比与木兰花碱标准溶液的浓度,在0.50~20.00 mg/L范围内线性关系良好,相关系数为0.9989,检出限为0.1 mg/L。 本方法简单、快速、无需样品前处理,可用于有毒药材关木通的直接、原位、快速分析和鉴定。本研究结果对木通中药材的质量控制具有重要参考价值。
关键词 直喷离子化质谱; 关木通; 木兰花碱; 马兜铃酸A
1 引 言
木通为常用中药,可分为木通、川木通与关木通,历史上三者被允许混用。虽然传统上它们统称为木通,但三者来源不同,木通属于木通科,川木通属于毛茛科,关木通属于马兜铃科[1]。丁林生等[2,3]对关木通的化学成分进行研究,发现其含马兜铃酸和木兰花碱等成分。关木通中含有的马兜铃酸A会引起人体肾脏损害,属“有毒”类中药,已于2003年被取消了用药标准。但由于历史遗留问题以及木通资源短缺等原因,关木通在市场上作为木通、川木通的替代品的现象屡禁不止。因此,建立一种快速、简单的关木通、木通和川木通的鉴别方法至关重要。
传统的鉴别木通方法主要是根据3种药材外观性状的异同,依靠经验进行区分,鉴别结果不够准确。谢丽莎等[4]利用紫外光谱组法对3种木通进行了鉴别,但是它们的紫外吸收光谱很接近,需先求得吸光系数再根据吸光系数的差异进行鉴别; 李睿等[5]采用近红外漫反射光谱法对3种木通进行了鉴别,但该方法需要经二阶导数处理后建立聚类分析模型; 孙萍等[6]利用LC-MS技术对3种木通进行了鉴定,但需要经过繁琐的样品前处理过程,有机溶剂消耗大、操作繁琐费时。
敞开式质谱技术作为一种快速分析技术,具有无需或仅需简单的样品前处理、可实现样品原位分析等优点[7~9]。自2004年Cooks等[10]提出该技术以来,得到了迅速发展。直喷离子化技术是敞开式质谱技术的一种,由于它具有简单、易操作、溶剂消耗少等特点,近年来被广泛应用于环境、食品、药品及公共安全等领域[11~13]。然而,利用直喷离子化技术直接鉴别3种木通的研究还未见文献报道。
本研究采用直喷离子化质谱技术,通过对关木通的敞开式质谱轮廓进行分析,提出了将木兰花碱作为关木通标志性成分进行鉴别的方法,并采用荷葉碱作为内标,对关木通中的木兰花碱含量进行了半定量测定。本方法简单、快速、灵敏,对木通的真伪鉴别,尤其是有毒中药材关木通的鉴别具有重要意义。
2 实验部分
2.1 仪器与试剂
Thermo Finnigan-LCQ离子阱质谱,配LCQ-tune工作站(英国菲尼根公司); 高压直流电源(天津东文高压电源有限公司); LC-20AT 高效液相色谱仪(日本岛津公司); 高速万能粉碎机(北京市永光明医疗仪器有限公司); KQ3200E型超声波发生器(昆山市超声仪器有限公司); 喷雾滤纸购买于沃特曼公司。
马兜铃酸A和荷叶碱对照品(中国药品生物制品检定所); 木兰花碱对照品(上海源叶生物科技有限公司); 甲醇为色谱纯,其它试剂均为分析纯,购于国药集团; 实验用水为二次蒸馏水。木通科木通、毛茛科川木通、马兜铃科关木通等药材均由九芝堂药学专家提供并进行鉴定。
2.2 质谱条件
实验采用ESI离子源正离子模式,扫描范围m/z 100~1000; 无需气体; 喷雾电压:+3.50 kV; 毛细管锥孔电压:10 V; 源温度:250℃。二级质谱碰撞能量:30%。
2.3 实验方法
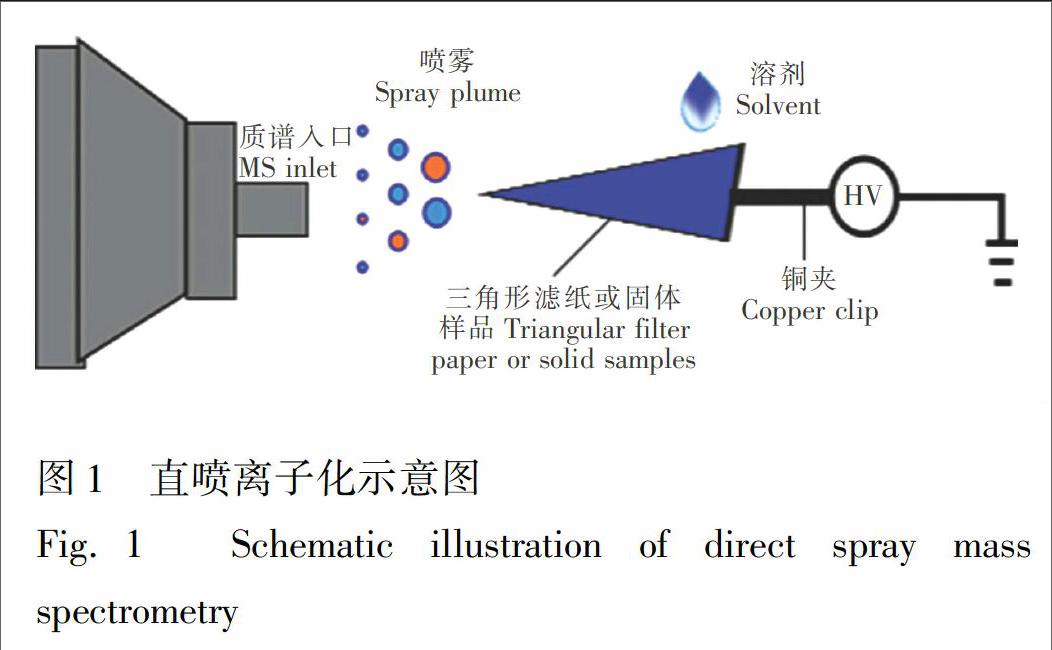
直喷离子化技术主要在一个三角形滤纸(或其他小尖端物体)上进行:少量样品被提前加在滤纸(或其它小尖端物品)上,再用少量溶剂湿润样品载体或样品本身,施加高压,此时样品被离子化,进入质谱仪。此技术分为样品装载、分离、离子化3个过程。直喷离子化示意图如图1。为了保证结果的重现性和准确性,滤纸或样品尖端距质谱入口的距离固定在5~10 mm左右。实验中,液体样品的进样采用纸喷雾方式,固体样品的进样采用直接喷雾方式。
2.4 木兰花碱纸喷雾半定量分析
标准曲线的绘制:采用荷叶碱作为内标,以木兰花碱与荷叶碱的信号强度比作为纵坐标,木兰花碱标准溶液的浓度作为横坐标建立标准曲线。木兰花碱的系列标准溶液浓度分别为0.50、1.00、5.00、10.00和20.00 mg/L,内标荷叶碱的含量均为4 mg/L。用沃特曼滤纸做载体,取15 μL混合标准溶液进行喷雾分析。
样品溶液的处理:称取关木通药材粉末0.4 g, 加入20.00 mL无水乙醇(含冰乙酸0.50 mL),浸泡0.5 h,超声提取0.5 h,2000 r/min离心15 min,取上清液,加入计算量的内标溶液,最后用甲醇稀释至20 mL(内标荷叶碱的含量为4 mg/L)。
3 结果与讨论
3.1 木通、川木通与关木通药材直接喷雾分析
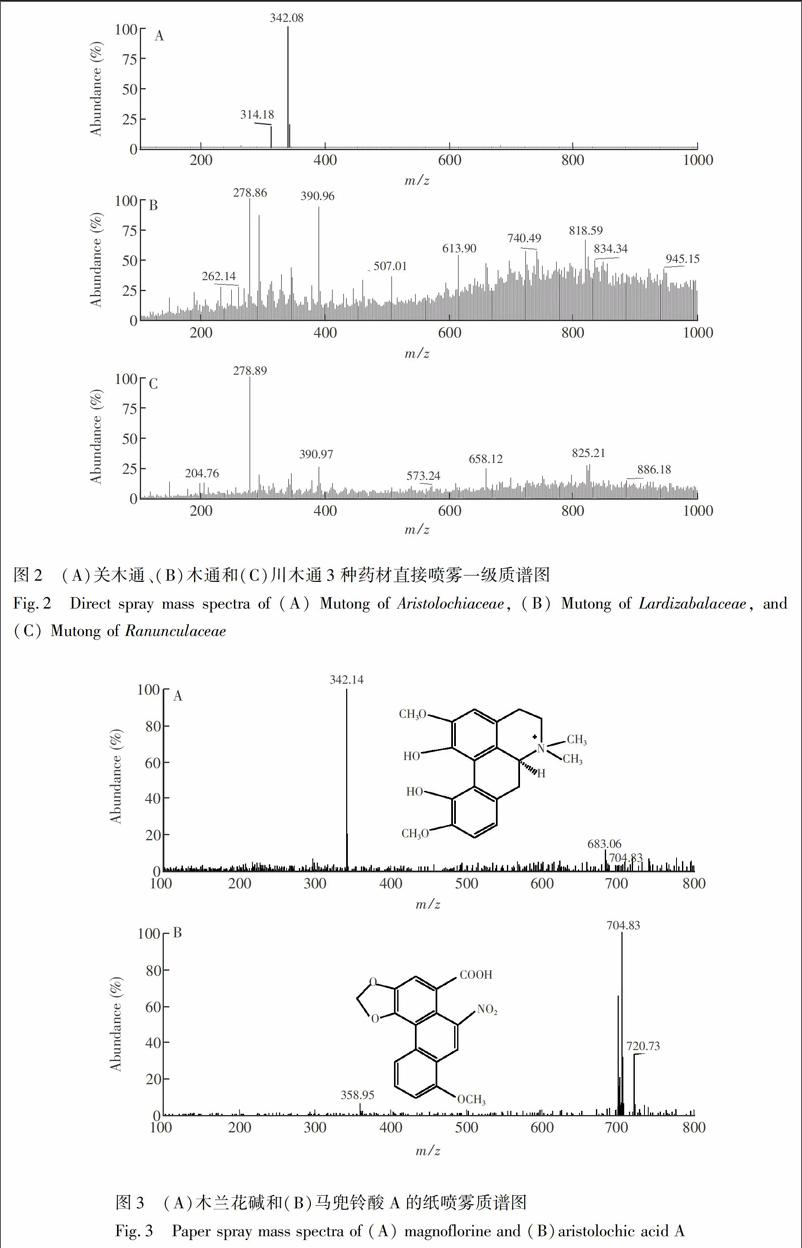
在2.2节质谱条件下,对3种木通药材进行了直接喷雾和一级全扫描质谱分析(图2)。由图2可知,在关木通的质谱中可以明显观测到m/z 342.08强峰,而木通、川木通在上述特征峰位置均无相应的峰出现。
3.2 关木通的特征峰分析
3.2.1 标准溶液纸喷雾分析 根据关木通中特征峰m/z 342.08的信息,推测此特征峰可能为马兜铃酸A (C17H11NO7,分子量341.27 )或木兰花碱(C20H24NO+4,分子量342.41)。为此,在同样质谱条件下,对两种物质的标准溶液进行了纸喷雾质谱分析。由图3B可知,马兜铃酸A一级质谱主要质谱峰为[M+NH4]+(m/z 358.95)离子、[2M+NH4]+(m/z 699.76)离子和[2M+Na]+(m/z 704.83)离子,其中[2M+Na]+离子为基峰,在m/z 342处没有相应的分子离子峰,此结果与文献报道吻合[14] 。而木兰花碱的一级质谱在m/z 342处有很强的峰 (图3A)。
3.2.2 m/z 342纸喷雾二级质谱分析 为了进一步验证关木通中的m/z 342峰的归属,对关木通提取液和木兰花碱标准溶液中m/z 342峰进行了纸喷雾二级质谱分析。由图4可知,两者的碎片几乎完全一样,各碎片离子的相对丰度也基本一致,且都以m/z 297.07为基峰,由此可以证明,关木通药材中的m/z 342.08峰确为木兰花碱。
3.2.3 关木通中马兜铃酸A和木兰花碱成分的液相色谱分析 为了验证关木通中的马兜铃酸A和木兰花碱成分,同时利用液相色谱进行了结果验证,结果见图5。比较标准溶液和提取液的液相色谱分析结果及各峰相应的紫外图谱可知,关木通中确实存在马兜铃酸A和木兰花碱成分。
然而,关木通的敞开式质谱直喷测定结果中,并没有发现马兜铃酸A的特征离子,究其原因,马兜铃酸A加合离子多,敞开式质谱响应灵敏度较低。另一方面,從木兰花碱(5 mg/L)和马兜铃酸A(10 mg/L)混合标准溶液的一级质谱图(图6)可见,木兰花碱的存在干扰了马兜铃酸A的响应。
由于木兰花碱的质谱响应好,压低了马兜铃酸A的信号,从谱图上只能见到木兰花碱的峰,而见不到马兜铃酸A的峰。由此可见,利用马兜铃酸A难以进行关木通的鉴定,相反,采用响应信号好的木兰花碱进行鉴别,可以获得更可靠的关木通鉴定结果。
3.3 关木通中木兰花碱的半定量分析
因马兜铃酸A和木兰花碱分子量相近,紫外响应也很接近,相互干扰测定。采用敞开式质谱分析方法,可以去除关木通中马兜铃酸A的干扰,对其中的木兰花碱进行半定量测定。以荷叶碱为内标,以木兰花碱与内标的信号强度比为纵坐标,木兰花碱标准溶液的浓度为横坐标建立线性关系,在 0.50~20.00 mg/L范围内测得两者线性相关,相关系数达到0.9989,检出限为0.1 mg/L,对1.00、5.00和10.00 mg/L 3个浓度水平的木兰花碱平行测定,测得木兰花碱浓度的RSD<5%。
按照2.4节进行样品处理,平行6次,测得关木通提取液中木兰花碱的平均含量为984.3 μg/g,RSD为4.7%。说明本方法可用作关木通中木兰花碱半定量分析的依据。本方法在无需样品预处理的情况下,能够根据木兰花碱快速鉴别关木通,并且检测结果稳定,具有较好的重复性。
4 结 论
采用直喷离子化质谱检测技术,在无需样品预处理的前提下,通过对关木通药材进行直喷分析,分析了其中马兜铃酸A和木兰花碱的敞开式质谱,获得了其正离子模式下的指纹图谱,找出了其中的标志性成分木兰花碱,建立了快速检测关木通中木兰花碱的半定量分析方法,可成功应用于有毒药材关木通与木通、川木通的鉴别。本方法简单、快速、准确,为中药材的质量控制提供了参考。
References
1 ZHOU Juan-Juan, PAN Jin-Huo. Her. Med., 2009, 28(5): 620-622
周娟娟, 潘金火. 医药导报, 2009, 28(5): 620-622
2 LIU Yang-Qing, ZHAO Hui-Hui, HOU Na, ZHAO Ping. Chinese J. Anal.Chem., 2006, 34(S1): 161-164
刘养清, 赵慧辉, 侯 娜, 赵 平. 分析化学, 2006, 34(S1): 161-164
3 SHANG Ming-Ying, LI Jun, HU Bo, YANG Shan, LI Chang-Ling, ZHENG Jun-Hua. Chinese Tradit. Herbal Drugs, 2000, 31(12): 899-900
尚明英, 李 军, 胡 波, 杨 珊, 李长龄, 郑俊华. 中草药, 2000, 31(12): 899-900
4 XIE Li-Sha, TAN Yuan-Feng. Shanghai J.Tradit. Chinese Med., 2004, 38 (9): 58-59
谢丽莎, 谈远峰. 上海中医药杂志, 2004, 38 (9): 58-59
5 LI Rui, FAN Xia-Lei, ZHOU Xiao-Hua, FENG You-Long. Chinese J. Pharmaceut., 2011, 42 (12): 933-936
李 睿, 樊夏雷, 周小华, 冯有龙. 中国医药工业杂志, 2011, 42 (12 ): 933-936
6 SUN Ping, LUO Guo-An. J. Chinese Med. Mat., 2004, 27(12): 898-901
孙 萍, 罗国安. 中药材, 2004, 27(12): 898-901
7 CHEN Huan-Wen, HU Bin, ZHANG Xie. Chinese J. Anal.Chem., 2010, 38(8): 1069-1088
陈焕文, 胡 斌, 张 燮. 分析化学, 2010, 38(8): 1069-1088
8 FENG Bao-Sheng, BAI Yu, LIU Hu-Wei. University Chem., 2013, 28(4): 1-8
冯鲍盛, 白 玉, 刘虎威. 大学化学, 2013, 28(4): 1-8
9 Feng B S, Zhang J L, Chang C L, Li L P, Li M, Xiong X C, Guo C G, Tang F, Bai Y, Liu H W. Anal. Chem., 2014, 86 (9): 4164-4169
10 Takals Z, Wiseman J M, Gologan B, Cooks R G. Science, 2004, 306(15): 47l-473
11 Chan S L F, Wong M Y M, Tang H W, Che C M, Ng K M. Rapid Commun. Mass Spectrom., 2011, 25(19): 2837-2843
12 Malaj N, Ouyang Z, Sindonaa G, Cooks R G. Anal. Methods, 2012, 4(7): 1913-1919
13 LUO Li-Ping, WANG Jiang, ZHANG Wen-Jun, DAI Xi-Mo, FANG Xiao-Wei, ZHANG Xi, LIU Ya-Li, CHENG Huan-Wen. Chinese J.Anal.Chem., 2013, 41(7): 1050-1056
罗丽萍, 王 姜, 章文军, 戴喜末, 方小伟, 张 茜, 刘亚丽, 陈焕文. 分析化学, 2013, 41(7): 1050-1056
14 Yuan J B, Liu Q, Wei G B, Tang F, Ding L, Yao S Z. Rapid Commun. Mass Spectrom., 2007, 21(14): 2332-2342

