基于纤维降解能力分析的青贮饲料发酵用灵芝菌株的筛选
丁琳 薛绿艳 赵雅敏 钱蕾 李佳华 卢晓凤 曹军

摘要[目的]获得较适宜秸秆降解的灵芝菌株。[方法]通过显色圈法初筛和比色法复筛从28株食品级灵芝菌种中筛选适宜秸秆发酵的灵芝菌株的方法。[结果]添加黑芝进行青贮饲料的辅助发酵,经过1 d即可进入乳酸发酵阶段,45 d即可获得pH小于4.2的青贮饲料,且具有较高的纤维素酶和木质素酶活力的菌株发酵所得的饲料中乳酸含量更高。[结论]添加灵芝可以加速乳酸发酵的起始时间,并能缩短青贮饲料发酵的周期,提高饲料中的乳酸含量。
关键词灵芝;青贮饲料;纤维降解;乳酸发酵
中圖分类号S816.5+3文献标识码A文章编号0517-6611(2017)17-0088-03
Abstract[Objective] To screen out Ganoderma lucidum strain for straw degradation. [Method] Ganoderma lucidum strain for straw fermentation was screened out from 28 strains of foodlevel strains of G. lucidum by color circle method and colorimetric screening. [Result] Ganoderma neojaponicum was added to assist the fermentation of silage, it entered the fermentation stage of lactic acid after one day. After 45 days, silage with pH of less than 4.2 was obtained. The feed fermented with strain with higher activities of cellulase and ligninase had high content of lactic acid. [Conclusion] Adding G. lucidum can accelerate the start time of lactic acid fermentation, shorten the cycle of silage fermentation, and increase the content of lactic acid in feed.
Key wordsGanoderma lucidum;Silage;Fiber degradation;Lactic acid fermentation
基金项目南通大学大学生创新训练计划项目(2016061)。
作者简介丁琳(1995—),女,江苏江阴人,本科生,专业:微生物学。*通讯作者,讲师,博士,从事天然产物活性研究。
收稿日期2017-04-12
目前,世界秸秆的年产量为20亿~30亿t,我国近年秸秆可收集资源量约3亿t/a,由于多种原因,1/3以上的秸秆被废弃或直接焚烧,造成了极大的资源浪费[1]。秸秆经过青贮发酵后不仅能保存青绿饲料的新鲜和绝大部分的营养,而且还可以增加饲料芳香的酸味、使饲料柔软多汁、能刺激家畜的食欲、消化液的分泌和肠道的蠕动,增加采食量,提高饲料的消化利用率[2]。尽管国内外的现有研究结果已经提供了青贮饲料的基本加工工艺及过程,并对其加工工艺进行了优化,如通过添加各类微生物、添加糖源、添加纤维素制剂等方式促进青贮体系乳酸发酵的进行[3],但青贮饲料的制作过程仍存在发酵周期长、纤维素类物质降解不充分、动物吸收率不高等问题。
笔者尝试采用灵芝进行青贮饲料的发酵,利用灵芝的纤维素酶和木质素酶进行秸秆纤维类组分的降解,并利用靈芝代谢的各类活性物质调节动物的免疫等,以改善青贮饲料的品质。笔者对实验室现有灵芝菌种进行了筛选,考察各株菌的纤维素酶及木质素酶活力,以期获得具有较高纤维素酶和木质素酶活力的菌株,提高发酵体系中的小分子糖比例,旨在为后续的灵芝辅助发酵秸秆的相关试验奠定基础,为秸秆的综合利用提供借鉴。
1材料与方法
1.1试验材料
为保证发酵饲料的安全性,试验所用灵芝菌种均为医用或食用菌株,所有菌株购自梁山正大食用菌研究所,共28株。
1.2试验方法
1.2.1菌种的活化。
将菌种接种于PDA平板上,28 ℃下培养4~5 d,待其菌丝长到整个平板的2/3后,取边缘菌丝再次转接到PDA平板上,28 ℃下培养进行二次活化。
1.2.2纤维素酶及木质素酶活力的半定量分析[4-5]。
①纤维素酶。采用刚果红透明圈法,将固体活化的菌种接种于含1% CMC的PDA平板上,28 ℃下培养3 d,用0.1%刚果红染液染色30 min后,弃染液,用1 mol/L NaCl溶液脱色1 h后测量菌落直径d和透明圈直径D,以D/d为筛选指标,初步筛选出纤维素酶活力较高的菌株。
②木质素酶。采用愈创木酚法,将菌种接种于含有001%愈创木酚的PDA平板上,28 ℃下培养3 d,测量菌落直径d和透明圈直径D,以D/d为筛选指标,初步筛选出木质素酶活力较高的菌株。
1.2.3纤维素酶及木质素酶活力的定量分析[4-5]。
用直径1 cm的打孔器将PDA平板上的边缘菌丝接种到秸秆产酶培养基[1 L含秸秆粉(玉米秸秆粉碎后过100目筛)10 g、硫酸铵4 g、磷酸二氢钾2 g、七水硫酸镁0.5 g、蛋白胨10 g、牛肉膏5 g]中28 ℃、180 r/min培养3 d,取发酵液6 000 r/min离心25 min,上清液即为粗酶液。
1.2.3.1纤维素酶活力的测定。
采用DNS显色法测定,反应体系中加入1.5 mL 1% CMC溶液,再加入0.5 mL粗酶液,50 ℃水浴30 min(對照无需水浴),再加入2 mL DNS溶液,沸水浴5 min,流水冷却至室温,于540 nm处测定吸光值。
纤维素酶活力单位定义为1 min内转化1 μmol/L底物所需的酶量为1个活力单位(U)。
1.2.3.2木质素酶活力的测定。
(1)漆酶(Lac酶)活力。漆酶活力的测定采用ABTS氧化法。反应体系中加入500 μL 100 mmol/L pH 4.5的丙二酸缓冲液,再加入500 μL 0.6 mmol/L的ABTS,30 ℃水浴5 min,对照无需水浴并置于冰上。最后,加入50 μL粗酶液启动反应,在420 nm处测量吸光度,并记录l min内吸光值的变化。
(2)锰过氧化物酶(Mnp)活力。反应体系中加入500 μL 100 mmol/L pH 4.5的丙二酸缓冲液和100 μL 10 mmol/L MnSO4,并加入350 μL的蒸馏水维持一定的体系,再加入10 mmol/L 的H2O2 10 μL,30 ℃水浴5 min,对照无需水浴并置于冰上。最后,加入50 μL的粗酶液启动反应,在270 nm处测量吸光度,并记录1 min内吸光值的变化。
(3)木质素过氧化物酶(LiP)活力。反应体系中加入500 μL 200 mmol/L pH 3.0的酒石酸缓冲液和100 μL 40 mmol/L的藜芦醇,并加入350 μL的蒸馏水维持一定的体系,再加入20 mmol/L的 H2O2 10 μL,30 ℃水浴5 min,对照无需水浴并置于冰上。最后,加入50 μL的粗酶液启动反应,在310 nm波长处测定吸光度,并记录1 min内吸光值的变化。
木质素酶活力单位定义为单位时间内吸光度变化0.1为1个活力单位(U)。
1.2.4青贮饲料的制备及质量分析。
1.2.4.1
灵芝菌种的液体发酵。将灵芝接种于PDA培养基,28 ℃条件下倒置培养3 d,然后打孔取菌饼接入100 mL PDA液体培养基,28 ℃、150 r/min振荡培养3 d,获得种子培养液。按1%的比例接种于液体发酵罐中,28 ℃,搅拌转数200~500 r/min,控制溶氧量在30%,发酵5 d后获得pH为(4.5±0.5)的含悬浮菌丝的发酵液(菌体干重达8~9 g/L),用于青贮饲料的发酵。
1.2.4.2
青贮饲料的制备[6]。将玉米在乳熟后期收获(含水量65% ~ 70%),切成1~2 cm的小段,分装在青贮袋中,每装入20~30 g青贮袋中压实1次,减少残留空气,每袋装100 g。试验组按3%的比例接种灵芝发酵液,每种菌株做3个平行,常温密闭发酵,分别放置1、2和45 d,开袋即获得灵芝青贮饲料;对照组不接菌。
1.2.4.3
酸度的测定[7]。称取10 g青贮饲料,浸入25 mL蒸馏水中,4 ℃密封过夜,抽滤,取滤液,使用pH计测定饲料直接酸度。取2 mL滤液,用2 mL乙酸乙酯萃取,回收上层乙酸乙酯,取5 μL进行气相色谱分析(GCMS2010-QP2010,岛津)。分析条件如下:进样室温度240 ℃,FID检测器温度250 ℃,1∶5分流进样,色谱柱为Ptx-5(30 m×0.25 mm×025 μm,Restek,USA),载气为氮气,柱温90 ℃,乳酸保留时间为2.338 min。
1.3数据处理
试验结果均以平均值±标准差表示。使用Excel 2007软件对试验数据进行统计分析与绘图,组间差异显著性采用t检验分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2结果与分析
2.1纤维素酶和木质素酶活力的半定量分析
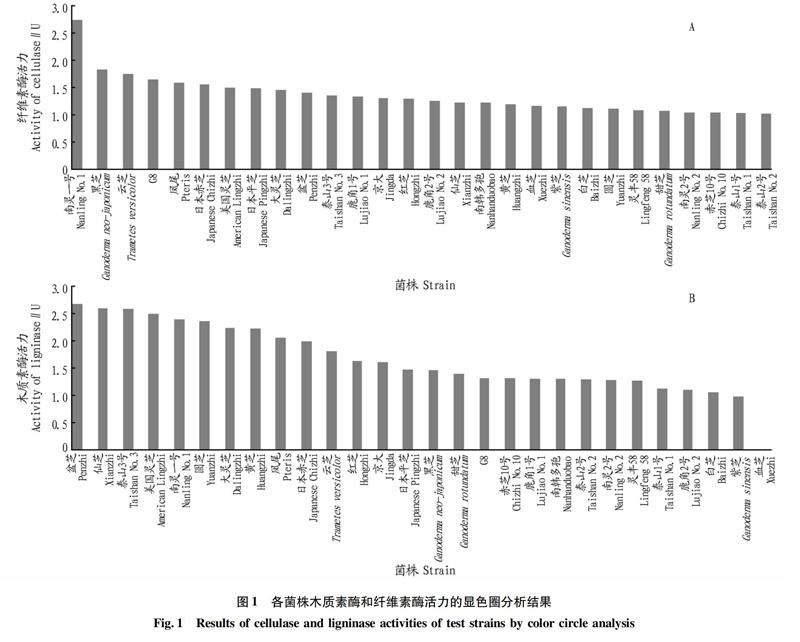
为初步筛选出纤维素和木质素降解能力较强的菌株,采用显色圈法进行了各菌株纤维素酶和木质素酶活力的初步分析,结果如图1所
示。秸秆中纤维素的比例最高,其次为木质素和半纤维
素,但是纤维的微观结构则是成束的纤维素被包在半纤维素和木质素的包层中间。如需将秸秆中的纤维素降解为小分子糖类以供青贮微生物发酵的进行,则需要具有较高木质素酶活的菌株完成木质素的降解,以充分暴露纤维素[6]。通过以上试验发现,不同菌株间纤维素酶和木质素酶的活力存在较大差异。从适宜秸秆发酵的角度来看,首先从28株灵芝菌种中排除木质素酶活较低的9株菌,并在剩余的19株菌中选取纤维素酶活较高的9株菌进行后续的纤维素酶和木质素酶活力的定量分析。经过初步筛选可知,纤维素酶和木质素酶活力较高的菌株为南灵一号、黑芝、云芝、G8、日本赤芝、美国灵芝、日本平芝、盆芝、大灵芝,并继续以凤尾为对照,进行后续的纤维素外切酶、纤维素内切酶、过氧化物酶、漆酶、锰过氧化物酶活力的定量分析。
2.2纤维素酶和木质素酶活力的定量分析
通过对筛选出的9株菌的纤维素酶和木质素酶活力进行测定,发现各菌株的不同酶类间的活力也存在较大差异,结果如表1所示。
由于产酶培养基中添加了秸秆粉,有利于考察各菌株秸秆利用的能力。在以秸秆为纤维素和木质素来源的培养基中,云芝、日本平芝和黑芝表现出较强的木质素降解能力,其他菌株的木质素酶活力较低,有些酶的活力低于检测灵敏限。从纤维素降解能力来看,盡管南灵一号和大灵芝与云芝、日本平芝和黑芝相比具有更强的纤维素降解能力,但其木质素酶活力相对较低,对木质素的降解能力有限,会限制秸秆发酵过程中纤维素的降解与利用。具有较高木质素酶活力的云芝、日本平芝和黑芝则可以更好地分解秸秆,一方面可以为发酵体系中微生物的生长提供更好的碳源,另一方面也更利于动物对纤维的消化。
從纤维素的水解方式来看,由于纤维素属于大分子糖類,较高的内切酶活力更容易将大分子打断成小分子,增加外切酶的作用位点,可以获得更好的水解效果,因此通过比较云芝、日本平芝和黑芝的纤维素内切酶和外切酶活力,选择内切酶活力较高的黑芝进行秸秆发酵的初步试验。
2.3青贮饲料的质量分析
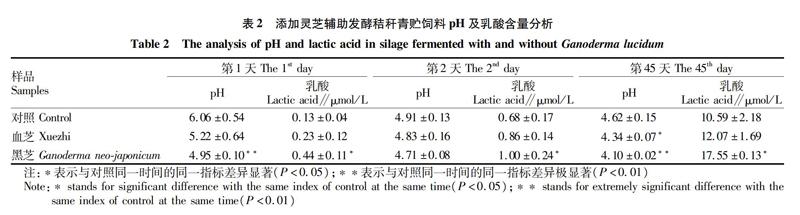
青贮饲料是在密封环境下完成乳酸发酵获得的,其品质要求pH降至4.2以下,并能保持较好的稳定性,因此pH和乳酸是青贮饲料品质评价的基本指标。灵芝是好氧菌,可以迅速消耗密封环境中的氧气,促进乳酸发酵的起始。由表2可知,接种组的秸秆发酵1 d后,样品中的乳酸产量较对照组显著提高(P<0.05),体系的pH也发生显著下降(P<0.01),且黑芝较血芝的变化明显。发酵第2天,对照组也进入厌氧发酵阶段,灵芝辅助发酵处理组的pH和乳酸产量与对照组不存在显著差异。发酵45 d后,灵芝接种组的pH较对照组低,接种黑芝的样品pH已降至4.2以下,达到了青贮饲料的成品要求,且对应样品中的乳酸水平也较对照组显著提高(P<0.05)。
3讨论与结论
青贮饲料作为家畜冬季青绿饲料的重要来源,不仅可以为家畜提供具有良好营养和口感的饲料,而且可以解决大量作物秸秆废弃物带来的环境问题。为进一步改善青贮饲料的口感和营养,越来越多的研究将重点放在青贮添加剂上,特别是特殊菌群的添加。笔者筛选出具有较高木质素酶和纤维素酶活力的灵芝菌株,进行青贮饲料的发酵,获得了较理想的青贮饲料成品。
青贮饲料的发酵分为2个阶段:第1阶段为耗氧发酵阶段,体系中的微生物通过生长代谢,消耗氧气;第2阶段为厌氧发酵阶段,氧气耗净后体系进入以乳酸发酵为主的青贮主发酵阶段[3]。该试验过程中添加活的灵芝菌,在发酵的前期通过降解秸秆进行生长,生长过程中消耗氧气,从而缩短了耗氧发酵的周期,使发酵过程提前进入乳酸发酵阶段,同时为乳酸菌的生长保留更多可利用的营养物质;在发酵过程中,灵芝还可以代谢产生纤维素酶和木质素酶,通过降解植物纤维成分提供糖类物质,促进体系中有益菌的生长,且不会产生其他真菌发酵产生的霉味。该试验结果表明,采用具有较高木质素酶和纤维素酶活力的黑芝辅助发酵,1 d后即可检测到乳酸发酵产物,45 d即可达到青贮饲料的品质要求,缩短了常规需要60 d的发酵过程。
此外,灵芝还具有很多活性代谢产物,可以从多个方面来提高青贮饲料的品质,如灵芝发酵产物灵芝多糖具有抑制芽孢菌生长的活性[8],可以减少发酵过程中芽孢菌生长引起2次发酵而产生的不良气味,可以抑制部分霉菌的生长,提高青贮饲料的开口稳定性;灵芝本身可代谢产生灵芝多糖及灵芝三萜类成分[9],提高饲喂动物的免疫力,从而减少动物疾病的发生等。该研究仅初步确定了灵芝辅助发酵青贮饲料的菌株,后续将继续进行灵芝辅助发酵对发酵体系微生物菌群的影响,及灵芝青贮饲料对动物免疫力的影响等相关试验,完成对灵芝辅助发酵青贮饲料的产品开发。
参考文献
[1] 韦茂贵,王晓玉,谢光辉.中国各省大田作物田间秸秆资源量及其时间分布[J].中国农业大学学报,2012,17(6):32-44.
[2] 周德宝.青贮饲料的研究、发展及现状[J].氨基酸和生物资源,2004,26(2):32-34.
[3] 倪奎奎.全株水稻青贮饲料中微生物菌群以及发酵品质分析[D].郑州:郑州大学,2016.
[4] 魏艳红.纤维素酶产生菌的分离鉴定及产酶条件优化[D].武汉:华中师范大学,2009:12-14.
[5] 杨礼富,谢贵水,王真辉,等.木质纤维素酶高产菌株的筛选和鉴定[J].热带作物学报,2001,22(3):70-77.
[6] RIBEIRO G O,GONALVES L C,PEREIRA L G,et al.Effect of fibrolytic enzymes added to a Andropogon gayanus grass silageconcentrate diet on rumen fermentation in batch cultures and the artificial rumen(Rusitec)[J].Animal,2015(20):1-10.
[7] BROBERG A,JACOBSSON K,STRM K,et al.Metabolite profiles of lactic acid bacteria in grass silage[J].Appl Environ Microbiol,2007,73(17):5547-5552.
[8] 周金凤,姚强,张露萍,等.灵芝不同培养基发酵液粗提物抑菌活性研究[J].中国酿造,2010(3):53-55.
[9] WEI Z H,DUAN Y Y,QIAN Y Q,et al.Screening of Ganoderma strains with high polysaccharides and ganoderic acid contents and optimization of the fermentation medium by statistical methods[J].Bioprocess Biosyst Eng,2014,37(9):1789-1797.

