肺癌细胞株中EPS8表达下降对顺铂化疗敏感性的影响
杜海坚,李伟峰,孙青峰,王元亨,黄文杰
(1.广州军区广州总医院 呼吸内科,广东 广州 510010;2.广东药科大学,广东 广州 510006;3.中国人民解放军第四军医大学,陕西 西安 710000)
肺癌细胞株中EPS8表达下降对顺铂化疗敏感性的影响
杜海坚1,李伟峰1,孙青峰2,王元亨3,黄文杰1
(1.广州军区广州总医院 呼吸内科,广东 广州 510010;2.广东药科大学,广东 广州 510006;3.中国人民解放军第四军医大学,陕西 西安 710000)
目的探究肺癌细胞株中表皮生长因子受体通路底物8(EPS8)表达下降对顺铂化疗敏感性的影响。方法脂质体转染法将EPS8沉默后并通过实时荧光定量聚合酶链反应(qRT-PCR)检测EPS8在各细胞系的沉默效率。采用Caspase-3/7细胞凋亡实验检测,5 μmol顺铂对淋巴母细胞样细胞系(LCLs)和A549肺癌细胞凋亡的影响。Alamar Blue细胞生长抑制实验中采用0.01 μmol/L光神霉素A作为EPS8抑制剂单用及联用不同浓度顺铂,Alamar Blue细胞生长抑制实验检测其对癌和非癌细胞系生长抑制的影响。结果与对照组比较,LCLs细胞系中EPS8的沉默导致顺铂干预时细胞存活率升高7.9%,凋亡率下降8.7%。与此相反,顺铂干预导致肺癌细胞存活率下降20.6%。光神霉素A在LCLs细胞系中能够降低EPS8的表达,并与对照组比较,非癌细胞系LCLs在顺铂干预时具有更低Caspase-3/7活性,凋亡率降低。在5种非小细胞肺癌(NSCLC)细胞系中,光神霉素A同样能够导致EPS8表达下降。与LCLs细胞系比较,光神霉素A的干预能够使4种NSCLC细胞和膀胱癌细胞HTB9对顺铂的敏感性增加(P<0.05),但NSCLC中存在EGFR突变的H1975细胞对顺铂的敏感性并未出现统计学改变(P>0.05)。结论通过核糖核酸(RNA)干扰或者光神霉素A将EPS8表达抑制后,肿瘤细胞对顺铂的敏感性升高,而正常细胞LCLs对其敏感性却出现下降。对EPS8分子机制的进一步研究有望其成为抗肿瘤治疗的新靶点。
顺铂;光神霉素A;敏感性;淋巴母细胞样细胞;非小细胞肺癌
Abstract:ObjectiveTo evaluate the role of epidermal growth factor receptor pathway substrate 8 (EPS8)in cellular susceptibility to cisplatin in tumor cells and normal cells.MethodsEPS8 RNA interference was used to determine EPS8 silencing efficiency in each cell line by qRT-PCR.Caspase-3/7 was used to detect the apoptosis of lymphoblastoid cell lines(LCLs)and A549 lung cancer cell when treated with 5 μmol/L cisplatin after EPS8 was silenced.In the Alamar Blue cell growth inhibition assay,0.01 μmol/L mycophenolate as anEPS8 inhibitor was used alone or in combination with different concentrations of cisplatin to detected its effect on the growth inhibition of cancer and non-cancer cell lines.ResultsCompared with the control group,the survival rate of EPS8 in LCLs cell line was increased by 7.9%and the apoptosis rate decreased by 8.7%.In contrast,cisplatin intervention resulted in a 20.6%reduction in lung cancer cell survival.The expression of EPS8 was decreased in LCLs cell line,and the Caspase-3/7 activity was lower in the non-cancer cell line LCLs treated by cisplatin compared with the control group,and the apoptosis rate was decreased.In the five kinds of non-small cell lung cancer (NSCLC)cell lines,mithramycin also lead to decreased expression of EPS8.Compared with the LCLs cell line,the sensitivity to cisplatin increased significantly in the four NSCLC cells and the bladder cancer cell HTB9 (P<0.05),but it had no statistically significant in the NSCLC,the EGFR mutated H1975 cells(P>0.05).ConclusionsThere are significantly increased of sensitivity to cisplatin in cancer cells when EPS8 inhibition through the RNA interference or mithramycin treated,while normal cells decrease its sensitivity.
Keywords:cisplatin;mithramycin;sensitivity;lymphoblastoid cells;non-small cell lung cancer
顺铂作为铂类化疗药中的代表,临床上主要用于头颈部癌[1]、卵巢癌[2]、宫颈癌[3]及肺癌[4]治疗,效果确切。然而其毒副作用和固有的获得耐药性严重影响该药疗效的发挥[5]。研究化疗药导致严重毒副作用的遗传和分子机制,及可能受影响的作用通路,尤其是发现跟细胞毒性相关基因的表达情况,有利于改善临床疗法,削弱甚至消除化疗药物的毒副作用,提高患者的生活质量,延长生存期限。
对于多数的淋巴母细胞样细胞系(lymphoblastoid cell lines,LCLs),药物诱导的细胞生长抑制作用是通过药理学表型进行检测。然而这是一种通过细胞凋亡和非凋亡途径引起的细胞死亡,细胞周期抑制以及受损细胞的DNA修复等极为宽泛的表型所导致的细胞坏死[6]。
一项全基因组关联分析(genome-wide association study,GWAS)揭示[7],2 449 个单核苷酸多态性(single nucleotide polymorphisms,SNPs) 和 1 629 个SNPs分别与顺铂诱导的细胞凋亡和细胞毒性有关(P=0.000)。在共有的SNPs中,rs4343077作为次要等位基因在顺铂诱导时具有更低的凋亡率(P=0.000)。这个SNP位于表皮生长因子受体通路底物8(epidermal growth factor receptor pathway substrate 8,EPS8)的内含子区域。研究发现[8],EPS8确实与顺铂/紫杉醇诱导的药物反应性有关。当EPS8沉默后,宫颈癌细胞对化疗药物干预变得更为敏感。恶性胶质瘤中EPS8过表达并促进肿瘤细胞的生长[9]。此外,多项研究表明,在其他诸如结直肠癌等实体肿瘤中,EPS8的表达均升高。因此,笔者猜测EPS8表达降低可能是通过增强肿瘤细胞对化疗药物的敏感性而影响后者的促凋亡能力。
由于EPS8在肿瘤细胞中对顺铂反应的重要性以及前人发现的EPS8(rs4343077)中SNP与顺铂引起的细胞毒性和细胞凋亡均有关[10]。因此笔者进一步探究EPS8与顺铂敏感性的关联。为此,本文利用沉默核糖核酸(silencing ribonucleic acid,siRNA)和已知的EPS8抑制剂——光神霉素A对多种LCLs细胞及膀胱癌和非小细胞肺癌细胞(non-small cell lung cancer,NSCLC)中EPS8进行沉默和抑制。探究当EPS8表达降低时,淋巴母细胞和实体瘤细胞对顺铂诱导的细胞毒性的改变。
1 材料与方法
1.1 细胞系
各种LCLs(GM6991、GM7348、GM10838、GM11994及GM12239)、膀胱癌细胞HTB9及人NSCLC细胞NCI-H2126(购自美国ATCC细胞库),保存在含15%胎牛血清(浙江省德清县天杭生物科技有限公司)和20 μmol/L-谷氨酰胺的RPMI 1640培养基(roswell park memorial institute 1640)中(美国Hyclone公司);人 NSCLC细胞系(A549、NCI H1437、NCI-H1563及NCI-H1975)(购自中国科学院上海细胞库),所有的细胞均培养在37℃、5%二氧化碳CO2细胞培养箱中。
1.2 药物
顺铂和光神霉素A(购自美国Sigma公司),分别用二甲基亚砜(dimethyl sulfoxide,DMSO)和磷酸盐缓冲液(phosphate buffered saline,PBS)稀释至 20.00和 0.06 μmol/L。
1.3 RNA干扰
沉默实验旨在验证较低的EPS8表达水平对顺铂诱导的细胞毒性和细胞凋亡的影响。采用脂质体转染法,转染前1天将5种LCLs细胞(GM6991、GM7348、GM10838、GM11994 及 GM12239)和 A549细胞接种于24孔板中,使其在第2天转染时长至30%~50%融合。吸去培养板中培养基,用PBS清洗细胞2次后添加无抗生素无血清高糖培养基(dulbecco's modified eagle medium,DMEM)(美国 Hyclone公司)400 μl/孔,分别用 50 μl无血清 DMEM培养基稀释20 pmol siRNA(广州市锐博生物科技有限公司)和1 μl LipofectamineTM2000脂质体(美国invitrogen公司),室温静置5 min后将两者混匀继续放置20 min形成复合物。每孔加入100 μl转染复合液后置于37℃、5%CO2环境下培养24和48 h,然后采用实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测EPS8基因沉默情况。
1.4 qRT-PCR实验
细胞于核转染EPS8 siRNA 24和48 h后,采用RNAiso Plus Total RNA提取试剂盒(日本TaKaRa株式会社)提取细胞RNA,用Prime ScriptTMRT with gDNA Eraser试剂盒(日本TaKaRa株式会社)将信使核糖核酸(messenger ribonucleic acid,mRNA)逆转录成互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA),并调整其终浓度为25或50 ng/μl,应用 Applied Biosystems Step One Plus real-time PCR仪器(美国Thermo Scientific公司)对EPS8的mRNA表达进行相对定量分析。
1.5 Alamar Blue细胞毒性实验
采用Alamar Blue细胞生长抑制实验检测顺铂和光神霉素A对细胞毒性的影响。在EPS8 siRNA实验中,5 μmol/L顺铂分别处理核转染的LCLs细胞系(GM6991、GM7348、GM10838、GM11994 及 GM12 239)及A549细胞24 h,然后加入Alamar Blue孵育24 h后,采用Multiskan MK3型酶标仪(美国Thermo Fisher Scientific公司)在570 nm波长检测细胞存活率。为观察光神霉素A对EPS8沉默的细胞毒性影响,细胞系(GM6991、GM7348、GM10838、GM11994、A549、H1437、H1563、H1975 及 H2126)铺板后,单用光神霉素 A(0 及 0.01 μmol/L)和单用顺铂(0.0、1.0、2.5、5.0、10.0、20.0、25.0 及 50.0 μmol/L)以及多种不同浓度的顺铂联合0.01 μmol/L光神霉素A进行干预。待铺板细胞贴壁后加入光神霉素A,随后加入顺铂干预6 h,加入总体积10%的Alamar Blue孵育至24 h,最后用酶标仪在570 nm波长处进行检测,每种处理均至少设置3个复孔,且实验至少重复3次以确保结果的可靠性。
1.6 细胞凋亡实验
采用Caspase-3/7细胞凋亡检测试剂盒(美国Promega公司)检测顺铂和光神霉素A诱导的细胞凋亡情况。在EPS8 siRNA实验中,核转染后细胞铺板并加入5 μmol/L的顺铂干预5 h,并在24 h后检测细胞的Caspase-3/7活性。为检测光神霉素A干预后细胞EPS8基因的表达,细胞铺板后加入0.01 μmol/L的光神霉素A,再加入5 μmol/L的顺铂处理24 h。然后检测细胞Caspase-3/7活性并与对照组(无药物干预)进行对比。实验至少重复3次以确保结果的可靠性。
1.7 统计学方法
数据分析采用SPSS 17.0进行统计分析,计量资料以均数±标准差(±s)表示,组间比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 RNA干扰成功沉默EPS8
5种LCLs细胞系和A549肺癌细胞用于EPS8沉默的研究。分别转染阴性对照和EPS8 siRNA。与阴性对照组比较,6种细胞系中EPS8均成功沉默。所有LCLs细胞系中EPS8在24和48 h分别沉默至(19.01±4.32)%和(40.61±7.29)%。A549细胞中EPS8 siRNA的沉默效率与阴性对照比较,EPS8 mRNA分别沉默至7.4%和10.5%。见图1A。
2.2 EPS8的沉默增加A549对顺铂敏感性
EPS8被成功沉默之后,笔者通过细胞存活率和Caspase-3/7活性来评估细胞对顺铂敏感性的改变。EPS8的表达与顺铂诱导的细胞毒性的相关性表明,在5 μmol/L顺铂干预时,更高的细胞存活率与更低的EPS8表达水平有关(P=0.047)。当顺铂干预时,EPS8的沉默能将LCLs细胞系的存活率平均提高7.9%(P=0.019),凋亡率平均降低 8.7%(P=0.004),该结果表明,低水平的EPS8表达可以导致LCLs细胞对顺铂的敏感性降低。因此,LCLs细胞系中EPS8的表达降低能够拮抗顺铂毒性。与此相反,EPS8在A549细胞表达下调时对顺铂有更高的敏感性,细胞存活率的降幅为20.6%(P=0.000)。见图1B。
2.3 光神霉素A降低EPS8在癌细胞和LCLs细胞系中的表达
0.01 μmol/L光神霉素A干预细胞系6和24h后对EPS8 mRNA表达水平进行检测。当光神霉素A干预时,与对照组比较,检测的4种LCLs细胞中EPS8 mRNA的表达在6和24 h时分别降至(74.42±3.46)%和(29.82±3.71)%,相比于没有药物干预的对照组,5种NSCLC细胞和膀胱癌细胞在光神霉素A干预6和24 h时EPS8 mRNA的表达分别降低至(95.72±3.42)%和(59.91±14.73)%,该检测结果证实0.01 μmol/L光神霉素A干预可以引起肺癌和膀胱癌细胞以及非癌的LCLs细胞中EPS8 mRNA表达降低。见图2。
2.4 光神霉素A降低LCLs细胞系对顺铂的敏感性
随后检测光神霉素A对LCLs细胞系中顺铂诱导的Caspase-3/7活化的影响。当单用顺铂干预时,4种LCLs细胞系的Caspase-3/7活性为(5.94±0.91)。相比之下,顺铂联用光神霉素A Caspase-3/7活性减少到(3.38±0.52),4 种 LCLs细胞系中单用 0.01 μmol/L光神霉素A Caspase-3/7的活性为(3.41±0.44)。虽然光神霉素A和顺铂均能诱导细胞凋亡,但与顺铂单用比较,两者联用Caspase-3/7活性降低至(42.72±6.82%,P=0.000)。提示光神霉素A在细胞凋亡上发挥保护作用。见图3。
2.5 光神霉素A增强肿瘤细胞对顺铂的敏感性
笔者选用5种不同突变类型的NSCLC细胞系进行研究。单用光神霉素A对该癌细胞的影响不一,细胞敏感性从59.7%到92.9%不等,光神霉素A干预时,随着顺铂浓度的逐渐增加,发现5种NSCLC细胞中有4种存活率较未用光神霉素A下降(P<0.05)。H1975细胞存在EGFR突变,并未发现其敏感性有变化。笔者同时发现,顺铂和光神霉素A对膀胱癌细胞有影响,较光神霉素A单用,膀胱癌细胞HTB9对顺铂的敏感性同样增强(P<0.05)。见附表和图4。
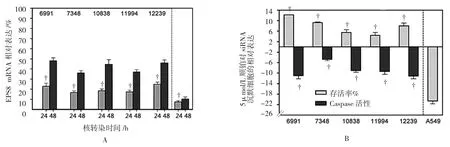
图1 5μmol/L顺铂干预对EPS8沉默后癌细胞和非癌细胞存活率及Caspase-3/7活性的影响
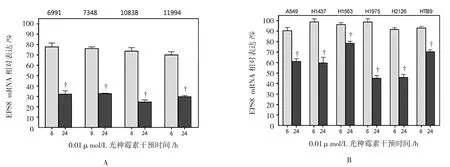
图2 0.01μmol/L光神霉素A对癌细胞和LDLs细胞系EPS8 mRNA的影响
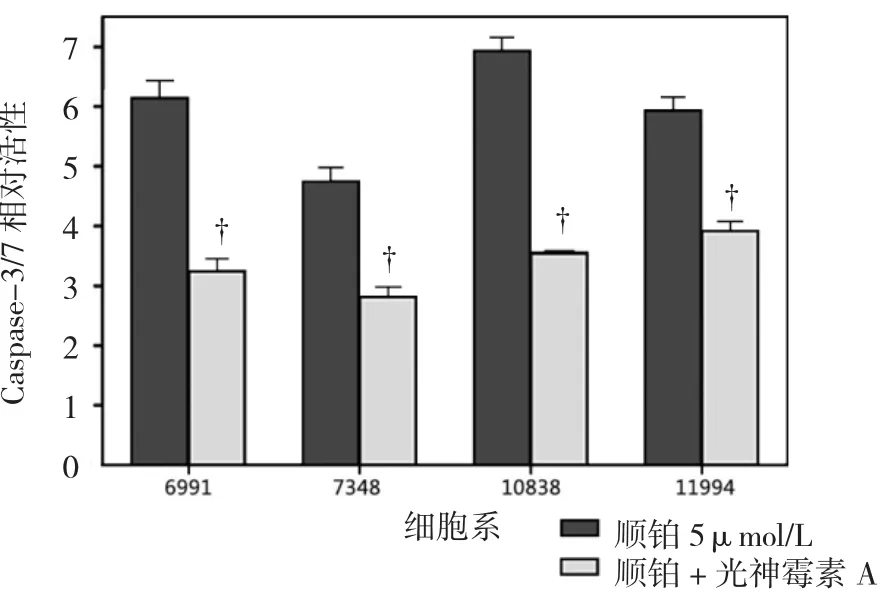
图3 5μmol/L顺铂联用0.01μmol/L光神霉素A导致LCLs细胞系中Caspase-3/7活性下降
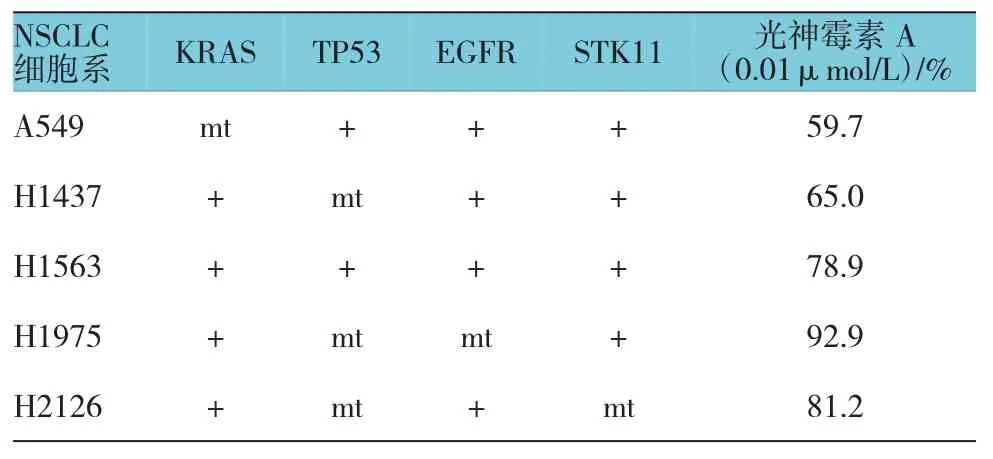
附表 光神霉素A对不同突变型NSCLC细胞系敏感性的影响
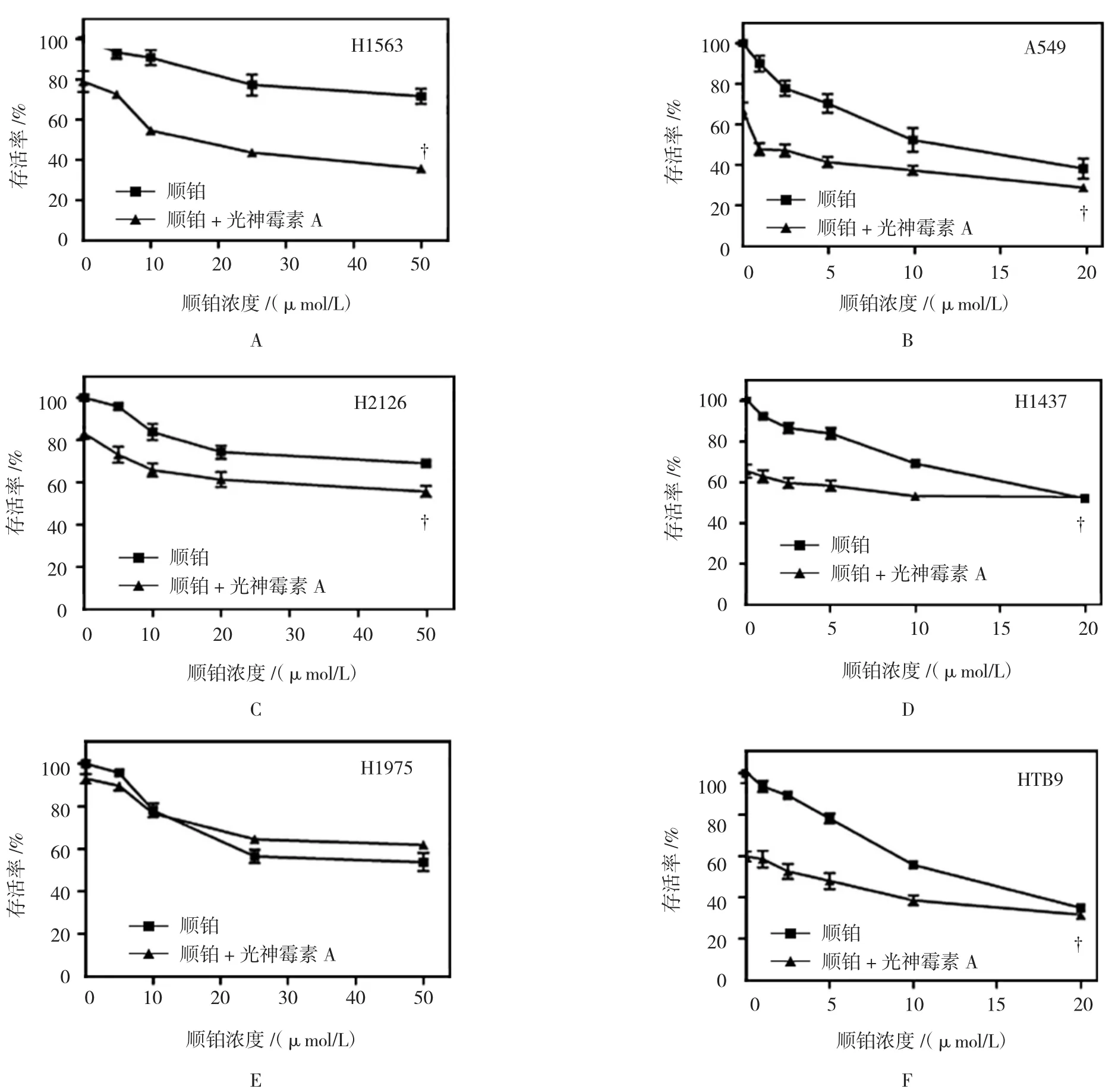
图4 光神霉素A存在和缺乏时,不同浓度顺铂对NSCLC细胞系和膀胱癌细胞HTB9存活率的影响
3 讨论
在本研究中,笔者评估EPS8作为潜在的靶点用于顺铂药物的联合治疗。EPS8的选择是基于以前的临床GWAS结果,使用多种细胞表型进行衡量:Caspase-3/7活性水平代表顺铂诱导的细胞毒性和细胞凋亡情况。SNP(EPS8内含子),rs4343077与顺铂诱导的细胞毒性和细胞凋亡有关。通过对沉默EPS8的5种LCLs细胞系进行细胞生长抑制实验和Caspase-3/7活化实验,笔者发现当EPS8表达下降时,LCLs细胞系对顺铂的化疗敏感性下降。笔者的结果验证前人的发现[7],通过对EPS8基因沉默发现,肺癌细胞A549对顺铂的敏感性确实增强。
笔者将研究范围扩展至其他的肺癌细胞系和膀胱癌细胞以及LCLs细胞系。在LCLs细胞系中沉默EPS8,随后利用光神霉素A进行干预,与顺铂单用比较,光神霉素A和顺铂联用导致细胞凋亡活性降低。虽然细胞毒性实验发现当光神霉素A干预时,LCLs细胞系对顺铂的敏感性会有少许的增加,但相反的是,肿瘤细胞系却增加得更为显著。此外,NSCLC细胞系中存在EGFR突变的H1975细胞却是个例外。总之,通过siRNA或者使用诸如光神霉素A等特异性抑制剂将EPS8沉默,这或许是提高肿瘤对顺铂敏感性的治疗策略。
EPS8是在肿瘤细胞中发挥恶性转化作用的肿瘤相关蛋白。其是EGFR的底物,通过Rac参与EGFR信号通路[11]。SOS1以及ABI1是溶血磷脂酸诱导的细胞迁移和Rac激活的必要组成部分,已被发现在卵巢癌转移中发挥关键作用[11]。EPS8的表达水平同样作为早期宫颈癌患者的预后指标[12]。EPS8高表达患者往往意味着宫旁浸润和淋巴结转移风险的升高和生存率的下降。
光神霉素A原本是一种来源于疮痂病的抗生素,是EPS8的潜在抑制剂。笔者发现,光神霉素A可以减少人类大肠腺上皮癌细胞系和人肺癌上皮细胞系中EPS8的mRNA和蛋白水平。此外,通过光神霉素A干预引起的EPS8表达下调,导致肿瘤细胞生长和迁移能力大幅降低[13]。在美国自1970年起,光神霉素A就已被批准上市,用于湿疹样癌、睾丸癌和恶性肿瘤相关的骨病变中高钙血症的临床治疗。然而,多年来由于其严重的副作用和狭窄的治疗窗导致临床应用光神霉素A受到极大的局限。患者在接受光神霉素A治疗时,会产生肝、肾和骨髓系统毒性,导致恶心、呕吐和出血的发生,给患者带来极大痛苦[14]。尽管副作用严重,但由于其在分子水平上的研究进展,导致科学家对光神霉素A产生新的兴趣。
光神霉素A能够直接通过抑制EPS8的活性增强因子SRC而抑制EPS8的表达[13]。还能与位于脱氧核糖核酸(deoxyribonucleic acid,DNA)小沟内富含GC碱基序列的DNA区域相互作用,从而阻止转录因子特异性蛋白 1(specificity protein 1,Sp1)与多种原癌基因的启动子结合[15]。然而,Sp1结合位点与无关的原癌基因相结合并不会产生作用,比如启动子p21cip1/waf1。因此,光神霉素A可能不是针对Sp1的特异性抑制剂,而是靶向于Sp1有相互作用的癌基因的上游。
又有文献报道,光神霉素A能够降低c-myc、cmyb、c-src、c-met和 FOXM1 表达[16],提高 FOXO3A的表达水平,后者是一种调控DNA损伤应答的转录因子,这或许是因为该基因与光神霉素A作用靶点的通路下游相关[17]。例如,EPS8也可以上调FOXM1,后者已被证实直接与Sp1结合,是在癌症的发生、发展中发生关键作用的一种因子[18],即Sp1和FOXM1通过反式激活促进c-myc的协同作用。
此外,研究发现EPS8的表达下降会降低Src、Shc和参与细胞黏附及迁移相关的细胞内络氨酸激酶(focal adhesion kinase,FAK)(也称为 PTK2)的表达水平[19]。EPS8同样也可能通过PI3K/AKT/mTOR信号通路或Ras-Raf-MEK-ERK通路调节FOXO3A。前人研究顺铂耐药性发现,当使用光神霉素A进行干预时,顺铂耐药细胞因为FOXO3A的改变而出现增敏效果,当通过降低AKT信号通路中FOXO3A的活性时,促进顺铂诱导的细胞凋亡[20]。因此,很可能是EPS8表达水平降低引起AKT减少,进而引发FOXO3A磷酸化而导致肿瘤细胞凋亡,而不是继续增殖。
本实验发现,NSCLC细胞系中只有存在EGFR突变的H1975细胞在光神霉素A干预时细胞死亡率没有增加。H1975肺癌细胞在21号外显子上存在1个由亮氨酸到精氨酸的点突变(L858R)以及1种二次突变T790M,改变正常的EGFR活性。EGFR酪氨酸抑制剂通常被用来增加EGFR突变的肿瘤细胞对铂剂的敏感性[21]。然而,这些抑制剂对EGFR野生型肿瘤却往往无效。笔者猜测,光神霉素A可能通过抑制在肿瘤细胞生长、黏附和迁移过程中发挥重要作用的EPS8和其下游靶基因,进而促进EGFR野生型肿瘤细胞对顺铂增敏的效果。足够剂量的光神霉素A可以抑制特定的肿瘤基因且不会产生额外的副作用,从而使化疗药对肿瘤细胞产生更高效的杀伤作用。
综上所述,笔者的研究结果验证EPS8参与细胞对顺铂的反应过程。当然不排除笔者使用的光神霉素A可能存在更加特殊的EPS8抑制机制,而导致其在肿瘤细胞和正常细胞之间产生不同的作用。与顺铂单用比较,联用光神霉素A能够降低EPS8的表达,减少LCLs细胞系凋亡。而且与肿瘤细胞相比,光神霉素A干预导致的EPS8表达下降对正常细胞LCLs毒性极小。进一步证实EPS8在顺铂诱导的细胞毒性中的作用和以及在临床提高顺铂疗效中作为潜在靶点的重要性。
[1]简洁君,李国义,余滋中,等.紫杉类-顺铂-氟尿嘧啶联合诱导化疗对晚期头颈癌疗效和安全性的Meta分析[J].临床耳鼻咽喉头颈外科杂志,2016,30(4):282-287.
[2]汤凯雯,陈历排,杜佩妍,等.化疗联合顺铂腹腔热灌注治疗中晚期卵巢癌术后的效果[J].广东医学,2015,36(11):1746-1749.
[3]罗自娟,曹晨,孙娟娟,等.多西紫杉醇与紫杉醇联合顺铂同步放化疗治疗晚期宫颈癌的疗效比较[J].现代生物医学进展,2016,16(10):1934-1936.
[4]WU Y L,LU S,CHENG Y,et al.Efficacy and safety of pemetrexed/cisplatin versus gemcitabine/cisplatin as first-line treatment in Chinese patients with advanced nonsquamous non-small cell lung cancer[J].Lung Cancer,2014,85(3):401-407.
[5]高传柱,费凡,王天帅,等.经典顺铂类抗肿瘤药物耐药性研究综述[J].昆明理工大学学报(自然科学版),2013,38(6):78-83.
[6]李晓惠,蒋蔚峰,张贺龙,等.非小细胞肺癌患者外周血ERCC1单核苷酸多态性与顺铂化疗疗效的相关性[J].中华肿瘤防治杂志,2010,17(3):169-172.
[7]WEN Y,GORSIC L K,WHEELER H E,et al.Chemotherapeutic-induced apoptosis:a phenotype for pharmacogenomics studies[J].Pharmacogenetics&Genomics,2011,21(8):476-488.
[8]PAN C H,CHANG Y F,LEE M S,et al.Vorinostat enhances the cisplatin-mediated anticancer effects in small cell lung cancer cells[J].BMC Cancer,2016,16(1):857.
[9]孙婧,金卢阳,王慧莹,等.Eps8与恶性肿瘤增殖、转移和预后的相关研究进展[J].中国实验血液学杂志,2013,21(2):493-497.
[10]LIU P S,JONG T H,MAA M C,et al.The interplay between Eps8 and IRSp53 contributes to Src-mediated transformation[J].Oncogene,2010,29(27):3977-3989.
[11]王冰,吴晓荣,辛晓燕,等.EPS8在卵巢浆液性腺癌中的表达分析[J].西部医学,2014,26(3):276-279.
[12]林少丹,周晖,王东雁,等.早期宫颈癌子宫动脉转移的研究[J].中山大学学报(医学科学版),2016,37(4):568-574.
[13]YANG T P,CHIOU H L,MAA M C,et al.Mithramycin inhibits human epithelial carcinoma cell proliferation and migration involving downregulation of Eps8 expression[J].Chemico-biological Interactions,2010,183(1):181-186.
[14]李怀永,邵淑丽,张伟伟,等.光神霉素A抑制人肺腺癌A549/DDP细胞MRP1基因表达[J].中国细胞生物学学报,2014,36(3):326-330.
[15]HOU C,WEIDENBACH S,CANO K E,et al.Structures of mithramycin analogues bound to DNA and implications for targeting transcription factor FLI1[J].Nucleic Acids Research,2016,44(18):8990-9004.
[16]STABILE L P,HE G,LUI V W,et al.C-Src activation mediates erlotinib resistance in head and neck cancer by stimulating c-Met[J].Clinical Cancer Research,2013,19(2):380-392.
[17]SHIOTA M,YOKOMIZO A,KASHIWAGI E,et al.Foxo3a expression and acetylation regulate cancer cell growth and sensitivity to cisplatin[J].Cancer Science,2010,101(5):1177-1185.
[18]ABDEL-RAHMAN W M,RUOSAARI S,KNUUTILA S,et al.Differential roles of EPS8 in carcinogenesis:loss of protein expression in a subset of colorectal carcinoma and adenoma[J].World Journal of Gastroenterology,2012,18(29):3896-3903.
[19]郑星星,王建刚.FoxO3a转录因子在肿瘤治疗中的作用[J].肿瘤学杂志,2014,20(5):409-412.
[20]GAUGHAN E M,COSTA D B.Genotype-driven therapies for non-small cell lung cancer:focus on EGFR,KRAS and ALK gene abnormalities[J].Rapeutic Advances in Medical Oncology,2011,3(3):113-125.
[21]陈扬.EGFR抑制剂对肿瘤的抑制和放疗增敏作用研究进展[J].中国肿瘤临床,2015,42(11):580-584.
Effects of EPS8 expression decreased on cisplatin sensitivity in lung cancer cell
Hai-jian Du1,Wei-feng Li1,Qing-feng Sun2,Yuan-heng Wang3,Wen-jie Huang1
(1.Department of Respiratory,General Hospital of Guangzhou Military Command of PLA,Guangzhou,Guangdong 510010,China;2.Guangdong Pharmaceutical University,Guangzhou,Guangdong 510006,China;3.The Fourth Military Medical University of PLA,Xi'an,Shaanxi 710000,China)
R730.53
A
10.3969/j.issn.1005-8982.2017.15.004
1005-8982(2017)15-0015-07
2016-11-19
黄文杰,Tel:13600466358

