缢蛏天然抗性相关巨噬蛋白2(Sc-Nramp2)基因克隆及其在副溶血弧菌刺激下的表达分析
林德海,刘晨珊,董迎辉,何琳,林志华*
(1.浙江万里学院 浙江省水产种质资源高效利用技术研究重点实验室,浙江 宁波 315100)
缢蛏天然抗性相关巨噬蛋白2(Sc-Nramp2)基因克隆及其在副溶血弧菌刺激下的表达分析
林德海1,刘晨珊1,董迎辉1,何琳1,林志华1*
(1.浙江万里学院 浙江省水产种质资源高效利用技术研究重点实验室,浙江 宁波 315100)
克隆得到缢蛏天然抗性相关巨噬蛋白2(Sc-Nramp2)基因的cDNA全长序列3 681 bp,该基因的开放阅读框有1 776 bp,编码591个氨基酸,预测分子量为65.86 kDa;其结构具有Slc11蛋白家族的典型特征,包括有10个典型的跨膜结构和2个糖基化位点。Sc-Nramp2基因3′-UTR有2个类似于脊椎动物Nramp2中铁反应控制蛋白结合位点;同源性分析表明,Sc-Nramp2和太平洋牡蛎Nramp2-like的同源性最高为71.6%。实时荧光定量PCR结果表明,Sc-Nramp2基因在闭壳肌、外套膜、肝胰腺、斧足、水管和鳃6个组织中均有表达,其中肝胰腺中的表达量最高,其次是鳃,与其他组织均有极显著性差异(P<0.01);注射副溶血弧菌后,肝胰腺中Sc-Nramp2基因的表达量较对照组显著上调(P<0.01),且表达量呈现先上升后下降的趋势,在12 h时达到最大表达量,推测Sc-Nramp2基因参与了缢蛏非特异性免疫应答反应。
缢蛏;Sc-Nramp2;基因克隆;副溶血弧菌;基因表达
1 引言
天然抗性相关巨噬蛋白(natural resistance associated macrophage protein, Nramp)也称溶质转运蛋白家族11(solute carrier family 11,SLC11),是一类古老的膜整合转运蛋白,含有10~12个典型的跨膜区、1个胞质内转运蛋白特征结构域和1~2个糖基化的胞质外环状结构,在各物种间保持高度保守性[1]。该家族包括Nramp1和Nramp2[2],Nramp1主要特异性表达于巨噬细胞和组织网状内皮系统[3],Nramp2则广泛表达于大多数组织和细胞[4]。Nramp蛋白对生物体内细胞的病原体可以起到抵抗的作用,主要是通过阳离子运输功能减少巨噬细胞内金属离子的浓度,抑制胞内病菌对金属离子的利用,调节巨噬细胞的抗菌活性[5]。研究发现,人Nramp1基因多态性与多种自身免疫性疾病和由病毒、细菌、寄生虫等引起的传染性疾病相关[6]。小鼠Nramp1在抵抗牛分枝杆菌(Mycobacteriumbovis)、沙门氏菌(Salmonella)的感染起着重要的调控作用[7—8],单个密码子突变(Gly169→Asp) 可导致基因功能的丧失[9]。迄今为止,已在人[10]、鼠[1]、猪[11]等哺乳动物中克隆得到Nramp基因cDNA全长。在鱼类中,已得到了虹鳟(Oncorhynchusmykiss)[12]、大菱鲆(Scophthalmusmaximus)[13]、鲈鱼(Lateolabraxjaponicus)[14]、真鲷(Pagrosomusmajor)[15]、草鱼(Ctenopharyngodonidellus)[16]和斑马鱼(Daniorerio)[17]等Nramp基因全长,并分析了基因的序列特征。然而,关于Nramp基因的研究主要集中在哺乳动物和鱼类,在贝类中仅见太平洋牡蛎(Crassostreagigas)Nramp2-like在NCBI上有序列信息。
缢蛏(Sinonovaculaconstricta)是我国重要海水养殖贝类之一,肉质鲜美,营养丰富,深受消费者喜爱,在浙江、福建、广东沿海一带有着悠久的养殖历史。近年来,由细菌性疾病造成的缢蛏病害时有发生,其中又以弧菌为主要致病菌[18]。贝类对病原的防御与脊椎动物不同,体内不存在特异性免疫淋巴细胞和相应抗体,是通过巨噬细胞和多种非免疫球蛋白介导的非特异性免疫杀灭进入体内的病原[19]。目前在缢蛏中已有热休克蛋白ScHsc70[20]、小分子热休克蛋白Sc-sHSP[21]、肌动蛋白β-ACTIN1[22]、铁蛋白[23]和组织蛋白酶B[24]等免疫相关基因的报道。本研究对Sc-Nramp2基因的序列特征、组织表达和副溶血弧菌感染后的表达进行分析,以期为深入研究其在缢蛏免疫过程中的作用机理奠定基础。
2 材料与方法
2.1 实验材料
实验用缢蛏材料于2015年10月取自宁波市海洋与渔业研究院科技创新基地。取健康的缢蛏成贝经活体解剖,迅速取其闭壳肌、外套膜、肝胰腺、足、水管和鳃6个组织,用液氮速冻后分别放入冻存管中,并保存于-80℃冰箱中备用。
2.2 攻毒实验
取200颗缢蛏暂养于海水中,水温(18±1)℃,盐度为25,定时投喂扁藻、金藻,持续充气,每日换水一次,暂养一周后进行攻毒实验。
将实验室保存的副溶血弧菌(VibrioParahaemolyticus)活化后,扩大培养,用PBS将菌液浓度稀释到OD600=0.4。将缢蛏随机分组,每组100颗。在实验组每颗缢蛏斧足注射50 μL 副溶血弧菌菌液,对照组每颗注射50 μL PBS,注射后放回海水中。分别于注射后0 h、2 h、4 h、6 h、12 h、24 h、48 h、72 h取样肝胰腺用液氮速冻,于-80℃冰箱中保存。
2.3Sc-Nramp2基因cDNA全长的克隆
采用Trizol法提取缢蛏肝胰腺样品RNA,用1%琼脂糖电泳检测其完整性,NanoVue微量紫外分光光度计检测浓度和纯度。利用SMART RACE试剂盒(Clontech)以总RNA为模板合成cDNA。从缢蛏转录组文库的注释信息中,检索到Sc-Nramp2基因的EST片段,以此分别设计3′RACE和5′RACE特异性引物N-1和N-2(表1),用Advantage 2 Polymerase试剂盒(Clontech)根据试剂盒说明书要求扩增Sc-Nramp2的cDNA全长。PCR产物经1.0%琼脂糖凝胶电泳检测,胶回收试剂盒(TIANGEN)割胶纯化。纯化后的产物与T1 (TransGen)载体连接,转化到大肠杆菌DH5α (TaKaRa)中进行克隆,挑取出阳性克隆送往Invitrogen公司测序。
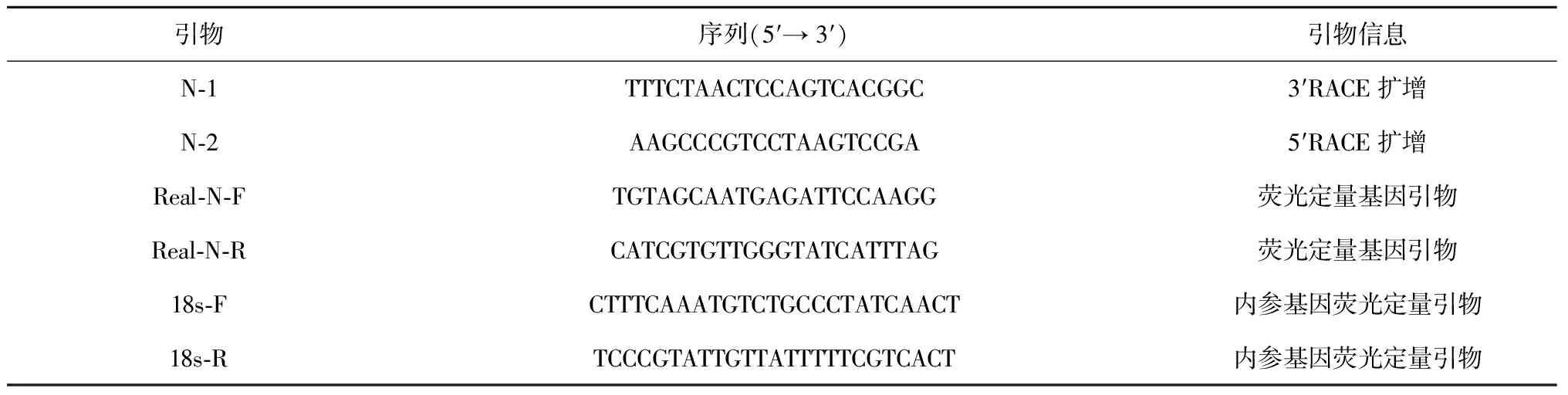
表1 实验所用的引物及序列
2.4Sc-Nramp2基因的序列及进化分析
用DNAMAN 7软件对测序结果序列进行拼接,得到Sc-Nramp2基因的cDNA全长序列并搜索开放阅读框,推测出其编码的氨基酸序列;用NCBI blast(http: //www.ncbi.nlm.nih.gov/BLAST/)搜索同源序列和功能域;用序列处理在线工具包(http: //www.bio-soft.net/sms/index.html)预测翻译蛋白质的理化性质;用NetNGlyc 1.0 Server(http: //www.cbs.dtu.dk/services/NetNGlyc/)预测糖基化位点;用ExPASy ProtScale(http: //web.Expasy.org/protscale/)软件分析蛋白质疏水性;用SignalP 4.1 Serve(http: //www.cbs.dtu.dk/services/SignalP)预测蛋白质的信号肽;用DAS(http: //www.sbc.su.se/~miklos/DAS/)软件预测蛋白质的跨膜区;用Swiss Model(http: //swissmodel. Expasy. org/workspace/)软件预测蛋白质三级结构。
2.5Sc-Nramp2基因在不同组织中的差异表达分析
利用Trizol(Invitrogen)法提取6个组织(闭壳肌、外套膜、肝胰腺、斧足、水管和鳃,n=3)的RNA,按照Promega反转录试剂盒说明书进行反转录获得cDNA第一链,用作荧光定量PCR的模板。根据已获得的Sc-Nramp2基因cDNA全长序列设计Real-N-F和Real-N-R(表1)用为荧光定量引物,以18S rRNA(表1)基因为内参进行相对定量。荧光定量PCR的反应体系为20 μL,包含:SYBR Green Mix(Bio-rad)10 mL,cDNA模板0.8 mL,上下游特异性引物(10 mmol/L)各1 mL,以DEPC-H2O补足。用ABI 7500 fast荧光定量PCR仪进行扩增,具体反应程序:95℃预变性20 s;95℃变性3 s,60℃退火30 s,共40个循环;95℃15 s,60℃1 min,95℃15 s,60℃15 s,制成熔解曲线。每个组织样品设3个平行,基因的相对mRNA水平采用2-ΔΔCt进行计算,结果用平均值±标准差(mean±SD)表示,采用SPSS16.0进行ANOVA单因素方差分析,P<0.05为差异显著,P<0.01为差异极显著。
3 结果
3.1Sc-Nramp2基因cDNA全长序列分析
经RACE克隆得到Sc-Nramp2基因cDNA序列全长3 681 bp(GenBank登录号:KX197930.1),开放阅读框(Open Reading Frame, ORF)有1 776 bp,编码591个氨基酸,5′末端非翻译区(Untranslated Regions, 5′-UTR)长91 bp,3′-UTR为1 817 bp,包含一个终止密码子TAG、加尾信号和32 bp的polyA尾巴。另外,在3′-UTR发现了2个铁反应控制蛋白结合位点(Iron-responsive regulatory-protein-binding site, IRE) (CNNNNNCAGTG)的特征序列(图1)。
3.2Sc-Nramp2基因的功能域、结构域与高级结构预测
Sc-Nramp2基因共编码591个氨基酸,推导出蛋白质分子量为65.86 kDa,理论等电点pI=4.93。ExPASy Protscale 软件预测显示,该蛋白质在氨基酸组成上,非极性氨基酸所占比例较高,表现为疏水性;SignalP软件预测该蛋白没有明显的信号肽;DAS软件预测该蛋白有10个明显的跨膜区域。NCBI Blastx 预测该蛋白的功能域结果显示,Sc-Nramp2基因有1个较为保守的结构域,利用NetNGlyc 1.0 Server软件分析得到2个N-糖基化位点,分别在4-7aa,557-560aa。Swiss model软件预测得到的Sc-Nramp2蛋白的二级结构包含291个氢键、19个α-螺旋和28个转角(图2)。
3.3Sc-Nramp2基因氨基酸序列同源性及系统进化树分析
利用MAGE6.0软件将Sc-Nramp2的氨基酸序列同其他物种Nramp1和Nramp2的氨基酸序列进行比对及用NJ法构建系统进化树(图3)。氨基酸序列比对表明,Sc-Nramp2与太平洋牡蛎Nramp2-like(Crassostreagigas, NP_001292237.1)、章鱼Nramp2-like(Octopusbimaculoides, XP 014772339.1)、光棘球海胆Nramp1(Strongylocentrotuspurpuratus, XP 003728002.1)等软体动物的同源性为57%~71.6%,与鱼类的同源性在53.4%~54.5%之间,与鸟类的同源性为52.2%~53.5%,与两栖类的同源性为53.9%~54.9%,与哺乳类Nramp1的同源性(52.7%~53.2%)要低于哺乳类Nramp2的同源性(55.6%~56.1%)。从进化树中可以看出,鱼类聚为一支,再与哺乳类Nramp2聚为一大支,而高等脊椎动物中鸟类、两栖类与哺乳类Nramp1聚为一大支,推测其具有类似的功能。
3.4Sc-Nramp2基因在6个组织中的表达差异分析
利用实时荧光定量PCR检测Sc-Nramp2基因在6个组织中的相对表达量,结果显示,在6个组织中均有表达,其中肝胰腺的表达量最高,其次是鳃,与其他组织有显著性差异(图4)。
3.5Sc-Nramp2基因在副溶血弧菌刺激后的表达特征分析
缢蛏在被副溶血弧菌侵染刺激后,不同时间取其肝胰腺组织,检测在刺激后的Sc-Nramp2基因的表达情况。如图5所示,实验组的表达量在刺激后4 h有明显上升并持续上升到12 h,在12 h时的表达量达到最大值,约为对照组的12.7倍,与对照组和空白组均呈显著性差异(P<0.01)。表达量在12 h后开始下降,48 h和72 h后的表达量变化不大。

图1 Sc-Nramp2基因全长cDNA序列及其氨基酸序列推测Fig.1 The nucleotide and deduced amino acid sequence of the Sc-Nramp2 gene加框部分分别代表起始密码子、终止密码子和加尾信号,*代表蛋白翻译结束,单下划线代表跨膜区,分别标注为TM1~10,阴影加粗的是2个N-糖基化位点,位于 3′-UTR 的2个 IRE 位点用阴影和下划线标出,polyA尾巴用双下划线标出The letters boxes are the start codon, the stop codon and the polyadenylation signal sequence, the * represents the end of the protein translation, the transmembrane regions (TM) are underlined with single lines and numbered 1-10, the N-glycosylation sites are marked with shaded and bold, the IRE sites located in 3′UTR are underlined and shaded, and the double underlined part is polyA
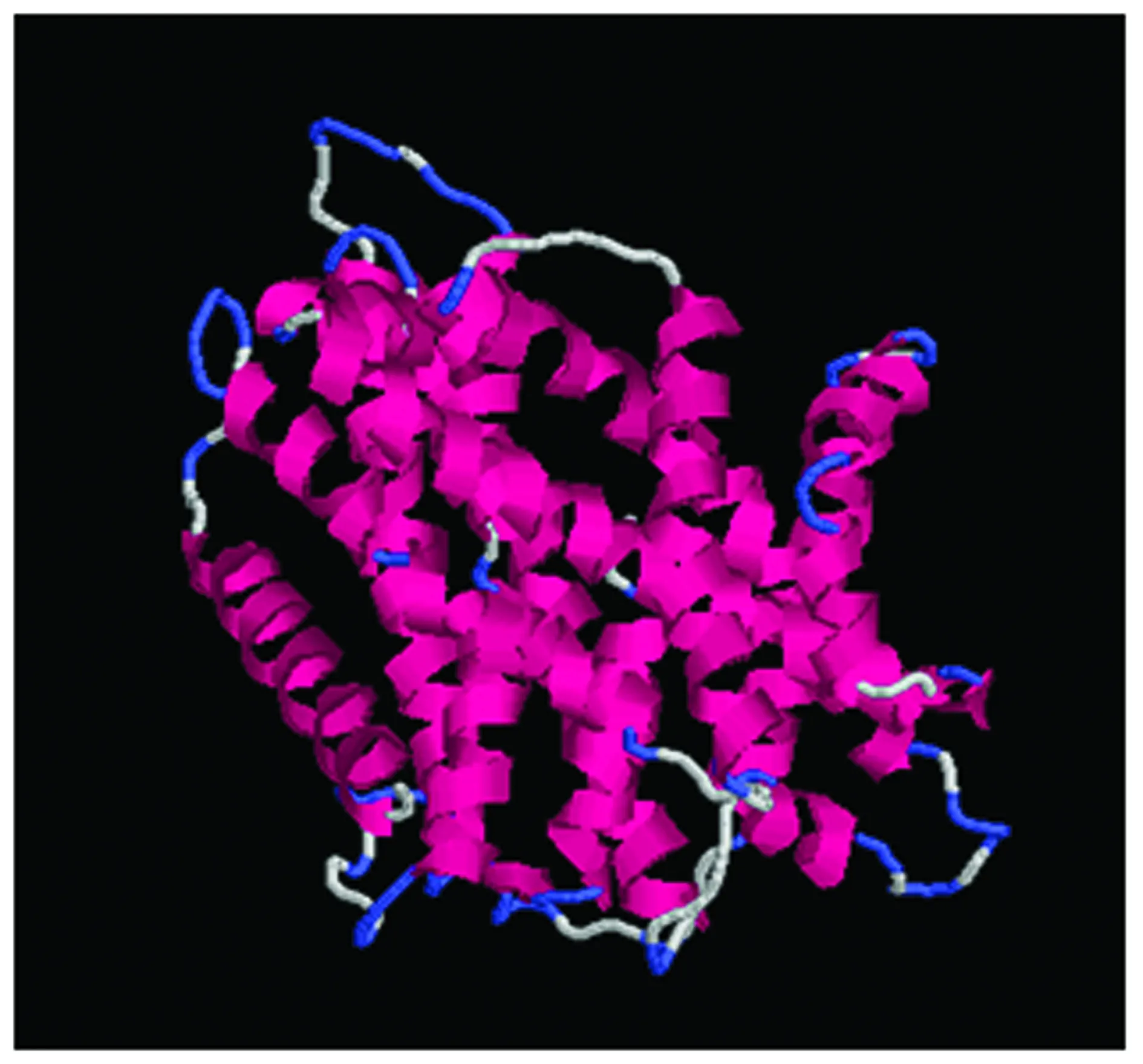
图2 Sc-Nramp2蛋白的二级结构预测图Fig.2 The prediction of Sc-Nramp2 protein secondary structure红色为α-螺旋,蓝色为转角The red represents the alpha-helix, blue represents the turn

图3 用MAGE6.0软件NJ法构建的缢蛏与其他物种Nramp1和Nramp2系统进化树Fig.3 Neighbor-joing phylogenetic tree of Nramp between S.constrzcta and other species using MEGA6.0 software
4 讨论
本研究克隆得到的Sc-Nramp2基因的全长cDNA,与已报道的其他动物Nramp氨基酸序列比对分析,Sc-Nramp2与其他动物的Nramp2 较为相似,包含10个明显的跨膜区域,1个较为保守的结构域和2个N-糖基化位点,这些特征与小鼠[4]、人[25]、草鱼[13]和虹鳟[9]等大致相似。另外,在Sc-Nramp2的3′-UTR发现了2个IRE位点。有研究表明,5′UTR 和 3′UTR端 IRE 位点与细胞中铁的代谢密切相关[26],在哺乳动物Nramp2的相关研究中,发现铁的转运吸收与IRE位点紧密相关[27-28]。Saeij等[29]推测,在鲤Nramp中的IRE可能通过与铁调控蛋白结合来调节Nramp的mRNA水平,当铁调控蛋白与Nramp5′-UTR端的IRE位点结合时可以阻止RNA的翻译,当与3′-UTR端的IRE位点结合时可以保护RNA免受降解。至于贝类Nramp基因的IRE位点是否与其在哺乳动物Nramp2中起着相同的作用还需进一步研究。

图4 Sc-Nramp2基因在6个组织中的表达特征分析Fig.4 The distribution of Sc-Nramp2 expression in six tissues of S.constrzcta不同字母代表极显著差异(P<0.01)Different letters indicates an extremely significant difference (P< 0.01)
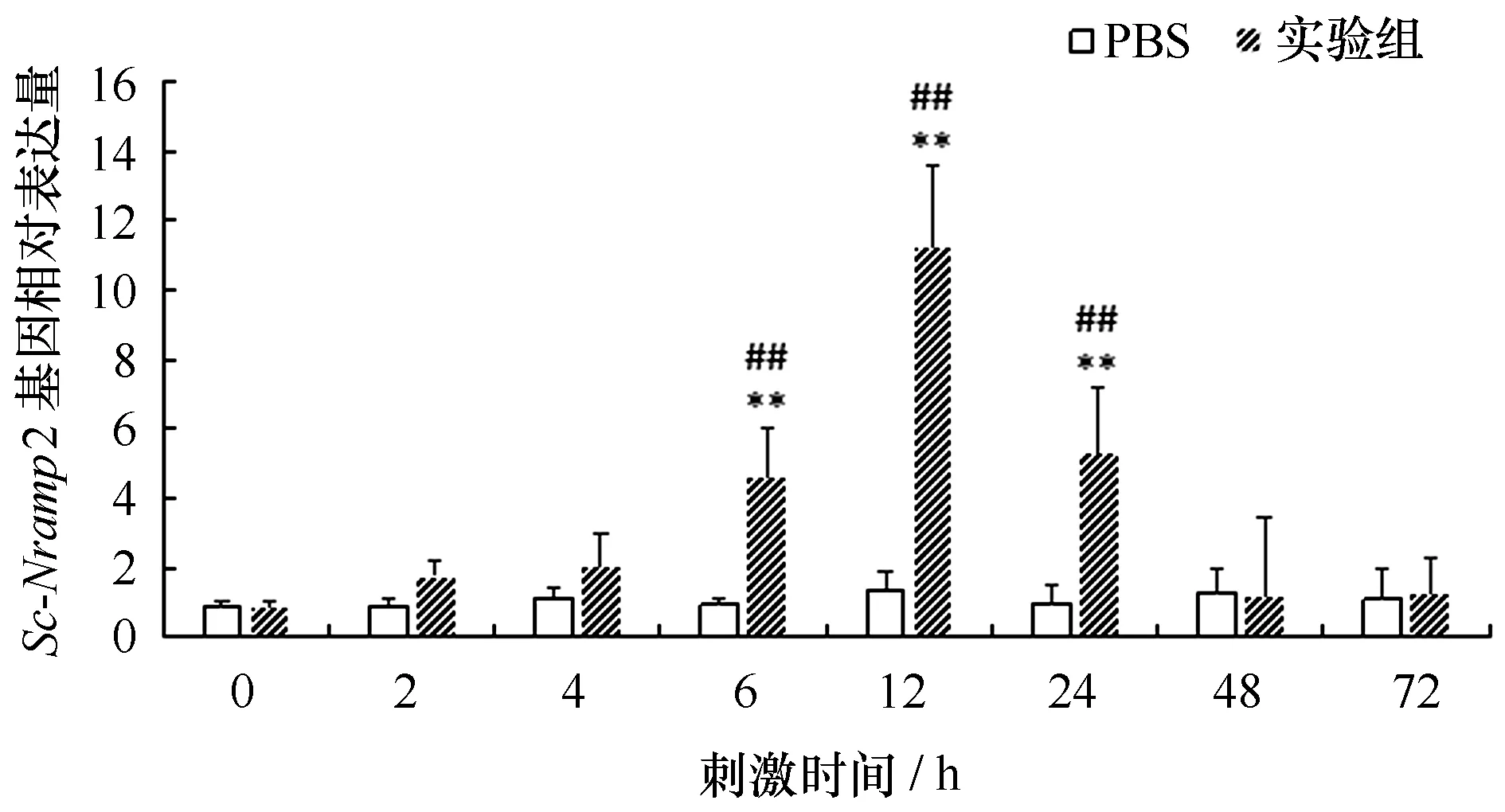
图5 副溶血弧菌感染后,Sc-Nramp2在肝胰腺中的表达量变化Fig.5 Expression characteristic analysis of Sc-Nramp2 in hepatopancreas by V. Parahaemolyticus**表示该时间点基因表达量与0 h相比差异极显著(P<0.01),##表示相同时间点实验组与PBS对照组基因表达量差异极显著(P<0.01)The “**” indicates an extremely significant difference (P<0.01) from the blank group; the “##” indicates that the experimental group is extremely different from the control group (P< 0.01)
Nramp1基因在哺乳动物中呈现特异性表达,如人的肝脏、肾脏和胰脏[30],牛的网状内皮中的巨噬细胞[31],而Nramp2基因则在哺乳动物各组织中广泛表达。本研究在缢蛏闭壳肌、外套膜、肝胰腺、斧足、水管和鳃6个组织中均检测到Nramp2基因的表达但表达量不同,其中,在肝胰腺中的表达量最高,鳃组织表达量仅次于肝胰腺,而在水管、外套膜,在足和闭壳肌中的表达量最低。Sc-Nramp2基因的这种组织表达形式与哺乳类Nramp2较为相似。此外,在草鱼[13]和鲈鱼[11]中发现Nramp基因在脾脏和肾脏中的表达量最高,而缢蛏中肝胰腺的Nramp2基因表达量最高,这与肝胰脏是大多数动物的重要解毒器官有关。关于缢蛏免疫相关基因与病菌感染之间的关系已有一些研究,金凯等[32]研究发现缢蛏丝氨酸蛋白酶基因ScSp在被鳗弧菌(Vibrioanguillarum) 诱导感染后4 h和8 h,在肝胰腺中的表达量显著上调;冯冰冰[20]研究发现缢蛏在被副溶血弧菌和鳗弧菌感染后,缢蛏热休克蛋白70(ScHsc70)、小热休克蛋白(Sc-sHSP)和铁蛋白基因(ScFERs)在肝胰腺组织的表达量都显著高于其他组织且呈现上调趋势,这与肝胰腺是大多数动物的一个具有解毒功效的重要组织有关。本研究中的缢蛏6个组织表达情况也表明了Sc-Nramp2具有组织特异性表达模式,与上述研究有相似之处,表明肝胰腺是缢蛏合成免疫相关蛋白的重要组织。
对缢蛏进行副溶血弧菌感染实验后研究发现,实验组缢蛏肝胰腺Sc-Nramp2表达量相较于PBS对照组有明显的上调,在12 h达到最大值,是PBS对照组的12.7倍左右,随着时间的推移Nramp2表达量逐渐下降接近正常值,这与半滑舌鳎(Cynoglossussemilaevis)[33]、尼罗罗非鱼(Oreochromisniloticus)[34]、草鱼[13]的研究结果相似。由此推测,起始由于副溶血弧菌的感染诱导了缢蛏细胞内免疫相关基因的表达量上升,随后由于细胞病变效应且细胞生长受到了限制等,致使基因表达量下降,在小鼠中也报道过类似的现象[35]。这些结果表明,Sc-Nramp2基因参与了缢蛏的先天性免疫应答,与被感染后机体的免疫反应密切相关。缢蛏等贝类属于低等动物,在遭受外界病菌感染时,依靠先天免疫合成蛋白,而肝胰腺则是缢蛏重要的免疫器官,在对抗病菌入侵时发挥防御作用。至于Sc-Nramp2与副溶血弧菌感染之间的相互作用机理,及其在免疫系统中扮演的具体角色,还需开展大量深入研究。
5 结论
本研究首次克隆得到缢蛏Sc-Nramp2基因全长cDNA序列,同源性分析表明和太平洋牡蛎Nramp2-like基因的相似度最高。Sc-Nramp2基因在缢蛏6个组织中都有表达,且在肝胰腺中的表达量最高;经副溶血弧菌侵染后,Sc-Nramp2基因在肝胰腺中表达量上升,表明该基因在肝胰腺中参与了缢蛏的天然免疫过程。研究结果为进一步研究缢蛏Sc-Nramp2基因的功能和作用机制奠定了基础。
[1] Skamene E, Pietrangeli C E. Genetics of the immune response to infectious pathogens[J]. Current Opinion in Immunology, 1991, 3(4): 511-517.
[2] Blackwell J M, Goswami T, Evans C A W, et al. SLC11A1 (formerly NRAMP1) and disease resistance[J]. Cellular Microbiology, 2001, 3(12): 773-784.
[3] Feng J, Li Y, Hashad M, et al. Bovine natural resistance associated macrophage protein 1 (Nramp1) gene[J]. Genome Research, 1996, 6(10): 956-964.
[4] Gruenheid S, Cellier M, Vidal S, et al. Identification and characterization of a second mouseNrampgene[J]. Genomics, 1995, 25(2): 514-525.
[5] Bairoch A. The PROSITE dictionary of sites and patterns in proteins, its current status[J]. Nucleic Acids Research, 1993, 21(13): 3097-3103.
[6] Bellamy R.NRAMP1 and susceptibility to tuberculosis[J]. The International Journal of Tuberculosis and Lung Disease, 2002, 6(9): 747.
[7] Gros P, Skamene E, Forget A. Genetic control of natural resistance to Mycobacterium bovis (BCG) in mice[J]. The Journal of Immunology, 1981, 127(6): 2417-2421.
[8] Goto Y, Nakamura R M, Takahashi H, et al. Genetic control of resistance toMycobacteriumintracellulareinfection in mice[J]. Infection and Immunity, 1984, 46(1): 135-140.
[9] Govoni G, Vidal S, Gauthier S, et al. TheBcg/Ity/Lshlocus: genetic transfer of resistance to infections in C57BL/6J mice transgenic for theNramp1Gly169allele[J]. Infection and Immunity, 1996, 64(8): 2923-2929.
[10] Cellier M, Govoni G, Vidal S, et al. Human natural resistance-associated macrophage protein: cDNA cloning, chromosomal mapping, genomic organization, and tissue-specific expression[J]. Journal of Experimental Medicine, 1994, 180(5): 1741-1752.
[11] Sun H S, Wang L, Rothschild M F, et al. Mapping of the natural resistance-associated macrophage protein 1 (NRAMP1) gene to pig chromosome 15[J]. Animal Genetics, 1998, 29(2): 138-140.
[12] Dorschner M O, Phillips R B. Comparative analysis of two Nramp loci from rainbow trout[J]. DNA and Cell Biology, 1999, 18(7): 573-583.
[13] Chen Songlin, Zhang Yuxi, Xu Jianyong, et al. Molecular cloning, characterization and expression analysis of natural resistance associated macrophage protein (Nramp) cDNA from turbot (Scophthalmusmaximus)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 147(1): 29-37.
[14] 刘洋. 外源基因表达载体的构建以及向斑马鱼(Daniarerio)和鲈鱼(Lateolabraxjaponicus)胚胎的转移[D]. 青岛: 中国海洋大学, 2004.
Liu Yang. Exogenous genes construction, transfer in to embryos of Zebrafish (DaniaRerio) and Sea Perch (LateolabraxJaponicus)[D]. Qingdao: Ocean University of China, 2004.
[15] Chen Songlin, Xu Meiyu, Ji Xiangshan, et al. Cloning and characterisation of natural resistance associated macrophage protein (Nramp) cDNA from red sea bream (Pagrusmajor)[J]. Fish & Shellfish Immunology, 2004, 17(4): 305-313.
[16] 范玉顶, 徐进, 罗晓松, 等. 草鱼天然抗性相关巨噬蛋白基因全长cDNA的克隆与表达分析[J]. 中国水产科学, 2011, 18(1): 38-47.
Fan Yuding, Xu Jin, Luo Xiaosong, et al. Molecular cloning, characterization and expression of natural resistance associated macrophage protein (Nramp) gene cDNA from grass carp (Ctenopharyngodonidella)[J]. Journal of Fishery Sciences of China, 2011, 18(1): 38-47.
[17] Donovan A, Brownlie A, Dorschner M O, et al. The zebrafish mutant genechardonnay(cdy) encodes divalent metal transporter 1 (DMT1)[J]. Blood, 2002, 100(13): 4655-4659.
[18] 邱晴, 谢李珍, 傅兴隆, 等. 缢蛏副溶血弧菌的分离与鉴定[J]. 安徽农学通报, 2010, 16(12): 46-47, 89.
Qiu Qing, Xie Lizhen, Fu Xinglong, et al. Isolation and identification ofVibrioParahaemolyticusfromSinonovaculaconstricta[J]. Anhui Agricultural Science Bulletin, 2010, 16(12): 46-47, 89.
[19] Anderson R S. Effects of anthropogenic agents on bivalve cellular and humoral defense mechanism[J]. Special Publication. American Fisheries Society, 1988, 18: 238-242.
[20] 冯冰冰, 牛东红, 钟玉民, 等. 缢蛏ScHsc70cDNA的分子特性和表达分析[J]. 中国水产科学, 2012, 19(1): 33-44.
Feng Bingbing, Niu Donghong, Zhong Yumin, et al. Molecular characteristics and expression analysis of ScHsc70 cDNA in agamaki clam (Sinonovaculaconstricta)[J]. Journal of Fishery Sciences of China, 2012, 19(1): 33-44.
[21] 冯冰冰. 缢蛏肝胰脏cDNA文库构建和免疫相关基因的克隆与表达研究[D]. 上海: 上海海洋大学, 2011.
Feng Bingbing. cDNA library construction of hepatopancreas and immune-relevant genes cloning and expression analysis inSinonovaculaconstricta[D]. Shanghai: Shanghai Ocean University, 2011.
[22] 冯冰冰, 钟玉民, 牛东红, 等. 缢蛏β-ACTIN1基因的分子特性及其表达分析[J]. 水产学报, 2011, 35(5): 650-659.
Feng Bingbing, Zhong Yumin, Niu Donghong, et al. Molecular characteristics and expression analysis ofβ-ACTIN1 gene fromSinonovaculaconstricta[D]. Journal of Fisheries of China, 2011, 35(5): 650-659.
[23] 牛东红, 冯冰冰, 李家乐. 缢蛏铁蛋白基因的分子特性及其表达分析[J]. 上海海洋大学学报, 2012, 21(5): 641-649.
Niu Donghong, Feng Bingbing, Li Jiale. Molecular characteristics and expression analysis of ferritin gene fromSinonovaculaconstricta[J]. Journal of Shanghai Ocean University, 2012, 21(5): 641-649.
[24] Niu Donghong, Jin Kai, Wang Lei, et al. Identification of cathepsin B in the razor clamSinonovaculaconstrictaand its role in innate immune responses[J]. Developmental & Comparative Immunology, 2013, 41(1): 94-99.
[25] Kishi F, Tabuchi M. Complete nucleotide sequence of humanNRAMP2 cDNA[J]. Molecular Immunology, 1997, 34(12/13): 839-842.
[26] Klausner R D, Rouault T A, Harford J B. Regulating the fate of mRNA: the control of cellular iron metabolism[J]. Cell, 1993, 72(1): 19-28.
[27] Gunshin H, Mackenzie B, Berger U V, et al. Cloning and characterization of a mammalian proton-coupled metal-ion transporter[J]. Nature, 1997, 388(6641): 482-488.
[28] Forbes J R, Gros P. Divalent-metal transport by NRAMP proteins at the interface of host-pathogen interactions[J]. Trends in Microbiology, 2001, 9(8): 397-403.
[29] Saeij J P J, Wiegertjes G F, Stet R J M. Identification and characterization of a fish natural resistance-associated macrophage protein (NRAMP) cDNA[J]. Immunogenetics, 1999, 50(1/2): 60-66.
[30] Cellier M, Shustik C, Dalton W, et al. Expression of the human NRAMP1 gene in professional primary phagocytes: studies in blood cells and in HL-60 promyelocytic leukemia[J]. Journal of Leukocyte Biology, 1997, 61(1): 96-105.
[31] Barthel R, Feng Jianwei, Piedrahita J A, et al. Stable transfection of the bovineNRAMP1 gene into murine RAW264.7 cells: effect onBrucellaabortussurvival[J]. Infection and Immunity, 2001, 69(5): 3110-3119.
[32] 金凯, 牛东红, 王劦, 等. 缢蛏丝氨酸蛋白酶基因的序列特征及其表达分析[J]. 上海海洋大学学报, 2013, 22(4): 481-487.
Jin Kai, Niu Donghong, Wang Lie, et al. Molecular characteristics and expression analysis of serine protease fromSinonovaculaconstricta[J]. Journal of Shanghai Ocean University, 2013, 22(4): 481-487.
[33] 邢贺飞. 半滑舌鳎抗病相关SNP标记的筛选及两种免疫相关基因的克隆与初步分析[D]. 上海: 上海海洋大学, 2015.
Xing Hefei. Screening and identification of disease-resistant related single nucleotide polymorphism markers, and cloning and preliminary analysis of two immune-related genes in half smooth tongue sole (Cynoglossussemilaevis)[D]. Shanghai: Shanghai Ocean University, 2015.
[34] 李同明. 尼罗罗非鱼Nramp基因的克隆分析与表达研究[D]. 泰安: 山东农业大学, 2013.
Li Tongming. Molecular cloning and expression analysis ofNrampgene in Nile tilapia (Oreochromisniloticus)[D]. Tai′an: Shandong Agricultural University, 2013.
[35] Atkinson P G P, Blackwell J M, Barton C H. Nramp1 locus encodes a 65 kDa interferon-γ-inducible protein in murine macrophages[J]. Biochemical Journal, 1997, 325(3): 779-786.
Cloning of natural resistance associated macrophage protein2 (Sc-Nramp2)gene fromsinonovaculaconstrictaand the expression analysis undervibrioparahaemolyticusstimulation
Lin Dehai1, Liu Chenshan1, Dong Yinghui1, He Lin1, Lin Zhihua1
(1.KeyLaboratoryofAquaticGermplasmResourceofZhejiang,ZhejiangWanliUniversity,Ningbo315100,China)
The cDNA sequence of natural resistance associated macrophage protein inSinonovaculaconstricta(Sc-Nramp2) was cloned by SMART RACE techniques. The ORF of cDNA sequence, coding for a protein of amino acids, was 1 773 bp and the molecular weight was deduced for 65.86 kDa.Sc-Nramp2 protein has the typical structural features with Solute carrier family 11 member, with 10 typical transmembrane domains and 2 glycosylation site. In 3′-UTR,Sc-Nramp2 was the presence of two IRE which was similar to the vertebrate Nramp2. Homology analysis indicated that the identity of Nramp withCrassostreagigaswas 71.6%. Real-time quantitative RT-PCR analysis indicated that the mRNA was expressed in all the six tissues, including adductor muscle, mantle, hepatopancreas, foot, waterpipe and gill. Nramp was expressed with the highest expression level in the hepatopancreas, then the gill, which had extremely significant differences from other tissues(P<0.01). The expression of Nramp in the hepatopancreas injected withV.Parahaemolyticusincreased significantly(P<0.01). It rose to maximum expression at the 12thhour and returned to the initial level. These results indicated thatSc-Nramp2 is involved in innate immunity of this species.
Sinonovaculaconstricta;Sc-Nramp2;gene cloning;VibrioParahaemolyticus;gene expression
10.3969/j.issn.0253-4193.2017.08.007
2016-11-23;
2017-04-13。
国家现代贝类产业技术体系项目(CARS-48);浙江省重大科技专项(2016C12907-7);国家水产种质资源平台项目(2015DKA30470);宁波市科技富民项目(2015C1000);浙江省重中之重学科学生创新项目(CX2015011);浙江省教育厅一般项目(Y201329410)。
林德海(1990—),男,浙江省苍南县人,从事海洋贝类种质资源与遗传育种研究。E-mail:772351303@qq.com
*通信作者:林志华,博士,研究员。E-mail:zhihua9988@126.com
Q786
A
0253-4193(2017)08-0070-08
林德海,刘晨珊,董迎辉,等. 缢蛏天然抗性相关巨噬蛋白2(Sc-Nramp2)基因克隆及其在副溶血弧菌刺激下的表达分析[J].海洋学报,2017,39(8):70—77,
Lin Dehai, Liu Chenshan, Dong Yinghui,et al. Cloning of natural resistance associated macrophage protein 2 (Sc-Nramp2)gene from sinonovacula constricta and the expression analysis under vibrio parahaemolyticus stimulation[J]. Haiyang Xuebao,2017,39(8):70—77, doi:10.3969/j.issn.0253-4193.2017.08.007

