以脐带间充质干细胞为载体的靶向基因治疗系统联合5-FU对裸鼠HepG2移植瘤的作用
孔凡妮,查剑英,杨圆圆,卢杨 ,李真真,张砚君(中国医学科学院血液病医院血液学研究所,天津30000;西安交通大学第二附属医院)
以脐带间充质干细胞为载体的靶向基因治疗系统联合5-FU对裸鼠HepG2移植瘤的作用
孔凡妮1,查剑英1,杨圆圆1,卢杨1,李真真2,张砚君1
(1中国医学科学院血液病医院血液学研究所,天津300020;2西安交通大学第二附属医院)
目的 构建以人脐带间充质干细胞(HUMSCs)为载体的靶向基因治疗系统,观察该系统联合低剂量5-FU对裸鼠HepG2移植瘤的治疗作用。方法 采用组织块接种法从新鲜无菌新生儿脐带中分离HUMSCs,利用PCR、重叠PCR、酶切、连接等分子生物学技术构建慢病毒表达质粒LentiR.E1A和腺病毒穿梭质粒pAd-hTERTp-IL24,并包装慢病毒LentiR.E1A和腺病毒Ad-hTERTp-IL24。采用Transwell实验观察慢病毒和腺病毒共感染对HUMSCs向HepG2细胞趋化的影响。采用皮下接种的方法建立HepG2移植瘤模型,将荷瘤小鼠分成5组各5只,分别给予尾静脉注射PBS、HUMSCs、低剂量5-FU、慢病毒感染HUMSCs联用低剂量5-FU、双病毒共感染HUMSCs联用低剂量5-FU的治疗,比较各组的抑瘤效应。利用BD Annexin-Ⅴ-PE凋亡试剂盒检测腺病毒Ad-hTERTp-IL24与低剂量5-FU联用诱导肝癌细胞凋亡情况。 结果 成功构建了慢病毒表达载体pLentiR.E1A和腺病毒表达载体pAd-hTERTp-IL24,并成功包装出了慢病毒LentiR.E1A和腺病毒Ad-hTERTp-IL24。Transwell实验显示,慢病毒和腺病毒共感染HUMSCs向肿瘤细胞的迁移能力无明显改变。联合低剂量5-FU治疗裸鼠肝移植瘤中治疗组肿瘤体积较对照组减小(P<0.01)。Ad-hTERTp-IL24与低剂量5-FU联用诱导肿瘤微环境内的肿瘤细胞发生凋亡,其荧光强度明显强于Ad-Track+5-Fu组和5-Fu组。结论 成功构建了以HUMSCs为载体的靶向基因治疗系统,由HUMSCS.LentiR.E1A运载携带抑瘤基因的腺病毒Ad-hTERTp-IL24联用低剂量5-FU对裸鼠HepG2移植瘤有明显抑制作用。
脐带间充质干细胞;腺病毒;靶向基因治疗系统;5-氟尿嘧啶;HepG2移植瘤
肝癌由于其发病隐匿,患者被确诊时往往已达晚期并伴随肝功能不全,多数预后很差。目前,针对肝癌的传统治疗手段包括手术、化疗和放疗等,但疗效均欠佳。随着肿瘤分子生物学和现代细胞分子生物学技术的快速发展,基因治疗成为未来肿瘤治疗的新希望。间充质干细胞具有来源广泛、扩增迅速、外源基因导入高效、低免疫原性和在体内向炎症损伤及肿瘤部位归巢等优势[1],作为基因治疗的运载细胞受到越来越多的关注。研究[2,3]显示,将运载体人脐带间充质干细胞(HUMSCs)携带腺病毒复制所必需的早期基因E1A,使其成为腺病毒包装细胞,具备在肿瘤部位靶向释放腺病毒的能力。人端粒酶逆转录酶启动子(hTERTp)在肿瘤细胞中具有较高的转录活性,能够驱动抑瘤基因白细胞介素24(IL-24)表达[4,5]。因此,将hTERTp装载于腺病毒上用以操控IL-24表达,可使该治疗基因特异高效地在肿瘤细胞表达而对正常细胞没有影响[6,7]。复制缺陷型腺病毒有一定的局限性,比如它缺乏条件复制型病毒的放大效应及病毒扩散的能力、治疗基因在肿瘤细胞表达水平不高等,势必影响疗效。我们的前期研究已利用基因工程方法成功构建慢病毒表达质粒P LentiR.E1A和腺病毒穿梭质粒pAd-hTERTp-IL24,并成功包装出相应的慢病毒和腺病毒;并证实由双病毒共感染的HUMSCs可以包装出IL-24腺病毒,其对HepG2细胞系的感染效率较好[8]。5-FU作为肝癌治疗中常用的化疗药物,低剂量的5-FU能提高肿瘤细胞表面柯萨奇腺病毒受体(CAR)表达,与腺病毒联合应用表现出协同作用[9],使其抑瘤作用更显著。在此研究基础上,近一年时间我们利用经过E1A基因修饰的HUMSCs复制和包装出由hTERTp启动子驱动的特异抑瘤基因IL-24的Ad-hTERTp-IL24质粒,观察其与低剂量5-FU联合治疗HepG2肝癌皮下移植瘤的效果。
1 材料与方法
1.1 材料 5~6周龄SPF级雌性BALB/c裸鼠,体质量15~17 g,购自北京维通利华实验动物技术有限公司。新鲜无菌新生儿脐带,由天津市中心妇产科提供,获得孕产妇知情同意。BD Annexin-Ⅴ-PE凋亡试剂盒。人肝细胞癌细胞系HepG2、人胚肾细胞系293A由中国医学科学院血液病医院血液学研究所实验室保存;人胚肾细胞系293T细胞由中国医学科学院血液学研究所国家重点实验室程涛教授馈赠。
1.2 HUMSCs的分离培养与鉴定 采用组织块接种法。将新生儿脐带剪碎,种植于10 cm2平皿中,于37 ℃、5% CO2孵箱中倒置;贴壁4 h后,添加含10% FBS和2 mmol/L谷氨酰胺的DF-12培养液8 mL。继续培养7~10 d后,显微镜下可见组织块周围有长梭形纤维状细胞爬出,形成克隆样。待细胞长至70%~80%融合时可进行传代培养。取培养3~6代HUMSCs,消化离心后分别加入CD105-APC、CD73-PE、CD90-PE、CD34-PE、CD19-PE、CD45-PE的直标抗体或同型对照抗体,用流式细胞仪进行表型鉴定。3个阳性表面标志CD105、CD73、CD90阳性率均接近100%,3个阴性表面标志CD34、CD45、CD19表达均为阴性,表明获得了生长状态良好的HUMSCs。
1.3 慢病毒表达质粒pLentiR.E1A和腺病毒穿梭质粒pAd-hTERTp-IL24的构建 参考文献[8]方法,构建表达E1A的慢病毒表达质粒pLentiR.E1A。根据Invitrogen三质粒包装系统操作手册,将pLentiR.E1A、pLentiR(空载体对照)分别和2种包装质粒共转染293T细胞,收集病毒上清液保存备用。将hTERTp片段和IL24基因全长克隆入pAd-Track,构建腺病毒穿梭质粒pAd-hTERTp-IL24。将穿梭质粒pAd-hTERTp-IL24、pAd-Track(空载体对照)分别与pAd-Easy-1骨架质粒正确重组后,根据pAd-Easy腺病毒包装手册说明,于293A细胞中包装腺病毒质粒Ad-hTERTp-IL24。
1.4 双病毒共感染HUMSCs向HepG2细胞的趋化作用观察 采用Transwell实验。取对数生长期HepG2细胞,用含5% FBS的DMEM培养基调整细胞密度为1×105/mL,接种于24孔板中。次日将Transwell小室放入已接种HepG2细胞的24孔板中,于细胞培养箱预平衡1 h。其间消化收集腺病毒和慢病毒共感染12 h的HUMSCs(双病毒共感染HUMSCs组),共感染腺病毒和对照慢病毒LentiR的HUMSCs(慢病毒感染HUMSCs组)和未处理的空白HUMSCs(对照组)。培养20 h后,取出小室用0.1%结晶紫溶液染色45 min;倒置、风干后在倒置显微镜下随机选取5个20倍物镜视野计数染色细胞数目。实验重复3次。
1.5 双病毒共感染HUMSCs联合低剂量5-FU对裸鼠肝癌皮下移植瘤的作用观察 建立BALB/c裸鼠HepG2移植瘤模型。收集对数生长期HepG2细胞,冷PBS洗2次,调整细胞密度为2.5×107/mL,取200 μL细胞悬液接种于小鼠右前肢根部背侧皮下,建立肝癌移植瘤模型。接种后每天测量肿瘤长径和短径,计算肿瘤体积,肿瘤体积=1/2×长径×短径2。待肿瘤生长至200~300 mm3时,将小鼠分为空白组、对照组、5-FU组、慢病毒+5-FU组、双病毒+5-FU组5组各5只,分别向小鼠尾静脉注射PBS、HUMSCs、5-FU、慢病毒感染的HUMSCs和5-FU、双病毒共感染的HUMSCs和5-FU;联用5-FU的治疗组从HUMSCs注射后第3天开始腹腔注射药物,10 mg/kg,连续给药5 d。自开始治疗之日起,每隔3 d用游标卡尺测量各组小鼠移植瘤模型的肿瘤长径和短径,计算肿瘤体积。相对肿瘤体积比(RTV)=Vt/V0(V0为治疗开始时的体积,Vt为每次测量的体积),肿瘤抑制率=(1-治疗组RTV/空白组RTV)×100%。
1.6 腺病毒Ad-hTERTp-IL24与低剂量5-FU联用对肝癌细胞的作用观察 取对数生长期HepG2细胞,以1.5×105/mL接种于6孔板上的其中4个孔,培养1~2 h待细胞沉于孔板底部后,其中2孔按100 MOI的感染复数分别加入腺病毒Ad-hTERTp-IL24和对照病毒Ad-Track,再分别加入低剂量5-FU(终浓度2 μg/mL),另外2孔分别加入等体积PBS(空白组)和低剂量5-FU(终浓度2 μg/mL),37 ℃、5% CO2培养箱内继续培养。培养48 h后,收集细胞,使用BD AnnexinⅤ-PE试剂盒检测细胞凋亡情况,在荧光显微镜下观察细胞。正常细胞无染色,凋亡细胞和坏死细胞呈红色荧光,根据荧光强弱判断凋亡发生的程度。

2 结果
2.1 双病毒共感染前后HUMSCs向肿瘤细胞的趋化作用比较 结晶紫染色显示,对照组、慢病毒感染HUMSCs组和双病毒共感染HUMSCs组向HepG2细胞迁移的HUMSCs细胞数量均在60个左右,三组间比较无明显差异。
2.2 双病毒共感染HUMSCs联合低剂量5-FU的抑瘤作用 治疗后第6天,双病毒+5-FU组的平均肿瘤体积为180 mm3,空白组的平均肿瘤体积为400 mm3,两组比较P<0.01。且随着治疗时间的延长,这一趋势更为明显。初始治疗后第21天,双病毒+5-FU组的肿瘤抑制率为70.8%,高于慢病毒+5-FU组(23.2%)和5-FU组(21.4%),见图1。
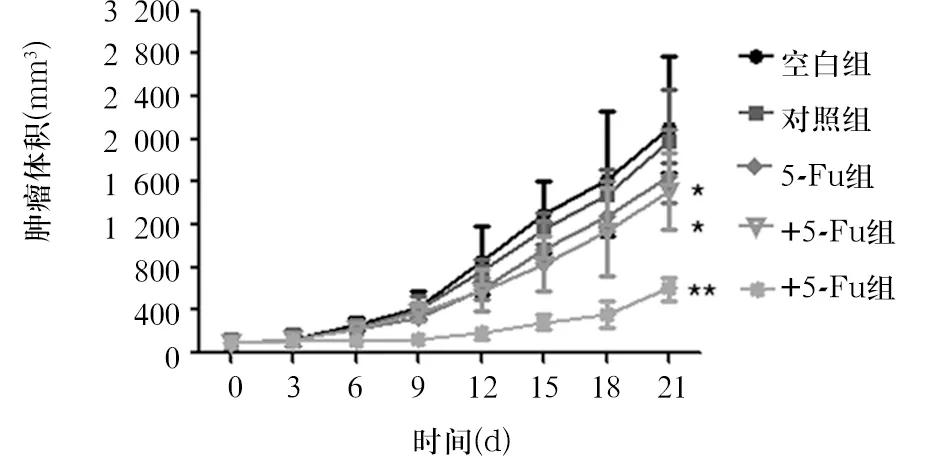
注:与空白组比较,*P<0.05,**P<0.01。
图1 双病毒共感染HUMSCs联用低剂量5-FU对HepG2移植瘤生长的抑制作用
2.3 腺病毒Ad-hTERTp-IL24与低剂量5-FU联用诱导肝癌细胞发生凋亡 荧光显微镜下可见,空白组几乎没有红色荧光,Ad-hTERTp-IL24联合5-FU组红色荧光非常明显,荧光强度明显强于Ad-Track+5-FU组和5-FU组。
3 讨论
大多数肝癌患者伴随基础的肝脏疾病,如肝硬化、肝功能代偿失调,手术切除效率低,放疗和化疗的效果差,病死率极高。基因靶向治疗是恶性肿瘤治疗中最有发展前景的领域之一,其中腺病毒的基因治疗在临床试验中的应用最为广泛[10~12]。由于腺病毒宿主范围广,可有效感染多种靶细胞,包括分裂和非分裂细胞,而其基因组游离于细胞基因组之外,可短期高效地表达目的基因,其已经应用于多种癌症的治疗研究。但腺病毒的基因治疗存在缺乏靶向性、免疫原性等问题。HUMSCs具有在体内向炎症损伤及肿瘤部位归巢、来源广泛、扩增迅速、外源基因导入高效、低免疫原性等优势[1],在基因治疗中呈现出广阔的应用前景。
我们的前期研究显示,在HepG2肝癌移植瘤模型小鼠体内,病毒感染的HUMSCs可以选择性地归巢于肿瘤部位[13]。本研究基于腺病毒基因治疗和HUMSCs肿瘤归巢的特性,设计了一种以HUMSCs为载体的靶向肝癌的腺病毒治疗体系。5-FU是临床治疗肝癌常用的化疗药物,我们将其与腺病毒靶向治疗体系联用以增加疗效,观察对HepG2肝癌移植瘤模型小鼠的抑瘤效应。首先采用组织块接种法分离HUMSCs,利用PCR、重叠PCR、酶切、连接等分子生物学技术构建慢病毒表达质粒LentiR.E1A和腺病毒穿梭质粒pAd-hTERTp-IL24,并成功包装出了慢病毒和腺病毒共感染HUMSCs。利用Transwell试验观察双病毒感染对HUMSCs向HepG2细胞趋化作用的影响。关于HUMSCs对肝癌HepG2细胞的趋化性已有报道,在HepG2细胞条件培养基的作用下,大量HUMSCs向其迁移,且呈细胞浓度依赖性;另外慢病毒感染HUMSCs后,对其迁移特性并无显著影响[13]。本研究结果显示,双病毒共感染后HUMSCs向HepG2细胞的趋化作用没有改变。简言之,腺病毒与慢病毒LentiR.E1A共感染HUMSCs并不影响其体内外向肿瘤部位归巢的能力。为了验证该治疗体系的治疗效果,我们建立了BALB/c裸鼠HepG2肝癌移植瘤模型,经尾静脉注射双病毒共感染的HUMSCS并联合低剂量5-FU,结果显示,该联合方案对BALB/c裸鼠HepG2移植瘤的生长具有明显抑制作用,优于单独应用的治疗效果。利用BD Annexin-Ⅴ-PE凋亡试剂盒检测腺病毒Ad-hTERTp-IL24与低剂量5-FU联用诱导肝癌细胞凋亡情况,通过荧光显微镜观察荧光强弱来判断凋亡发生的程度。结果显示,腺病毒Ad-hTERTp-IL24联合5-FU组红色荧光非常明显,与该腺病毒作用体内肿瘤微环境对HepG2移植瘤生长的抑制作用结果一致[14]。
综上所述,我们建立了以HUMSCs为载体的腺病毒基因治疗体系,即利用E1A基因修饰的HUMSCs复制和包装出特异治疗基因(由hTERTp启动子驱动的抑瘤基因IL-24)的腺病毒。复制缺陷的腺病毒感染E1A基因修饰的HUMSCs后可在细胞中复制包装,最终释放腺病毒颗粒;在HepG2肝癌移植瘤模型小鼠体内,病毒感染的HUMSCs可选择性向肿瘤部位归巢,随着腺病毒的大量复制,HUMSCs最终被裂解,并在肿瘤周围释放携带由hTER启动子驱动的特异抑瘤基因IL-24的腺病毒颗粒,感染肿瘤细胞后,因为肿瘤细胞内hTERT启动子具有较高的转录活性,可以特异高效地启动IL-24基因的表达,发挥其抗肿瘤作用;当与5-FU联合应用时抑瘤作用更显著。该靶向治疗体系既解决了腺病毒载体缺乏靶向性的问题,又保留其高效的基因转导能力,并利用HUMSCs向微小转移灶归巢的能力,为肝癌治疗特别是转移灶的治疗提供了一个安全、有效、靶向性好的基因导入体系。
[1] Fernández Vallone VB, Romaniuk MA, et al. Mesenchymal stem cells and their use in therapy: what has been achieved[J]. Differentiation, 2013,85(1-2):1-10.
[2] Yuan X, Zhang Q, Li Z, et al. Mesenchymal stem cells deliver and release conditionally replicative adenovirus depending on hepatic differentiation to eliminate hepatocellular carcinoma cells specifically[J]. Cancer Lett, 2016,381(1):85-95.
[3] Zang RY, Shi DR, Lu HJ, et al. Adenovirus 5 E1a-mediated gene therapy for human ovarian cancer cells in vitro and in vivo[J]. Int J Gynecol Cancer, 2001,11(1):18-23.
[4] Ito H, Kyo S, Kanaya T, et al. Expression of human telomerase subunits and correlation with telomerase activity in urothelial cancer[J]. Clin Cancer Res, 1998,4(7):1603-1608.
[5] Fan Y, Liu Z, Fang X, et al. Differential expression of full-length telomerase reverse transcriptase mRNA and telomerase activity between normal and malignant renal tissues[J]. Clin Cancer Res, 2005,11(12):4331-4337.
[6] Higashi K, Hazama S, Araki A, et al. A novel cancer vaccine strategy with combined IL-18 and HSV-TK gene therapy driven by the hTERT promoter in a murine colorectal cancer model[J]. Int J Oncol, 2014,45(4):1412-1420.
[7] Bougel S, Lhermitte B, Gallagher G, et al. Methylation of the hTERT promoter: a novel cancer biomarker for leptomeningeal metastasis detection in cerebrospinal fluids[J]. Clin Cancer Res, 2013,19(8):2216-2223.
[8] 杨圆圆,卢杨,张晓龙,等.双病毒共感染的人脐带间充质干细胞多重靶向肝癌细胞的治疗体系的建立[J].生物医学工程与临床,2016,20(5):450-457.
[9] Souza KT, Pereira AA, Araujo RL, et al. Replacing 5-fluorouracil by capecitabine in localised squamous cell carcinoma of the anal canal: systematic review and meta-analysis[J]. Ecancermedicalscience, 2016,10:699.
[10] Tazawa H, Kagawa S, Fujiwara T. Advances in adenovirus-mediated p53 cancer gene therapy[J]. Expert Opin Biol Ther, 2013,13(11):1569-1583.
[11] Rosewell Shaw A, Suzuki M. Recent advances in oncolytic adenovirus therapies for cancer[J]. Curr Opin Virol, 2016,21:9-15.
[12] Farzad L, Cerullo V, Yagyu S, et al. Combinatorial treatment with oncolytic adenovirus and helper-dependent adenovirus augments adenoviral cancer gene therapy[J]. Mol Ther Oncolytics, 2014,1:14008.
[13] Yan C, Yang M, Li Z, et al.Suppression of orthotopically implanted hepatocarcinoma in mice by umbilical cord-derived mesenchymal stem cells with sTRAIL gene expression driven by AFP promoter[J]. Biomaterials, 2014,35(9):3035-3043.
[14] Long Q, Yang R, Lu W. Adenovirus-mediated truncated Bid overexpression induced by the Cre/LoxP system promotes the cell apoptosis of CD133+ovarian cancer stem cells[J]. Oncol Rep, 2017,37(1):155-162.
Effect of targeted gene therapeutic system with HUMSCs as vectors combined with 5-FU on HepG2 exnograft tumor of nude mice
KONGFanni1,ZHAJianying,YANGYuanyuan,LUYang,LIZhenzhen,ZHANGYanjun
(1ChineseAcademyofMedicalSciencesHospitalofBloodDiseases&InstituteofHematology,Tianjin300020,China)
Objective To construct a targeted gene therapy system with human umbilical cord mesenchymal stem cells (HUMSCs) as vectors, and to observe its therapeutic effect on nude mice HepG2 xenografts combined with low-dose 5-fluorouracil (5-FU). Methods HUMSCs were isolated from fresh sterile neonatal umbilical cord by tissue adherent method. We used the methods of PCR, overlap PCR, and restriction enzyme cleavage and linkage to construct the lentiviral expression vector pLentiR.E1A and the adenovirus shuttle vector pAd-hTERTp-IL24. The migratory ability to HepG2 cells of HUMSCs co-infected by lentivirus and adenovirus in vitro was determined by Transwell experiment. HepG2 transplanted tumor model was established in BALB/c nude mice by subcutaneous inoculation. The tumor-bearing mice were divided into five groups and the groups were separately injected with PBS, HUMSCs, low-dose 5-FU, HUMSCs infected by lentivirus combined with ow-dose 5-FU, and HUMSCs co-infected by double virus combined with 5-FU. The anti-tumor effect of each group was compared. The apoptosis of hepatocellular carcinoma cells induced by adenovirus Ad-hTERTp-IL24 and low-dose 5-FU was detected by BD Annexin-Ⅴ-PE apoptotic kit.Results The lentiviral expression vector pLentiR.E1A and adenovirus expression vector pAd-hTERTp-IL24 were successfully constructed and the lentivirus LentiR.E1A and adenovirus Ad-hTERTp-IL24 were successfully packaged. Transwell experiment showed that there was no significant change in the migratory ability of HUMSCs to tumor cells after co-infected by double virus. In treatment of HepG2 exnograft tumor of nude mice, the tumor volume was significantly smaller in the treatment group than in the control group (P<0.01). Ad-hTERTp-IL24 combined with low-dose 5-FU induced tumor apoptosis in the tumor microenvironment, and its fluorescence intensity was stronger than that of the other treatment control groups.Conclusion The targeted gene therapeutic system based on HUMSCs is successfully established, and adenovirus Ad-hTERTp-IL24 combined with low-dose 5-FU have significant inhibitory effect on HepG2 exnograft tumor of nude mice.
human umbilical cord mesenchymal stem cells; adenovirus; targeted gene therapeutic system; 5-fluorouracil; HepG2 exnograft tumor
国家科技重大专项基金资助项目(2012ZX09102301-015)。
孔凡妮(1988-),女,硕士研究生,主要研究方向为肿瘤药理学。E-mail: fannikong@163.com
张砚君(1977-),女,博士,助理研究员,主要研究方向为肿瘤药理学。E-mail: junjunfriend@126.com
10.3969/j.issn.1002-266X.2017.26.003
R394.6
A
1002-266X(2017)26-0009-04
2017-02-04)

