紫外/超声协同灭活隐孢子虫的影响因素及机制
李绍峰, 徐宏平,, 冉治霖, 张可方, 张朝升
1.深圳职业技术学院, 深圳市工业节水及城市污水资源化技术重点实验室, 广东 深圳 518055 2.广州大学土木工程学院, 广东 广州 510006 3.深圳信息职业技术学院交通与环境学院, 广东 深圳 518172
紫外/超声协同灭活隐孢子虫的影响因素及机制
李绍峰1, 徐宏平1,2, 冉治霖3, 张可方2, 张朝升2
1.深圳职业技术学院, 深圳市工业节水及城市污水资源化技术重点实验室, 广东 深圳 518055 2.广州大学土木工程学院, 广东 广州 510006 3.深圳信息职业技术学院交通与环境学院, 广东 深圳 518172
为研究UVUS(UltravioletUltrasonic, 紫外超声)协同对水中隐孢子虫的灭活机制,采用UV灯(功率为14 W)与US发生器(频率为20 kHz,功率为150 W)组合装置协同灭活隐孢子虫,考察pH、温度、浊度和HA(腐殖酸)对UVUS协同灭活隐孢子虫的影响,并通过SEM(扫描电镜)、蛋白质试验和琼脂糖凝胶电泳检测对灭活机制进行了探讨. 结果表明:pH对UVUS杀灭隐孢子虫的影响不大,碱性条件下灭活率略高于中性和酸性条件;温度对灭活率有一定影响,5 ℃下灭活率较低,随温度的上升,灭活率逐渐提高,25 ℃下10 min灭活率可达99%以上;悬浮物抑制隐孢子虫的灭活,浊度为40 NTU时,UVUS作用25 min的灭活率仅为93.88%;HA对灭活的影响表现为低浓度促进,高浓度抑制;ρ(HA)高于10 mgL时,继续增大ρ(HA)对隐孢子虫灭活率影响不大. 研究显示: UVUS协同作用对隐孢子虫的灭活机制主要是使其卵囊破裂,同时损伤了隐孢子虫胞内的DNA.
隐孢子虫; 超声; 紫外; 影响因素; 灭活机制
隐孢子虫是一种可寄生于人与动物体肠道的寄生虫,属原虫类病原体,可通过食物、水源和动物传播来感染宿主,呈全球性分布,并且常引起隐孢子虫病群体性暴发事件[1- 3]. 人对隐孢子虫病普遍易感,患者易产生腹痛、反胃、痉挛等多种不良症状[4- 5]. 隐孢子病威胁公众健康,甚至影响经济发展,受到全球的关注,因此研究隐孢子虫对临床和公共卫生以及维护社会稳定都有重大意义[6].
多数隐孢子虫卵囊属厚壁型卵囊,传统的氯系水处理消毒剂(如液氯、二氧化氯、氯胺等)对其作用效果不佳[7],大剂量杀菌剂的加入还会引起致癌性消毒副产物的生成,影响水质安全与卫生. UV(Ultraviolet,紫外)光作为目前在各水厂尤其是城市污水处理厂广泛应用的消毒方法,对细菌、病毒及微藻有着良好的杀灭效果[8- 12],消毒过程无副产物,而且污染物遗传特性不增强[13]. 另外也有研究[14- 18]表明,UV可以用于灭活隐孢子虫,但所需灭活时间较长,单一UV灭活并不经济. 而US(Ultrasonic,超声)技术在灭活领域的高效性及具有不产生消毒副产物的优点,被认为是一项新的有效消毒方法[19- 20],但也存在着灭活耗能高等缺点[21]. 有研究利用US作为UV消毒前预处理进行污水处理,借助US破碎水中大颗粒悬浮物,使微生物失去依附,从而更易被UV杀灭,增强了UV消毒效果[22].
该研究根据UV和US各自不同作用特点和机制,以UV灯与US发生器组合装置协同灭活隐孢子虫,考察pH、温度、浊度、有机物等因素对UVUS灭活隐孢子虫的影响,同时利用扫描电镜观察、蛋白质试验和琼脂糖凝胶电泳成像来对UVUS灭活隐孢子虫的机理进行探讨,以期为UVUS技术用于两虫的灭活提供依据.
1 材料与方法
1.1 试验装置
试验装置如图1所示. US发生器为150 W、20 kHz;低压UV灯为美国KADINDUV灯管,功率14 W,型号GPH287T5L;置有含隐孢子虫卵囊原水的玻璃管,直径4 cm;水槽及暗箱(外部封有锡纸)均为PVC材料.
将100 mL浓度为2×104mL-1的虫样置于反应装置中,控制温度为(22±1)℃,pH为7.0±0.2. US发生器选用150 W、20 kHz,与UV联合作用25 min,分别在1、3、5、10、15、20和25 min时用1.5 mL离心管取样1 mL进行活性检测或相关试验.

注:1—US反应器;2—进水口;3—US传感器;4—反应器;5—水浴槽;6—出水口;7—UV灯.图1 UVUS反应装置Fig.1 Experiment apparatus of ultraviolet synergistic ultrasonic
1.2 试验材料
所用隐孢子虫(Cryptosporidium)卵囊为C.baileyi.HauC株,提取自患隐孢子虫病鸡的排泄物. 虫样低温(4 ℃)存放于2.5%重铬酸钾悬浮液中. PI(普匹碘胺)、DAPI(4,6-二脒基- 2-苯基-吲哚)及Hanks 平衡盐溶液均为美国Sigma产品.
1.3 分析方法
1.3.1 荧光活性染色法
隐孢子虫活性检测采用荧光活体染色法[23]. 取1 mL样品于4 ℃、10 000 rmin下离心5 min,用Hanks平衡盐溶液清洗3次;弃上清液至200 μL,加100 μL DAPI、100 μL PI使用液,37 ℃避光水浴1 h. 再用平衡溶液清洗3次,将样品中多余的DAPI与PI洗净. 涂片后在400倍荧光显微镜(OLYMPUS,BX- 51)下镜检,灭活率(η)计算公式:
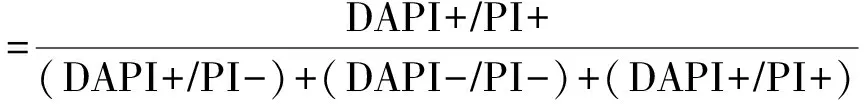
式中:DAPI+为细胞壁外侧呈淡蓝色,细胞内部未被染色的隐孢子虫个数;DAPI-为细胞壁外侧和细胞内部均未染上淡蓝色的隐孢子虫个数;PI+为细胞核被染色红色的隐孢子虫个数;PI-为细胞内部未被染色,细胞壁也未被染成红色的隐孢子虫个数.
其中,“两虫”检测数量≥300个.
1.3.2 扫描电镜(SEM)
利用型号为S4700的扫描电镜(HITACHI, Japan)进行形态学观察. 采用2.5%的戊二醛固定样品后,用50%、75%、90%、100%的乙醇进行多次脱水,再分别用1∶1(体积比)的100%乙醇与醋酸异戊酯混合液进行置换,置换后的样品用针头或枪头挑出,放入称量纸叠成的小盒中干燥12 h. 最后使用离子溅射镀膜仪喷金.
1.3.3 体系溶解蛋白的检测
采用超微量分光光度计Nanodrop 2000(Thermo)检测体系中ρ(溶解蛋白). 蛋白质分子中的酪氨酸、苯丙氨酸和色氨酸残基使其在280 nm处具有UV吸收,吸光度与ρ(溶解蛋白)成正比[24].
1.3.4 基因组DNA检测
纯化后的隐孢子虫卵囊样品经液氮冻融3次,分别加入270 μL的裂解缓冲液和30 μL、20 mgmL的蛋白酶K,期间多次混匀并消化,55 ℃水浴12 h. 再加等体积CHCl3混匀离心(10 000 rmin)10 min,取上清液至另一离心管中,加入0.7倍体积的异丙醇沉淀20 min,离心10 min,去上清液后用70%的乙醇洗涤,再离心并去上清液一次,将沉淀物干燥10 min,用50 μL TE溶液(pH8.0)进行溶解,加入1 μL RNase A(10 mgmL)消化RNA,作用时间10 min,电泳检测结果.
2 结果与讨论
控制温度为(22±1)℃,浊度为1 NTU条件下,考察pH分别为5、6、7、8和9对UVUS灭活隐孢子虫的影响. 由图2可见,随pH的增加,灭活率有所提高. pH分别为5、7和9时,UVUS作用15 min的灭活率分别为93.33%、94.87%和95.45%. 在灭活时间为25 min时,不同pH下的灭活率均达到了99.99%. 碱性条件下灭活率略高于中性和酸性条件,但总体而言pH对USUV灭活隐孢子虫的影响不大.

pH:1—5;2—6;3—7;4—8;5—9.图2 pH对UVUS灭活隐孢子虫的影响Fig.2 Influence of pH on inactivation of Cryptosporidium under UV US

温度℃:1—5;2—15;3—25;4—35.图3 温度对UVUS灭活隐孢子虫的影响Fig.3 Influence of temprature on inactivation of Cryptosporidium parvum under UVUS
在pH为7,浊度1 NTU条件下,考察温度分别为5、10、15、20和25 ℃时USUV灭活隐孢子虫的情况. 由图3可见,在温度为5和15 ℃时,作用时间为10 min时灭活率分别为81.82%和88.37%;当温度升至25 ℃时,灭活率增至92.86%,说明温度高,有利于灭活. 在35 ℃下灭活率达到90%以上所需时间少于10 min,而5 ℃条件下灭活率达到90%以上则需作用20 min. 这主要是因为温度升高会导致空化泡的阀域值降低,空化泡更易发生[25- 26],另一方面,在较低温度下尚有部分隐孢子虫处于休眠状态,代谢率低,不易被杀灭.

浊度NTU:1—1;2—4;3—15;4—25;5—40.图4 浊度对UVUS灭活隐孢子虫的影响Fig.4 Effect of turbidity on inactivating Cryptosporidium under UVUS
pH为7、温度为(22±1)℃条件下,考察不同浊度(1、4、15、25和40 NTU)下USUV对隐孢子虫的的灭活率. 由图4可见,当浊度为1 NTU时,15 min的灭活率为95.07%. 研究[27]表明,控制温度为(20±1)℃, 仅US(151 W、19.8 kHz)作用15 min,浊度为0与1.13 NTU(此时灭活率最高)时隐孢子虫的灭活率分别为92.5%、94.7%. 忽略温度微弱差异的影响,对比可见UVUS灭活率高于US灭活率. 浊度为4和15 NTU时,要使隐孢子虫灭活率达到95%以上所需的灭活时间分别为20和25 min. 在浊度为40 NTU时,UVUS作用25 min后的灭活率仅为93.88%. 究其原因,①低浊度时溶液中的微粒会造成空化作用,产生的气泡发生不对称溃陷,变为更多更微小的气泡,增强了空化作用的强度[28- 29];②浊度过大时溶液中的悬浮物吸收了声波和UV光辐照的能量[30],导致了隐孢子虫灭活率下降.
HA(Humic Acid,腐殖酸)是一种广泛存在的天然高分子有机物,以HA为代表有机物考察其对USUV 灭活隐孢子虫的影响. 温度为(22±1)℃,浊度为1 NTU时,不同ρ(HA)(0.5、1、2、5、10、20和50 mgL)下隐孢子虫灭活率见图5. 试验中不对水样的pH调节以免缓冲溶液对试验结果造成干扰. 由图5可见,同一作用时间下,隐孢子虫灭活率随ρ(HA)的增加先升再降. 在ρ(HA)为0~1 mgL时,灭活率逐渐上升,并且ρ(HA)为1 mgL条件下(灭活时间25 min)隐孢子虫灭活率为99.99%.ρ(HA)高于2 mgL时,继续增大ρ(HA),隐孢子虫灭活率开始下降,在ρ(HA)达到50 mgL时,灭活率降至90.91%.

作用时间min:1—5;2—10;3—20;4—25.图5 ρ(HA)对UVUS灭活隐孢子虫的影响Fig.5 Effect of HA on inactivating Cryptosporidium under UVUS
研究[27]显示,ρ(HA)为50.0 mgL时US作用15 min灭活率为78.4%,显然USUV作用效果优于单独US. 在ρ(HA)大于10 mgL时,灭活率下降不多,即此时再增大ρ(HA),对隐孢子虫灭活率影响不大,说明有机物对UVUS灭活隐孢子虫的影响存在一个饱和阈值. HA对隐孢子虫灭活率影响的原因可能是低质量浓度(小于1 mgL)的HA促进了US的空化作用,高质量浓度的HA则主要表现为与隐孢子虫形成竞争关系,造成隐孢子虫灭活率下降. 同时HA是UV线的强吸收体,吸收了部分UV光的能量,削弱了对隐孢子的灭活效果.
UV照射细菌后,其体内DNA分子上的两个相邻的胸腺嘧啶(T)或胞嘧啶(C)之间会形成胸腺嘧啶二聚体(CPDs),该结构的形成是核酸的功能受到损伤和破坏,微生物死亡的主要原因[31- 32]. 但由于微生物自身的修复机制使处理水中的细菌及病原体产生光复活,导致实际工程中微生物指标不能达到要求. US对生物体的表面结构有所破坏,其机械作用能够改变水中颗粒污染物的粒径组成;US的空化作用所产生的高速微射流的机械剪切作用与自由基的氧化作用,能够破坏微生物的细胞壁、细胞膜,从而使细胞质流出,使细胞酶及转运系统受到破坏[27,33]. US的协同能够在一定程度上对光复合现象产生抑制效果. 该研究通过扫描电镜观察、蛋白质试验以及琼脂糖凝胶电泳检测探究UVUS对隐孢子虫的表面结构和核酸(主要DNA)的破坏或损伤.
2.5.1ρ(溶解蛋白)及隐孢子虫细胞形态变化
采用US发生器(150 W、20 kHz)耦合低压UV灯(功率14 W,波长范围为254 nm),在pH为7、浊度为1 NTU、温度为(22±1)℃的条件下,对浓度为2×104mL-1的隐孢子虫悬浮液分别灭活1、5、15和25 min. 利用超微量分光光度计,检测灭活体系中ρ(溶解蛋白)的变化,结果如图6所示. 由图6可见,UVUS作用5 min,体系中ρ(溶解蛋白)由0.357 mgmL 增至0.538 mgmL,5 min后ρ(溶解蛋白)的增加趋缓;UVUS作用时间增至25 min,体系中ρ(溶解蛋白)达到最大值(0.615 mgmL).

图6 UVUS灭活隐孢子虫体系ρ(溶解蛋白)的变化Fig.6 SEM photos and protein concentraion of Cryptosporidium inactivated by UVUS

图7 UVUS灭活隐孢子虫细胞形态变化Fig.7 SEM photos of Cryptosporidium inactivated by UVUS
通过SEM(扫描电镜)10 000倍下对隐孢子虫细胞形态结构的变化进行观察,结果如图7所示. 由图7可见,UVUS作用5 min,体系中大部分隐孢子虫已经外壁破裂死亡,囊内的可溶性蛋白流出溶解;而5 min 后,只有少部分抗性强的厚壁卵囊破壁流出蛋白;UVUS作用时间由1 min增至25 min,隐孢子虫细胞结构和表面形态发生很大的变化,外壁先发生局部的裂隙然后到卵囊整体裂解,过程完整,最后导致虫体死亡,这与体系中ρ(溶解蛋白)变化规律相一致.
2.5.3 琼脂糖凝胶电泳检测

图8 UVUS处理前后隐孢子虫基因组DNA电泳图谱Fig.8 Agarose gelelectrophoresis of Cryptosporidium genomic DNA by UVUS
3 结论
b) HA对耦合作用下的灭活是低浓度时促进,高浓度抑制,并且ρ(HA)高于10 mgL时,继续增大ρ(HA)对隐孢子虫灭活率影响不大.
c) 通过扫描电镜(SEM)观察、蛋白质试验和琼脂糖凝胶电泳检测发现,UVUS灭活隐孢子虫的机制为US使隐孢子虫卵囊破裂,细胞质流出死亡,UV同时损伤隐孢子虫的DNA.
[1] ROBERTSON L J.GiardiaandCryptosporidiuminfections in sheep and goats:a review of the potential for transmission to humans via environmental contamination[J].Epidemiology and Infection,2009,137(7):913- 921.
[2] GRACZYK T K,MAJEWSKA A C,SCHWAB K J.The role of aquatic birds in dissemination of human waterborne enteropathogens[J].Trends in Parasitology,2008,24(2):55- 59.
[3] 夏云婷,查玉娥,田向红,等.牧区生活饮用水贾第鞭毛虫和隐孢子虫的调查[J].环境与健康杂志,2015,32(2):134- 135. XIA Yunting,ZHA Yue,TIAN Xianghong,etal.Investigation ofGiardiaandCryptosporidiumcontamination in drinking water in a pasturing area in Inner Mongolia[J].Journal Environmental Health,2015,32(2):134- 135.
[4] 杨兴友,王光西.人体隐孢子虫病流行状况[J].寄生虫病与感染性疾病,2005,3(3):135- 137. YANG Xingyou,WANG Guangxi.Prevalence of cryptosporidiosis in human body[J].Parasitoses and Infectious Disease,2005,3(3):135- 137.
[5] LISLE J,ROSE J.Cryptosporidiumcontamination of water in the USA and UK:a mini-review[J].Water SRT-Aqua,1995,44(3):103- 117.
[6] ORTEGA P G,SMITH H V,CACCIO S M,etal.New tools provide further insights intoGiardiaandCryptosporidiumbiology[J].Trends in Parasitology,2009,25(9):410- 416.
[7] MONTEMAYOR M,GALOFRE B,RIBAS F,etal.Comparative study between two laser scanning cytometers and epifluorescence microscopy for the detection ofCryptosporidiumoocysts in water[J].Cytometry Part A,71A,2007,71(3):163- 169.
[8] 张萍,张再兴,付兴华,等.紫外线灭活新城疫病毒体外抗肿瘤作用的研究[J].中国煤炭工业医学杂志,2007,10(4):457- 458. ZHANG Ping,ZHANG Zaixing,FU Xinghua,etal.Study on anti tumor effect of ultraviolet inactivatedNewcastlediseasevirus in vitro[J].Chinese Journal of Coal Industry Medicine,2007,10(4):457- 458.
[9] 楼朝刚,夏东升,赵凡,等.微波无极UV光对自来水中微生物的灭活作用[J].环境工程,2008,26(3):10- 12. LOU Chaogang,XIA Dongsheng,ZHAO Fan,etal.Inactivation of microbe in running water using microwave electrodeless ultraviolet light[J].Environmental Engineering,2008,26(3):10- 12.
[10] 刘澈,刘文君.UV-C对几种海洋微藻的灭活效果研究[J].海洋环境科学,2013,32(2):171- 174. LIU Che,LIU Wenjun.The inactivation efficiencies of UV-C on several species of marine microalgaes[J].Marine Environmental Science,2013,32(2):171- 174.
[11] LESSER M P.Elevated temperature and ultraviolet radiation cause oxidative stress and inhibit photosynthesis in symbiotic dinoflagellates[J].Limnology and Oceanography,1996,41(2):271- 283.
[12] KARENTZ D,CLEAVER J E,MITCHELL D L.Cell survival characteristics and molecular responses of Antarctic phytoplankton to ultraviolet-b radiation[J].Journal of Phycology,1991,27(6):326- 341.
[13] THOMAS H,REGINA S,SIEGFRIED K,etal.Genotoxic response of Austrian groundwater samples treated under standardized UV(254 nm) -disinfection conditions in a combination of three different bioassays[J].Water Research,2002,36(1):25- 32.
[14] GOFF L L,KHALDI S,FAVENNEC L,etal.Evaluation of water treatment plant UV reactor efficiency againstCryptosporidiumparvumoocyst infectivity in immune competent suckling mice[J].Journal of Applied Microbiology,2010,108(3):1060- 1065.
[15] BELOSEVIC M,CRAIK S A,STAFFORD J L,etal.Studies on the resistancereactivation ofGiardiamuris cysts andCryptosporidiumparvunoocysts exposed to medium-press-ure ultraviolet radiation[J].Fems Microbiology Letters,2001,204(1):197- 203.
[16] ALEXANDER A M,ERNEST A M,PETER M W,etal.The effect of UV light on the inactivation ofGiardialamblia andGiardiamuriscysts as determined by animal infectivity assay(P- 2951- 01)[J].Water Research,2002,36:2098- 2108.
[17] DRESCHER A C,GREENE D M,GADGIL A J.Cryptosporidiuminactivation by low-pressure UV in water[J].Journal of Environmental Health,2001,64(3):31- 35.
[18] ANDREW T C,WALLIS P.The Effect of UV irradiation on human derived giardia lambilia cysts[J].Water Research,2002,36(3):963- 969.
[19] OLVER M,EGUIA A.RODRIGUEZ O,etal.Inactivation ofCryptosporidiumparvumoocysts in water using ultrasonic treatment[J].Bioresource Technology,2008,99:2046- 2049.
[20] AMIR A,BAZYAR L,WERNER K,etal.Low frequency ultrasound and UV-C for elimination of pathogens in recirculating aquaculture systems[J].Ultrasonics Sonochemistry,2013,20(5):1211- 1216.
[21] JOYCE E,PHULL S S,LORIMER J P,etal.The development and evaluation of ultrasound for the treatment of bacterial suspensions:a study of frequency power and sonication time on cultured bacillus species[J].Ultrasonics Sonochemistry.2003,10(6):315- 318.
[22] TORBEN B,UWE N.Improved waste water disinfection by ultrasonic pretreatment[J].Ultrasonics Sonochemistry,2004,11(5):333- 336.
[23] 冉治霖,李绍峰,黄君礼,等.二氧化氯灭活水中隐孢子虫的影响因素及机理研究[J].中国环境科学,2011,31(6):904- 909. RAN Zhilin1,LI Shaofeng,HUANG Junli,etal.Cryptosporidiuminactivated by chlorine dioxide in water and disinfect mechanisms[J].China Environmental Science,2011,31(6):904- 909.
[24] 张爱梅,王荣,谢华,等.蛋白质检测的方法学研究概述[J].生物技术通讯,2011,22(1):130- 134. ZHANG Aimei,WANG Rong,XIE Hua,etal.Summarization on the methodology study of protein detection[J].Letters Biotechnology,2011,22(1):130- 134.
[25] 李争彩,林书玉.超声空化影响因素的数值模拟研究[J].陕西师范大学学报(自然科学版),2008,36(1):38- 42. LI Zhengcai,LIN Shuyu.Numerical simulation of the factors influencing ultrasonic cavitation[J].Journal of Shaanxi Normal University (Natural Science Edition),2008,36(1):38- 42.
[26] 胡健龙,冉治霖,李绍峰,等.US灭活饮用水中隐孢子虫研究[J].中国环境科学,2014,34(2):431- 436. HU Jianlong,RAN Zhilin,LI Shaofeng,etal.Inactivation ofCryptosporidiumparvumin drinking water by ultrasonic irradiation[J].China Environmental Science,2014,34(2):431- 436.
[27] 李绍峰,冉治霖,胡健龙,等.超声灭活水中隐孢子虫影响因素及机制[J].环境科学研究,2014,27(4):434- 440. LI Shaofeng,RAN Zhilin,HU Jianlong.Influence factors and mechanism of ultrasonic inactivatingCryptosporidiumin water[J].Research of Environmental Sciences,2014,27(4):434- 440.
[28] SRAVAN K S,AVVARU B,PANDIT P S,etal.Characterization of sonochemical reactor for physicochemical transformation[J].Industrial and Engineering Chemistry Research,2009,48(21):9402- 9407.
[29] JING Kunyan,WANG Yaoyao.Ultrasonic effects on the degradation kinetics,preliminary characterization and antioxidant activities of polysaccharides from Phellinus linteus mycelia[J].Ultrasonics Sonochemistry,2016,29(3):251- 257.
[30] TORU T,KYUICHI Y,MANICKAM S,etal.Correlation between acoustic cavitation noise and yield enhancement of sonochemical reaction by particle addition[J].Journal of Physical Chemistry A,2005,109(21):4869- 4872.
[31] 张立成,赵军,傅金祥.UV线灭活饮用水中隐孢子虫[J].沈阳建筑工程学院学报(自然科学版),2002,18(1):47- 50. ZHANG Licheng,ZHAO Jun,FU Jinxiang.Using UV to inactivateCryptosporidiumin drinking water[J].Journal of Shenyang Archit and Civil Engineering University(Natural Science),2002,18(1):47- 50.
[32] 聂雪彪,刘文君,何凤华.天津开发区净水厂三期工程紫外线消毒系统应用研究[J].城镇给排水,2011,37(8):11- 16.
[33] 杨艳玲,马长红,李星,等.超声波灭活水中微生物试验研究[J].北京工业大学学报,2015,41(3):446- 451. YANG Yanling,MA Changhong,LI Xing,etal.Experimental Study on Inactivation of Microorganism in Aqueous Solution Using Ultrasound[J].Journal of Beijing University of Technology,2015,41(3):446- 451.
Ultraviolet / Ultrasound Coordination for InactivatingCryptosporidiumparvum
LI Shaofeng1, XU Hongping1,2, RAN Zhilin3, ZHANG Kefang2, ZHANG Chaosheng2
1.Shenzhen Key Laboratory of Industrial Water Saving and Municipal Sewage Reclamation Technology, Shenzhen Polytechnic Institute, Shenzhen 518055, China 2.School of Civil Engineering, Guangzhou University, Guangzhou 510006, China 3.Department of Transportation and Environment, Shenzhen Institute of Information Technology, Shenzhen 518172, China
UV was coupled with US for inactivatingCryptosporidiumparvumin water, and the effects of pH, temperature, turbidity and humic acid (HA) were investigated. Furthermore, the inactivation mechanism was investigated by scanning electron microscopy, agarose gel electrophoresis and protein test detection. The results showed that pH had little discussed on the USUV inactivatingC.parvum. The inactivation rate at 5 ℃ was fairly low, and at 25 ℃ it required 20 min to achieve more than 99% inactivation rate. Suspended matter inhibited the inactivation rate under the coupling action; when turbidity was 40NTU, the inactivation rate of UVUS in 25 min was only 93.9%. The inactivation effect of coupling was promoted by HA at low concentration and inhibited by high content. When the dosage of HA was higher than 10 mgL, increasing the concentration of HA had little effect on theC.parvuminactivation rate. By scanning electron microscopy (SEM) observations, protein test and agarose gel electrophoresis, it was determined that UVUS madeC.parvumoocysts burst, whileCryptosporidium′s DNA was also damaged.
Cryptosporidiumparvum; ultrasound; ultraviolet; effect factors; inactivating mechanism
2016-09-24
2017-04-22
广东省自然科学基金项目(2014A030313951);广东省千百十培养计划项目;深圳市科技计划项目(JCYJ20160226092135176)
李绍峰(1972-),男,湖南邵东人,教授,博士,主要从事水污染控制及污水资源化技术研究,lshaofeng@szpt.edu.cn.
X703.1
1001- 6929(2017)08- 1310- 06
A
10.13198j.issn.1001- 6929.2017.02.55
李绍峰,徐宏平,冉治霖,等.紫外/超声协同灭活隐孢子虫的影响因素及机制[J].环境科学研究,2017,30(8):1310- 1315.
LI Shaofeng,XU Hongping,RAN Zhilin,etal.Ultraviolet/Ultrasound coordination for inactivatingCryptosporidiumparvum[J].Research of Environmental Sciences,2017,30(8):1310- 1315.

