莠去津对野生植物群落下土壤微生物功能多样性的影响
闫 冰, 齐 月, 付 刚, 贺 婧, 肖能文, 李俊生*
1.中国环境科学研究院, 北京 100012 2.北京师范大学水科学研究院, 北京 100875 3.中国人民大学环境学院, 北京 100872
莠去津对野生植物群落下土壤微生物功能多样性的影响
闫 冰1,2, 齐 月1,2, 付 刚1,2, 贺 婧1,3, 肖能文1, 李俊生1*
1.中国环境科学研究院, 北京 100012 2.北京师范大学水科学研究院, 北京 100875 3.中国人民大学环境学院, 北京 100872
为探明亚致死剂量农药对土壤微生物多样性影响,基于大田控制试验,采用Biolog-ECO微平板技术分析喷施亚致死剂量的莠去津对野生植物群落下土壤微生物群落功能多样性的影响. 结果表明:①莠去津的喷施浓度对土壤微生物群落利用全部碳源的能力无显著影响(P>0.05),但与喷施处理后第30天相比,处理后第60天的土壤微生物群落利用全部碳源的能力有所降低,其中处理Ⅰ〔喷施浓度(以质量浓度计)为1 200 ghm2〕、处理Ⅲ(喷施浓度为300 ghm2)显著下降(P<0.05),而CK(对照组)、处理Ⅱ(喷施浓度为600 ghm2)降低程度不显著(P>0.05),并且其各处理间土壤微生物群落对全部碳源的利用能力大小为CK>处理Ⅲ>处理Ⅱ>处理Ⅰ. ②喷施处理后第30天土壤微生物群落对碳水化合物类碳源的利用能力最强,对羧酸类碳源的利用能力相对较弱;喷施处理后第60天土壤微生物群落对碳水化合物类碳源的利用能力降幅最大,处理Ⅰ、处理Ⅱ、处理Ⅲ分别下降了0.63、0.78、0.85、0.76. ③喷施除草剂后第30天处理Ⅱ的Shannon-Wiener指数和Simpson指数显著低于其他处理(P<0.05),而第60天各处理间多样性指数无显著差异;与喷施处理后第30天相比,第60天各处理多样性指数都有所下降,但没有显著差异(P>0.05). ④对土壤微生物群落碳源利用能力进行主成分分析结果显示,提取的与土壤微生物碳源利用相关的主成分累积贡献率为86.6%,主成分1能够区分喷施处理后两个时期的土壤微生物群落特征. ⑤冗余分析(RDA)表明,pH是土壤微生物利用碳源能力差异的重要影响因素之一. 研究显示,除草剂莠去津的施用可在一定程度上降低野生植物群落下土壤微生物群落功能多样性.
莠去津; 土壤微生物; 微生物功能多样性; Biolog-ECO微平板技术
土壤微生物是土壤及整个生态系统的重要组成部分,是生态系统物质循环和能量流动中的重要驱动者,对土壤肥力的形成、污染物降解和土壤结构保持等起着积极作用[1],并且在各种生物地球化学循环中扮演着不可替代的角色[2]. 土壤中含有数量惊人的土壤微生物,并且具有极其丰富的微生物多样性[3]. 土壤微生物多样性对维持土壤生态系统健康稳定及可持续性至关重要[4- 5],是评价土壤质量的重要生物学指标[6].
除草剂是当今广泛使用的一类农药,由于具有高效和适合机械化作业等特点,其产量和使用量都呈现出逐年增加的趋势[7- 10]. 除草剂的大量施用在给农业生产带来效益的同时,也给生态环境带来一系列的影响. 农田中喷施的除草剂通过直接和间接的方式进入土壤,对土壤微生物数量、多样性、生态特征等产生影响[11- 14].有研究[15]显示,土壤微生物多样性对植物生长及产量都有强烈的影响. 并且,有研究[16]认为土壤微生物在土壤中农药的降解上扮演着重要角色. 目前,化学农药的施用对土壤微生物及其活性的影响,已成为评价农药生态安全的重要指标之一[17- 18].
农田周边野生植物群落的生物多样性是农田生态系统生物多样性中的重要组成部分,其为农业生产提供了重要的服务功能[19]. 野生植物多样性促进作物害虫的天敌和传粉动物群落多样性和密度的发展,还可以作为作物害虫防治的植物诱饵,并促进农田及周边土壤的养分循环[20- 21]. 一直以来人们关注的主要是除草剂的除草效果[22- 23]及其对田内土壤微生物的影响[12- 13],而对于农田除草剂施用过程中飘散到周边的亚致死剂量的除草剂对生物多样性的影响研究较少. 亚致死剂量的除草剂可能会影响农田周边野生植物群落的生物多样性,也可能对土壤微生物产生影响,因此,研究亚致死剂量的除草剂对土壤微生物影响至关重要.
该研究基于室外大田控制试验,采用Biolog-ECO微平板技术对不同亚致死剂量除草剂施用下土壤微生物群落功能多样性变化进行研究,以期为评价亚致死剂量除草剂在土壤中的生态安全提供参考,为探索更为经济合理地使用除草剂提供基础数据,为减少环境污染提供参考.
1 材料与方法
1.1 研究区概况
试验地设置在中国环境科学研究院北京顺义试验基地内,该试验基地位于北京市(39.4°N~41.6°N、115.7°E~117.4°E)顺义区赵全营镇. 该地属典型的北温带半湿润大陆性季风气候,夏季高温多雨,冬季寒冷干燥,春、秋短促,全年无霜期180~200 d,年均气温13.4 ℃,年均降水量595 mm. 降水季节分配不均匀,全年80%的降水集中在6—8月.
1.2 试验设计
试验所用地块于2011—2013年种植过玉米和油菜,并且未施用过任何农药,于2014年3月进行人工翻地,充分均匀混合使整个试验地块土壤处于匀质状态. 试验采用随机区组设计,设置四组处理:CK(对照组,喷施等量的清水)、处理Ⅰ〔大田推荐剂量,喷施浓度(以质量浓度计)为 1 200 ghm2,以ai(有效成分)计,下同〕、处理Ⅱ(大田推荐剂量的12,喷施浓度为600 ghm2)、处理Ⅲ(大田推荐剂量的14,喷施浓度为300 ghm2),每个处理三次重复,试验共设置12个,小区大小为3 m×5 m,各小区间设置宽度为2 m 的隔离带. 试验于2014年6月20日进行除草剂喷施处理,喷施前用塑料薄膜围建起高度为1.5 m的隔离网,防止除草剂飘散导致各试验处理间产生相互影响.
试验所用除草剂为莠去津(山东胜邦绿野化学有限公司生产),具有土壤处理作用兼有茎叶处理作用,能被植物根吸收,华北地区大田推荐剂量为 1 200 ghm2. 试验所用喷雾器为上海生产的worth牌NS- 5型手动农药喷雾器,喷头压力设定为2×105Pa.
各试验小区内的植物群落类型都为野生植物群落,主要物种组成为马唐(Digitariasanguinalis)、反枝苋(Amaranthusretroflexus)、苘麻(AbutilontheophrastiMedicus)、藜(Chenopodiumalbum)等.
1.3 样品采集
试验在除草剂喷施处理后第30天、第60天进行样品采集,于2014年7月20日进行第一次样品采集,于2014年8月20日进行第二次样品采集. 取样时除去地表的凋落物层,垂直取0~15 cm的土壤,每个小区内用五点取样法取样并进行充分混匀后记做一个样品,除去植物残体、根系、石块等杂物,用无菌自封袋封装再用冰盒带回实验室放入4 ℃冰箱中保存待用.
1.4 研究方法
采用电位法测定土壤pH,称取10 g过2 mm筛的风干土,加入25 mL去CO2的超纯水,土水比为1∶2.5,振荡2 min后静置30 min进行土壤pH测定,用元素分析仪(Costech ECS 4012,Italy)测量土壤w(TC)、w(TN).
利用Biolog-ECO微平板法研究施用除草剂对土壤微生物功能多样性的影响. 称取相当于10 g干质量的鲜土置于无菌锥形瓶中,加入90 mL浓度为0.85%的无菌生理盐水,将混合液放置在恒温摇床上振荡30 min(200 rmin),静止沉淀15 min,吸取上清液,采用十倍稀释法将其用无菌生理盐水稀释至浓度为10-3. 将制备好的微生物菌悬浮液倒入无菌移液槽中,用八通道移液器将菌悬液接种于Biolog-ECO微平板中,每孔150 μL,全部接种工作在超净工作台上完成. 最后,将Biolog-ECO微平板置于28 ℃恒温培养箱中避光培养7 d,每隔24 h用酶标仪读取590 nm处的吸光值.
根据读取的吸光值数据计算Biolog-ECO微平板板孔的AWCD(average well color development,平均颜色变化率)〔见式(1)〕,用以表示土壤微生物群落利用全部碳源的能力[24]. 采用培养第72小时时的数据计算Shannon-Wiener指数(H′)〔见式(2)〕、Simpson指数(D)〔见式(3)〕、McIntos指数(U)〔见式(4)〕,丰富度指数(S)用有颜色变化的微孔数(微孔光密度值>0.15)表示[25- 27],用于反映土壤微生物群落的功能多样性.
(1)
(2)
(3)
(4)
式中:Ci为第i孔在590 nm下的光密度值;R为对照孔的光密度,若Ci-R≤0,记为0;n为Biolog-ECO微平板的碳源种类数目,n=31;Pi为第i孔相对光密度值(C-R)与整个平板相对光密度总和的比率;ni为第i孔的相对吸光度.
利用SPSS 22.0对土壤微生物功能多样性指数进行单因素方差分析(one-way ANOVA),采用最小显著差异法(LSD)进行多重比较. 根据培养第72小时数据,利用R软件vegan包进行主成分分析(PCA)及冗余分析(RDA),并用ggplot2包进行绘图.
2 结果与分析
2.1 土壤微生物利用全部碳源的代谢活性变化
喷施处理后第30天、第60天土壤微生物群落AWCD随培养时间的变化情况如图1所示. 由图1可见,随着培养时间的延长,土壤微生物对全部碳源的代谢能力呈现出增加的趋势. 喷施处理后第30天、培养第168小时各处理组之间无显著差异(P>0.05),但处理Ⅲ的AWCD值相对较高,而其他三组处理的AWCD值非常接近. 喷施处理后第60天,各处理组间AWCD值大小为CK>处理Ⅲ>处理Ⅱ>处理Ⅰ,但单因素方差分析结果表明,培养第168小时各处理组间AWCD值无显著差异(P>0.05). 表明喷施处理后第60天,不同处理对土壤微生物活性没有显著影响. 对比分析喷施处理后第30天和第60天两个阶段土壤微生物群落AWCD值(见表1)发现,处理后第60天各处理土壤微生物群落AWCD值都有所下降,其中处理Ⅰ和处理Ⅲ显著降低(P<0.05),而CK和处理Ⅱ没有显著降低(P>0.05).
2.2 土壤微生物利用不同种类碳源的动力学特征
Biolog-ECO微平板中的全部碳源可划分为六大类,即多聚物类、糖类、氨基酸类、胺类、羧酸类、酚酸类. 培养第72小时时,不同处理下的土壤微生物对不同碳源利用情况如图2所示. 由图2可知,喷施处理后第30天土壤微生物对碳水化合物类碳源的利用
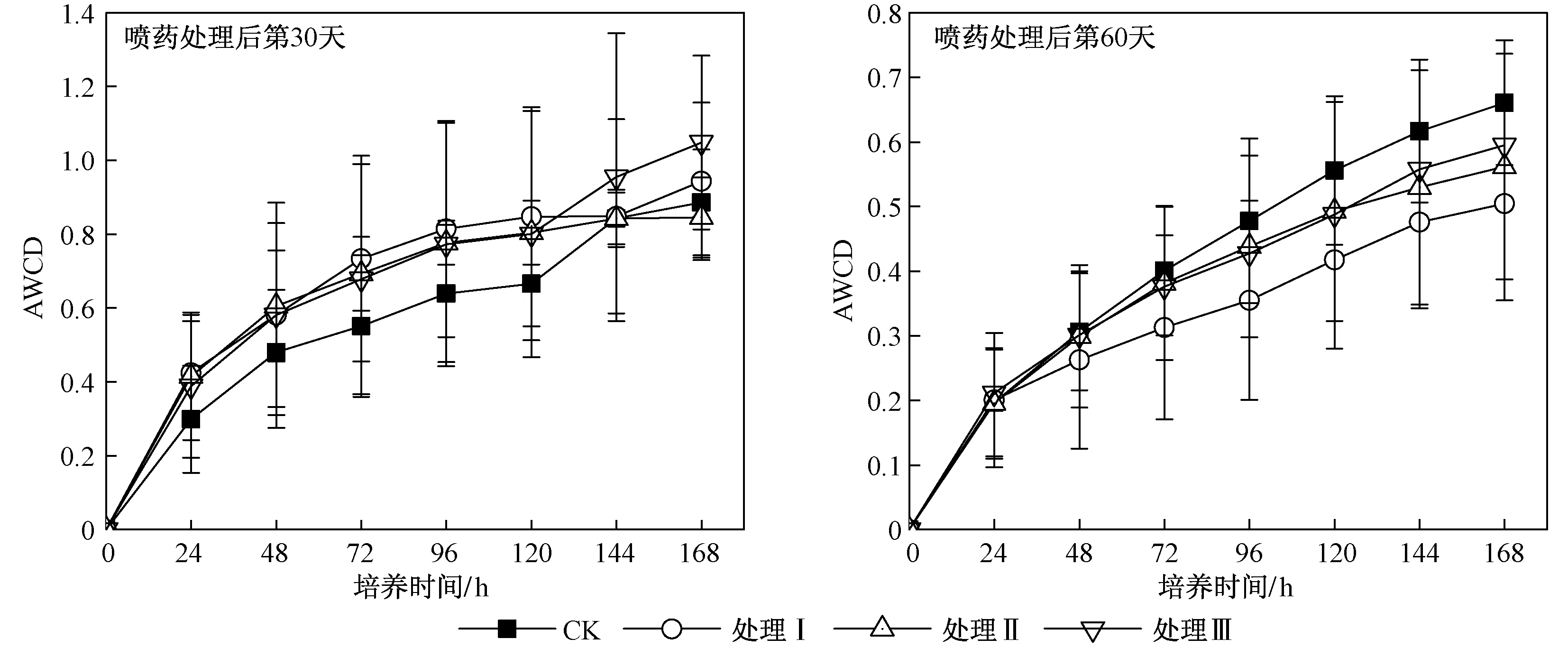
图1 不同处理土壤微生物群落平均颜色变化率(AWCD)随培养时间的变化Fig.1 Variation of soil microbial communities average well color development(AWCD) with incubation time in different treatment
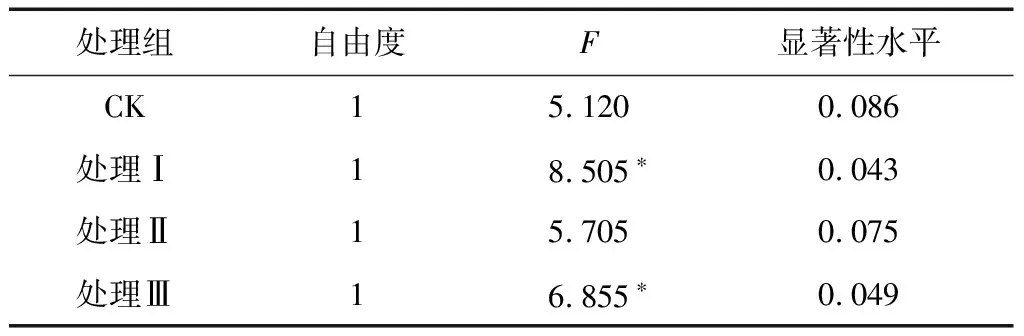
Table 1 ANOVA results of AWCD for different treatments incubation 168 hours under 30 d and 60 d after spraying
能力最强,对羧酸类碳源的利用能力最弱,并且对碳水化合物类碳源和羧酸类碳源的利用能力上存在显著差异(P<0.05),说明利用碳水化合物类碳源的土壤微生物群落显著多于利用羧酸类碳源的土壤微生物群落. 喷施处理后第30天,各处理间土壤微生物利用羧酸类和氨基酸类碳源能力都存在显著差异(P<0.05),对其他类型碳源利用能力无显著差异(P>0.05),说明不同处理对利用羧酸类和氨基酸类碳源的微生物影响较大. 喷施处理后第60天土壤微生物对多聚物、碳水化合物、氨基酸和胺类碳源的利用能力相对较强,对酚酸类和羧酸类碳源的利用能力相对较弱. 喷施处理后第60天,各处理间土壤微生物利用各类碳源均无显著差异,说明喷施处理后第60天各处理造成的差异减弱. 对比喷施处理后第30天和第60天土壤微生物利用各类碳源的能力发现,碳水化合物类碳源和氨基酸类碳源在两个时期内的AWCD值降幅最大.

注:同一碳源类型中不同字母表示差异显著(P≤0.05).图2 不同处理土壤微生物对各类碳源利用情况Fig.2 Utilization of different carbon sources of soil microorganisms under the different treatments
2.3 土壤微生物对碳源利用的多样性指数分析
由表2可知,喷施处理后后第30天土壤微生物群落Shannon-Wiener指数和Simpson指数在处理Ⅱ中显著低于其他处理(P<0.05),不同处理对McIntosh指数和丰富度指数没有显著影响(P>0.05). 喷施除草剂处理后第60天,各处理对土壤微生物群落多样性指数都无显著影响(P>0.05). 同时,对喷施处理后后第30天和第60天各处理的多样性指数进行t检验(数据未列出)发现,与第30天相比,第60天的土壤微生物多样性指数降低,但所有处理的第30天和第60天土壤微生物多样性指数都无显著差异(P>0.05). 说明喷施除草剂处理后,随着时间的变化土壤微生物群落功能多样性并不存在显著变化的情况. 喷施处理后第30天,各处理对土壤微生物群落Shannon-Wiener指数和Simpson指数有显著影响(P<0.05),而喷施处理后第60天这种影响不显著,说明喷施除草剂对土壤微生物群落功能多样性有影响,但60 d后这种影响开始减退或各处理间差异消失.
2.4 土壤微生物群落利用碳源的主成分分析

表2 不同处理土壤微生物群落功能多样性指数
注:数据为平均值±标准偏差. 同一行中不同字母表示差异显著(P≤0.05).
基于培养第72 小时时的吸光值数据,对喷施处理后第30天和第60天的土壤微生物代谢碳源能力进行主成分分析(PCA),按照主成分提取原则[28]共提取了7个主成分(principal component,PC). 结果显示,7个主成分累积方差贡献率为86.6%,其中PC1(主成分1)~PC7(主成分7)的方差贡献率分别为60.36%、7.48%、5.95%、3.79%、3.52%、3.10%和2.44%.
不同处理土壤微生物碳源代谢的PCA排序图如图3所示. 由图3可知,PC1和PC2共解释了67.84%的变异. 在PC1上喷药后各处理明显分为两簇,第30天的所有样地聚为一簇,第60天的所有样地聚为另一簇. PCA分析发现,土壤微生物群落结构在喷施处理后第30天和第60天间呈现出显著差异(P<0.05). 在PC2上,喷施处理后第30天处理Ⅱ的土壤微生物群落结构和其他处理存在显著差异(P<0.05),喷施处理后第60天各处理间的土壤微生物群落结构没有显示出显著差异(P>0.05).
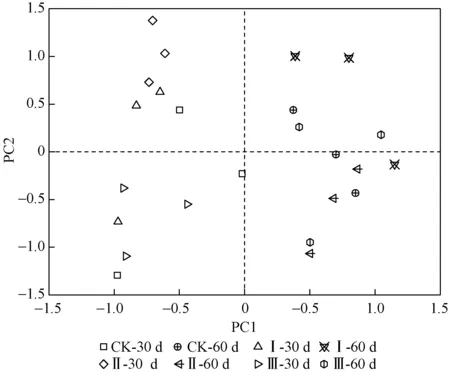
注:30 d和60 d分别表示喷施处理后第30天和第60天,下同.图3 不同处理土壤微生物群落利用碳源能力的主成分分析Fig.3 Principal component analysis of carbon sources utilization of soil microbial communities under different treatments
通过对主成分相关性矩阵进行分析(见表3)可知,对PC1贡献较大的碳源共12种,其中碳水化合物类碳源占66.67%,氨基酸类碳源占16.67,多聚物类碳源和酚酸类碳源均占8.33%,说明影响PC1的主要是碳水化合物类碳源,其次是氨基酸类碳源. 对PC2贡献较大的碳源只有一种,为碳水化合物类碳源.

表3 与PC1、PC2显著相关的主要碳源种类
2.4 土壤微生物群落功能冗余分析
利用培养第72 小时的吸光值数据进行降趋对应分析(detrended correspondence analysis,DCA),结果发现,排序轴中的最大值为1.1,因此选择冗余分析(RDA)方法分析环境因子与土壤微生物碳源代谢能力之间的关系(见图7). 结果显示,轴1和轴2分别解释碳源代谢能力总变异的38.32%和2.51%,pH、w(TC)和w(TN)与轴1和轴2都呈显著正相关(P<0.05),其中pH与土壤微生物碳源代谢能力相关性最强(箭头连线长度最长). 蒙特卡罗置换检验(Monte Carlo permutation test)显示显著性为0.02,则认为排序结果可以接受环境因子对碳源代谢能力变异的解释量.

注:TC—w(TC);TN—w(TN).图4 土壤微生物群落功能特征与环境因子的冗余分析Fig.4 RDA for environmental factors and soil microbial function diversity
3 讨论
土壤微生物群落利用全部碳源的能力随着处理后时间的延长而降低,与喷施处理后第30天相比,喷施处理后第60天土壤微生物利用碳源的能力降低,处理Ⅰ和处理Ⅲ的土壤微生物群落AWCD都显著下降,但同一时期内各处理间土壤微生物群落利用碳源的能力没有显著差异. 说明莠去津在不同浓度梯度下对土壤微生物活性没有产生显著影响,而随着时间增加除草剂对土壤微生物活性的影响呈现出增加的趋势. 喷施处理后第30天各处理土壤微生物群落对碳源的利用能力表现为处理Ⅰ相对较高. 有研究认为,在土壤中有农药开始介入时,土壤微生物群落对进入到土壤中的农药具有一定的耐受性,并且一些微生物会利用农药为碳源进行分解作用,这会导致微生物进行繁殖[29]. 该研究发现,莠去津对土壤微生物群落的影响在喷施处理后第60天开始显现,表现为CK处理的土壤微生物群落利用碳源能力相对较大,其次是处理Ⅲ、处理Ⅱ、处理Ⅰ. 因此,喷施处理后第60天各喷施农药处理组相比,低浓度莠去津处理的土壤微生物群落活性相对较高.
土壤微生物对不同碳源利用能力的差异在一定程度上指示土壤微生物群落的结构组成[30]. 喷施处理后两个时期(第30天、第60天)土壤微生物群落对羧酸类碳源的利用能力都较低,并且各处理下土壤微生物群落对碳水化合物类碳源的利用能力降幅最大,随着时间的增加对利用碳水化合物类碳源的微生物的影响加剧. 研究[31- 32]发现,干扰后不同时期偏好利用不同类型碳源的土壤微生物可能增加或减少. 不同处理间土壤微生物对某些类型碳源利用存在显著差异,同时也对一些类型碳源的利用没有显著差异. 姚斌等[33]认为,土壤微生物对不同类型碳源的利用不同,可能是除草剂进入土壤后土壤微生物能利用的碳源种类发生了改变. 孙约兵等[34]研究发现,施用一定浓度的硝磺草酮后,土壤微生物群落对Biolog-ECO微平板中全部碳源的代谢能力整体上呈现出升高的状态,但从土壤微生物对各类型的碳源利用能力上看,不同浓度的硝磺草酮处理间存在一定的差异.
Shannon-Wiener指数、Simpson指数、McIntosh指数和丰富度指数分布用来反映土壤微生物的丰富度、最常见的物种优势度和均匀度[30,35]. 喷施除草剂后,随着时间的增加各多样性指数都有所降低,但是差异并未达到显著水平. 杨永华等[36]研究认为,农药污染的土壤中土壤微生物群落Shannon指数、Simpson指数和McIntosh指数显著降低,主要原因是由于受农药污染土壤微生物群落中利用碳源的微生物物种的均一程度受到显著影响.
喷施处理后第30天,土壤微生物群落Shannon-Wiener指数和Simpson指数在处理Ⅱ中显著低于其他处理,而喷施处理后第60天,各处理间土壤微生物群落多样性指数表现出无显著差异. 分析认为,在莠去津施用初期,土壤微生物群落对不同浓度的处理响应不同,碳源利用的多样性存在明显差异,而随着时间的推移,这种影响被微生物群落自身的修复调剂能力抵消. 除草剂进入土壤后可能造成土壤微生物群落功能发生变化,适量的农药处理将使得土壤中原有的微生物群落内部种群间的竞争关系发生变化,原有的平衡遭到破坏,优势类群改变[37]. Ros等[38]研究发现,高浓度莠去津刺激土壤细菌生长,这些都可能使微生物多样性降低. Moreno等[39]通过研究不同浓度莠去津处理下的土壤微生物量碳和呼吸发现,高浓度条件下土壤微生物量碳减少,同时土壤微生物呼吸增强. 但是笔者并没有发现高浓度的莠去津能够显著减少土壤微生物群落的功能多样性指数. 郑丽萍等[40]认为,低浓度有机氯会造成逆境刺激微生物代谢加强,导致土壤微生物对碳源的利用率较高,而高浓度有机氯污染可能对微生物的活性起极大的抑制作用,减少微生物多样性. 农药作为土壤微生物群落的外来干扰因素,浓度较小时,其干扰被微生物群落自身强大的功能性冗余所抵消,而当其浓度增大时,可能使得某些微生物菌种的生长受到抑制,最终导致土壤微生物群落均匀性下降[41]. 对土壤微生物代谢特性进行RDA分析,表明pH是土壤微生物碳源利用能力差异的重要因子,推测喷施莠去津对土壤理化性质的影响是造成土壤微生物碳源利用能力差异的重要原因. 但笔者发现,包括pH在内的环境因子只能解释变量的42.21%,因此除此之外还存在其他影响因素,需要进一步研究.
该研究对亚致死剂量除草剂莠去津处理后的土壤微生物群落功能多样性进行了研究,得到了一些初步结果. 虽然Biolog-ECO微平板技术能够简单、方便、快捷灵敏地反映出土壤微生物碳源代谢能力,进而评估土壤微生物群落碳源代谢功能多样性. 但由于其自身存在的局限性,即微平板中只有31种碳源,导致其不能反映自然条件下土壤中的复杂环境,致使所得的研究结果也并不能够完整地反映土壤中微生物群落的功能多样性和复杂性[42]. 因此,在后续的研究中,还应结合高通量测序技术,深入研究亚致死剂量除草剂对非靶标植物群落下的土壤微生物群落的影响,以期为阐释除草剂对土壤微生物多样性的影响提供理论依据.
4 结论
a) 喷施不同浓度莠去津后对土壤微生物代谢活性存在一定程度的影响,但是差异不明显. 全剂量的莠去津(处理Ⅰ)喷施处理后,对土壤微生物代谢活性的影响程度最大,亚致死剂量的影响程度相对较弱.
b) 喷施除草剂莠去津后,随着时间的增加对利用不同类型碳源的土壤微生物群落都存在一定的影响,其中对利用碳水化合物类碳源的微生物的影响最为强烈.
c) 喷施莠去津后,土壤微生物群落的Shannon-Wiener指数、Simpson指数和McIntosh指数都呈下降趋势,但没有达到显著水平(P>0.05). 除草剂的施用在一定程度上降低土壤微生物群落功能多样性.
d) 土壤理化因子是土壤微生物代谢能力差异的重要影响因素,该研究中pH、TN、TC都对土壤微生物群落代谢碳源能力有显著影响,而pH的影响最强烈.
[1] ZAK D R,HOLMES W E,WHITE D C,etal.Plant diversity,soil microbial communities,and ecosystem function:are there any links?[J].Ecology,2003,84(8):2042- 2050.
[2] FALKOWSKI P G,FENCHEL T,DELONG E F.The microbial engines that drive Earth′s biogeochemical cycles[J].Science,2008,320(5879):1034- 1039.
[3] GANS J,WOLINSKY M,DUNBAR J.Computational improvements reveal great bacterial diversity and high metal toxicity in soil[J].Science,2005,309(5739):1387- 1390.
[4] BAUHUS J,KHANNA P.Carbon and nitrogen turnover in two acid forest soils of southeast Australia as affected by phosphorus addition and drying and rewetting cycles [J].Biology and Fertility of Soils,1994,17(3):212- 218.
[5] WARDLE D.A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil[J].Biological reviews,1992,67(3):321- 358.
[6] SUN Ruibo,ZHANG Xuexian,GUO Xisheng,etal.Bacterial diversity in soils subjected to long-term chemical fertilization can be more stably maintained with the addition of livestock manure than wheat straw[J].Soil Biology and Biochemistry,2015,88(9):9- 18.
[7] GIANESSI L P,REIGNER N P.The value of herbicides in US crop production[J].Weed Technology,2007,21(2):559- 566.
[8] DAVIS A S,HILL J D,CHASE C A,etal.Increasing cropping system diversity balances productivity,profitability and environmental health[J].PloS One,2012,7(10):e47149.
[9] YOUNG B G,GIBSON D J,GAGE K L,etal.Agricultural weeds in glyphosate-resistant cropping systems in the United States[J].Weed Science,2013,61(1):85- 97.
[10] 强胜,宋小玲,戴伟民.抗除草剂转基因作物面临的机遇与挑战及其发展策略[J].农业生物技术学报,2010,18(1):114- 125. QIANG Sheng,SONG Xiaoling,DAI Weimin The opportunity and challenge faced by transgenic herbicide-resistant crops and their development strategy[J].Journal of Agricultural Biotechnology,2010,18(1):114- 125.
[11] 姚斌,徐建民,尚鹤,等.阿特拉津除草剂对土壤微生物生态特征的影响[J].水土保持学报,2005,19(3):46- 49. YAO Bin,XU Jianmin,SHANG He,etal.Study on ecological effect of atrazine on soil microbial activity[J].Journal of Soil and Water Conservation,2005,19(3):46- 49.
[12] 赵兰,黎华寿.四种除草剂对稻田土壤微生物类群的影响[J].农业环境科学学报,2008,27(2):508- 514. ZHAO Lan,LI Huashou.The impacts of four typical herbicides on microbial population in paddy soil[J].Journal of Agro-Environm ent Science,2008,27(2):508- 514.
[13] 王正贵,封超年,郭文喜,等.除草剂异丙隆对麦田土壤微生物数量及酶活性的影响[J].应用与环境生物学报,2010,16(5):688- 691. WANG Zhenggui,FENG Chaonian,GUO Wenxi,etal.Effects of isoproturon on soil microbial populations and enzyme activities[J].Chinese Journal of Applied and Environmental Biology,2010,16(5):688- 691.
[14] 李鑫,张景云,张萌萌,等.化学除草剂不同施用方法对紫花苜蓿根际土壤微生物群落碳源利用的影响[J].草地学报,2014,22(1):57- 64. LI Xin,ZHANG Jingyun,ZHANG Mengmeng,etal.Effects of chemical herbicide at different spraying ways on the carbon source metabolism of soil microbial community in alfalfa rhizosphere[J].Acta Agrestia Sinica,2014,22(1):57- 64.
[15] BONKOWSKI M,ROY J.Soil microbial diversity and soil functioning affect competition among grasses in experimental microcosms[J].Oecologia,2005,143(2):232- 240.
[16] YU Y L,CHEN Y X,LUO Y M,etal.Rapid degradation of butachlor in wheat rhizosphere soil[J].Chemosphere,2003,50(6):771- 774.
[17] MARX MC,WOOD M,JARVIS S.A microplate fluorimetric assay for the study of enzyme diversity in soils[J].Soil Biology and Biochemistry,2001,33(12):1633- 1640.
[18] TRASAR C C,LEIROS M,SEOANE S,etal.Limitations of soil enzymes as indicators of soil pollution[J].Soil Biology and Biochemistry,2000,32(13):1867- 1875.
[19] ISAACS R,TUELL J,FIEDLER A,etal.Maximizing arthropod-mediated ecosystem services in agricultural landscapes:the role of native plants [J].Frontiers in Ecology and the Environment,2009,7(4):196- 203.
[20] MARSHALL E,BROWN V,BOATMAN N,etal.The role of weeds in supporting biological diversity within crop fields [J].Weed Research,2003,43(2):77- 89.
[21] PETITE S,BOURSAULT A,LE Guilloux M,etal.Weeds in agricultural landscapes:a review[J].Agronomy for Sustainable Development,2010,31(2):309- 317.
[22] 张盼盼,王君杰,陈凌,等.不同除草剂对糜子田杂草的防除效果[J].西北农业学报,2013,22(10):208- 212. ZHANG Panpan,WANG Junjie,CHEN Ling,etal.Control effect of different herbicides on weed in broomcorn millet field[J].Acta Agriculturae Boreali-occidentalis Sinica,2013,22(10):208- 212.
[23] DUKE S,DAYAN F,ROMAGNI J,etal.Natural products as sources of herbicides:current status and future trends[J].Weed Research,2000,40(1):99- 112.
[24] O′DONNELL A G,SEASMAN M,MACRAE A,etal.Plants and fertilisers as drivers of change in microbial community structure and function in soils [J].Plant and Soil,2001,232(1/2):135- 145.
[25] ZAK J C,WILLING M R,MOORHEAD D L,etal.Functional diversity of microbial communities:a quantitative approach[J].Soil Biology and Biochemistry,1994,26(9):1101- 1108.
[26] SCHIPPER L,DEGENS B,SPARLING G,etal.Changes in microbial heterotrophic diversity along five plant successional sequences[J].Soil Biology and Biochemistry,2001,33(15):2093- 2103.
[27] 林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010.
[28] 郝黎仁,樊元,郝哲欧.SPSS 使用统计分析[M].北京:中国水利水电出版社,2003.
[29] CROUZET O,WISZNIOWSKI J,DONNADIEU F,etal.Dose-dependent effects of the herbicide mesotrione on soil cyanobacterial communities[J].Archives of Environmental Contamination and Toxicology,2013,64(1):23- 31.
[30] 李春艳,刘标,韩正敏,等.转Bt水稻土壤微生物多样性对O3浓度升高的响应[J].中国环境科学,2014,34(11):2922- 2930. LI Chunyan,LI Biao,Han Zhengmin,etal.Responses to elevated O3of soil microbial diversity from transgenic Bt rice[J].China Environmental Science,2014,34(11):2922- 2930.
[31] 曹成有,姚金冬,韩晓姝,等.科尔沁沙地小叶锦鸡儿固沙群落土壤微生物功能多样性[J].应用生态学报,2011,22(9):2309- 2315. CAO Chengyou,YAO Jindong,HAN Xiaoshu,etal.Soil microbes functional diversity in sand-fixingCaraganamicrophyllacommunities in HorqinSandy Land[J].Chinese Journal of Applied Ecology,2011,22(9):2309- 2315.
[32] 李小容,韦金玉,陈云,等.海南岛不同林龄的木麻黄林地土壤微生物的功能多样性[J].植物生态学报,2014,38(6):608- 618. LI Xiaorong,WEI Jinyu,CHEN Yun,etal.Functional diversity of soil microorganisms inCasuarinaequisetifoliawoodlands of different stand ages in Hainan Island[J].Chinese Journal of Plant Ecology,2014,38(6):608- 618.
[33] 姚斌,徐建民,尚鹤,等.甲磺隆污染土壤的微生物生态效应[J].农业环境科学学报,2005,24(3):557- 561. YAO Bin,XUE Jianmin,SHANG He,etal.Ecological effect of metsulfuron-methyl on soil microbe[J].Journal of Agro-Envionment Science,2005,24(3):557- 561.
[34] 孙约兵,王润珑,徐应明,等.除草剂硝磺草酮对土壤微生物生态效应研究[J].中国环境科学,2016,36(1):190- 196. SUN Yuebing,WANG Runlong,XU Yingming,etal.Ecological effects of herbicide mesotrione on soil microbial communities[J].China Environmental Science,2016,36(1):190- 196.
[35] HU Junli,LIN Xiangui,WANG Junhua,etal.Microbial functional diversity,metabolic quotient,and invertase activity of a sandy loam soil as affected by long-term application of organic amendment and mineral fertilizer[J].Journal of Soils and Sediments,2011,11(2):271- 280.
[36] 杨永华,姚健,华晓梅.农药污染对土壤微生物群落功能多样性的影响[J].微生物学杂志,2000,20(2):23- 25. YANG Yonghua,YAO Jian,HUA Xiaomei.Effect of pesticide pollution against functional microbial diversity in soil[J].Journal of Microbiology,2000,20(2):23- 25.
[37] JOHNSEN K,JACOBSEN C S,TORSVIK V,etal.Pesticide effects on bacterial diversity in agricultural soils:a review[J].Biology and Fertility of Soils,2001,33(6):443- 453.
[38] ROS M,GOBERNA M,MORENO J,etal.Molecular and physiological bacterial diversity of a semi-arid soil contaminated with different levels of formulated atrazine[J].Applied Soil Ecology,2006,34(2):93- 102.
[39] MORENO J L,ALIAGA A,NAVAARRO S,etal.Effects of atrazine on microbial activity in semiarid soil[J].Applied Soil Ecology,2007,35(1):120- 127.
[40] 郑丽萍,龙涛,林玉锁,等.Biolog-ECO解析有机氯农药污染场地土壤微生物群落功能多样性特征[J].应用与环境生物学报,2013,19(5):759- 765. ZHENG Liping,LONG Tao,LIN Yusuo,etal.Biolog-ECO analysis of microbial community functional diversity in organochlorine contaminated soil[J].Chinese Journal of Applied and Environmental Biology,2013,19(5):759- 765.
[41] 张红,吕永龙,辛晓云,等.杀虫剂类POPs对土壤中微生物群落多样性的影响[J].生态学报,2005,25(4):937- 942. ZHANG Hong,LV Yonglong,XIN Xiaoyun,etal.Effects of organochlorine pesticides on soil microbial community functional diversity[J].Acta Ecologica Sinica,2005,25(4):937- 942.
[42] KONG W D,ZHU Y G,FU B J,etal.The veterinary antibiotic oxytetracycline and Cu influence functional diversity of the soil microbial community[J].Environmental Pollution,2006,143(1):129- 137.
Effects of Atrazine on Soil Microbial Functional Diversity of Wild Weed Communities
YAN Bing1,2, QI Yue1,2, FU Gang1,2, HE Jing1,3, XIAO Nengwen1, LI Junsheng1*
1.Chinese Research Academy of Environmental Sciences, Beijing 100012, China 2.College of Water Sciences, Beijing Normal University, Beijing 100875, China 3.School of Environment and Natural Resources, Renmin University of China, Beijing 100872, China
To evaluate the impacts of atrazine on soil microbial communities under wild weed communities, the functional diversity of soil microbial communities in different treatments was investigated with Biolog-ECO micro-plates. The results showed that spraying concentrations of atrazine had no significant influence on soil microbial carbon utilization (P>0.05). Compared with the 30thday after spraying, the soil microbial carbon utilization ability was reduced in the 60thday. The I and III treatments were reduced significantly (P<0.05), while the CK and II treatments had no significant reduction (P>0.05). After spraying herbicide, the order of the ability of soil microbial carbon utilization after 60 days was CK>III>II>I. The utilization abilities of different types of carbon sources were different after spraying herbicide. 30 days after spraying, the soil microbial communities mostly used carbohydrates as carbon source, and used Carboxylic acid least. 60 days after spraying, the ability to use carbohydrates as carbon source was largely declined, with treatments declined by 0.63, 0.78, 0.85, 0.76 respectively. 30 days after spraying herbicide, the Shannon-Wiener and Simpson indices of soil microbial community in treatment II were significant less than other treatments (P<0.05), but the diversity indices showed no significant differences among treatments 30 days after spraying herbicide. Compared with the 30thday after spraying, the diversity index was decreased in the 60thday after spraying, but the differences were not significant (P>0.05). Principal component analysis demonstrated that the principal components extracted from 31 carbon sources were related to soil microbial carbon source utilization; the principal components accounted for 86.6% of the total variables variance. Principal component 1 could separate characteristics of soil microbial community after spraying. Redundancy Analysis showed that pH was the main factor that was most highly correlated with variance of soil microbial carbon utilization. The functional diversity of soil microbial communities will be changed by spraying the herbicide atrazine.
atrazine; soil microorganisms; functional diversity; Biolog-ECO micro-plate
2017-02-14
2017-04-18
科技部重点研发计划项目(2016YFC1201100);北京市财政资金项目(PXM2014- 178218- 000005)
闫冰(1986-),男,黑龙江绥化人,yanbing718@126.com.
*责任作者,李俊生(1968-),男,安徽巢湖人,研究员,博士,博导,主要从事生物多样性保护、自然保护区管理、生物安全评估以及气候变化影响评价研究,lijsh@craes.org.cn
X172
1001- 6929(2017)08- 1246- 09
A
10.13198j.issn.1001- 6929.2017.02.54
闫冰,齐月,付刚,等.莠去津对野生植物群落下土壤微生物功能多样性的影响[J].环境科学研究,2017,30(8):1246- 1254.
YAN Bing,QI Yue,FU Gang,etal.Effects of atrazine on soil microbial functional diversity of wild weed communities [J].Research of Environmental Sciences,2017,30(8):1246- 1254.

