外源钙盐对盐胁迫下沙拐枣渗透调节和膜脂过氧化的影响
王文银, 高小刚, 司晓林, 徐当会
兰州大学生命科学学院, 草地农业生态系统国家重点实验室, 甘肃 兰州 730000
外源钙盐对盐胁迫下沙拐枣渗透调节和膜脂过氧化的影响
王文银, 高小刚, 司晓林, 徐当会*
兰州大学生命科学学院, 草地农业生态系统国家重点实验室, 甘肃 兰州 730000
为了解外源钙对缓解沙拐枣(Calligonummongolicum)盐胁迫的主要生理机制,采用盆栽法探究在0、100、200 mmolL的NaCl胁迫下,分别添加5、10、15和20 mmolL的Ca(NO3)2对沙拐枣同化枝中w(脯氨酸)、丙二醛含量、w(可溶性蛋白)、w(可溶性糖)的影响. 结果表明,单独添加Ca(NO3)2使沙拐枣同化枝内w(脯氨酸)、丙二醛含量、w(可溶性蛋白)以及w(可溶性糖)增加,即Ca(NO3)2对沙拐枣的生长造成了胁迫. 对w(脯氨酸)、丙二醛含量、w(可溶性蛋白)、w(可溶性糖)来说,NaCl和Ca(NO3)2之间均存在极显著的交互作用,与对照相比,在c(NaCl)分别为100、200 mmolL,添加c〔Ca(NO3)2〕为10、20 mmolL时,w(脯氨酸)显著增加,分别达到最大值(736.7、1 086.3 μgg);丙二醛含量分别降低了37.8%和40.5%,w(可溶性蛋白)以及w(可溶性糖)均增加. 总之,适宜浓度的钙盐通过增加渗透物质w(脯氨酸)、w(可溶性蛋白)及w(可溶性糖),降低丙二醛的含量来有效缓解盐胁迫对沙拐枣幼苗产生的伤害,当c(NaCl)c〔Ca(NO3)2〕为10∶1时,缓解作用最佳,并且钙盐对沙拐枣盐胁迫的缓解属于抗性诱导的调节作用.
沙拐枣; 外源钙; 盐胁迫; 脯氨酸; 丙二醛; 可溶性蛋白
土壤荒漠化对人类的生存与发展造成了很大程度的影响,据报道,我国大约有25%的土地受到荒漠化的影响. 我国还存在大面积的潜在荒漠化土地,而土壤盐渍化是造成土壤荒漠化的主要原因之一,大量开发和利用荒漠化土地,对荒漠化土地的利用以及环境的改善都具有现实的意义[1]. 面对土壤荒漠化,可通过采取化学方法或者水土管理的方法对其土壤盐渍化进行缓解,但需投入大量的财力以及人力,所需的成本较高,因此培育出抗盐的优势种是改良盐渍化土地有效的方法之一[2]. 同样土壤盐渍化及沙化是世界范围内影响植物生长发展的主要影响因子,许多研究学者试图通过筛选耐盐抗旱的优良物种来使其适应环境,便于在严酷的条件下生长,进而达到改善环境的目的. 对植物耐盐机理的了解和认识是成功培育优良耐盐品种的前提和基础.
在盐胁迫条件下,植物通过积累体内渗透物质脯氨酸的含量以缓解盐胁迫,因此,脯氨酸在植物细胞适应盐胁迫的过程中有重要的作用[3]. 盐分可以使植物细胞膜的渗透性增加,膜脂过氧化增强;丙二醛是膜脂过氧化的产物,其含量可以表征膜损坏的程度[4]. 在水分不足的地方,如荒漠地区以及盐胁迫的条件下,植物能否维持自身正常的生长状况,关键在于能否保持体内的水分平衡,一种重要的生理调节机制就是在水分胁迫时增加可溶性糖的积累,提高溶质的浓度,降低植物体的渗透势来抵御逆境伤害,维持正常的生存与生长[5- 6]. 对植物而言,Ca元素不仅仅是植物生长必需的大量营养元素之一,同时还是偶联胞外信号与胞内生理反应的第二信使[5],钙离子参与盐、干旱、高温、低温、弱光等带给植物的胁迫信号的转导,胁迫信号转导与胞内Ca2+浓度的变化及钙依赖型相关蛋白质的运转方式有关[7- 8],是植物代谢和发育的主要调控者. 适量的Ca可以降低质膜透性,调节胞内外Na+K+的比例,从而提高植物的抗盐性,促进植物的生长,因此研究Ca与植物耐盐相关性具有重要意义. 近些年来许多学者[9- 10]认为,通过Ca2+通道及Ca2+泵的变化使植物细胞中钙离子浓度发生变化,进一步改变盐胁迫信号,主要从所施外源钙的种类以及浓度方面进行对植物盐胁迫下光合作用、离子代谢、渗透调节等生理代谢过程的缓解作用进行了研究. Ca对植物的缓解作用主要与细胞膜的稳定性、根系对Na+的吸收以及抗氧化酶对植物的保护作用相关[11- 12],沙拐枣(Calligonummongolicum)是蓼科(Polygonaceae)沙拐枣属(Calligonum)落叶灌木,能在极端严酷的荒漠环境中生长,具有抗风蚀、耐沙割、抗干旱、耐沙埋、耐贫瘠、枝条茂密、萌蘖力强、根系发达等特性,具有良好的生态和经济效益[13]. 因此,沙拐枣已成为荒漠化植被恢复和重建、防风固沙林建设中的首选树种. 近些年来对沙拐枣的研究主要涉及其生理指标、光合特性指标[14]、水分生理特征[15]及种子萌发[16]等方面,王静静等[17]对盐胁迫下钙盐的添加对沙拐枣株高及光合指标进行了研究,但对Ca的缓解作用中起主要作用的是抗性诱导还是营养竞争这一问题难以回答. 为了探讨外源钙缓解植物盐胁迫伤害的主要生理机制,该研究以沙拐枣为对象,通过在不同盐胁迫浓度下添加不同浓度Ca(NO3)2的方法,分析提高沙拐枣耐盐性的生理因素,以期为进一步研究钙与植物耐盐相关性提供参考.
1 材料与方法
1.1 试验材料与试验处理
试验于2016年3—8月在兰州大学温室大棚(避雨)内进行,选择大小一致的沙拐枣苗进行移栽至180 mm×270 mm的塑料花盆内,每个花盆移栽1株,定期对其进行浇水,使其生长适应之后,在发芽后于6月2日开始NaCl处理和Ca(NO3)2处理,每隔7 d进行一次处理. 盆栽所用土壤为自然生境下的黄土,土壤中w(TN)为0.18 gkg,w(TP)为0.46 gkg,w(速效氮)为17.76 mgkg,w(速效磷)为2.04 mgkg,w(Na+)和w(Ca2+)分别为1.08、0.38 gkg,pH为7.51. 参考Kawasaki等[18- 19]的相关研究,试验设15个处理,不添加NaCl和Ca(NO3)2作为对照,100、200 mmolL NaCl处理,5、10、15、20 mmolL Ca(NO3)2处理,100、200 mmolL NaCl分别与5、10、15、20 mmolL Ca(NO3)2交互处理,上述浓度均为一次处理用量,每个处理重复4次. 8月3日处理结束后,采集单株植物个体上的同化枝,立即放入冰盒中,带回实验室进行分析测定.
1.2 同化枝内相关指标的测定
同化枝中w(脯氨酸)、丙二醛含量、w(可溶性蛋白)、w(可溶性糖)的测定方法见文献[20].
1.2.1w(脯氨酸)的测定
称取沙拐枣同化枝样品0.5 g,加入5 mL 3%磺基水杨酸,沸水浴10 min,冷却后 5 000 rmin离心5 min. 吸取2 mL上清液,再加2 mL冰醋酸和2 mL酸性茚三酮,沸水浴30 min,冷却后加4 mL甲苯,静置片刻,以甲苯为对照,520 nm波长下进行比色.
1.2.2 丙二醛含量的测定
称取沙拐枣同化枝0.5 g,用6 mL 5% TCA(三氯乙酸),3 000 rmin 离心10 min后,取2 mL上清液,加0.67% TBA(硫代巴比妥酸)2 mL,沸水浴15 min,迅速冷却,分别在450、532、600 nm波长下进行比色,测定吸光度值,计算丙二醛含量.
1.2.3w(可溶性蛋白)的测定
称取沙拐枣同化枝0.5 g于预冷的研钵中用5 mL蒸馏水进行研磨后,转移至离心管中,以 8 000 rmin 的速度离心5 min,吸取1 mL上清液,加入5 mL 100 mgL的考马斯亮蓝G- 250试剂,混匀后静止5 min,在595 nm波长下进行比色.
1.2.4w(可溶性糖)的测定
称取沙拐枣同化枝0.2 g,用12 mL蒸馏水研磨,沸水浴中煮沸20 min,以 8 000 rmin 的速度离心5 min,吸取0.2 mL上清液于玻璃管中,加0.8 mL蒸馏水及5 mL蒽酮,煮沸10 min,冷却至室温后在630 nm波长下进行比色.
1.3 数据处理
数据采用SPSS 19.0软件用单因素方差分析的方法进行分析处理,对NaCl与钙盐同时添加时沙拐枣同化枝中各指标的含量进行双因素方差分析,用最小显著差(Duncan中P=0.05)表示各处理之间的差异性,采用Origin 9.0软件作图.
2 结果与分析
2.1 外源钙对盐胁迫下沙拐枣同化枝中w(脯氨酸)的影响
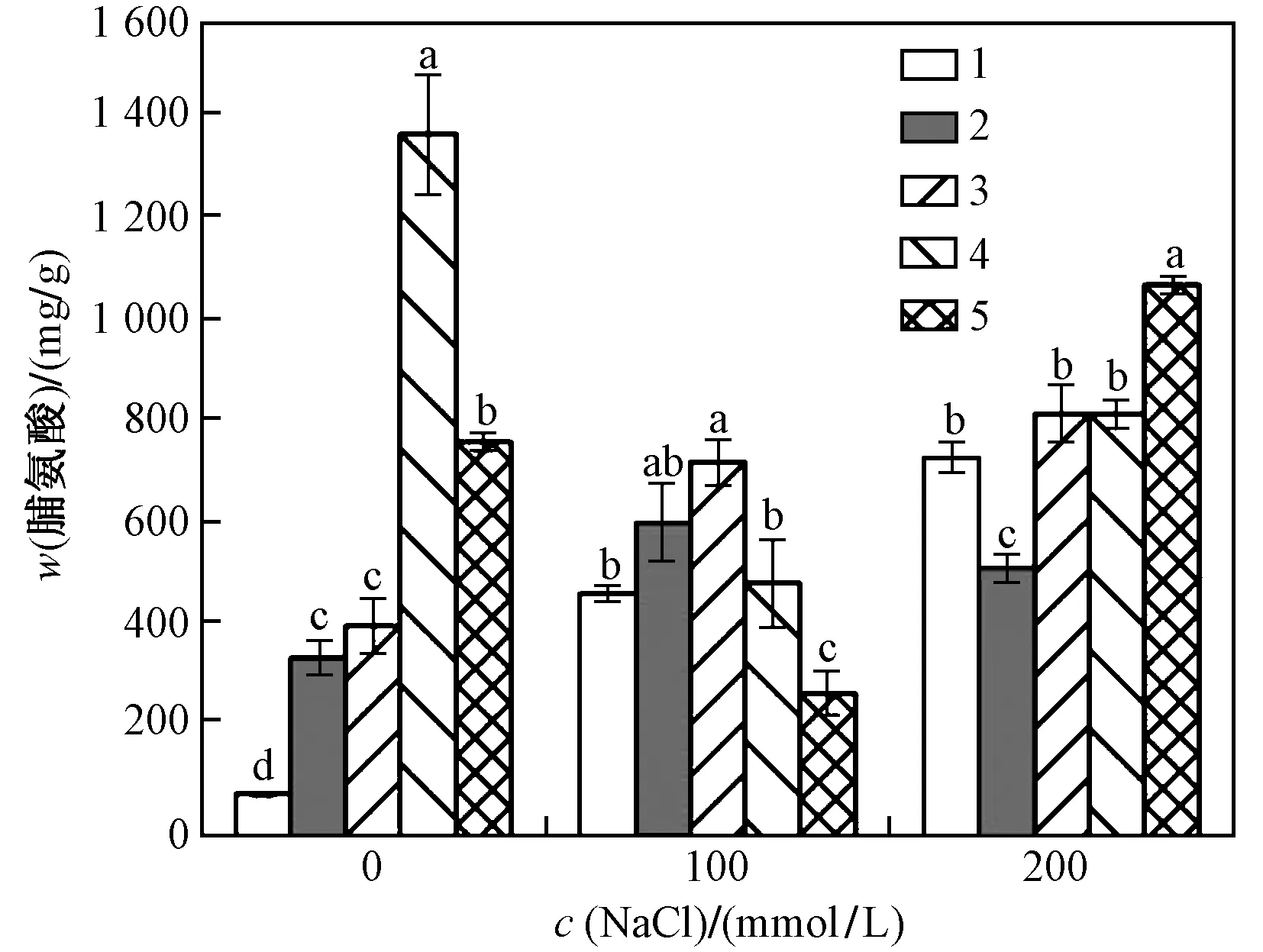
c〔Ca(NO3)2〕(mmolL):1—0;2—5;3—10;4—15;5—20.注:相同NaCl处理不同钙盐处理间不同小写字母表示差异显著(P<0.05). 下同. 图1 Ca(NO3)2对沙拐枣同化枝中w(脯氨酸)的影响Fig.1 Effect of Ca(NO3)2 on proline content in assimilating shoots of Calligonum mongolicum
由图1可见,在没有Ca(NO3)2交互处理时,随着c(NaCl)的增加,沙拐枣同化枝中的c(脯氨酸)也逐渐增大,当c(NaCl)分别为100和200 mmolL时,w(脯氨酸)分别比对照高475.8%、801.0%. 由此可
见,盐胁迫后沙拐枣受到渗透胁迫的伤害可以通过在同化枝内产生脯氨酸进行渗透调节,进而缓解胁迫伤害. 在没有NaCl胁迫的条件下,单独添加Ca(NO3)2时,随着c〔Ca(NO3)2〕的增大,沙拐枣同化枝中w(脯氨酸) 也逐渐增大,可以看出,Ca(NO3)2影响了沙拐枣的生长,对沙拐枣的生长产生了胁迫.
不仅NaCl、Ca(NO3)2处理会对沙拐枣同化枝中w(脯氨酸)造成显著差异,同时二者间还存在极显著(P<0.01)的交互作用(见表1). 当c(NaCl)为100 mmolL时,随着施加c〔Ca(NO3)2〕的增加,w(脯氨酸)呈先上升后下降的趋势,且不同处理之间差异显著(见图1);当c〔Ca(NO3)2〕为10 mmolL时,同化
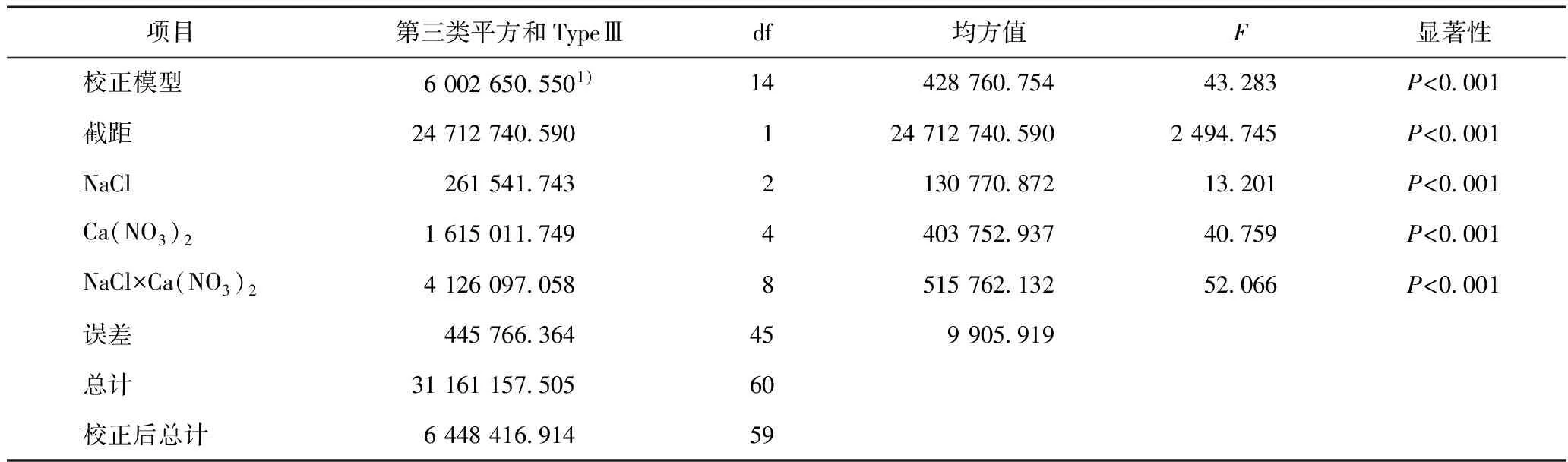
表1 不同浓度Ca(NO3)2与NaCl添加对w(脯氨酸)交互作用的分析结果
注:1)R2= 0.931,调整的R2=0.909.
枝内所积累的w(脯氨酸)达到最大值736.7 μgg,在20 mmolL Ca(NO3)2时降到最低,低于同等c(NaCl)处理下未添加Ca(NO3)2的沙拐枣同化枝内的w(脯氨酸);当c(NaCl)为200 mmolL时,添加c〔Ca(NO3)2〕 为20 mmolL时,植物体内w(脯氨酸)达到最高1 086.3 μgg,与同等c(NaCl)处理下未添加c〔Ca(NO3)2〕的沙拐枣同化枝内的w(脯氨酸)相比增加了45.6%.
2.2 外源钙对盐胁迫下沙拐枣同化枝中丙二醛含量的影响
由图2可知,在未添加Ca(NO3)2的情况下,丙二醛含量随外界c(NaCl)的增加呈逐渐上升的趋势. 无NaCl处理的情况下,沙拐枣同化枝内丙二醛含量随着外界c〔Ca(NO3)2〕的增加呈下降趋势,当浓度达到10 mmolL之后,丙二醛含量的变化不显著. NaCl与Ca(NO3)2同时添加对沙拐枣同化枝中丙二醛含量的影响存在极显著的(P<0.01)交互作用(见表2). 在c(NaCl)为100 mmolL、c〔Ca(NO3)2〕为10 mmolL时,沙拐枣同化枝内的丙二醛含量降到最低,与同c(NaCl)处理下未添加Ca(NO3)2的沙拐枣同化枝相比,丙二醛含量降低了49.0%,与对照相比降低了37.8%;当c(NaCl)为200 mmolL、添加不同浓度的Ca(NO3)2时,沙拐枣同化枝内丙二醛含量呈先升后降的趋势,但均低于同等NaCl处理时的含量,当c〔Ca(NO3)2〕为20 mmolL时,丙二醛含量降到最低,与对照相比降低了40.5%. 说明Ca(NO3)2可以通过促进植物体内丙二醛的代谢来缓解盐胁迫,当c(NaCl) 为100 mmolL时,10 mmolL的Ca(NO3)2缓解作用最佳,当c(NaCl)为200 mmolL时,20 mmolL 的Ca(NO3)2缓解作用最佳.

c〔Ca(NO3)2〕(mmolL):1—0;2—5;3—10;4—15;5—20.图2 Ca(NO3)2对沙拐枣同化枝中丙二醛含量的影响Fig.2 Effect of Ca(NO3)2 on MDA content in assimilating shoots of Calligonum mongolicum

表2 不同浓度Ca(NO3)2与NaCl添加对丙二醛含量交互作用的分析结果
注:1)R2= 0.772,调整的R2= 0.701.
2.3 外源钙对盐胁迫下沙拐枣同化枝中w(可溶性蛋白)的影响
由图3可以看出,单独NaCl处理时,w(可溶性蛋白)随着盐浓度的增加而上升,单独不同Ca(NO3)2处理时,沙拐枣同化枝内w(可溶性蛋白)均高于对照,说明NaCl和Ca(NO3)2单独处理时,对沙拐枣的生长均产生胁迫,导致同化枝内w(可溶性蛋白)的增加.

c〔Ca(NO3)2〕(mmolL):1—0;2—5;3—10;4—15;5—20.图3 Ca(NO3)2对沙拐枣同化枝中w(可溶性蛋白)的影响Fig.3 Effect of Ca(NO3)2 on soluble protein content in assimilating shoots of Calligonum mongolicum
NaCl和Ca(NO3)2的交互处理对沙拐枣中w(可溶性蛋白)的影响存在极显著(P<0.01)的交互作用(见表3). 当NaCl和Ca(NO3)2交互处理时,在同等的NaCl的处理下添加Ca(NO3)2,不论钙盐浓度的高低,w(可溶性蛋白)均高于NaCl处理,c(NaCl)为100 mmolL时,各处理之间不存在显著性差异,c(NaCl)为200 mmolL、c〔Ca(NO3)2〕高于10 mmolL时,w(可溶性蛋白)显著高于NaCl处理下的含量.
2.4 外源钙对盐胁迫下沙拐枣同化枝中w(可溶性糖)的影响
由图4可以看出,不同NaCl处理时w(可溶性糖)均低于对照,在无NaCl作用时,同化枝中w(可溶性糖)随c〔Ca(NO3)2〕的增加呈先增大后减小的趋势. NaCl和Ca(NO3)2的交互处理对沙拐枣中w(可溶性糖)的影响存在极显著(P<0.01)的交互作用(见表4). 当NaCl和Ca(NO3)2交互处理时,在同等NaCl的处理下添加Ca(NO3)2,w(可溶性糖)随c〔Ca(NO3)2〕的增加先增大后减小,其值均高于NaCl处理所对应的含量,c(NaCl)为100 mmolL时,添加不同的c〔Ca(NO3)2〕,各处理之间不存在显著性差异,当c〔Ca(NO3)2〕为10 mmolL时,w(可溶性糖)最大;c(NaCl)为200 mmolL、c〔Ca(NO3)2〕为20 mmolL时,w(可溶性糖)显著高于同等NaCl处理下的含量,并且在同组之间达到最大.

表3 不同浓度Ca(NO3)2与NaCl添加对w(可溶性蛋白)交互作用的分析结果
注:1)R2= 0.859,调整的R2= 0.815.
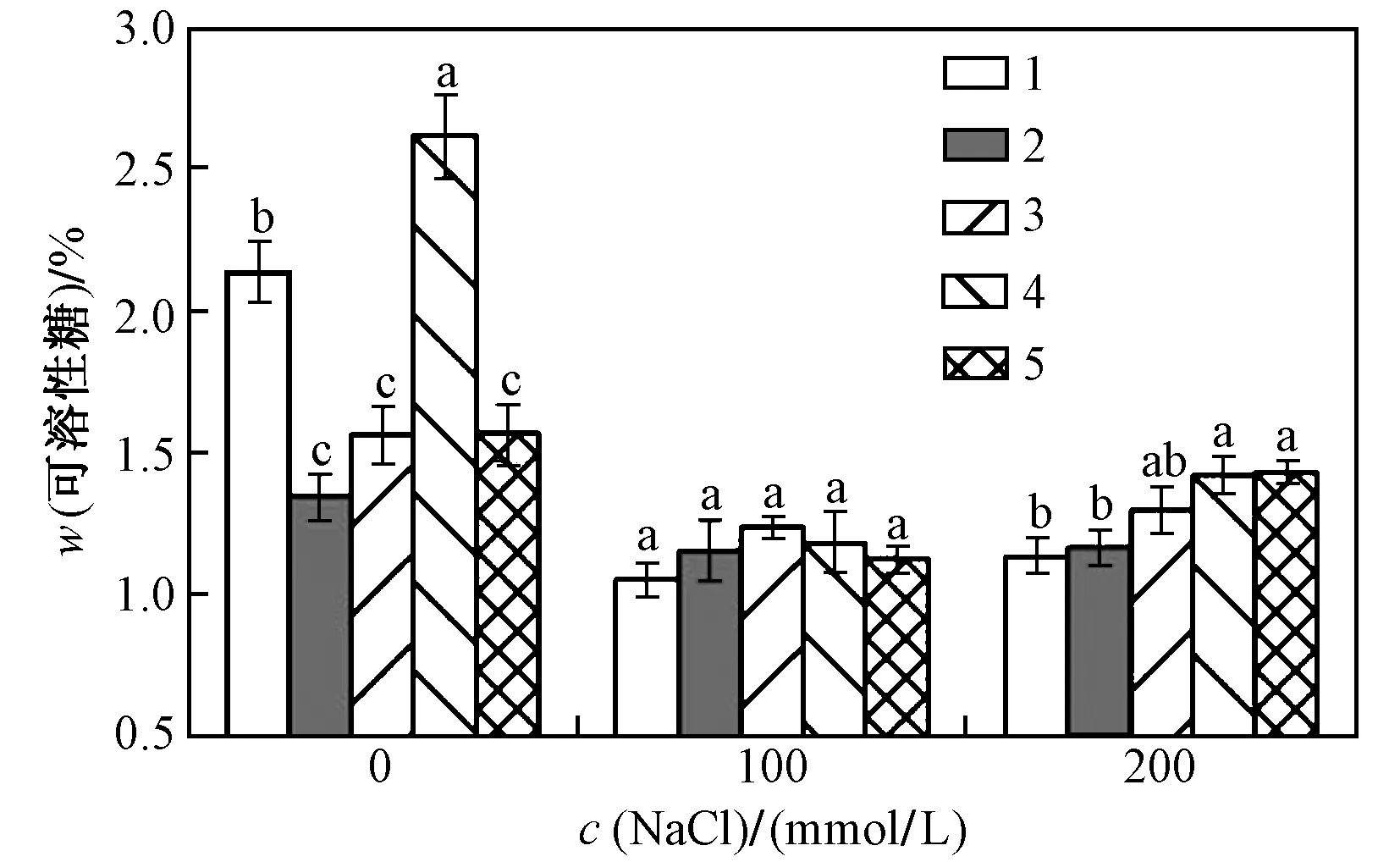
c〔Ca(NO3)2〕(mmolL):1—0;2—5;3—10;4—15;5—20.图4 Ca(NO3)2对沙拐枣同化枝中w(可溶性糖)的影响Fig.4 Effect of Ca(NO3)2 on soluble sugar content in assimilating shoots of Calligonum mongolicum
3 讨论
3.1 钙盐对盐胁迫下w(脯氨酸)的影响
Ca是植物生长所必需的元素,能够维持细胞结构的稳定性,调控细胞内外物质的运输,也可以作为信号转导物质,参与植物细胞内信号的传递[21]. 该研究分析了不同浓度Ca(NO3)2的添加对NaCl胁迫下沙拐枣生化指标的缓解作用,结果表明,随着c(NaCl) 的增加,w(脯氨酸)呈上升趋势(见图1),这与王康等[22]的研究结果一致,当c(NaCl)大于200 mmolL,同化枝中w(脯氨酸)是否会下降还有待进一步研究. NaCl可以产生渗透胁迫,影响植物对水分的吸收,从而导致生理干旱,脯氨酸是可溶性物质,是植物体内组成蛋白质的主要成分之一,以游离的状态广泛存在于植物体内,因此植物可以通过累积脯氨

表4 不同浓度Ca(NO3)2与NaCl添加对w(可溶性糖)交互作用的分析结果
注:1)R2=0.883,调整的R2=0.846.
酸来缓解外界盐的胁迫. 随着外界盐浓度的增加,植物需要自身积累更多的脯氨酸来缓解盐胁迫. NaCl之所以能使植物体内w(脯氨酸)增加,可能的原因是NaCl促进了P5CS基因的表达[21],单独添加Ca(NO3)2使w(脯氨酸)显著增加,说明单独添加Ca(NO3)2对植物造成了胁迫,NaCl胁迫下添加Ca(NO3)2可以提高沙拐枣同化枝中w(脯氨酸),这一结果与NaCl胁迫下加钙对青钱柳[23]、山茱萸[24]的研究结果一致,当NaCl与Ca(NO3)2交互处理时,存在极显著的交互作用(见表1),且添加Ca(NO3)2可以通过增加w(脯氨酸)来缓解盐胁迫对沙拐枣的伤害,当c(NaCl)为100 mmolL、c〔Ca(NO3)2〕为10 mmolL时,缓解效果最佳,当c(NaCl)为200 mmolL时,添加20 mmolL Ca(NO3)2的效果最佳,因此可以看出Ca(NO3)2的缓解作用并非Ca(NO3)2浓度越高缓解作用越好,当c(NaCl)不同时,达到最佳缓解作用所需c〔Ca(NO3)2〕也不同. 添加Ca(NO3)2之所以能促进脯氨酸含量的增加,可能是Ca2+诱导了P5CS基因的表达,也有可能是NO3-参与了脯氨酸的另一条合成路径,经硝酸还原酶和亚硝酸还原酶的作用将NO3-还原成NH4+,NH4+促进鸟氨酸和精氨酸的合成[21],从而促进脯氨酸的积累,也有可能是两者共同的结果,沙拐枣同化枝中w(脯氨酸)的增加还有待进一步进行研究.
3.2 钙盐对盐胁迫下丙二醛含量的影响
植物在衰老或逆境条件下,通常会发生膜脂过氧化反应,丙二醛是膜脂过氧化反应的最终分解产物,丙二醛含量的多少可以衡量植物细胞膜的氧化损坏程度. 在NaCl胁迫下,沙拐枣体内丙二醛含量增加说明NaCl胁迫导致沙拐枣细胞膜氧化受损,这一结果与YANG等[25]对白刺的研究结果一致. 在单独Ca(NO3)2处理时,丙二醛的含量随钙盐浓度的增加而降低,100、200mmolL NaCl处理时,添加Ca(NO3)2可以使植物体内丙二醛含量降低(见图2),说明Ca(NO3)2可以缓解NaCl胁迫对沙拐枣细胞膜的损坏,当c(NaCl)为100 mmolL时,10 mmolLCa(NO3)2缓解作用最佳,当c(NaCl)为200 mmolL、c〔Ca(NO3)2〕 为20 mmolL时缓解作用最佳. 说明并非添加Ca(NO3)2的浓度越高越好,钙盐浓度过高或过低都会使Ca(NO3)2的缓解作用下降,这与程玉静等[26]对黄瓜的研究结果一致. 当c(NaCl)c〔Ca(NO3)2〕为10∶1时,Ca(NO3)2对沙拐枣同化枝中丙二醛的缓解作用最好. 在NaCl胁迫下,植物体内产生大量的活性氧物质,包括O2-、OH-等,引起氧化应激反应,导致植物细胞膜过氧化损伤,导致丙二醛含量的上升,适宜的c〔Ca(NO3)2〕能降低NaCl胁迫下植物体内丙二醛的含量,究其原因:①添加外源钙,生成的Ca2+对细胞膜的保护作用,缓解了NaCl对细胞膜的伤害,进而导致丙二醛含量的降低;②Ca(NO3)2的添加除了引进Ca2+还引进了NO3-,引进的NO3-可以促进沙拐枣同化枝中w(脯氨酸)的累积,w(脯氨酸)的增加有助于烟酰胺腺嘌呤二核苷酸(NADPH)的消耗,维持了细胞中NADP+NADPH比例的平衡,约束了活性氧的累积,进而降低了丙二醛的含量[27].
3.3 钙盐对盐胁迫下w(可溶性蛋白)和w(可溶性糖)影响
图3表明,随着盐浓度的增加,沙拐枣同化枝中w(可溶性蛋白)增加,这与李悦等[28]对翅碱蓬的研究结果一致,这表明盐胁迫条件增强了植物细胞中蛋白质的合成代谢,促进更多蛋白质的合成参与渗透调节,使植物适应盐胁迫,以便更好的生长. 杨少辉等[29- 30]认为,植物在盐胁迫下会合成新的蛋白质,在逆境条件下,盐胁迫蛋白与细胞壁糖蛋白的作用相同,认为盐胁迫蛋白的增加是植物的一种自我保护的作用,Ca2+作为植物体内第二信使,它与钙调蛋白质结合形成有活性的 Ca2+-CaM 复合体,进行调控细胞内一系列生理生化过程. 笔者研究表明,与对照相比,只添加Ca(NO3)2时,同化枝中w(可溶性蛋白)随着盐浓度的增加先降低后增加,而在不同浓度NaCl胁迫下,添加不同浓度的Ca(NO3)2,同化枝中w(可溶性蛋白)均高于同等NaCl处理中的含量,表明Ca2+参与了盐胁迫信号传导的过程和蛋白质合成的过程,在缓解盐对植株的胁迫伤害中发挥着重要作用. 盐胁迫处理时,沙拐枣同化枝中w(可溶性糖)大幅度的降低,这与李姝睿[31]对芸豆的研究结果一致,w(可溶性糖)减低的原因可能是随盐浓度升高,导致植物体内Cl-浓度增加,使植物体内发生阴离子的竞争,磷酸在体内大量地积累,影响了光合作用的正常进行,使得呼吸作用增强,进而使细胞中糖分被消耗[31].
4 结论
a) 在盐胁迫下,添加适当浓度的Ca(NO3)2可提高沙拐枣同化枝中w(脯氨酸),降低丙二醛的含量,提高w(可溶性蛋白)和w(可溶性糖);盐胁迫启动了钙信号的表达,刺激植物产生一系列的应激反应来适应盐胁迫,降低膜脂过氧化反应,渗透调节物质的积累,增强蛋白质的合成代谢,缓解作用最佳,过低的钙浓度缓解作用不够,因此同过高的钙浓度一样,反而对植物造成伤害.
b) 施用Ca(NO3)2可以在一定程度上缓解盐胁迫对沙拐枣生理指标的影响,其中当c(NaCl)c〔Ca(NO3)2〕 为10∶1时浓度最为适宜,并且钙盐对盐胁迫的缓解作用是由抗性诱导所致并非营养竞争.
c) 添加适宜浓度的钙盐能够有效地缓解盐胁迫对沙拐枣幼苗产生的伤害,对不同盐胁迫生境中的沙拐枣而言,可通过添加外源钙的手段来提高存活率.
d) 研究显示,外源钙的添加对盐胁迫植物体内生理指标存在极显著的交互作用,但有关钙如何调控盐胁迫下沙拐枣基因转录表达及其分子机理,还有待进一步研究.
[1] GREENWAY A H,MUNNS R.Mechanisms of salt tolerance in nonhalophytes[J].Annual Review of Plant Biology,2003,31(31):149- 190.
[2] FORTMERIER R,SCHUBERT S.Salt tolerance of maize(ZeamaysL.):the role of sodium exclusion[J].Plant Cell & Environment,1995,18(9):1041- 1047.
[3] YOKOI S,BRESSAN R A,HASEGAWA P M.Salt stress tolerance of plants[J].Jircas Working Report,2002:25- 33.
[4] 李彦,张英鹏,孙明,等.盐分胁迫对植物的影响及植物耐盐机理研究进展[J].中国农学通报,2008,24(1):258- 265. LI Yan,ZHANG Yingpeng,SUN Ming,etal.Research advance in the effects of salt stress on plant and the mechanism of plant resistance[J].Chinese Agricultural Science Bulletin,2008,24(1):258- 265.
[5] MAHAJAN S,PANDEY G K,TUTEJA N.Calcium-and salt-stress signaling in plants:shedding light on SOS pathway[J].Archives of Biochemistry & Biophysics,2008,471(2):146- 158.
[6] MUNNS R,TESTER M.Mechanisms of salinity tolerance[J].Annual Review of Plant Biology,2008,59(1):651- 681.
[7] SHAO Hongbo,CHU Liye,SHAO Mingan,etal.Bioengineering plant resistance to abiotic stresses by the global calcium signal system[J].Biotechnology Advances,2008,26(6):503- 510.
[8] D′ONOFRIO C,LINDBERG S.Sodium induces simultaneous changes in cytosolic calcium and pH in salt-tolerant quince protoplasts[J].Journal of Plant Physiology,2009,166(16):1755- 1763.
[9] 毛桂莲,郑国琦,章英才,等.不同钙盐对NaCl胁迫下枸杞愈伤组织耐盐性的影响[J].干旱地区农业研究,2007,25(1):131- 134. MAO Guilian,ZHENG Guoqi,ZHANG Yingcai,etal.Effects of different calcium salt treatment on salt tolerance ofLyciumbarbarumL.callus under NaCl stress[J].Agricultural Research in the Arid Areas,2007,25(1):131- 134.
[10] 张振兴,孙锦,郭世荣,等.钙对盐胁迫下西瓜光合特性和果实品质的影响[J].园艺学报,2011,38(10):1929- 1938. ZHANG Zhenxing,SUN Jin,GUO Shirong,etal.Effects of supplemental calcium on the photosynthetic characteristics and fruit quality of watermelon under salt stress[J].Acta Horticulturae Sinica,2011,38(10):1929- 1938.
[11] HERNAMANDEZ M,FERNANDEZGARCIA N,DIAZVIVANCOS P,etal.A different role for hydrogen peroxide and the antioxidative system under short and long salt stress inBrassicaoleracearoots[J].Journal of Experimental Botany,2010,61(2):521- 535.
[12] SHABALA S,DEMIDCHIK V,SHABALA L,etal.Extracellular Ca2+ameliorates NaCl-induced K+loss from Arabidopsis root and leaf cells by controlling plasma membrane K+-permeable channels[J].Plant Physiology,2006,141(4):1653- 1665.
[13] 新疆植物志编辑委员会.新疆植物志(第一卷)[M].乌鲁木齐:新疆科技卫生出版社,1993:265.
[14] 苏培玺,赵爱芬,张立新,等.荒漠植物梭梭和沙拐枣光合作用、蒸腾作用及水分利用效率特征[J].西北植物学报,2003,23(1):11- 17. SU Peixi,ZHAO Aifen,ZHANG Lixin,etal.Characteristic in photosynthesis,transpiration and water use efficiency ofHaloxylonammodendronandCalligonummongolicumof desert species[J].Acta Botanica Boreali-Occidentalia Sinica,2003,23(1):11- 17.
[15] 李银芳,杨戈.头状沙拐枣的解剖学和水分生理特征[J].干旱区研究,1991(4):33- 37. LI Yinfang,YANG Ge.A study on the anatomic and hydrological physiological characteristics of a fine binder-Calligonumcaput-medusae[J].Arid Zone Research,1991(4):33- 37.
[16] TAO Ling,REN Jun.Effects of different seed pretreatments on germination of tenCalligonumspecies[J].Acta Botanica Boreali-Occidentalia Sinica,2004,24(4):601- 609.
[17] 王静静,张文鹏,徐当会.NaCl胁迫下钙对沙拐枣(Calligonumarborescens)株高及光合特性的影响[J].中国沙漠,2015,35(1):167- 174. WANG Jingjing,ZHANG Wenpeng,XU Danghui.Influence of calcium on the plant height,photosyphesis,fluorescence and chlorophyII content ofCalligonumarborescensunder NaCl stress[J].Journal of Desert Research,2015,35(1):167- 174.
[18] KAWASAKI S,BORCHERT C,DEYHOLOS M,etal.Gene expression profiles during the initial phase of salt stress in rice[J].Plant Cell,2001,13(4):889- 905.
[19] HEDIYE S A,TURKAN I,OZGECAN T Z,etal.Different antioxidant defense responses to salt stress during germination and vegetative stages of endemic halophyteGypsophilaoblanceolataBark[J].Environmental & Experimental Botany,2012,77(2):63- 76.
[20] 李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000.
[21] KNIGHT H,TREWAVAS A J,KNIGHT M R.Calcium signalling inArabidopsisthalianaresponding to drought and salinity[J].Plant Journal for Cell & Molecular Biology,1997,12(5):1067- 1078.
[22] 王康,刘艳香,董洁,等.盐胁迫对菊苣幼苗脯氨酸积累及其代谢途径的影响[J].草地学报,2011,19(1):102- 106. WANG Kang,LIU Yanxiang,DONG Jie,etal.Effects of NaCl stress on proline accumulation and metabolic pathways of Chicory(CichoriumintybusL.) seedlings[J].Acta Agrestia Sinica,2011,19(1):102- 106.
[23] YAO Lingrui,FANG Shengzuo,NICHOLS D J.A strategy of Ca2+alleviating Na+toxicity in salt-treatedCyclocaryapaliurusseedlings:photosynthetic and nutritional responses[J].Plant Growth Regulation,2012,68(3):351- 359.
[24] PATEL N T,VAGHELA P M,PATATEL A D,etal.Implications of calcium nutrition on the response ofCaesalpiniacrista(Fabaceae) to soil salinity[J].Acta Ecologica Sinica,2011,31(1):24- 30.
[25] YANG Yingli,WEI Xueling,SHI Ruxia,etal.Salinity-induced physiological modification in the callus from halophyteNitrariatangutorumBobr[J].Journal of Plant Growth Regulation,2010,29(4):465- 476.
[26] 程玉静,郭世荣,张润花,等.外源硝酸钙对黄瓜幼苗盐胁迫伤害的缓解作用[J].西北植物学报,2009,29(9):1853- 1859. CHENG Yujing,GUO Shirong,ZHANG Runhua,etal.Mitigative effect of exogenous Ca(NO3)2inCucumberseedlings under salt stress[J].Acta Botanica Boreali-Occidentalia Sinica,2009,29(9):1853- 1859.
[27] DA R I,VIITORELLO V A,SILVA J S,etal.Exogenous ornithine is an effective precursor and the δ-ornithine amino transferase pathway contributes to proline accumulation under high N recycling in salt-stressed cashew leaves[J].Journal of Plant Physiology,2012,169(1):41- 49.
[28] 李悦,陈忠林,王杰,等.盐胁迫对翅碱蓬生长和渗透调节物质浓度的影响[J].生态学杂志,2011,30(1):72- 76. LI Yue,CHEN Zhonglin,WANG Jie,etal.Effects of salt stress onSuaedaheteropteraKitagawa growth and osmosis-regulating substance concentration[J].Chinese Journal of Ecology,2011,30(1):72- 76.
[29] 杨少辉,季静,王罡.盐胁迫对植物的影响及植物的抗盐机理[J].世界科技研究与发展,2006,28(4):70- 76. YANG Shaohui,JI Jing,WANG Gang.Effects of salt stress on plants and the mechanism of salt tolerance[J].World Sci-Tech Research and Development,2006,28(4):70- 76.
[30] 肖强,郑海雷,陈瑶,等.盐度对互花米草生长及脯氨酸、可溶性糖和蛋白质含量的影响[J].生态学杂志,2005,24(4):373- 376. XIAO Qiang,ZHENG Hailei,CHEN Yao,etal.Effects of salinity on the growth and proline,soluble sugar and protein contents ofSpartinaalterniflora[J].Chinese Journal of Ecology,2005,24(4):373- 376.
[31] 李姝睿.盐胁迫对芸豆体内可溶性糖含量的影响[J].青海师范大学学报(自然科学版),2003(2):65- 66. LI Shurui.The content of the soluble sugar of kindey bean in the brine conditions[J].Journal of Qinghai Normal University(Natural Science),2003(2):65- 66.
Effects of Exogenous Calcium on Osmotic Adjustment and Peroxidation ofCalligonummongolicumMembrane Under Salt Stress
WANG Wenyin, GAO Xiaogang, SI Xiaolin, XU Danghui*
State Key Laboratory of Grassland and Agro-Ecosystem, School of Life Science, Lanzhou University, Lanzhou 730000, China
The aim of this study was to explore the regulating mechanism of exogenous calcium inCalligonummongolicumunder salt stress. The effects of calcium (5, 10, 15 and 20 mmolL concentrations) on osmotic adjustment and peroxidation ofC.mongolicummembrane under NaCl stress (0, 100, 200 mmolL) were studied, including the contents of proline, malondialdehyde, soluble proteins and soluble sugars in assimilating shoots ofC.mongolicum. The results showed that the contents of proline, malondialdehyde, soluble proteins and soluble sugars were increased after Ca(NO3)2treatment, which indicates that Ca(NO3)2addition alone is harmful toC.mongolicum. There was a highly significant interaction between calcium and salt on the content of proline, malondialdehyde, soluble protein and soluble sugar in assimilating shoots. Compared with the control, when NaCl concentration was 100 and 200 mmolL, and Ca(NO3)2was 10 mmolL and 20 mmolL; the content of proline was significantly increased to 736.7 μgg and 1086.3 μgg; the content of malondialdehyde decreased by 37.8% and 40.5%; and the contents of soluble proteins and soluble sugars were increased. As a whole, it could be noticed that suitable concentrations of calcium improved the salt tolerance ofC.mongolicumby increasing the osmoregulation substances such as proline, soluble protein and soluble sugar content, and decreasing malondialdehyde content. The optimal proportion wasc(NaCl)c(Ca(NO3)2) of 10∶1. The alleviation mechanism of exogenous calcium under salt stress was the regulation of resistance induction.
Calligonummongolicum; exogenous calcium; salt stress; proline; malondialdehyde; soluble protein
2017-01-12
2017-04-24
国家自然科学基金项目(30900171,31600336);兰州大学中央高校基本科研业务费专项基金项目〔Lzujbky- 2016- 93(862600)〕
王文银(1993-),女,甘肃会宁人,wangwy2015@lzu.edu.cn.
*责任作者,徐当会(1976-),女,甘肃正宁人,副教授,博士,主要从事植物生理生态研究,dhxu@lzu.edu.cn
X171.1
1001- 6929(2017)08- 1230- 08
A
10.13198j.issn.1001- 6929.2017.02.58
王文银,高小刚,司晓林,等.外源钙盐对盐胁迫下沙拐枣渗透调节和膜脂过氧化的影响[J].环境科学研究,2017,30(8):1230- 1237.
WANG Wenyin,GAO Xiaogang,SI Xiaolin,etal.Effects of exogenous calcium on osmotic adjustment and peroxidation ofCalligonummongolicummembrane under salt stress[J].Research of Environmental Sciences,2017,30(8):1230- 1237.

