基于ZnO纳米棒液相自组装固定血红蛋白及其直接电化学传感器
张 琦,段国萍,郭小玉,杨海峰
(资源化学教育部重点实验室,上海师范大学化学系,上海200234)
基于ZnO纳米棒液相自组装固定血红蛋白及其直接电化学传感器
张 琦,段国萍,郭小玉*,杨海峰*
(资源化学教育部重点实验室,上海师范大学化学系,上海200234)
自组装方法制备纳米生物传感器时,常利用聚电解质(如PDDA,poly(diallyl-dimethyl ammonium chloride))与纳米材料和酶的相互作用。但是聚电解质易导致纳米材料团聚,或损害酶的活性,且操作过程较复杂,制备重现性不理想。该工作,利用纳米ZnO与血红蛋白(Hb)等电点差异,直接在纳米材料分散液进行酶混合组装,然后再通过自组装,固定到玻碳电极表面,从而实现了Hb与电极间的直接电子传递。利用紫外吸收光谱(UV-vis)、透射电子显微镜(TEM)及循环伏安等方法对制备过程进行了表征。修饰电极测定H2O2溶液的线性范围是1.06×10-6~7.82×10-3mol/L,检测限是8.86×10-7mol/L(S/N=3)。相同实验条件下,制备电极对相同浓度H2O2的响应电流的相对标准偏差(R.S.D)在1.9%左右,表明该方法制备的生物传感器制备过程简单、有好的稳定性和重现性。
纳米ZnO;血红蛋白;自组装;直接电子传递
0 引言
H2O2是生物体内许多氧化酶反应的副产物,因此制备生物传感器[1-5]对其含量进行测定在生物、临床、食品和环境分析中具有重要意义[6]。检测H2O2有很多种方法,电化学法相对比较好。但是,H2O2的直接电化学检测需要相对较高的超电位[7]。纳米ZnO作为一种半导体材料,有很宽的能带隙,它有较好的生物亲和性,比表面积大,良好的生物相容性和高的电子传递特性[8]且等电点比较高,适合用来固定生物分子,尤其是低等电点的蛋白酶,比如血红蛋白(Hb)。
考虑到利用层层自组装制备基于纳米材料的生物传感器的研究中[9],遇到的主要技术问题是使用的聚电解质如PDDA(poly(diallyldimethyl ammonium chloride))易导致纳米材料发生团聚,或可能损害酶的活性,在电极表面的固定过程比较复杂,传感器的重现性不理想。该文开展一种基于生物活性分子与纳米材料等电点不同,先液相组装后再构建修饰电极:即纳米氧化锌分散液和血红蛋白混合组装后,再组装到玻碳电极(GCE)上。研究表明,这种简单易行的制备方法很好的实现了Hb与电极间的直接电子传递,而且对H2O2响应迅速,传感器的制备重现性大大提高。
1 实验部分
1.1 化学试剂
血红蛋白(Hb,来自牛血清,上海生化试剂公司)、纳米ZnO(自制)、H2O2(30%V/V水溶液)、Na2HPO4、KH2PO4、KCl、H3PO4、KCl、NaOH均为分析纯试剂,HAuCl4、柠檬酸三钠(国药集团化学试剂有限公司),实验所用水为超纯水(>18MΩ·cm)。
1.2 实验仪器
循环伏安(CV)测量在CHI650电化学工作站(上海辰华公司)上进行,并采用常规的三电极体系。其中,玻碳电极或经过修饰的玻碳电极作为工作电极,铂片电极作对电极,饱和甘汞电极(SCE)用作参比电极;紫外可见(UV-vis)光谱实验采用UV-8500型紫外可见分光光度计 (上海天美科学仪器有限公司);PHS-3C精密pH计(上海雷磁仪器厂);SK2200H超声仪 (上海科导超声仪器有限公司);透射电子显微谱(TEM谱)由JEOL-JEM200CX型透射电镜得到。
1.3 纳米ZnO分散液的制备
纳米ZnO是根据文献[10]运用种子助长的化学反应法制备的。具体的实验制备方法是:称取1.335 g硝酸锌溶解在100mL的超纯水中,同时,称取0.63 g二亚乙基三胺溶解在100mL的超纯水中,搅拌30min后,将这两种溶液混合并加热,在500mL的烤箱中在95℃的条件下加热3 h。最后将得到的产品冷却、蒸馏水洗涤并晾干。这样就制得了粒径大约在10~20 nm左右的棒状的纳米ZnO。 取前面已制备好的纳米ZnO 25 mg放入盛有25mL超纯水的烧杯中,搅拌4 h使之充分溶解,然后过滤得1mg/mL的纳米ZnO分散液。
1.4 修饰电极的制备
玻碳电极先用细的金相砂纸打磨干净,然后用二次蒸馏水超声,再依次用0.3,0.05μm Al2O3粉末进行抛光。抛光后电极依次用二次蒸馏水、乙醇、和二次蒸馏水进行超声清洗。将上面制备好的1 mg/mL的纳米ZnO分散液与1.34×10-4mol/L的血红蛋白(Hb,pH7.0)溶液以体积比为1∶1的比例混合。然后将处理干净的玻碳电极浸泡在混合溶液中放置于冰箱 (4℃)中进行自组装20 h,制备ZnONRs-Hb/GCE修饰电极。作为对比,相同条件下,还制备了ZnONPs/GCE修饰电极和裸玻碳电极。
1.5 测量方法
取10 mL 0.067 mol/L的磷酸盐缓冲溶液(PBS,pH7.0)于反应池中,连接三电极系统,铂电极为对电极,饱和的甘汞电极为参比电极,修饰电极为工作电极。CV实验在静止溶液中操作。计时电流(CA)实验在搅拌溶液中操作,待基线电流稳定后,加入一定量的H2O2,记录响应电流值。
2 结果与讨论
2.1 TEM表征
图1是纳米ZnO分散液和纳米ZnO-Hb溶液的透射电镜图。从图1(a)中可以发现所制备的纳米ZnO是棒状的,粒径在10~20 nm左右,当ZnO分散液和Hb溶液以体积比1∶1混合后,Hb密集地包埋在棒状的纳米ZnO中,如图1(b)。
2.2 紫外可见吸收光谱

图1 纳米ZnO(a)和纳米ZnO-Hb(b)的透射电镜图Fig.1 TEM imagesof ZnONRs(a)and ZnONRs-Hb(b)
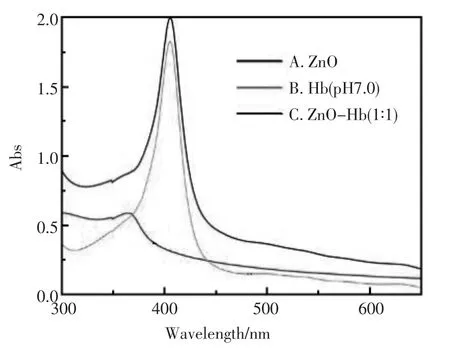
图2 不同溶液的紫外可见光谱图Fig.2 UV-visabsorption spectra of ZnONRs(A)、Hb(B)and ZnONRs-Hb(C)
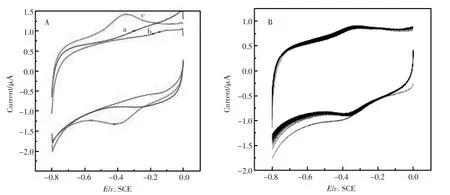
图3 (A)不同修饰电极的循环伏安图;(B)ZnONRs-Hb/GCE修饰电极在磷酸缓冲溶液(pH7.0)中连扫50圈Fig.3 (A)Cyclic voltammograms(CVs)ofbare GCE(a)ZnONRs/GCE(b)ZnONRs-Hb/GCE(c)in PBS(pH7.0).(B)Cyclic voltammograms(CVs)of ZnONRs-Hb/GCE in pH7.0 PBSsolutionwith 50 circles. Scan rateat200mV/s
图2是不同溶液的紫外可见光谱,棒状的纳米ZnO分散液在348 nm左右有最大吸收峰,如图2(A)。从图2(B)中,可以看到,血红蛋白(Hb)溶液的Soret带最大吸收峰出现在408 nm左右,另外,在Q带、CT带依次有500和640 nm两个吸收峰,说明血红蛋白保持着它原有的活性且二级结构保持完好没有破坏。当棒状的纳米ZnO分散液和Hb溶液混合后,最大吸收峰在408 nm左右,同时Q带、CT带依次有500,640 nm两个很弱的峰,如图2(C),这说明棒状的纳米ZnO分散液和Hb溶液混合后,相互作用结合在一起,同时血红蛋白仍然保持着它原有的活性且二级结构没有被破坏。
2.3 修饰电极的直接电化学行为
图3(A)是研究不同修饰电极在pH7.0的PBS溶液中的循环伏安曲线。图3(A)中(a)、(b)依次是裸玻碳电极、ZnONRs/GCE修饰电极的循环伏安曲线,都没有氧化还原峰。而ZnONRs-Hb/GCE修饰电极,如图3(A)中(c),可以很明显的看到有一对形状相似的氧化还原峰,这表明Hb实现了它与电极间的直接电子传递,反应如下:Hb(FeⅢ)+e=Hb(FeⅡ)。图3(B)是ZnO NRs-Hb/GCE修饰电极在pH7.0的PBS溶液中连续扫50圈的循环伏安曲线,可以看到,除了第一圈,氧化还原峰电位基本不变而且氧化峰电流也基本没变,这表明Hb比较牢固的固定在玻碳电极上。
2.4 修饰电极不同扫速的循环伏安曲线
图4(A)考察了不同扫描速度和氧化还原峰电流之间的关系,随着扫速的增大,氧化还原峰电流也逐渐的增大,但氧化还原峰电位基本不变。当扫速在100~600mV/s(a→f)间变化时,如图4(B)氧化还原峰电流与扫描速度成一次线性关系,表明这是一个表面控制的反应过程,即为薄层电化学行为。同时,也可以进一步说明Hb成功的固定到电极上并且实现了直接电子传递。
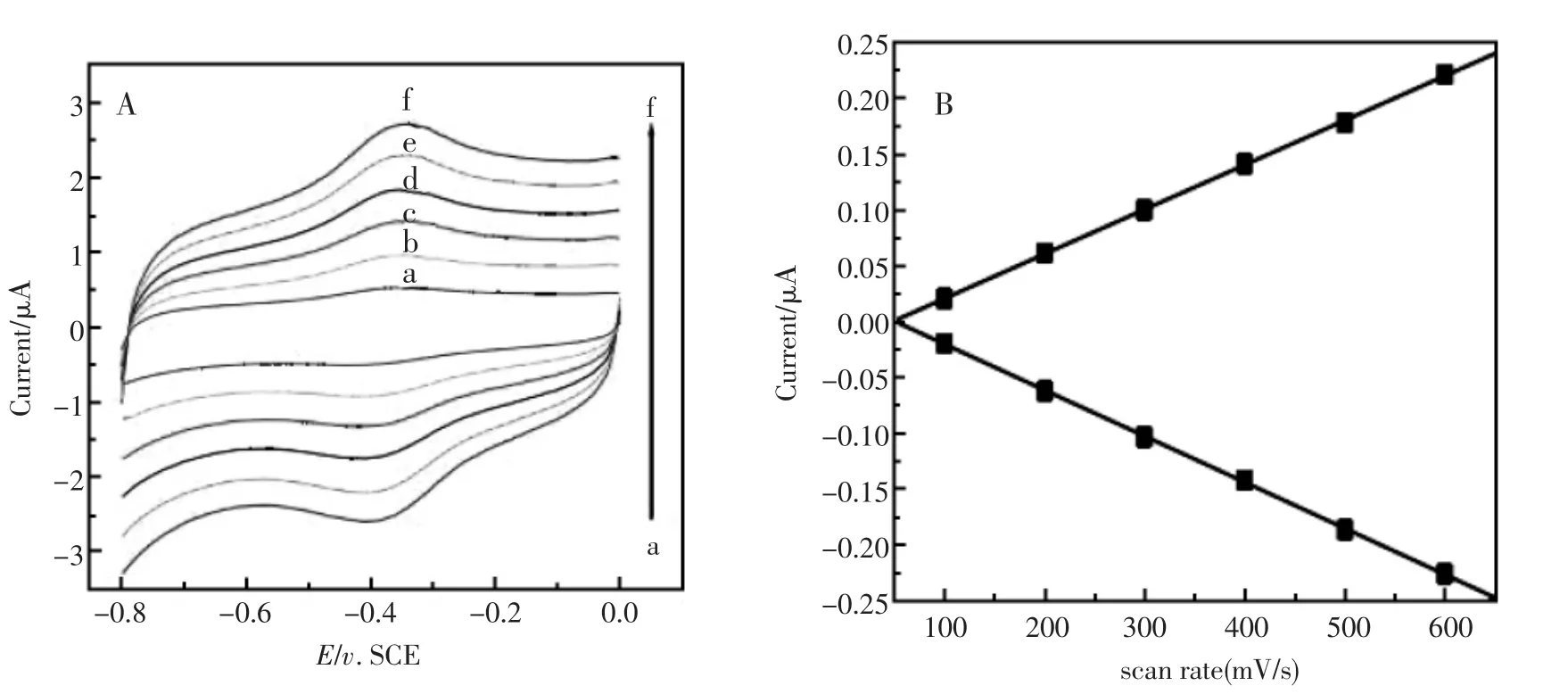
图4 (A)ZnONRs-Hb/GCE修饰电极在磷酸缓冲溶液(pH7.0)中不同扫速的循环伏安的曲线;(B)峰电流对扫速的线性关系Fig.4 (A)Cyclic voltammograms(CVs)of ZnONRs-Hb/GCE in pH7.0 PBSsolutionwith differentscan ratesof(from a to f)100,200,300,400,500,and 600mV/s.(B)A plotofpeak currents vs.scan rates
2.5 溶液pH的影响
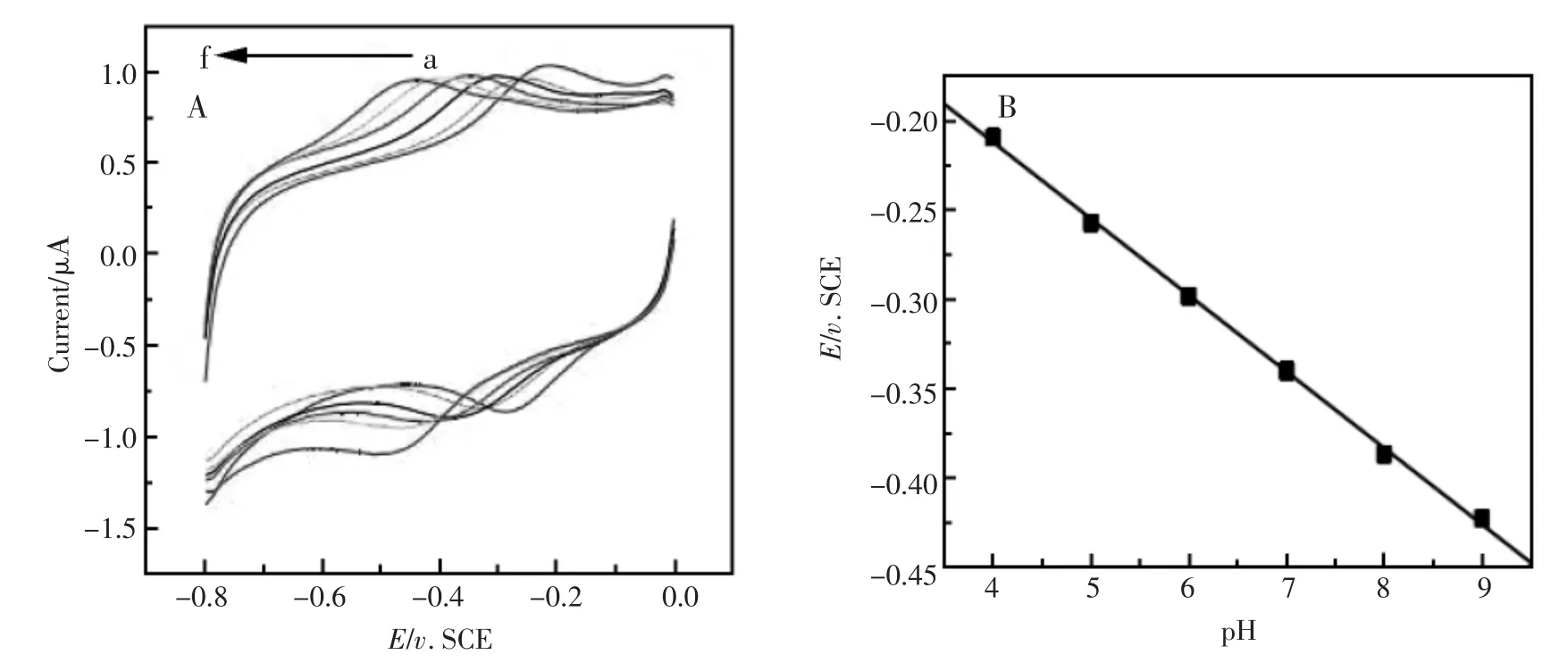
图5 (A)ZnONRs-Hb/GCE修饰电极在不同pH磷酸缓冲溶液中不同扫速的循环伏安的曲线;(B)pH对式量电位EØ的线性关系图Fig.5 (A)Cyclic voltammogramsof ZnONRs-Hb/GCE in 0.05mol/LPBSsolutionwith different.pH:4.0,5.0, 6.0,7.0,8.0,9.0(from a to f)(B)A Plotof the formalpotentialsvs.pH values.Scan rate at200mV/s
用循环伏安法研究了溶液pH对修饰电极式量电位EØ的影响。图5(A)表明,修饰电极的循环伏安行为在很大程度上受到外部溶液pH值的影响,该反应是:HbFe(III)+H++e-⇌HbHFe(II),从图中可以看到,当底液的pH值改变时,修饰电极的循环伏安氧化还原峰电位随缓冲溶液pH值的增加而负移。在pH值在4.0~9.0(a→f)之间时,式量电位EØ与溶液的pH值呈线性关系,如图5(B),斜率是-52.7mV/pH,这一数值与伴随一个质子转移的单电子可逆电极反应的理论值-57.6mV/pH(20℃)相接近。当从pH9.0返回到pH4.0测定,得到的循环伏安图与之前的一致,说明该修饰电极有很好的稳定性和可逆性。
2.6 修饰电极对过氧化氢(H2O2)的催化
从图6插图中,可以看到,裸玻碳电极、ZnO/ GCE修饰电极对H2O2均没有催化还原作用。但ZnO NRs-Hb/GCE修饰电极对H2O2有明显的电催化还原作用,如图4-6(b→e),随着H2O2浓度的增大,还原峰逐渐的增大而氧化峰逐渐减小甚至消失。这表明ZnONRs-Hb/GCE修饰电极对H2O2有良好的电催化还原作用,反应是:H2O2+ 2HbHFe(II)→2HbFe(III)+2H2O
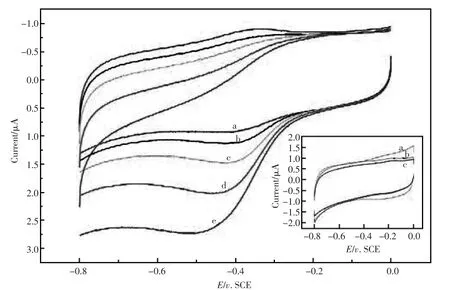
图6 不同修饰电极在磷酸缓冲溶液(pH=6.9)中不含H2O2及含不同浓度的H2O2的循环伏安曲线,扫速:200mV/sFig.6 Cyclic voltammogramsof ZnONRs-Hb/GCEatscan rateof200mV/s in PBS(pH7.0)withoutH2O2(a)andwith 0.045mol/L ofH2O210μL(b)20μL(c)30μL(d)40μL(e)Inset:bare GCE(a), ZnO/GCE atscan rate of200mV/s in 0.05mol/LPBS(pH7.0)withoutH2O2(b)and with 0.045mol/L of H2O2(c)
2.7 ZnO NRs-Hb/GCE修饰电极对过氧化氢(H2O2)的响应
图7是ZnO NRs-Hb/GCE修饰电极在恒电位-300mV时对不同浓度的H2O2的响应情况。从图7(A)中可以看出,ZnONRs-Hb/GCE修饰电极的响应电流随H2O2浓度的增大而增大,每次加入H2O2后,其响应电流在3 s内达到稳定,说明ZnONRs-Hb/GCE修饰电极对H2O2的响应速度快。通过实验结果计算得出,ZnONRs-Hb/GCE修饰电极对H2O2的响应的线性范围是1.06×10-6~7.82×10-3mol/L(r=0.996),检测限是8.86×10-7mol/L(S/N=3)。另外,根据图7(B)的线性关系图利用公式算得其Km是0.117mmol/L,表明修饰电极对H2O2的响应迅速而灵敏。
2.8 重现性和稳定性
该文还对ZnO NRs-Hb/GCE修饰电极的重现性和稳定性进行了研究。通过实验发现,4支ZnO NRs-Hb/GCE修饰电极在相同条件下对在PBS(pH7.0)溶液中对0.15mmol/L的H2O2的响应电流的相对偏差是1.9%左右,说明制备的生物传感器重现性好。同时,还考察了该修饰电极的稳定性。发现,ZnO NRs-Hb/GCE修饰电极在pH7.0的PBS溶液中在0到-0.8 V电位窗口下,以200mV/s的速度连续扫描50圈,氧化还原峰电位、响应电流基本没变,说明该修饰电极比较稳定。ZnONRs-Hb/GCE修饰电极在0.15mmol/LH2O2中测定后在4℃放置两周后,相同实验条件下对H2O2的响应电流是原来的96%,表明制备的生物传感器的重现性和稳定性都比较好。
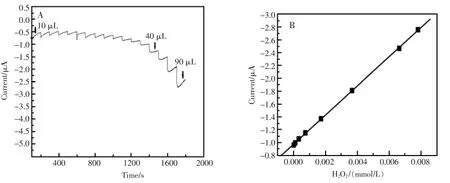
图7 (A)ZnONRs-Hb/GCE修饰电极在10mL pH7.0 PBS溶液中计时电流曲线(工作电位:-300mV)(B)响应电流对H2O2浓度线性关系图Fig.7 (A)A typicalamperometric i–tcurveof ZnONRs-Hb/GCEat-300mV in 10mLPBS solutionwith pH7.0(B)A plotofsteady-state currentvs.H2O2concentration
3 结论
该文将高等电点棒状纳米ZnO分散液和低等电点的血红蛋白酶溶液混合,利用它们的等电点较大的差异性,在溶液中相互作用组装,然后再自组装修饰到玻碳电极上,制备了直接电子转移的生物传感器。制备过程简单,易操作,重现性高。对H2O2的响应迅速,有较宽的检测浓度范围、检测限低。
[1]Zhu JT,ShiCG,Xu JJ,etal.Direct electrochemistry and electrocatalysisofhemoglobin on undoped nanocrystalline diamond modified glassy carbon electrode[J]. Bioelectrochem,2007,71:243-248.
[2]Feng JJ,Xu JJ,Chen H Y.Directelectron transfer and eleetrocatalysis of hemoglobin adsorbed on mesopoorus carbon through layer-by-layer assembly[J].Biosens. Bioelectorn,2007,22:1618-1624.
[3]Zhao S,Zhang K,BaiY,etal.Glucose oxidase clolloidal gold nanoparticles immobilized in Nafion film on glassy carbon electrode:Direct electorn transfer and elecrtocatalysis[J].Bioelectrochem,2006,69:158-163.
[4]Lu Q,Hu SS.Studieson directelectorn transferand biocatalytic properties of hemoglobin in polytetrafluoroethylene film[J].Chem.Phys.Lett.,2006,424:167-171.
[5]Cao D F,Hu N F.Direct electron transfer between hemoglobin and pyrolytic graphite electrod-esenhanced by Fe3O4nanoparticles in their Layer-by-Layer self-assembly films[J].Biophys.Chem.,2006,121:209-217.
[6]Collins L Z,Maggio B,Gallagher A,etal.Safety evaluation of a novelwhitening gel,contain-ing 6%hydrogen peroxide and a commercially available whitening gel containing 18%Carbamide peroxide in an exaggerated use clinicalstudy[J].J.Dent.,2004,32:47-50.
[7]CurriM L,Agostiano A,Leo G.Developmentofa novel enzyme miconductor nanoparticles system for biosensor application[J].Mater.Sci.Eng.C,2002,22:449-452.
[8]Topoglidis E,Class A EG,ORegan B,etal.The flavins are an important class of biochemical compounds which are found in both plants and animals[J].JElectroanal. Chem.,2001,517:20-27.
[9]Wink Th,vanZuilen S J,Bult A,et al.Self-assembled monolayers for biosensors[J].Analyst.,1997,122:43-50.
[10]Zhang H,Yang DR,Ma X Y,etal.Straightand thin ZnO nanorods:hectogram-scale Synthesis at low temperature and cathodoluminescence[J].J.Phys.Chem.B.,2006, 110:827-830.
ZnO-nanorods-based self-assembly in liquid phase for immobilization of hemoglobin and directelectrochem istry sensor
Zhang Qi,Duan Guo-ping,Guo Xiao-yu*,Yang Hai-feng*
(The Education Ministry Key Lab ofResource Chemistry,DepartmentofChemistry,ShanghaiNormalUniversity, Shanghai200234,China)
Self-assemblymethod could be used to synthesize nanomaterial-based biosensor by the help of polyelectrolyte such as poly(diallyldimethylammonium chloride)(PDDA).However,polyelectrolyte resulted in severe aggregation ofnanomaterialsor damaging the bioactivity ofhemoglobin(Hb).In addition,the processofpreparationwas relatively complicate and poor reproducibility.In thiswork,we developed a simplermethod that the ZnONPs sufficiently bound with Hb,taking advantage of the great difference of isoelectric pointbetween ZnONPs and Hb,and then self-assemblemethod wasused tomodify them on the cleaned glassy carbon electrode(GCE).The directelectron transfer of Hb was realized on the as-prepared electrode.UV-vis Spectrophotometer,TEM and cyclic voltammetrywere used to characterize the synthesis processofbiosensor.The responses of H2O2were linearly proportional to the concentration from 1.06×10-6~7.82×10-3mol/L with a detection limitof8.86×10-7mol/L(S/N=3).R.S.Dwas about l.9%foras-prepared electrodes in 0.15mmol/LH2O2in 0.05mol/LPBS(pH7.0).Thisbiosensor exhibited the facile-made,good reproducibility and stability.
ZnO nanoparticles;hemoglobin;self-assembly;directelectron transfer
国家自然科学基金面上项目(21475088)
*通信联系人,E-mail:haifengyang@yahoo.com,gxy2012@shnu.edu.cn,Tel.:021-64322144

