超高效液相色谱-串联质谱快速测定水产饲料中甲基睾丸酮的含量
杨金兰,陈俊*,陈成桐,关歆,刘秀芬,陈嘉勋
(1.广州市海洋与渔业环境监测中心,广东 广州 510235;2.中国广州分析测试中心广东省分析测试技术公共实验室,广东 广州 510070)
超高效液相色谱-串联质谱快速测定水产饲料中甲基睾丸酮的含量
杨金兰1,陈俊1*,陈成桐1,关歆1,刘秀芬1,陈嘉勋2
(1.广州市海洋与渔业环境监测中心,广东 广州 510235;2.中国广州分析测试中心广东省分析测试技术公共实验室,广东 广州 510070)
建立了水产饲料中甲基睾丸酮的超高效液相色谱-串联质谱分析方法。具体优化了检测过程中提取液体积分数、提取时间、固相萃取柱、洗脱液浓缩方式、质谱条件和流动相组成等对加标回收率有影响的主要因素。样品经40%甲醇水提取,提取液经C18固相萃取柱净化,用超高效液相色谱-串联质谱仪测定。甲基睾丸酮的质量浓度在0.50~10.00 μg/L线性良好,该方法的检出限为2.00 μg/kg,定量限为5.00 μg/kg。本方法适用于大批量饲料中的甲基睾丸酮的快速检测。[中国渔业质量与标准,2017,7(3):38-43]
超高效液相色谱-串联质谱;饲料;甲基睾丸酮;检测
甲基睾丸酮(methyltestosterone,简称MET)俗称甲基睾丸素,属于雄性激素类。由于它对鱼类具有促生长、雄性化和增加产量等作用[1],一些不法商家在鱼饲料中掺入MET,以实现鱼体的雄性化,达到增加产量目的。相关研究[2-5]表明,MET在水产动物体内的代谢时间较长,痕量残留都会打乱人体激素平衡,导致生理功能紊乱,同时对新生儿也会产生畸形、黄疸及溶血等症状,因此,美国等多个国家都禁止在水产养殖中使用MET。中国农业部在2002年颁布的235号公告《动物性食品中兽药最高残留限量》[6]规定禁止使用甲基睾丸酮并且动物性食品中不得检出。
目前,鱼体中甲基睾丸酮的检测研究方法报道较多,无论是液相色谱法[7-8],还是液相色谱-串联质谱法[9-10],甚至酶联免疫法[11]都很成熟。而对饲料中甲基睾丸酮的检测方法研究却报道很少,只有国家标准方法液相色谱-串联质谱法[12]和地方标准方法高效液相色谱法[13]。对于基质复杂的饲料来说,杂峰非常多,采用液相色谱法来分析,目标峰很容易受到干扰,且检出限高,前处理繁琐。液相色谱-串联质谱法,检测限低、前处理简单,定性科学、定量准确。因此,本研究在国家标准方法液相色谱-串联质谱法的基础上对提取液体积分数、提取时间、固相萃取柱类型、洗脱液浓缩方式、流动相、色谱和质谱条件等因素进行优化,建立了一种检出限低、前处理简单、回收率高的检测水产饲料中甲基睾丸酮的液相色谱-串联质谱方法。该方法快速、准确,且能满足饲料中甲基睾丸酮大批量样本的快速分析。
1 材料与方法
1.1 仪器与试剂
Kinetex C18色谱柱(100 mm×2.1 mm,2.6 μm),Waters-Oasis HLB 固相萃取柱(60 mg,3 mL),Supelco-C18固相萃取柱(60 mg,3 mL),UPLC-MS/MS(岛津LC20ADXR-AB SCIEX Triple Quad 5500),以及超声清洗器、粉碎机、离心机、旋涡振荡器、电子天平、Milli Q去离子水发生器等。
供试饲料为罗非鱼配合饲料,来源于江门市澳华特种水产公司。甲基睾丸酮标准品(99.0%)购于德国Dr.Ehrenstorfer公司,甲醇为色谱纯,水为超纯水。
标准溶液配制:用甲醇溶解MET标准品配成质量浓度为500 μg/mL的标准储备液,储存于4 ℃冰箱中,使用时根据需要稀释成不同质量浓度的中间标准溶液及标准工作液。
1.2 实验方法
1.2.1 样品处理
将罗非鱼配合饲料用粉碎机碾成粉末状,准确称取(5.00±0.05)g样品,置于100 mL离心管中,准确加入40%甲醇水50.00 mL,加塞,充分摇动1 min,再置超声水浴提取10 min,其间充分摇动两次。取出后于8 000 r/min离心5 min。
1.2.2 净化
分别用3 mL甲醇、3 mL水活化C18固相萃取柱,准确取上清液5.00 mL上柱,在没加压的情况下,让其自然流下,再用3 mL水和3 mL 5%甲醇溶液洗涤固相萃取柱,抽至近干,在不抽真空情况下,加入2 mL甲醇,收集洗脱液,甲醇定容至2 mL。涡旋振荡1 min,过0.22 μm有机相滤膜,然后上机检测。
1.2.3 测定
1.2.3.1 液相色谱条件
流动相A相为甲醇,B相为0.1%甲酸水溶液,梯度洗脱见表1。设定流速为0.3 mL/min,柱温为30.0 ℃,进样量为10.0 μL,采集时间为6 min。

表1 流动相梯度洗脱表Tab.1 Gradient elution of mobile phase
注:A为甲醇,B为0.1%甲酸水溶液。
1.2.3.2 质谱离子源条件
电喷雾(ESI)离子源下采用正离子模式,多反应监测(MRM),其他参数详见表2。
1.2.3.3 定性定量测定
取适量样品制备液和相应浓度的MET标准工作液进行测定,以保留时间和二级离子m/z109、97进行定性。定性方法:试样保留时间与标准品的相对偏差不大于15%,分别计算样品与标准工作溶液中非定量离子对与定量离子对色谱峰面积的比值,仅当两者数值的相对偏差不大于20%。定量方法:以二级子离子m/z97作为定量子离子,以峰面积比较进行单点或多点校正定量。

表2 质谱参数Tab.2 Parameters of mass spectrometry
注:甲基睾丸酮(m/z)的定量离子对为303/97,定性离子对为303/109。
2 结果与讨论
2.1 提取液体积分数的选择
取空白饲料样品5.00 g,加入质量分数分别为5.00、10.00、20.00、40.00和50.00 μg/kg的MET标准液,混匀放置0.5 h后,加入50.00 mL不同体积分数的甲醇水溶液,然后测定各样品的加标回收率,结果见表3。由结果可看出,当甲醇水溶液的体积分数为40%时,样品中的MET能充分被提取,回收率在80.1%以上,能满足日常检测样品回收要求,且干扰峰较少。当体积分数为20%~30%时,样品回收率低,可能是甲醇含量低,对样品中的MET提取效果不高。当体积分数大于50%时,样品回收率也随着甲醇含量的升高而降低,同时干扰峰明显增加很多。可能原因有两方面,一是随着甲醇水体积分数增高,杂质溶于甲醇水也增多,所以杂峰增多;二是过柱时,由于甲醇水体积分数增高,样品没能很好吸咐在C18柱上,而是直接被洗脱出来,所以回收率也相应降低。因此,本实验选用体积分数为40%的甲醇水作为提取液。
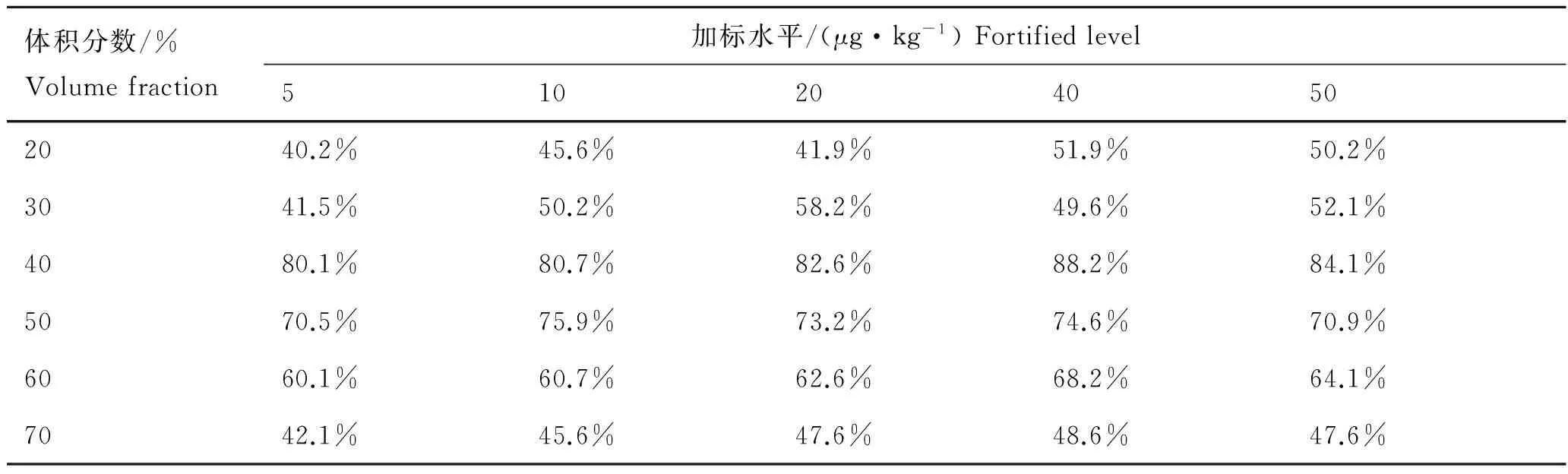
表3 不同体积分数的甲醇水对加标平均回收率的影响Tab.3 Effect of different volume fraction of methanol and water solutions on average recovery
2.2 超声提取时间的选择
取空白饲料样品5.0 g,加入质量分数分别为20.00、40.00和80.00 μg/kg的MET标准液,混匀放置0.5 h后,加入提取液,采用不同的超声时间,按上述前处理操作,然后测定各样品,结果见图1。从图1可看出,各样品在超声10 min后,不同质量分数的加标浓度的回收率己趋于持平。同时发现超声时间越久,杂峰越多,可能超声时间长,对饲料里的杂质提取得越多,因此,本实验选用10 min超声时间。

图1 不同提取时间对回收率的影响Fig.1 Effect of different extraction time on recovery rate
2.3 固相萃取柱的选择
固相萃取法是目前MET残留检测主要使用的净化方法[14-15],主要是利用官能团之间的作用力来分离目标物和基质干扰物,并最终洗脱出待测分析物。
根据MET的化学性质,选择了HLB和C18柱进行实验,实验结果详见表4。C18柱的回收率(80.2%以上)较HLB柱(57.9%以上)高,且该柱选择性较HLB柱好,杂峰较少,HLB柱保留杂质较多,影响低质量分数样品的测定。故本实验选用C18柱作为净化柱。
2.4 洗脱液浓缩方式的选择
国标方法采用了洗脱2 mL,浓缩蒸干再定容的方法,而本研究选择了直接洗脱上机,不浓缩蒸干,其两者的回收率基本没差别,但直接洗脱上机的方式不仅可以节省时间还可以减少损失。其次,本研究还发现,用2 mL洗脱液能将MET完全洗脱出来。
2.5 质谱条件的优化
采用针泵进样模式,在ESI+电离模式下质谱信号强,所以选择了ESI+作为电离模式,确定电离模式后,再优化质谱离子源参数。选取气帘气(CUR) 25、30、35、40 MPa,电喷雾电压5 000、5 300、5 500 V,离子源温度(TEM) 500、550、600、650 ℃,雾化气(GS1) 50、55、60、65 kPa,辅助气(GS2) 50、55、60、65 kPa等进行优化,最后得出质谱离子源最佳参数:气帘气(CUR)为40 MPa,电喷雾电压为5 500 V,离子源温度(TEM)为500 ℃,雾化气(GS1)为55 kPa,辅助气(GS2)为55 kPa。甲基睾丸酮的碎片选择离子质谱图见图2。

表4 两种净化萃取柱平均回收率比较Tab.4 Comparison of two kinds of extraction column on average recovery

图2 MET碎片选择离子质谱图Fig.2 Ion chromatogram of MET
2.6 流动相组成的确定
流动相的组成影响着MET的峰形、保留时间还有检测灵敏度。实验过程中分别选择乙腈-水或甲醇-水为流动相,结果发现,以1.00、5.00、10.00 ng/mL的标准液进样,甲醇-水为流动相信号响应强于乙腈-水,且无杂质峰,而乙腈-水出现了一个大杂峰,可能是溶剂峰,所以选用甲醇-水作为流动相见图3。在流动相中加入甲酸,可以对峰型有所改善,还可以增加其离子化效率、提高灵敏度,但加入过多的酸则会抑制目标物的离子化,进而降低灵敏度。实验选用了0.1%、0.2%、0.3%、0.5%体积分数的甲酸含量,结果表明,以含0.1%体积分数甲酸的甲醇溶液为流动相时效果最好。
2.7 两种方法在样品前处理时间上的比较
由表5可见,使用国标方法GB/T22260—2008需要45 min,而使用本方法只需要15 min,大大缩短了前处理的时间。
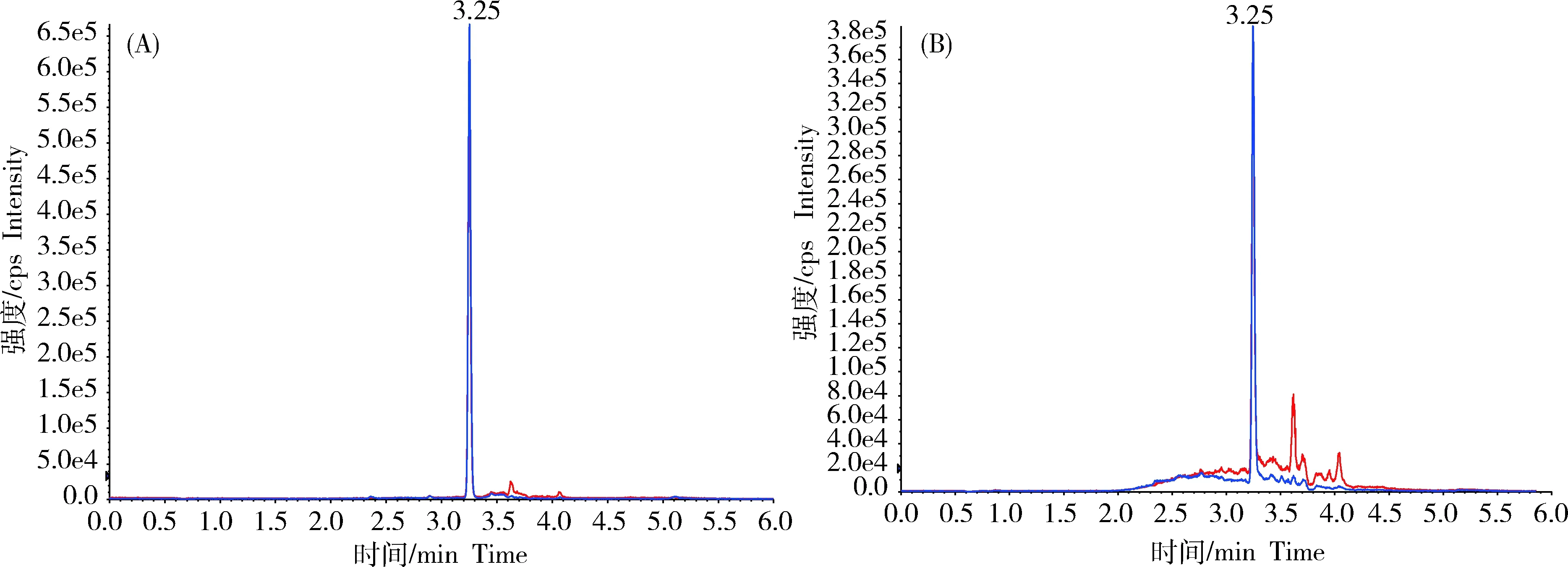
图3 以甲醇-水(A)和乙腈-水(B)为流动相的5.00 ng·mL-1的标准液图谱Fig.3 Chromatogram of a standard solution with 5.00 ng·mL-1 of MET by methanol water (A) and acetonitrile water (B)as mobile phase
表5 两种方法在样品前处理时间上的比较

Tab.5 Comparison of two methods in detection of sample pretreatment time min

图4 MET标准曲线图Fig.4 Standard curve of MET
2.8 线性范围、检出限及定量下限
用MET标准使用液配制质量浓度分别为0.50、1.00、2.00、5.00、10.00 μg/L的标准溶液,进样测定后,制作标准曲线,MET的线性方程及相关系数为y=1.53e5x+2.4e4(r=0.999 9),详见图4。结果表明,在0.500~10.00 μg/L MET线性良好。以信噪比S/N=3和S/N=10对应的药物浓度分别定义为方法的检出限(LOD)与定量限(LOQ),将加标质量浓度逐级稀释添加于空白饲料样品中测定信噪比,最终确定该方法的检出限为2.00 μg/kg,定量限为5.00 μg/kg。
2.9 准确度和精密度
在空白草鱼饲料、对虾饲料和鱼虾混养配合饲料中,加入MET标准溶液,加标水平分别为5.00、10.00、50.00 μg/kg,每个水平做6个平行样品。测定结果显示,改良后的方法其加标回收率都在80%以上,相对标准偏差在3.0%以下,具体回收率和相对标准偏差见表6。

表6 MET加标回收率及相对标准偏差Tab.6 Recovery and relative standard deviation (RSD ) of MET-fortified samples n=6
3 结论
通过对提取液体积分数、提取时间、固相萃取柱、洗脱液浓缩方式、质谱条件和流动相组成等对加标回收率有影响的主要因素进行优化,确定了水产饲料中MET含量测定的最佳测定条件。在此条件下测定饲料中MET含量,其前处理简便、回收率和精密度高,MET质量浓度在0.50~10.00 μg/L内线性良好,方法检出限为2.00 μg/kg,定量限为5.00 μg/kg。结果表明,该法适用于大批量水产饲料中MET的检测。
[1] Rivero-Wendt C L,Miranda-Vilela A L, Ferreira M F, et al. Lack of genotoxicity in Astyanax bimaculatus and Oreochromis niloticus of 17alpha-methyltestosterone used in fish hatcheries to produce male monosex populations [J]. Genet Mol Res, 2013, 12(4): 5013-5022.
[2] 邹琴, 陈培基, 李刘冬, 等. 甲基睾丸酮在罗非鱼苗种体内的消解规律[J]. 水生生物学报,2010, 34(2): 250-255.
[3] Okazaki K, Imazawa T, Nakamura H, et al. A repeated 28-day oral dose toxicity study of 17α-methyltestosterone in rats, based on the Enhanced OECD Test Guideline 407 for screening the endocrine-disrupting chemicals[J]. Arch Toxicol, 2002, 75(11/12): 635-642.
[4] Han Y, Ma Q, Lu J, et al. Optimisation for subcritical fluid extraction of 17-methyltestosterone with 1, 1, 1,2-tetrafluoroethane for HPLC analysis [J]. Food Chem, 2012, 135(4): 2988-2993.
[5] 刘少贞, 朱玉婷, 赵凌瑞. 17α-甲基睾酮对麦穗鱼性腺组织学的影响[J]. 山西农业大学学报(自然科学版), 2016, 36(2): 147-152.
[6] 农业部畜牧兽医局. 农业部发布动物性食品中兽药最高残留限量[J]. 中国兽药杂志, 2003, 37(3): 5-11.
[7] 陈培基, 李刘冬, 邹琴, 等. 高效液相色谱法测定水产品中甲基睾丸酮残留量的优化研究[J]. 食品科学, 2010, 31(6): 223-226.
[8] 张璇, 蔡友琼, 惠芸华, 等. 超高压液相色谱法测定水产品中甲基睾酮的残留量[J]. 分析试验室, 2014, 33(4): 459-461.
[9] 聂建荣, 朱孟丽, 朱铭立, 等. HPLC-MS/MS快速检测水产品中甲基睾丸酮的研究[J]. 广东农业科学, 2008 (6): 107-109.
[10] 李佩佩, 郭远明, 陈雪昌, 等. 凝胶渗透色谱-超高效液相色谱-串联质谱法测定水产品中甲基睾酮含量[J]. 理化检验-化学分册, 2013, 49(5): 570-576.
[11] 王强, 王旭峰, 黄珂, 等. 酶联免疫吸附法测定水产品中甲基睾酮残留[J]. 现代食品科技, 2015, 31(5): 303-307.
[12] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB/T 22260—2008饲料中甲基睾丸酮的测定—高效液相色谱串联质谱法[S]. 北京:中国标准出版社, 2008.
[13] 安徽省质量技术监督局. DB34/T 1364—2011饲料中甲基睾丸酮的测定—高效液相色谱法[S]. 合肥:安徽省质量技术监督局, 2011.
[14] 聂建荣, 李大光, 邓香连, 等. LC-MS/MS法同时测定动物源性食品中甲基睾丸酮和己烯雌酚的方法研究[J]. 中国兽药杂志, 2009, 43(4): 20-24.
[15] 祝璟琳, 杨弘, 肖炜, 等. 超高效液相色谱—串联质谱联用测定罗非鱼肌肉中甲基睾丸酮残留[J]. 食品科学, 2011, 32(22): 243-247.
Rapiddetermination of methyltestosterone in feed by ultra-performance liquidchromatography-tandem mass spectrometry
YANG Jinlan1, CHEN Jun1*, CHEN Chengtong1, GUAN Xin1, LIU Xiufen1, CHEN Jiaxun2
(1.Guangzhou Environmental Monitoring Center of Ocean and Fishery, Guangzhou 510235, China; 2. Guangdong Provincial PublicLaboratory of Analysis and Testing Technology, China National Analytical Center, Guangzhou 510070, China)
Ultra-performance liquid chromato graphy-tandem mass spectrometry (UPLC-MS/MS) analysis method was established for methyltestosterone in feed. It optimized the factors affecting recovery, such as volume fraction of methanol extract, time of extract, selection of solid phase extraction column, concentrated way, mass spectrometry conditions and mobile phase etc. The sample was extracted by 40% methanol aqueous, and was then purified with C18solid phase, and measured by UPLC-MS. The calibration curve was linear with a correlation coefficient of over 0.999 9 within the concentration range of 0.50-10.00 μg/L. The limit of detection was 2.00 μg/kg and the limit of quantitation was 5.00 μg/kg. The method developed in this study is suitable for rapid determination of methyltestosterone residues in large batches of feed. [Chinese Fishery Quality and Standards, 2017, 7(3):38-43]
ultra-performance liquid chromatography-tandem mass spectrometry; feed; methyltestosterone; detection
CHEN Jun, quanjun7391@sina.com
10.3969/j.issn.2095-1833.2017.03.006
2016-12-09;接收日期:2017-01-23
2016年省级渔港建设和渔业发展专项资金项目(2130199)
杨金兰(1986-),女,工程师,研究方向为水产品质量安全研究,527977629@qq.com
陈俊,高级工程师,研究方向为海洋与渔业环境监测及水产品质量安全,quanjun7391@sina.com
S91
A
2095-1833(2017)03-0038-06

