2型糖尿病合并动脉粥样硬化性心血管疾病患者降糖药物应用专家共识
洪天配 母义明 纪立农 郭晓蕙 朱大龙 童南伟 霍勇 谌贻璞 赵冬 焦凯 李全民 李焱 李艳波 李玉秀 刘建英 彭永德 秦映芬 苏青 汤旭磊 向光大 杨刚毅 叶山东 张波
·指南与共识·
2型糖尿病合并动脉粥样硬化性心血管疾病患者降糖药物应用专家共识
洪天配 母义明 纪立农 郭晓蕙 朱大龙 童南伟 霍勇 谌贻璞 赵冬 焦凯 李全民 李焱 李艳波 李玉秀 刘建英 彭永德 秦映芬 苏青 汤旭磊 向光大 杨刚毅 叶山东 张波
动脉粥样硬化性心血管疾病(ASCVD)包括冠心病、缺血性卒中及外周动脉疾病,是2型糖尿病(T2DM)患者致死和致残的主要原因。目前国内外糖尿病防治指南均推荐,对于T2DM患者,必须加强高血糖、高血压、血脂异常、肥胖等多重心血管危险因素的综合管理,以最大限度降低心血管事件和死亡风险。近年来,由于美国FDA的强制性要求,全球已完成或正在开展一系列新型降糖药物的心血管结局研究(CVOT)。已经公布的两项CVOT显示,在伴有心血管疾病或高危因素的T2DM患者中,恩格列净和利拉鲁肽可显著降低心血管事件和死亡风险。因此,本共识建议,对于T2DM合并ASCVD患者,在选择降糖药物时,除关注降糖疗效外,还应特别注意心血管安全性问题;对于血糖控制不佳的这类患者,在二甲双胍等标准治疗的基础上可考虑优先选择具有明确心血管获益证据的降糖药物(如利拉鲁肽或恩格列净)治疗。
糖尿病,2型; 动脉粥样硬化性心血管疾病; 降糖药物
随着经济高速发展、生活方式改变及人口老龄化,我国糖尿病患病率呈快速上升趋势。2007~2008年流行病学调查[1]显示,我国20岁以上成人糖尿病患病率为9.7%。2010年流行病学调查[2]显示,我国18岁以上成人糖尿病患病率为11.6%。在我国糖尿病患者中,90%以上为2型糖尿病(T2DM)[3]。动脉粥样硬化性心血管疾病(ASCVD)包括冠心病、缺血性卒中及外周动脉疾病。T2DM与ASCVD关系密切,两者共存可进一步增加心血管事件和死亡风险,半数以上糖尿病患者的死亡与ASCVD相关[4]。近年来,随着临床研究证据的不断积累和更新,关于降糖药物与T2DM患者心血管结局之间的关系也日益明确。因此,合理规范应用降糖药物对于T2DM合并ASCVD患者显得尤为重要。
为了指导我国临床医师对T2DM合并ASCVD患者进行规范化管理,并且充分了解T2DM合并ASCVD患者的综合管理策略、降糖治疗原则、血糖控制目标及常用降糖药物合理应用,由我国内分泌科、心内科、肾内科及临床流行病学专家联合制定了本共识。
1 T2DM合并ASCVD的流行病学
2006年中国心脏调查[5]发现,52.9%的冠心病住院患者合并糖尿病。另一方面,在全国三甲医院住院T2DM患者中,17.1%合并心血管疾病,13.2%合并脑血管疾病[6]。在我国大型城市住院T2DM患者中,25.1%合并冠心病,17.3%合并脑血管疾病[7]。中国“3B”研究[8]显示,在门诊就诊的T2DM患者中,14.6%合并心血管疾病,10.1%合并包括缺血性卒中在内的脑血管疾病。上述研究数据表明,我国T2DM患者合并ASCVD的情况非常普遍,已日益成为糖尿病管理的一个巨大挑战,值得临床医生给予高度重视。
2 T2DM患者中ASCVD危险因素的综合管理
除高血糖外,T2DM患者往往合并有高血压、血脂异常、肥胖等多重心血管危险因素。因此,对于大多数T2DM患者,特别是合并ASCVD的患者,应采取综合管理策略,在控制血糖的同时,全面管理好各种心血管危险因素,具体措施包括生活方式干预、降压、调脂、抗血小板治疗、减重等,以期最大程度降低心血管事件和死亡风险。
2.1 生活方式干预
对于所有T2DM合并ASCVD患者,生活方式干预应作为综合管理策略的基础性措施,并贯穿于综合治疗的全过程。生活方式干预包括健康教育、戒烟限酒、限盐(<6 g/d)、合理饮食、规律运动、注意保持心理平衡等。
2.2 降压治疗
高血压与高血糖并存可使ASCVD发生和发展风险显著增加,从而增加T2DM患者的病死率。研究显示,控制高血压可显著降低ASCVD发生和发展的风险,降压治疗的心血管获益主要源自血压控制本身。因此,对于大多数T2DM合并高血压患者,血压控制目标为<140/80 mmHg;对于年轻、没有并发症、合并白蛋白尿或糖尿病慢性肾脏病(CKD)患者,可将收缩压控制在<130 mmHg[3, 9]。选择降压药物时,应综合考虑疗效、心肾保护作用、安全性、依从性、对代谢的影响等因素。大多数患者需要至少两种不同作用机制的降压药物的联合治疗。
2.3 调脂治疗
T2DM患者通常合并多项血脂异常,主要表现为TG升高、LDL-C升高及HDL-C降低,三者均与T2DM患者ASCVD发生风险增高相关。T2DM合并ASCVD患者属于极高危人群,调脂治疗的首要干预靶点LDL-C目标值为<1.8 mmol/L,次要干预靶点非HDL-C目标值为<2.6 mmol/L。为了达到上述目标,应首选他汀类药物。经他汀类治疗后,如非HDL-C仍不能达到目标值,可在他汀类基础上加用贝特类、高纯度鱼油制剂。对于严重高TG血症(空腹TG≥5.7 mmol/L)患者,应首先考虑使用贝特类、高纯度鱼油制剂或烟酸类药物治疗,以预防急性胰腺炎的发生[10]。
2.4 抗血小板治疗
T2DM患者的高凝血状态是发生心血管事件的重要原因之一。在ASCVD或伴有心血管高危因素的患者中,阿司匹林可有效预防卒中、心肌梗死等心脑血管事件。对于T2DM合并ASCVD患者,应常规使用阿司匹林作为二级预防措施,最佳剂量为75~150 mg/d;对于阿司匹林过敏或不耐受的患者,可考虑使用氯吡格雷(75 mg/d)作为替代治疗。对于急性冠状动脉综合征(ACS)患者,可使用阿司匹林和氯吡格雷双联抗血小板治疗1年[3, 11]。
2.5 体重管理
超重或肥胖、腹型肥胖可增加胰岛素抵抗(IR),使ASCVD发生风险显著增加。体重控制目标包括体重指数(BMI)<24 kg/m2和腰围(WC)达标(男性<90 cm,女性<85 cm)。不同降糖药对体重和内脏脂肪的影响存在差异,胰岛素、磺脲类药物(SUs)及噻唑烷二酮类(TZDs)可导致体重增加;二甲双胍可减轻体重,对内脏脂肪的影响尚不明确;胰升糖素样肽1(GLP-1)受体激动剂和钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂既可减轻体重,又可减少内脏脂肪。因此,对于合并超重或肥胖(尤其是腹型肥胖)的T2DM患者,应优先考虑使用兼具减轻体重和减少内脏脂肪的降糖药物[12]。
2.6 血糖管理
糖尿病是ASCVD的独立危险因素,不同类型的高血糖状态,包括空腹血糖(FPG)、餐后血糖(PPG)以及HbA1c的升高,均是ASCVD的危险因素。因此,血糖管理是T2DM合并ASCVD患者综合管理策略中的重要组成部分,以下将对此进行详细阐述。
3 T2DM合并ASCVD患者的血糖管理策略和控制目标
对于T2DM合并ASCVD患者,血糖管理的总原则是必须兼顾降糖有效性和心血管安全性,并且优先考虑选择具有心血管获益证据的降糖药物。英国糖尿病前瞻性研究(UKPDS)及其后续的10年随访研究[13-14]显示,在新诊断的T2DM患者中,严格血糖控制(HbA1c<7.0%)对降低心血管事件的远期风险非常重要。然而,退伍军人糖尿病研究(VADT)[15]、控制糖尿病患者心血管风险行动研究(ACCORD)[16]、糖尿病与血管疾病行动研究(ADVANCE)[17]等随机对照临床试验(RCTs)均显示,在年龄较大、病程较长或合并ASCVD的T2DM患者中,强化降糖治疗并不能显著降低心血管事件风险。此外,对于合并ASCVD的T2DM患者,一旦发生低血糖还可能诱发心律失常、心肌梗死、卒中、猝死等。因此,对于这类患者而言,降糖治疗的安全性可能比降糖疗效更为重要,应尽量在避免低血糖的前提下使血糖控制达标。
本共识建议,T2DM合并ASCVD患者的血糖控制目标应该遵循个体化原则,综合考虑患者的年龄、糖尿病病程、ASCVD病史、其他并发症或合并症、低血糖风险等因素,充分平衡严格血糖控制的利弊得失。基于现有的循证医学证据,本共识推荐T2DM合并ASCVD患者的血糖控制目标如下:
(1)对于大多数患者,HbA1c目标应控制在<7.0%。
(2)对于年龄较大、糖尿病病程较长、存在低血糖高危因素的患者,HbA1c目标应控制在<7.5%或<8.0%。
(3)对于慢性疾病终末期患者,如纽约心脏学会(NYHA)心功能Ⅲ-Ⅳ级、终末期肾病、恶性肿瘤伴有转移、中重度认知功能障碍等,HbA1c控制目标可适当放宽至<8.5%。
4 T2DM合并ASCVD患者的降糖药物治疗
4.1 降糖药物的心血管安全性评价
2008年,美国食品药品监督管理局(FDA)发布了强制性指导意见,要求所有新批准上市的降糖药都必须进行心血管安全性评估。根据这一要求,目前全球已开展了一系列新型降糖药物的心血管结局研究(CVOT)。传统降糖药物由于不受这条强制性要求的制约,故缺少CVOT证据,其心血管安全性评估通常基于针对降糖治疗策略的大型RCT数据或基于针对降糖疗效的多项RCTs的荟萃分析结果。根据目前已有的CVOT证据(表1),本共识将降糖药物的心血管安全性分为获益、中性及其他3大类。
4.1.1 具有心血管获益证据的降糖药物 目前明确具有心血管获益的降糖药物包括二甲双胍、恩格列净及利拉鲁肽。二甲双胍是T2DM降糖治疗的一线药物,其心血管安全性证据来自UKPDS及其后续的10年随访研究[13-14]。UKPDS 研究纳入1704例合并超重或肥胖的新诊断T2DM患者,随机分为给予传统治疗(饮食控制为主,n=411)、二甲双胍强化降糖治疗(n=342)或其他药物(SUs或胰岛素)强化降糖治疗(n=951),中位随访时间为10.7年。结果显示,与传统治疗相比,二甲双胍可显著降低心血管事件风险,其中心肌梗死风险下降39%(P=0.010),心血管事件复合终点(心肌梗死、猝死、心绞痛、卒中或周围血管疾病)风险下降30%(P=0.020);二甲双胍与其他药物的两种强化降糖治疗MACE,主要心血管不良事件,3个终点MACE包括心血管死亡、非致死性心肌梗死或卒中;ACS,急性冠脉综合征。
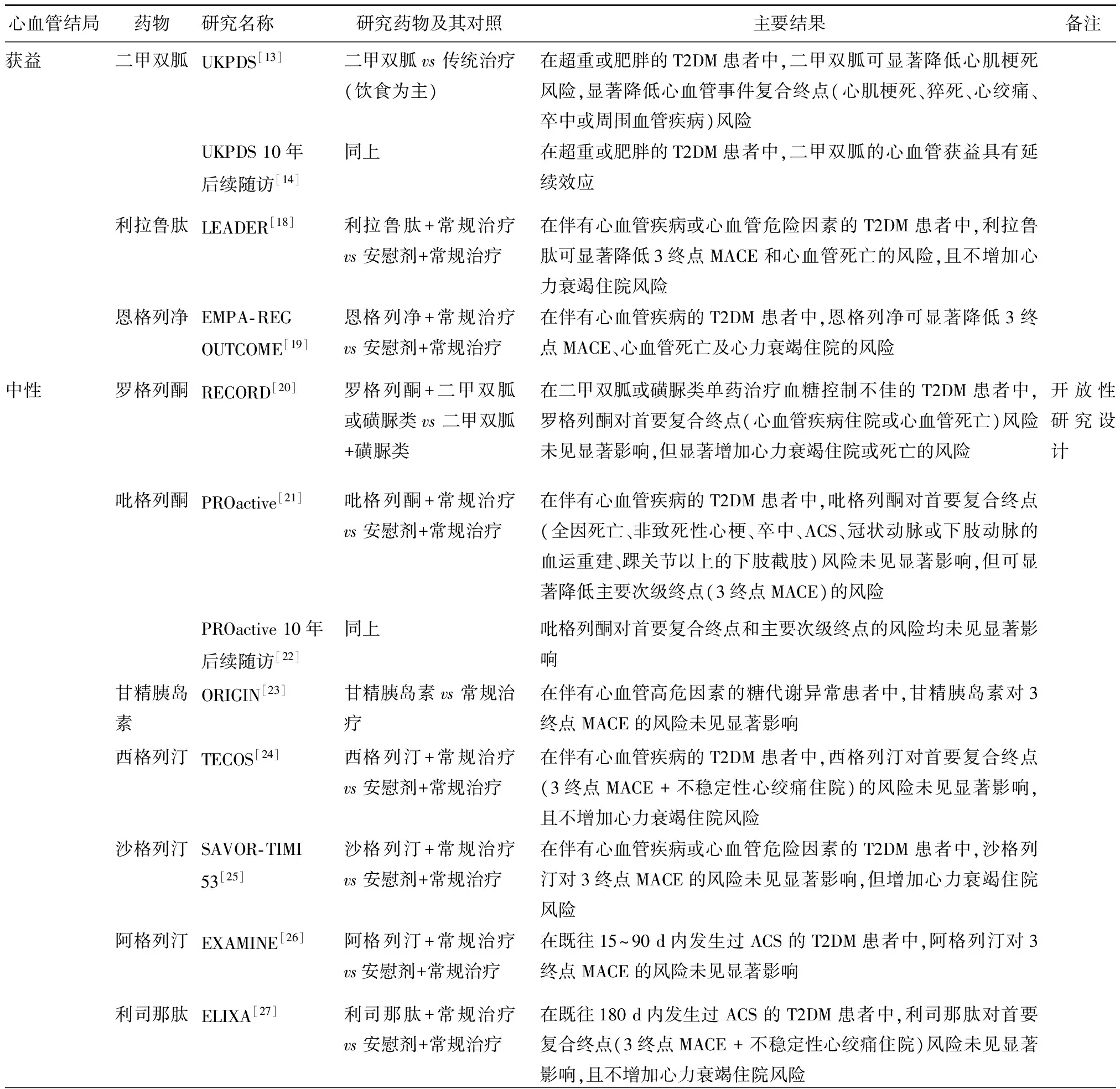
表1 T2DM患者降糖药物治疗的心血管结局研究
方案之间相比,心血管事件风险差异无统计学意义[13]。UKPDS研究结束后继续随访10年仍发现,二甲双胍的心血管获益具有延续效应,与传统治疗相比,其心肌梗死风险下降33%(P=0.005)[14]。
SGLT-2抑制剂恩格列净是第一个通过CVOT证实具有明确心血管获益的新型降糖药物,但目前尚未在我国上市。恩格列净心血管事件结局(EMPA-REG OUTCOME)研究[19]纳入7020例伴有心血管疾病的T2DM患者,中位随访时间为3.1年。结果显示,在常规治疗基础上,与安慰剂相比,恩格列净可显著降低3终点的主要心血管不良事件(3终点MACE,包括心血管死亡、非致死性心肌梗死或非致死性卒中)风险14%(P=0.04),降低心血管死亡风险38%(P<0.001),降低心力衰竭住院风险35%(P=0.002)。
GLP-1受体激动剂利拉鲁肽是目前在中国上市的降糖药物中唯一被CVOT证实具有心血管获益的降糖药物。利拉鲁肽在糖尿病患者中的心血管结局评估(LEADER)研究[18]纳入9340例伴有心血管疾病或心血管危险因素的T2DM患者,其中81.3%的患者既往有心血管病史(包括心肌梗死、卒中或短暂性脑缺血发作、曾行血运重建术、冠状动脉或颈动脉或下肢动脉狭窄≥50%),中位随访时间为3.8年。结果显示,在常规治疗基础上,与安慰剂相比,利拉鲁肽可使3终点MACE风险降低13%(P<0.001),心血管死亡风险降低22%(P=0.007),扩展的心血管事件复合终点(心血管死亡、非致死性心肌梗死、非致死性卒中、血运重建、不稳定性心绞痛住院或心力衰竭住院)风险降低12%(P=0.005),且不增加心力衰竭住院风险。
EMPA-REG OUTCOME和LEADER均为大型、多中心、随机、双盲、安慰剂对照的CVOT,这两项研究分别为恩格列净和利拉鲁肽的心血管保护作用提供了可靠证据,对于T2DM合并ASCVD患者的降糖治疗策略制定具有里程碑意义。
4.1.2 具有心血管效应为中性证据的降糖药物 在T2DM患者中,CVOT证实心血管效应为中性的降糖药物包括罗格列酮、吡格列酮、甘精胰岛素、西格列汀、沙格列汀、阿格列汀及利司那肽。
评估罗格列酮对糖尿病患者心血管结局和血糖控制影响(RECORD)研究[20]是一项开放标签的RCT研究,4447例二甲双胍或SUs单药治疗血糖控制不佳的T2DM患者随机分为两组:在原有治疗基础上联合罗格列酮,或在原有治疗基础上联合SUs或双胍类,平均随访时间为5.5年。结果显示,与二甲双胍联合SUs治疗组相比,罗格列酮联合二甲双胍或SUs组的首要心血管终点事件(心血管疾病住院或心血管死亡)风险达到非劣效性标准(HR为0.99,95%CI为0.85~1.16);心力衰竭住院或死亡的相对风险显著增加(HR2.10, 95%CI1.35~3.27)。
吡格列酮对大血管事件影响的前瞻性临床试验(PROactive)[21]是一项随机、双盲、安慰剂对照的临床研究,在5238例伴有心血管疾病的T2DM患者中评估吡格列酮的心血管安全性。受试者在常规治疗基础上联合吡格列酮或安慰剂治疗,平均随访时间为34.5个月。结果显示,与安慰剂组相比,吡格列酮组的首要复合事件终点(全因死亡、非致死性心肌梗死、卒中、ACS、冠状动脉或下肢动脉的血运重建、踝关节以上的下肢截肢)风险差异无统计学意义(HR0.90, 95%CI0.80~1.02,P=0.095),主要次级终点(全因死亡、非致死性心肌梗死或卒中)相对风险下降16%(P=0.027)。PROactive研究结束后继续随访7.8年发现,两组间在首要终点和主要次级终点方面比较,差异均无统计学意义[22]。
甘精胰岛素初始干预转归(ORIGIN)研究[23]采用随机、双盲、2×2析因设计,纳入12537例有心血管高危因素的IFG、IGT或T2DM患者,随机分为甘精胰岛素或常规治疗,中位随访时间为6.2年。结果显示,与常规治疗组相比,甘精胰岛素治疗组3终点MACE的风险差异无统计学意义(HR1.02, 95%CI0.94~1.11,P=0.63)。
在二肽基肽酶4(DPP-4)抑制剂中进行的3项随机、双盲、安慰剂对照的CVOT均显示,DPP-4抑制剂既不增加也不降低心血管事件发生风险。评估T2DM患者中西格列汀心血管安全性(TECOS)研究[24]纳入14671例有心血管病史的T2DM患者,中位随访时间为3年。结果显示,在常规降糖治疗基础上,与安慰剂组相比,西格列汀组首要心血管事件复合终点(3终点MACE + 不稳定型心绞痛住院)的风险达到非劣效性标准(HR0.98, 95%CI0.88~1.09),且不增加心力衰竭住院风险。评价沙格列汀在糖尿病患者中的心血管结局(SAVOR-TIMI53)研究[25]纳入16492例伴有心血管疾病或心血管危险因素的T2DM患者,中位随访时间为2.1年。结果显示,在常规降糖治疗基础上,与安慰剂组相比,沙格列汀组3终点MACE的风险达到非劣效性标准(HR1.00, 95%CI0.89~1.12),但心力衰竭住院相对风险增加27%(P=0.007)。阿格列汀与标准治疗在T2DM合并ACS患者中心血管结局比较(EXAMINE)研究[26]在5380例既往15~90 d内发生过ACS的T2DM患者中评估阿格列汀的心血管安全性,中位随访时间为18个月。结果显示,在常规降糖治疗基础上,与安慰剂组相比,阿格列汀组3终点MACE的风险达到非劣效性标准(HR0.96, 单侧重复CI上限 1.16)。
利司那肽治疗T2DM合并ACS患者的心血管事件评估(ELIXA)研究[27]是一项随机、双盲、安慰剂对照的临床试验,纳入6068例在既往180 d内发生过ACS的T2DM患者,中位随访时间为25个月。结果显示,在常规降糖治疗基础上,与安慰剂组相比,利司那肽组首要心血管事件复合终点(3终点MACE+不稳定性心绞痛住院)的风险达到非劣效性标准(HR1.02, 95%CI0.89~1.17),且不增加心力衰竭住院风险。
上述研究数据表明,罗格列酮、吡格列酮、甘精胰岛素、西格列汀、沙格列汀、阿格列汀及利司那肽的心血管效应为中性,既不增加也不降低心血管事件发生风险。
4.1.3 其他降糖药物 (1)目前缺少在T2DM患者中评估心血管安全性的CVOT证据的降糖药物。对于那些未进行CVOT的传统降糖药物而言,其心血管安全性证据主要源自针对降糖治疗策略的RCT研究数据或基于针对降糖疗效的多项RCTs的荟萃分析结果,这些药物包括SUs、格列奈类、维格列汀及大部分胰岛素制剂。
47项RCTs研究的荟萃分析[28]显示,与安慰剂或活性对照药相比,SUs不增加T2DM患者全因死亡、心血管死亡、心肌梗死及卒中的风险。
那格列奈和缬沙坦在IGT人群中的结局研究(NAVIGATOR)[29]显示,在有心血管事件病史或心血管危险因素的IGT患者中,与安慰剂相比,那格列奈治疗5年后,首要心血管事件复合终点(3终点MACE + 心力衰竭住院)风险差异无统计学意义(HR0.94, 95%CI0.82~1.09,P=0.43)。
25项Ⅲ期临床试验的荟萃分析[30]显示,与安慰剂或活性对照药相比,维格列汀不增加T2DM患者心脑血管事件风险,其中50 mg/d组的相对风险为0.88(95%CI 0.37~2.11)、100 mg/d组的相对风险为0.84(95%CI0.62~1.14)。
T2DM心血管结局(HEART2D)研究[31]显示,在急性心肌梗死后的T2DM患者中,餐时胰岛素或基础胰岛素治疗2.7年后,首要心血管事件复合终点(3终点MACE + 冠状动脉血运重建或ACS住院)的风险相似(HR0.98, 95%CI0.88~1.21)。事后亚组分析[32]提示,在年龄>65.7岁亚组中,与基础胰岛素组相比,餐时胰岛素组首次心血管事件的发生风险更低(HR0.69, 95%CI0.49~0.96),表现为发生比例更低、时间更晚。
(2)CVOT尚在进行中的降糖药物。目前,正在进行CVOT的降糖药物包括阿卡波糖、利格列汀、艾塞那肽(周制剂)、度拉唐肽、阿必鲁肽、达格列净、坎格列净及德谷胰岛素。
4.2 降糖药物的用药原则
降糖治疗的目标不仅仅是单纯控制血糖,更重要的是减少糖尿病并发症(特别是心血管事件)、降低死亡风险,从而改善患者的远期预后。生活方式干预是T2DM患者降糖治疗的基础性措施,应贯穿于降糖治疗的始终。如果单纯生活方式干预不能使血糖控制达标,应开始药物治疗。对于合并ASCVD的T2DM患者,尤应注意心血管安全性问题,并且优先考虑选择具有心血管获益证据的降糖药物。
4.2.1 一线治疗 大多数国内外指南均推荐二甲双胍作为T2DM患者单药治疗的一线首选药物和联合治疗的基本用药,如无禁忌证且能够耐受,二甲双胍应一直保留在T2DM患者的降糖治疗方案中。若存在禁忌证或无法耐受,建议视患者的具体情况考虑选择具有心血管保护或中性的降糖药物。
4.2.2 联合治疗 若一线降糖药物单药治疗3个月不能使血糖控制达标,需考虑两种降糖药物联合治疗。根据患者的不同情况,选择个体化的联合用药方案。对于T2DM合并ASCVD患者,可优先考虑联合具有明确心血管获益证据的降糖药物(如利拉鲁肽或恩格列净)治疗,以最大限度降低患者心血管事件和死亡的风险。
若两种降糖药物联合治疗3个月不能使患者血糖控制达标,可考虑联合第3种降糖药物或者联合胰岛素治疗。
4.3 降糖治疗的药物选择
4.3.1 非胰岛素降糖药 表2总结了常用非胰岛素降糖药的作用机制、使用方法、降糖疗效、低血糖风险、对体重的影响、注意事项等主要信息[3, 33-36]。
4.3.2 胰岛素 表3总结了常用胰岛素的作用特点和注意事项[3]。
4.4 其他特殊情况
4.4.1 ASCVD急性期 对于处在ASCVD急性期(如ACS、缺血性卒中急性期、冠状动脉血运重建围手术期等)的T2DM患者,其降糖治疗方案需要充分考虑疾病特点、机体应激状况以及严格降糖治疗的获益/风险比。对于合并ACS的患者,若血糖>10.0 mmol/L,可采用以胰岛素为基础的降糖治疗方案,使血糖水平控制在7.8~10.0 mmol/L,同时注意避免发生低血糖[37]。对于接受经皮冠状动脉介入治疗(PCI)的患者,使用对比剂前可以不停用二甲双胍,但应密切监测肾功能,造影后应连续两日检验血清肌酐(Scr),若Scr值比造影前上升26.5 μmol/L,则应考虑对比剂肾病发生[38],应立即停用二甲双胍,直至肾功能恢复至基础水平,方可重新开始二甲双胍治疗[37]。目前尚无充分的证据提示,不同降糖药物对接受PCI治疗患者的预后存在不同的影响[9]。对于接受冠状动脉旁路移植术(CABG)的患者,围手术期不推荐口服降糖药,应使用胰岛素治疗[37]。

表2 常用非胰岛素降糖药的主要特点和注意事项
表中主要信息来自药品说明书,HbA1c降幅来自参考文献;DPP-4,二肽基肽酶4;GLP-1,胰升糖素样肽-1;SGLT-2,钠-葡萄糖协同转运蛋白2
4.4.2 心力衰竭 T2DM和ASCVD患者常合并心力衰竭。对于合并心力衰竭的T2DM患者,制定降糖治疗方案时,应关注某些降糖药物对心力衰竭的潜在不良影响。
二甲双胍:在定期检查心、肾功能的情况下,稳定期的慢性心力衰竭患者可以服用二甲双胍,但因存在乳酸性酸中毒的潜在风险,急性、病情不稳定或住院的心力衰竭患者禁用[11]。
TZDs:可引起水钠潴留和血容量扩张,诱发或加重心力衰竭,故急性心力衰竭、NYHA心功能Ⅱ~Ⅳ级的慢性心力衰竭患者禁用。
DPP-4抑制剂:SAVOR-TIMI 53研究[25]显示,对于伴有心血管事件病史或心血管危险因素的T2DM患者,沙格列汀可增加心力衰竭住院风险。EXAMINE研究事后分析[39]显示,对于无心力衰竭病史、近期发生过ACS的T2DM患者,阿格列汀增加心力衰竭住院风险(HR1.76,P=0.026)。2015年4月,美国FDA对沙格列汀和阿格列汀提出警示,要求在说明书中增加对心力衰竭风险的标示。TECOS研究[24]显示,在有心血管病史的T2DM患者中,西格列汀不增加心力衰竭住院风险。维格列汀的相关研究证据尚不充分。
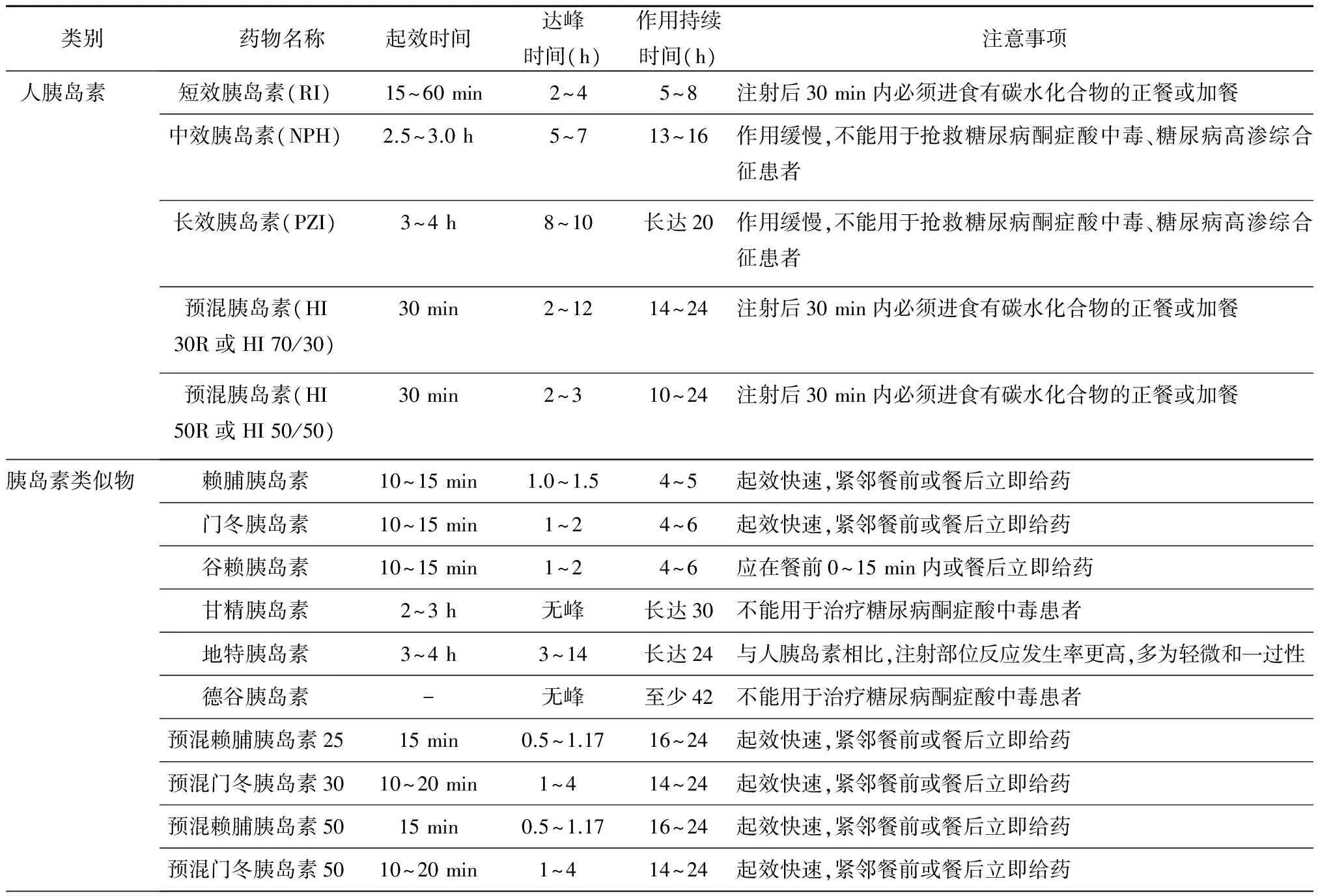
表3 常用胰岛素的主要特点和注意事项
表中注意事项来自药品说明书,其余信息改编自《中国2型糖尿病防治指南(2013年版)》附录5[3];德谷胰岛素尚未在中国上市,其信息源自美国FDA药品说明书
GLP-1受体激动剂:LEADER和ELIXA研究[18, 27]显示,在心血管事件高危的T2DM患者中,利拉鲁肽和利司那肽治疗不增加心力衰竭住院风险。
SGLT-2抑制剂:EMPA-REG OUTCOME研究[19]显示,在伴有心血管疾病的T2DM患者中,恩格列净可降低心力衰竭住院风险。
胰岛素:胰岛素治疗不增加心力衰竭患者的死亡风险[40]。ORIGIN研究[23]显示,在有心血管高危因素的糖代谢异常患者中,与二甲双胍或SUs相比,甘精胰岛素治疗不增加心力衰竭住院风险。
其他降糖药物在心力衰竭患者中应用的安全性尚待进一步评估。
4.4.3 低血糖 低血糖对心血管系统具有显著的不良影响,其短期风险包括诱发心律失常、心血管事件,长期风险为认知障碍和痴呆,严重低血糖甚至可导致患者猝死[4, 41]。因此,对于合并ASCVD的T2DM患者,在降糖治疗过程中尤其应尽量避免出现低血糖。
胰岛素和胰岛素促泌剂均可引起低血糖,与SUs相比,格列奈类药物的低血糖风险相对较低。二甲双胍、α-糖苷酶抑制剂、TZDs、GLP-1受体激动剂、DPP-4抑制剂以及SGLT-2抑制剂单独使用时通常不会导致低血糖。在接受降糖治疗的患者中,一旦发生低血糖,应迅速补充葡萄糖或含糖食物,以使血糖水平恢复正常,并及时调整降糖治疗方案。
4.4.4 肾功能不全 T2DM和ASCVD患者常合并CKD。当患者存在肾功能不全[eGFR<60 ml/(min·1.73 m2)]时,大多数非胰岛素降糖药物的药代动力学会发生改变。因此,对于合并CKD的患者,降糖药物的选择应基于药物的药代动力学特征和患者肾功能状态进行综合判断,以确保在有效降糖的同时不增加低血糖风险,并避免诱发乳酸性酸中毒[42]。
瑞格列奈和利格列汀在CKD 1~5期全程均可使用,且无需调整剂量。其他非胰岛素降糖药的使用均可因肾功能不全的不同程度而受到一定的影响[42]。二甲双胍在CKD 3a期[eGFR 45~59 ml/(min·1.73 m2)]时应减量,在CKD 3b期[eGFR 30~45 ml/(min·1.73 m2)]时证据相对有限,谨慎观察下减量使用,在CKD 4期[eGFR<30 ml/(min·1.73 m2)]时禁用[11]。基于LEADER研究[18]和LIRA-RENAL研究[43]的数据,推荐利拉鲁肽可用于CKD 1~3期,从CKD 4期开始禁用。根据美国FDA批准的药品说明书,恩格列净可用于CKD 1~3a期,从3b期开始不推荐使用。
在CVOT中,包括肾脏不良事件在内的微血管事件通常作为研究的次要终点。在LEADER研究[18]中,24.7%的患者基线时合并CKD 3期或以上,利拉鲁肽可使肾脏事件复合终点(包括新发大量蛋白尿、Scr倍增、终末期肾病或肾病导致的死亡)的风险显著降低22%(P=0.003)。在EMPA-REG OUTCOME研究[19]中,25.9%的患者基线时伴有CKD 3期,恩格列净可使肾脏事件复合终点(Scr倍增、起始肾脏替代治疗或因肾病死亡)的风险显著降低46%(P<0.001)。
2016年6月,美国FDA修改坎格列净和达格列净的药物说明书,新增急性肾损伤风险的标签警示信息,建议处方这两种药物之前全面考虑增加急性肾损伤风险的各种因素,并在服药期间监测肾功能的动态变化。
表4总结了T2DM合并ASCVD患者降糖药物使用应着重关注的主要安全性问题,其中包括药物的心血管效应、低血糖风险、对体重的影响、在心力衰竭或肝肾功能不全等特殊患者中应用的注意事项。

5 结语与展望
对于T2DM合并ASCVD患者,应采取综合管理策略,全面控制高血糖、高血压、血脂异常、超重或肥胖等多重心血管危险因素。在血糖管理方面,临床医师应充分考虑降糖药物的疗效与安全性之间的平衡,并且全面了解常用降糖药物的心血管安全性,这样才能熟练掌握其应用原则。
随着CVOT的广泛开展,其研究结果将陆续公布。最新公布的SUSTAIN-6研究显示,新型长效GLP-1受体激动剂索马鲁肽(semaglutide,尚未被批准上市)同样也可显著降低心血管事件风险[44]。因此,有理由相信未来将会出现越来越多可为T2DM患者带来心血管保护作用的降糖药物,这将推动T2DM(特别是合并ASCVD)患者的治疗策略和理念发生巨大的变革。
[1] Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China. N Engl J Med, 2010, 362: 1090-1101.
[2] Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults. JAMA, 2013, 310: 948-959.
[3] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版). 中华糖尿病杂志, 2014, 22: S2-S42.
[4] Task Force Members, Rydén L, Grant PJ, et al. ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: the Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). Eur Heart J, 2013, 34: 3035-3087.
[5] Hu DY, Pan CY, Yu JM, et al. The relationship between coronary artery disease and abnormal glucose regulation in China: the China Heart Survey. Eur Heart J, 2006, 27: 2573-2579.
[6] 中华医学会糖尿病学分会糖尿病慢性并发症调查组. 全国住院糖尿病患者慢性并发症及其相关危险因素10年回顾性调查分析. 中国糖尿病杂志, 2003, 11: 232-237.
[7] 张斌, 向红丁, 毛微波, 等. 北京、上海、天津、重庆四城市住院2型糖尿病患者糖尿病慢性并发症及相关大血管疾病的流行病学分析. 中国医学科学院学报, 2002, 24: 452-456.
[8] Ji L, Hu D, Pan C, et al. Primacy of the 3B approach to control risk factors for cardiovascular disease in type 2 diabetes patients. Am J Med, 2013, 126: 925.e11- e 22.
[9] 中华医学会心血管病学分会流行病学组, 中国医师协会心血管内科医师分会, 中国老年学学会心脑血管病专业委员会.糖代谢异常与动脉粥样硬化性心血管疾病临床诊断和治疗指南. 中华心血管病杂志, 2015, 43: 488-506.
[10] 中国成人血脂异常防治指南修订联合委员会. 中国成人血脂异常防治指南(2016年修订版). 中国循环杂志, 2016, 31: 937-953.
[11] American Diabetes Association. Standards of medical care in diabetes-2017. Diabetes Care, 2017, 40(Suppl 1): S1-S135.
[12] 中华医学会内分泌学分会. 中国2型糖尿病合并肥胖综合管理专家共识. 中华内分泌代谢杂志, 2016, 32: 623-627.
[13] UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet, 1998, 352: 854-865.
[14] Holman RR, Paul SK, Bethel MA, et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med, 2008, 359: 1577-1589.
[15] Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med, 2009, 360:129-139.
[16] The Action to Control Cardiovascular Risk in Diabetes Study Group. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med, 2008, 358: 2545-2559.
[17] ADVANCE Collaborative Group, Patel A, MacMahon S, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med, 2008, 358: 2560-2572.
[18] Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med, 2016, 375: 311-322.
[19] Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med, 2015, 373: 2117-2128.
[20] Home PD, Pocock SJ, Beck-Nielsen H, et al. Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomised, open-label trial. Lancet, 2009, 373:2125-2135.
[21] Dormandy JA, Charbonnel B, Eckland DJ, et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet, 2005, 366: 1279-1289.
[22] Erdmann E, Harding S, Lam H, et al. Ten-year observational follow-up of PROactive: a randomized cardiovascular outcomes trial evaluating pioglitazone in type 2 diabetes. 2016, 18:266-273.
[23] The ORIGIN Trial Investigators. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med, 2012, 367:319-328.
[24] Green JB, Bethel MA, Armstrong PW, et al. Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes. N Engl J Med, 2015, 373:232-242.
[25] Scirica BM, Bhatt DL, Braunwald E, et al. Saxagliptin and cardiovascular outcomesin patients with type 2 diabetes mellitus. N Engl J Med, 2013, 369:1317-1326.
[26] White WB, Cannon CP, Heller SR, et al. Alogliptin after acute coronary syndromein patients with type 2 diabetes. N Engl J Med, 2013, 369:1327-1335.
[27] Pfeffer MA, Claggett B, Diaz R, et al. Lixisenatide in patients with type 2 diabetes and acute coronary syndrome. N Engl J Med, 2015, 373:2247-2257.
[28] Varvaki Rados D, Catani Pinto L, Reck Remonti L, et al. The association between sulfonylurea use and all-cause and cardiovascular mortality: A meta-analysis with trial sequential analysis of randomized clinical trials. PLoS Med, 2016, 13:e1001992.
[29] Group NS, Holman RR, Haffner SM, et al. Effect of nateglinide on the incidence of diabetes and cardiovascular events. N Engl J Med, 2010, 362: 1463-1476.
[30] Schweizer A, Dejager S, Foley JE, et al. Assessing the cardio-cerebrovascular safety of vildagliptin: meta-analysis of adjudicated events from a large phase III type 2 diabetes population. Diabetes Obes Metab, 2010, 12:485-494.
[31] Raz I, Wilson PW, Strojek K, et al. Effects of prandial versus fasting glycemia on cardiovascular outcomes in type 2 diabetes: the HEART2D trial. Diabetes Care, 2009, 32:381-386.
[32] Raz I, Ceriello A, Wilson PW, et al. Post hoc subgroup analysis of the HEART2D trial demonstrates lower cardiovascular risk in older patients targeting postprandial versus fasting/premeal glycemia. Diabetes Care, 2011, 34:1511-1513.
[33] van de Laar FA, Lucassen PL, Akkermans RP, et al. Alpha-glucosidase inhibitors for patients with type 2 diabetes: results from a Cochrane systematic review and meta-analysis. Diabetes Care, 2005, 28: 154-163.
[34] Cai X, Gao X, Yang W, et al. DPP-4 inhibitor treatment in Chinese type 2 diabetes patients: A meta-analysis. Diabetes Technol Ther, 2016, 18: 784-793.
[35] Kim YG, Hahn S, Oh TJ, et al. Differences in the HbA1c-lowering efficacy of glucagon-like peptide-1 analogues between Asians and non-Asians: a systematic review and meta-analysis. Diabetes Obes Metab, 2014, 16: 900-909.
[36] Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care, 2015, 38:140-149.
[37] 高颖, 杨光燃, 周迎生, 等. 心血管疾病合并糖尿病口服降糖药物应用专家共识. 中华内科杂志, 2014, 53: 833-838.
[38] KDIGO. Section 2: AKI Definition. Kidney Int Suppl (2011), 2012, 2: 19-36.
[39] Zannad F, Cannon CP, Cushman WC, et al. Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE: a multicentre, randomised, double-blind trial. Lancet, 2015, 385:2067-2076.
[40] Masoudi FA, Inzucchi SE, Wang Y, et al. Thiazolidinediones, metformin, and outcomes in older patients with diabetes and heart failure: an observational study. Circulation, 2005, 111: 583-590.
[41] Frier BM, Schernthaner G, Heller SR. Hypoglycemia and cardiovascular risk. Diabetes Care, 2011, 34(Suppl 2): S132-S137.
[42] 洪天配, 郭晓蕙. 2型糖尿病合并慢性肾脏病患者口服降糖药治疗的新进展. 2016, 24: 769-772.
[43] Davies MJ, Bain SC, Atkin SL, et al. Efficacy and safety of liraglutide versus placebo as add-on to glucose-lowering therapy in patients with type 2 diabetes and moderate renal impairment (LIRA-RENAL): A randomized clinical trial. Diabetes Care, 2016, 39: 222-230.
[44] Marso SP, Bain SC, Consoli A, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med, 375: 1834-1844.
来源:中国糖尿病杂志,2017,25(6):481-492.
Chinese expert consensus on anti-diabetic agents in treating patients with type 2 diabetes and atherosclerotic cardiovascular disease
HONGTian-pei,MUYi-ming,JILi-nong,etal.
DepartmentofEndocrinology,PekingUniversityThirdHospital,Beijing100191,China
Correspondingauthor:HONGTian-pei,E-mail:tpho66@bjmu.edu.cn
【Summary】 Atherosclerotic cardiovascular disease (ASCVD), defined as coronary heart disease, cerebral ischemic stroke and peripheral arterial disease presumed to be of atherosclerotic origin, is the leading cause of morbidity and mortality in patients with type 2 diabetes mellitus (T2DM). In the national and international guidelines for T2DM, it has been recommended that multiple cardiovascular risk factors, including hyperglycemia, hypertension, dyslipidemia and obesity, should be controlled simultaneously to reduce the risk of cardiovascular events and mortality. In responding to the FDA regulations, many cardiovascular outcome trials (CVOT) of novel anti-diabetic agents have been completed or are ongoing. Two recently published CVOTs show that liraglutide and empagliflozin significantly reduce the risk of major adverse cardiovascular events (MACE) in T2DM patients with a history of or at high risk for cardiovascular diseases. Therefore, it is recommended that cardiovascular effects should be considered when choosing anti-diabetic agents in patients with T2DM and ASCVD. The anti-diabetic agents whose cardiovascular benefits have been shown (eg. liraglutide and empagliflozin) should be prioritized as an add-on therapy in these patients with inadequate glycemic control on standard glucose-lowering medication such as metformin.
Diabetes mellitus, type 2; Atherosclerotic cardiovascular disease; Anti-diabetic agent
10.3969/j.issn.1004-8812.2017.07.001
100191 北京大学第三医院内分泌科(洪天配);解放军总医院内分泌科(母义明);北京大学人民医院内分泌科(纪立农);北京大学第一医院内分泌科(郭晓蕙),心内科(霍勇);南京鼓楼医院内分泌科(朱大龙);四川大学华西医院内分泌科(童南伟);北京安贞医院肾内科(谌贻璞),流行病研究室(赵冬);第四军医大学唐都医院内分泌科(焦凯);火箭军总医院内分泌科(李全民);中山大学孙逸仙纪念医院内分泌科(李焱);哈尔滨医科大学附属第一医院内分泌科(李艳波);北京协和医院内分泌科(李玉秀);南昌大学第一附属医院内分泌科(刘建英);上海交通大学附属第一人民医院内分泌科(彭永德);广西医科大学附属第一医院内分泌科(秦映芬);上海交通大学医学院附属新华医院内分泌科(苏青);兰州大学第一医院内分泌科(汤旭磊);广州军区武汉总医院内分泌科(向光大);重庆医科大学附属第二医院内分泌科(杨刚毅);安徽省立医院内分泌科(叶山东);中日友好医院内分泌科(张波)
洪天配,Email: tpho66@bjmu.edu.cn
R587.2
2017-05-25)

