基于DNA自组装的金属纳米结构制备及相关纳米光子学研究∗
张祎男王丽华柳华杰†樊春海‡
1)(中国科学院上海应用物理研究所,上海光源生物成像中心,中国科学院微观界面物理与探测重点实验室,上海 201800)
2)(中国科学院大学,北京 100049)
基于DNA自组装的金属纳米结构制备及相关纳米光子学研究∗
张祎男1)2)王丽华1)柳华杰1)†樊春海1)‡
1)(中国科学院上海应用物理研究所,上海光源生物成像中心,中国科学院微观界面物理与探测重点实验室,上海 201800)
2)(中国科学院大学,北京 100049)
(2017年1月23日收到;2017年4月19日收到修改稿)
纳米光子学是研究光在纳米尺度下的行为以及光和纳米材料相互作用的一门科学.金属纳米材料凭借其独特的表面等离子体效应,可以在衍射极限以下对光进行传递和聚焦,因而是纳米光子学研究的重点.大量研究表明,通过调控金属纳米材料的形貌和成分可以控制表面等离子体的性质,从而对光进行可控调节.近年来,随着DNA纳米技术的发展,又为纳米光子学的发展带来了新的机遇.首先,人们发现不同的DNA序列可以调控金属纳米颗粒的成长,从而影响金属纳米颗粒的形貌和成分.此外,利用DNA自组装技术,可以将金属纳米颗粒组装成为有序可控的纳米结构.因此,基于DNA的纳米光子学研究近年来发展十分迅速.在此背景下,本文对相关研究进行归纳与总结,以期吸引更多研究人员的关注,推动该领域的进一步发展.本文首先介绍了金属纳米结构基于表面等离体实现突破光学衍射极限的原理,然后按照DNA对金属纳米结构的形貌或成分影响方式的不同分成若干部分,对基于DNA的纳米光子学做了系统的综述,最后展望了未来可能的发展方向.
DNA,纳米光子学,表面等离子体,金属纳米结构
1 引 言
光的波粒二象性决定其与其他形式的波一样,都受到衍射极限的限制,传统的介质透镜无法把光聚焦成小于约λ/2波长的光斑.长期以来,突破光的衍射极限一直是研究人员追求的目标.2014年诺贝尔化学奖授予Stephen Hell,Eric Betzig和William Moerner,以表彰其在超高分辨荧光显微镜上的贡献,他们成功地在生物活体成像中突破了可见光的衍射极限(约200 nm),获取了分辨率在几十纳米之内的荧光图像.但突破光学衍射极限的研究并未止步于此.首先,超分辨荧光显微镜需要实现荧光在样品表面的标记,并非所有样品都适合观察;其次,对光的应用并不仅局限于超分辨成像,还在于检测和催化等领域.因此,对于突破光的衍射极限的研究仍方兴未艾.
纳米光子学作为光学与纳米技术高度交叉的一个分支,主要研究金属纳米材料与光的相互作用及对光的调控.金属纳米材料在光波影响下会产生表面等离子体(surface plasmons,SPs),可以在极小区域内实现光波的传播和聚焦.SPs是在外部电磁场的影响下,金属表面的自由电子与振荡频率相同的电磁波产生集体共振,并进而产生沿金属-介质界面传播的表面波.由于SPs的存在,金属纳米结构可以在亚波长范围内引导光的传播,并且可以把光聚焦成几纳米区域的高密度态,实现局域增强,并且不受衍射极限的限制[1].因此,近些年来纳米光子学的研究受到了广泛的关注.
脱氧核糖核酸(deoxynucleic acid,DNA)是多个脱氧核苷酸的聚合物,每个核苷酸包括一个脱氧核糖、一个磷酸和一个碱基.脱氧核苷酸的碱基可分为腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(G)和胸腺嘧啶(T)四种,其中A与T,C与G在氢键作用下特异性地互相配对,形成了作为遗传物质基础DNA.在经典的DNA双链结构中,外侧的磷酸骨架带负电,而金属离子一般带正电,因此金属离子和DNA之间存在静电吸附作用.根据这个原理,可以通过设计不同形状的DNA模板进行金属化,获得形貌可控的金属纳米结构[2].此外,不同DNA碱基与金属具有不同的亲和力,不同的DNA序列也会形成不同的二级结构.研究发现,通过改变DNA的序列可以得到具有特定形貌的金属纳米颗粒[3].通过对金属纳米颗粒形貌和组分的调控,可以影响其表面等离子体的性质,从而构建出特殊的光学器件,在衍射极限以下对光谱进行调节.近年来, DNA对于金属纳米颗粒生长的调控得到迅速的发展[2-5].
另一方面,基于碱基互补配对原理,DNA可以自组装构建出形状各异、尺寸可控的各种DNA纳米结构,以此为模板,将可以实现不同纳米颗粒的有序排列,也可以对金属纳米结构进行精确的构建与调控.20世纪90年代,Alivisatos等[6]和Mirkin等[7]同时提出用巯基标记的DNA修饰金纳米颗粒,通过DNA自组装形成了纳米金高级结构,由此揭开了基于DNA自组装构建金属纳米结构的帷幕.随着DNA纳米技术[8]的持续发展,越发复杂和精确的金属纳米结构不断出现[9,10],并被广泛用于构建特殊的纳米光学器件[11].相比于DNA对金属纳米颗粒生长的调控,基于DNA的自组装可以对数量更多的纳米颗粒同时进行操作,构建尺寸较大的光学器件,实现特殊的用途.
无论是DNA对金属纳米颗粒生长的调控,还是基于DNA自组装对金属纳米颗粒的排列,两种方式都实现了DNA对金属纳米结构的调控,即对表面等离子体性质的调控,从而实现了在衍射极限以下对光的操作.因此,基于DNA的纳米光子学已成为相关研究中的热点.相比之下,通过化学模板法及纳米光刻技术等化学和物理手段,虽然也可以制备出某些特殊金属纳米结构[12-14],但这些方法尚存在一些缺点:如化学模板法只适用于制备具有高度对称性的结构;纳米光刻技术受到分辨率的制约,在制备三维金属纳米结构上也存在较大难度.而基于DNA自组装技术能够构建出复杂、不对称的金属纳米结构,并且具有更好的成分可控性.尤其是通过这种方法,可以制备出尺寸在亚波长范围内的复杂金属纳米结构,并且可以实现对结构的精确调控,从而影响结构表面等离子体的性质,对该结构的纳米光子学特性进行调控.随着DNA合成成本的降低,基于DNA自组装的金属纳米结构将具有更加广阔的应用前景.
本文接下来首先介绍DNA纳米技术的发展,然后按照DNA对金属纳米结构影响方式的不同,对基于DNA的纳米光子学做系统的综述,涵盖DNA对于金属纳米颗粒生长的影响以及DNA自组装对金属纳米颗粒的排列两个方面,最后探讨了该领域未来的发展方向.需要指出的是,在介绍通过DNA自组装制备金属纳米结构方法的基础上[15,16],本文并着重强调了这些结构在纳米光子学上的应用,包括在荧光增强[11]、光学异构性[17]、表面拉曼散射增强(surface-enhanced Raman scattering,SERS)[18]以及暗场散射光谱调节[19]上的应用等.
2 DNA纳米技术
DNA纳米技术是以DNA为基本单元构建纳米组装结构的科学,与传统上仅将DNA视为遗传信息载体的思路不同,DNA纳米技术主要着眼于DNA单双链的力学参数,以DNA的碱基互补配对为基础,通过合理的结构设计形成有一定刚性的DNA纳米结构.自从20世纪80年代由Seeman等[20]提出以来,已经发展出种类繁多的DNA纳米结构,主要可以分为DNA tile[21]和DNA折纸[22,23]两大类.基于这些DNA纳米结构,实现了对金属纳米结构的更高层次的调控,极大推进了基于DNA的纳米光子学的发展.
2.1 DNA tile
DNA tile[24-30]由几条至几十条短链(几十个碱基)按照化学等比例退火合成,尺寸一般从几纳米到几十纳米不等.20世纪80年代,Seeman等从基因同源重组的Holliday中间体受到启发,设计了一种称为“四臂结”的简单但有开创性的结构,它是由四条DNA单链依次互补配对而成,每条链不是与另外一条完全结合,而是与其他多条链结合,同时Seeman还设想把四臂结的每一臂都伸出一个黏性末端并两两互补,则有可能连成大的网状结构,这些构成了DNA tile设计和自组装的基本思想.经过多年的发展,DNA tile已经衍生出众多系列,比如n臂结[27,28],DX[25],TX[29],4×4 tile[30]以及单链tile等[31](图1(a)—图1(d)).与后来出现的DNA折纸相比较,DNA tile合成要求较高,需要参与合成的短链间较为精确的化学计量比.在实际应用中,DNA tile通常借助彼此之间的相互连接形成较大的二维结构,并在特定位点伸出序列用于不同纳米物体的有序排布.
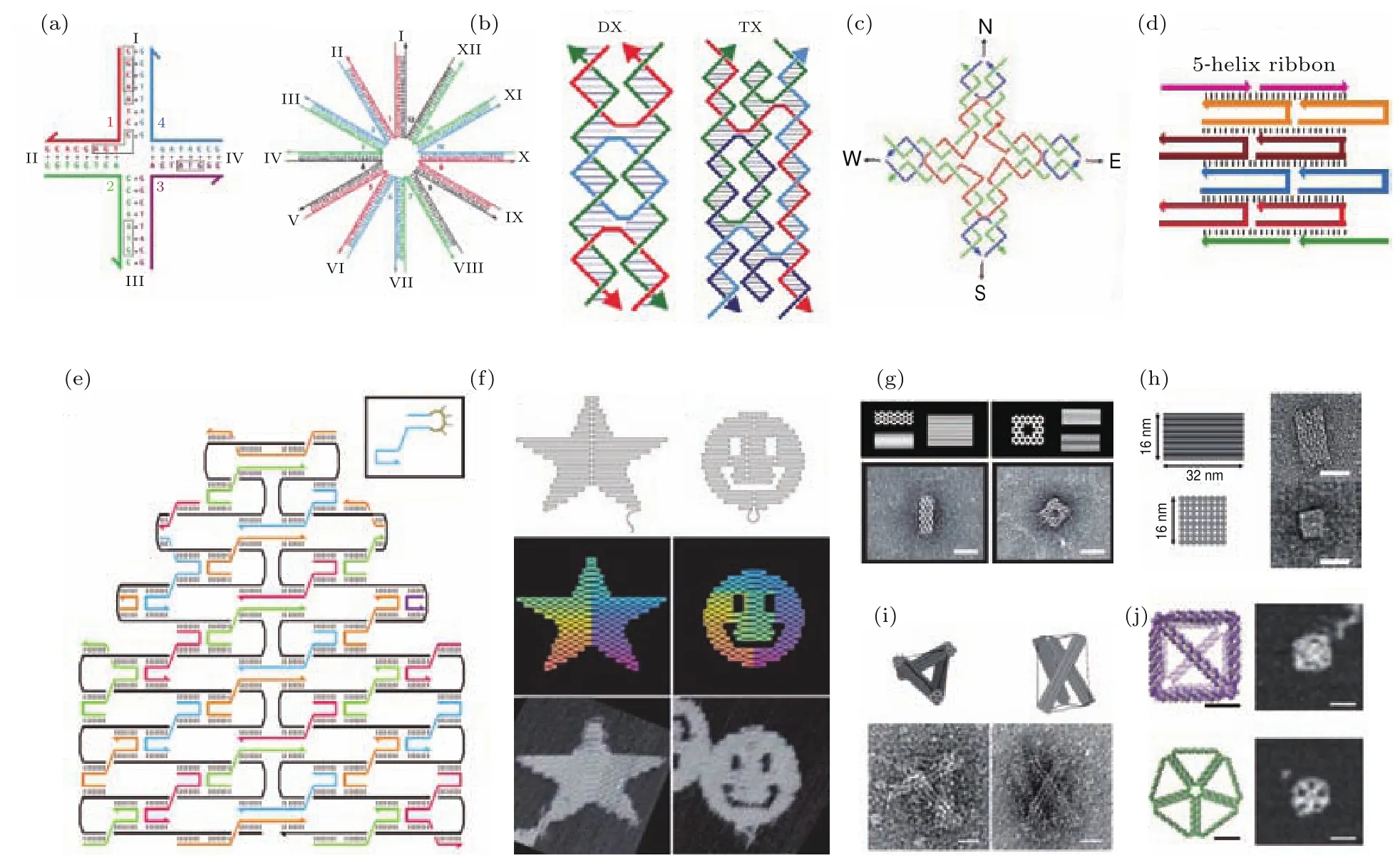
图1 DNA tile和DNA折纸结构 (a)DNA四臂结和十二臂结[27,28];(b)DX tile[25]和TX tile[29];(c)4×4 tile[30]; (d)单链tile[31];(e)DNA折纸的设计图[22];(f)一些二维DNA折纸的原子力显微照片[22];(g)基于“蜂窝”网格模型[32]的三维DNA折纸设计(上)和铀染电镜图(下);(h)基于立方网格模型[33]的三维DNA折纸设计(上)和铀染电镜图(下);(i)DNA折纸全张力结构[34];(j)三维框架网格DNA折纸[35]Fig.1.DNA tile and DNA origami:(a)DNA 4-arm and 12-arm junctions[27,28];(b)DX tile[25]and TX tile[29]; (c)4× 4 tile[30];(d)single-strand DNA tile[31];(e)the details of DNA origami design[22];(f)two-dimensional DNA origami fabricated by Rothemund[22];(g)the design(top)and stained TEM images(bottom)of threedimensional DNA origami based on honeycomb lattice model[32];(h)the design(top)and stained TEM images (bottom)of three-dimensional DNA origami based on square lattice model[33];(i)DNA tensegrity structures[34]; (j)three-dimensional DNA meshes[35].
2.2 DNA折纸
DNA折纸是由一条较长的骨架链(一般取自病毒单链DNA,几百到几千碱基)和数十至数百条订书链(几十个碱基)共同退火而成的一种DNA结构[22],尺寸一般在几十纳米到上百纳米,由Rothemund于2006年发明.该技术的原理是:用上百条短链与一条长链进行杂交,通过对长链的来回折叠形成纳米结构的基本轮廓,从而最终构建出特定形状的DNA纳米结构(图1(e),(f)).由于短链只与长链杂交而彼此间没有相互作用,该方法避免了类似DNA tile制备过程中苛刻化学计量比的限制,而且所用的长链可来自商业化的M13 mp18噬菌体.同时由于DNA双链本身的刚性和彼此间的协同作用,DNA折纸具有良好的力学性质.DNA折纸的发明对DNA纳米技术领域产生了深远的影响,并得到了迅速的发展.
此后,更加复杂的DNA折纸构建原理也相继被提出.Douglas等[32]设计了“蜂窝”网格模型,将DNA折纸从二维的平面结构发展为三维的立体结构(图1(g)).Ke等[33]提出了立方网格模型,以另外一种方式实现了三维DNA折纸结构的构建(图1(h)).此外还有DNA折纸全张力结构[34]和最近出现的三维框架网格结构等[35,36](图1(i),(j)).不断提出的新型DNA折纸结构为DNA纳米排布提供了丰富的模板,极大地促进了DNA纳米技术及相关领域的发展.
3 DNA对金属纳米颗粒生长的调控
根据作用机理的不同,DNA与金属离子间的相互作用可归为两种:一种是带负电的DNA骨架与金属离子间的静电相互作用,另一种是DNA碱基或二级结构与金属离子间的配位作用.通过调节这些相互作用,可以调控金属离子在DNA结构中的分布,在还原剂作用下可以得到形貌可控的金属纳米颗粒或结构.近年来越来越多的研究表明, DNA对金属纳米颗粒的形貌控制行之有效,甚至能发挥类似“基因密码”的作用.
3.1 DNA对金属纳米颗粒表面形貌的影响
将DNA链与金属纳米颗粒种子一起孵育时,由于与种子间的相互作用,DNA倾向于吸附在种子表面.当发生氧化还原反应时,溶液中金属离子将不断地在种子表面被还原,而吸附的DNA会对纳米颗粒的最终形貌产生影响.根据DNA序列的不同其产生的影响也不同,通过改变与金属纳米颗粒种子共孵育的DNA序列,可以对金属纳米颗粒的最终形貌进行调控,从而控制金属纳米颗粒的光学性质.
Wang等[37]分别将A30,T30,C30三种DNA链与纳米金种一起孵育,然后通过纳米金的再生长研究了不同序列对纳米金形貌的影响.他们发现T30对纳米金的生长没有影响,而A30,C30会诱导形成纳米金花,其紫外可见吸收光谱(ultravioletvisible absorption spectroscopy,UV-Vis)完全不同.在此基础上,他们通过观察与不同DNA序列组合孵育并进行再生长后纳米金形貌的演变,发现了不同DNA序列对于纳米金生长的影响,以及这些序列彼此间对纳米金生长的协同和竞争作用,提出了决定纳米金形貌的“基因密码”理论[3](图2(a)).Song等[5]将纳米金棒种子与A20,T20, C20,G20四种DNA链一起孵育,然后通过纳米金棒的再生长合成了不同的各向异性结构.他们发现与纳米金棒种子孵育的DNA序列及其排列组合以及改变生长时间,都将影响最终产物的形貌结构,并进而影响其紫外可见吸收光谱(图2(b)).而Tan等[38]采用相同的方法探究了A30,T30,C30, G20四种DNA链对于纳米金三角生长的影响,并以T30为例,观察了随还原时间不同导致的UVVis变化,获得了DNA浓度和HAuCl4浓度对产物最终形貌的影响规律(图2(c)).Wu等[39]还将这种思路沿用在研究DNA序列对纳米银颗粒生长的影响,发现除G10外,A10,T10,C10均可以使立方体状的银纳米种子生长成为顶点截断的八面体,对应的UV-Vis发生了明显的变化.
最近,Satyavolu等[40]还研究了不同DNA序列对于铂金二元纳米颗粒生长的影响,他们以铂的纳米立方颗粒为种子,分别加入A10,T10,C10, G10四种DNA链,观察了铂金纳米颗粒的最终形貌.他们通过紫外可见吸收光谱、扫描电子显微镜(scanning electron microscope,SEM)和扫描透射电子显微镜(scanning transmission electron microscopy,STEM)对纳米颗粒生长的动力学进行了探究,认为DNA通过影响金属原子在铂种子上的扩散和吸附影响纳米颗粒的最终形貌.他们的研究表明,DNA对于纳米颗粒形貌的控制不仅适用于单一组分体系,也可拓展到二元金属体系中,制备出具有特殊性质的表面等离子体的复合纳米材料,形成独特的光学性质.
以上工作采用的方法均是将DNA序列与金属纳米颗粒种子通过非共价吸附.与之不同,Shen等[41]研究了巯基修饰的A30序列对纳米金生长的调控,在他们的研究中,DNA通过金硫键作用共价连接在纳米金种子上.他们发现,在还原剂过量的情况下,通过改变金前驱体的浓度,可以得到形貌可控的纳米金花结构(图2(d)).由于在该反应中的浓度是影响纳米金花结构的惟一因素,因此他们将五种不同浓度下形成的纳米金花结构分别视为逐步提高浓度过程中五个阶段对应的中间产物,并通过小角X射线散射(small-angle X-ray scattering,SAXS)和TEM表征模拟了纳米金花结构的生长过程.他们的研究表明,在前三个阶段随着浓度的提高,“花瓣”开始出现并逐渐生长,但在第四个阶段“花瓣”开始变钝并且不同“花瓣”间发生融合,当进入第五个阶段时结构表面已经基本平滑.
通过DNA对金属纳米种子生长过程中的影响,可以得到高度不对称的金属纳米结构,这在一般的湿法合成中是难以实现的.这些不对称金属纳米结构上可形成特殊性质的表面等离子体,因而具有独特的光学特性,可用于制备特殊用途的纳米光子学器件.

图2 DNA对金属纳米颗粒表面形貌的影响 (a)不同DNA序列对纳米金形貌的影响[3];(b)DNA调控纳米金棒的形貌和光学性质[5];(c)DNA对金三角生长的影响[38];(d)DNA调控纳米金生长过程的SAXS表征[41]Fig.2.E ff ect of DNA on the morphology of metal nanoparticles:(a)E ff ect of DNA sequence on the morphology of gold nanoparticles[3];control of geometric and plasmonic properties of gold nanorods[5](b)and gold prisms[38](c)with DNA;(d)tuning the SAXS spectra of gold nanoparticles mediated by DNA-induced morphological changes[41].
3.2 DNA介导的金属纳米颗粒定向生长
除了DNA序列不同对金属纳米颗粒生长的调控作用以外,研究还发现,通过调节外部反应环境,可以实现DNA包覆金属纳米颗粒的进一步定向生长.在此过程中,如果使用另一种金属离子进行定向生长,将可获得二元有序复合金属纳米颗粒结构,如二聚体、核壳结构等,这些复杂有序结构普遍具有较为独特的光学性质.
Lee等[4]在巯基DNA修饰的纳米金上继续生长银纳米颗粒,构造出了特殊的纳米“雪人”结构(图3(a)).通过控制银纳米颗粒生长过程中的盐浓度,可以对生长出的银纳米颗粒尺寸进行调节,在高盐浓度下银倾向于包覆金纳米颗粒形成核壳结构,降低盐浓度后银在金纳米颗粒上占据的面积逐渐减小,形成类似雪人的二聚体结构,其紫外可见吸收光谱不断发生变化.通过在金颗粒尚未被银包覆的区域杂交小纳米金结构,他们还构建了不同的卫星结构.基于这种具有独特性质的表面等离子体的金银二聚体结构,他们在结构的缝隙处连接了不同的拉曼染料分子,研究了不同的二聚体结构对其拉曼散射的增强作用[42].他们通过控制盐浓度对金银二聚体结构中银纳米颗粒的粒径进行了调节,制备出不同缝隙的金银二聚体结构,并且研究了不同缝隙对于表面拉曼散射增强的影响.
Shen等[43]则通过DNA的调控合成了独特的金银二聚体“香菇”结构,他们在纳米金表面修饰标记有拉曼分子的巯基DNA,然后,除去胶体中的NaCl,通过在纳米金表面继续生长纳米银得到了目标结构(图3(b)).在金银二聚体的缝隙处存在着局域增强的电场,会对DNA上的拉曼分子信号产生极强的增强作用.在没有除去NaCl而直接在纳米金表面生长纳米银时,最终得到的结构中则没有缝隙,因而无法产生表面拉曼散射增强作用.他们还研究了纳米金种子的粒径和DNA修饰密度对最终结构和拉曼散射增强的影响,探索了香菇结构的形成机理.
Xu等[44]发现在形成金银二聚体结构后,还可以通过氧的刻蚀作用对银纳米颗粒的尺寸进行控制,使二聚体结构的表面等离子体性质发生改变,从而调节结构的紫外可见吸收光谱.另外他们还研究了温度、NaCl浓度以及刻蚀时间三种变量对结构及光谱影响的规律,并且发现当完全刻蚀掉纳米银后,其表面修饰的DNA会保留在残留的纳米金表面,通过这种方法他们构建出了各向异性的金属纳米卫星结构.
通过DNA的介导可以形成特殊的金属核壳结构,该结构有特殊的紫外可见吸收光谱,此外在内部的核和外层的壳之间的缝隙中存在强大的区域增强电场,对该处拉曼分子的散射信号有极强的增强作用.
Lim等[45]在纳米金表面修饰上一层标记拉曼分子的巯基DNA,然后通过再生长将这层DNA包在里面形成核壳结构.通过改变拉曼分子在DNA上标记的位置,可以改变其在核壳结构中的位置,他们发现当拉曼分子在缝隙区时其拉曼散射增强最为明显,内核其次而外层最弱.他们还分别观察了核壳结构缝隙中不同拉曼分子的数目以及不同壳层厚度下的拉曼散射光谱,发现了两者对拉曼信号强度影响的规律.
Zhao等[46]用含有连续腺嘌呤核苷酸的双嵌段DNA修饰纳米金,由于腺嘌呤核苷酸对纳米金具有良好的吸附性,含有连续腺嘌呤核苷酸的一段吸附在纳米金表面,而另外一段DNA伸向纳米金外侧(图3(c)).然后,他们将拉曼分子吸附在纳米金表面,并通过还原在纳米金表面生长出一层金壳,留在核壳结构缝隙处的拉曼分子在局域增强电场中其散射信号极大地增强.他们选用五种不同的拉曼分子,并在核壳结构中分别观察到对应的散射特征峰,接着他们在标记不同拉曼分子的核壳结构外修饰了不同的探针链,对于三种不同亚型的肝炎病毒DNA及其组合进行了检测,对于每种肝炎病毒亚型得到了特征的表面拉曼散射增强信号.
Hu等[47]用类似的办法,以15 nm的金纳米颗粒为核制备了缝隙在1.1 nm左右的纳米核壳结构(图3(d)).他们在核壳结构的缝隙中标记有荧光分子,研究了其拉曼信号增强的程度与金纳米颗粒粒径的关系,发现当金纳米颗粒粒径为76 nm时拉曼增强达到峰值.他们还在金纳米颗粒外修饰可与癌症相关表面受体CD44特异识别的透明质酸,将核壳结构作为特异性探针,实现了对癌细胞在荧光、暗场和拉曼散射模式下的多重成像.
Li等[48]则在前列腺特异抗原(PSA)小球外组装一层银纳米颗粒,然后标记上拉曼分子,接着在外面生长一层SiO2形成核壳结构.他们在核壳结构外修饰探针DNA,每种DNA序列对应标记的特定拉曼分子,由此构建出特异性的纳米SERS探针,根据拉曼散射特征峰即可以分辨出探针的种类.他们通过这种SERS探针成功地实现了对不同靶标DNA的检测.
通过DNA的影响在金属纳米种子生长形成二聚体或者核壳结构,在结构中的缝隙处由于表面等离子体的作用可以形成局域增强的电场,对于荧光及拉曼信号具有较强的放大作用,在检测等领域具有巨大的应用前景.
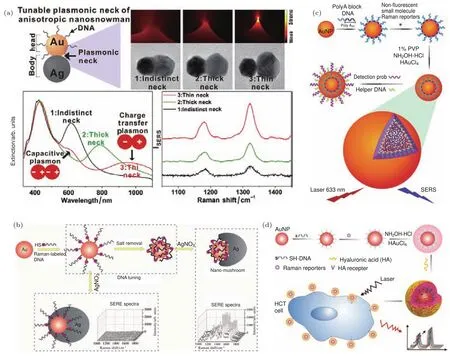
图3 DNA介导金属纳米结构构建及其纳米光子学性质 (a)金银二聚体纳米“雪人”结构[42];(b)金银二聚体“香菇”结构[43];(c)DNA介导的核壳结构[46];(d)DNA介导形成的核壳结构拉曼探针[47]Fig.3.Nanophotonic devices fabricated through DNA-mediated metallic nanostructures:(a)“Nanosnowmen”structures for SERS[42];(b)DNA-mediated Au-Ag heterodimers[43];(c)DNA-mediated core-shell structures[46]; (d)DNA-mediated SERS probes[47].
3.3DNA为模板的金属化
由于DNA链与金属离子间的相互作用以及DNA结构形状的可设计性,用DNA结构为模板可以实现对于金属纳米结构的形状控制,进而实现纳米光子学性质的调控.这种方法对于金属的种类没有特殊限制,具有广泛的适用性,甚至可以用于生长多元金属纳米结构.常用的DNA模板包括DNA双链、DNA tile以及DNA折纸等.
DNA双链作为最简单的DNA结构,常被用作DNA金属化的模板使用.Braun等[2]在金电极表面修饰了特定序列的DNA单链,用以将一条DNA双链组装在两极之间.然后他们在该DNA双链上吸附Ag+,并加入对苯二酚作为还原剂,沿DNA双链模板生长银纳米线,最终将两极连接起来.Monson和Woolley[49]在硅片表面修饰带正电的多聚赖氨酸,然后将DNA双链吸附在硅片表面上,紧接着在吸附DNA的区域滴加Cu2+,使DNA双链上吸附大量的Cu2+,此时在硅片上加入抗坏血酸作为还原剂,吸附在DNA链上的Cu2+被还原为Cu0,他们通过这种方法制备出约3 nm高的Cu纳米线. Gu等[50]则先在DNA双链上吸附Pd2+,然后以二甲基胺硼烷(dimethylamine broane,DMAB)作为还原剂沿着DNA双链生长出Pd晶核,在洗去多余的Pd2+后再加入Co2+,通过Pd的催化在DMAB还原作用下生长Co纳米线(图4(a)).随着Co纳米线的生长,其紫外可见吸收光谱发生变化,基于这种变化他们对Co纳米线的生长过程进行了跟踪.

图4 以DNA为模板的金属化 (a)以DNA双链为模板金属化形成的Co纳米线[50];(b)对4×4 tile金属化形成银纳米线[30];(c)基于回路状DNA折纸金属化形成金和铜的回路状纳米结构[53];(d)直接在三角DNA折纸上金属化形成银纳米簇[55]Fig.4.DNA-templated metallization:(a)Cobalt nanowires fabricated with double-stranded DNA template[50];(b)silver nanowires prepared with a 4× 4 tile ribbon template[30];(c)DNA origami-templated Au and Cu nanostructures with a circuit-shape[53];(d)direct metallization on a triangular DNA origami[55].
随着DNA tile和DNA折纸的出现,基于DNA的金属化开始以DNA tile和DNA折纸作为模板,形成特定形状的金属结构.Yan等[30]利用4×4 DNA tile的自组装形成了微米尺度的DNA带,将DNA带吸附在电极之间,然后以DNA带为模板进行金属化合成银纳米线,使电极形成回路(图4(b)).Liu等[51]采用DNA TX tile作为模板,基于类似的方法也生长出银纳米线,并测出了其伏安曲线.
更多的工作选择易合成的DNA折纸作为金属化模版.Liu等[52]设计了一种T形DNA折纸,并沿DNA折纸生长出了T形的金纳米颗粒聚集体.他们首先在DNA折纸表面生长出Pd种子,通过多次生长提高了Pd种子在DNA折纸表面的密度,然后在Pd种子的催化作用下通过氧化还原反应在DNA折纸表面生长出致密的金纳米结构.他们将这种思路沿用在回路状DNA折纸的金属化上[53],先在DNA上生长Ag种子,然后继续生长出了回路形的金或铜纳米结构(图4(c)).
Pilo Pais等[54]采用了不同的方法.他们先在DNA折纸上组装纳米金,然后以这些纳米金作为种子在表面生长纳米银,随着银纳米颗粒的不断生长,纳米颗粒逐渐变大并发生融合,通过这种方法构建出了包括环形、H形在内的不同金属纳米结构. Pal等[55]则是直接将还原基团特异性地连接在三角DNA折纸的一边,这样在加入银氨溶液后,银的还原只发生在修饰还原基团的区域,从而在三角DNA折纸上定点形成了具有荧光性质的银纳米簇(图4(d)),他们比较了在三角DNA折纸上形成的银纳米簇和游离DNA上还原基团形成的银纳米簇两者之间荧光发射和激发光谱的不同.
基于DNA模板进行金属化可以发挥DNA模板形状可控的优势,得到形状同样可控的金属纳米结构,但目前金属化得到的结构在尺寸控制上较为粗糙,且多局限于简单的一维或者二维结构,在控制的精确性以及三维尺寸控制方面尚存在较大困难.
4 DNA指导金属纳米结构自组装
除了直接调控金属纳米颗粒的生长以外, DNA还可以指导金属纳米颗粒的自组装,以DNA结构为模板可以实现不同纳米颗粒之间的有序排列,此外通过调节金属纳米颗粒表面修饰的DNA密度,也可以构建出有序的结构,实现特殊的纳米光子学性质.
4.1 基于DNA tile的金属纳米结构自组装
DNA tile尺寸较小,但可通过设计调节tile间的相互识别获得有限大小的tile图案或无限延展的tile阵列,因而可以进一步作为组装金属纳米颗粒的模板.2002年,Xiao等[56]首先用DX阵列实现了纳米金的有序排列,他们先合成了4种DX tile,其中一种用巯基连接一个纳米金颗粒,通过4种tile杂交形成DX阵列形成条纹状纳米金排列.按照类似的思路,Zheng等[57]用DX三角阵列和Sharma等[58]用4×4 tile阵列实现了不同的纳米金排布.John等[59]将纳米金杂交在一种DX tile上,通过几种DX tile形成DX阵列也实现了纳米金的条纹排列.Zhang等[60]先合成了4×4 tile的网格结构,然后通过加入与网格特定位点伸出序列互补的纳米金实现了等间距的纳米金二维排列.
随着DNA纳米技术的发展,出现了一些尺寸较大的DNA tile,在单个DNA tile或者有限几个DNA tile上可以实现金属纳米颗粒的有序排布. Zhang等[61]利用N角星系列通用tile分别组装出四面体、八面体和十二面体的DNA笼子,可以装入不同数目的金纳米颗粒.他们还在笼子外面组装纳米金,形成了类似CH4,SF6,W(CH3)6等多种小分子结构的金属纳米结构[62].有些工作在实现金属纳米颗粒有序排布的同时,还能对结构进行动态的调节.Aldaye和Sleiman[63]合成了一种有机杂化DNA环,将纳米金组装成数量可控的聚集体,并且通过DNA链置换可实现纳米金的动态可控解离与重新组装.Elbaz等[64]则合成了环环相扣的DNA纳米结构,可以选择性地在不同的环上组装纳米金,通过链置换反应控制DNA环的构型,进而对金属纳米结构进行动态调控.
通过金属纳米结构的可控调节,可以实现特殊性质的表面等离子体,从而在衍射极限以下实现对光的改变.Ding等[65]则将三个不同粒径的纳米金成线性组装在加长的TX tile上,构建出了纳米尺寸的光透镜.Sharma等[66]将纳米金共价连接在一种DX tile上,通过几种tile组装形成DX阵列,由于纳米金的位阻排斥作用,DX阵列卷曲成为柱状,从而形成左旋螺旋线型的纳米金排列,通过改变DX tile相连的方式可以形成不同螺旋构象的纳米金排列(图5(a)).
4.2 基于DNA折纸的金属纳米结构自组装
DNA折纸通常用于合成尺寸在几十至上百纳米的DNA纳米结构[22],由于产率高、易合成、刚性好、可控性好,已经成为DNA纳米技术研究的主要对象.伴随着DNA折纸的蓬勃发展,以DNA折纸为模板的自组装金属纳米结构及其纳米光子学研究迅速兴起.
2008年,Sharma等[67]用双巯基标记的订书链制备了单修饰的纳米金,这些单修饰的纳米金与其他订书链一起和骨架链退火可以合成含有纳米金图案的方块DNA折纸,纳米金在方块DNA折纸上的位置对应着修饰在纳米金上订书链在折纸上的位置.由于双巯基修饰在较高温度下的稳定性,单修饰纳米金可以承受DNA折纸退火合成的温度,最终合成的DNA折纸中纳米金的连接效率在90%以上.
更多的研究中使用DNA修饰的纳米金与DNA折纸上伸出链的直接杂交.Ding等[68]直接将5个三种不同粒径的纳米金杂交到三角DNA折纸上的特定位置,形成对称的线性排列.Pal等[69]则在三角DNA折纸的一条边上杂交了不同数目的银纳米颗粒,形成了不同的银纳米结构,还实现了金银纳米二聚体的组装.Pal等[70]还实现了各向异性纳米结构在DNA折纸上的组装,他们在三角DNA折纸的一边组装了两个40 nm×12 nm的纳米金棒,通过改变金棒在折纸上的组装位置,可以精确地调节纳米金棒的二聚体结构和对应的紫外可见吸收光谱.而Schreiber等[71]提出另一种思路,在柱状DNA折纸上组装不同数量的纳米金或纳米银粒子,然后将柱状DNA折纸组装在大粒径纳米金上,他们通过这种方法构造出了众多的卫星结构.
由于DNA折纸自组装的金属纳米结构具有极好的可控性,并且可以实现大尺寸金属纳米颗粒的自组装,因而被广泛应用于构建亚波长光学器件,在表面等离子体的作用下实现荧光增强[11]、光学活性[17]、表面拉曼散射增强[18]以及调节结构散射光谱等[19]用途.
Acuna等[11]在一个柱状DNA折纸两侧组装了一对金纳米颗粒构成纳米天线,在激光照射下纳米天线缝隙处在表面等离子体作用下形成局域增强的电场(图5(b)).他们在缝隙处组装上荧光分子,研究了在23 nm的固定缝隙宽度下荧光增强与纳米金数目和粒径的关系,发现在一对100 nm的纳米金中荧光增强可以达到117倍的峰值.Puchkova等[72]沿用相同的思路,通过改进DNA折纸的尺寸,进一步减小缝隙的尺寸,改变入射光的偏振方向以及使用淬灭剂降低荧光产率的方法,极大地提高了缝隙处的荧光增强倍数(超过5000倍),在25µM的背景荧光分子浓度下实现了单分子荧光检测.Ko等[73]则在一个方块DNA折纸上同时组装纳米金和量子点,通过控制量子点周围纳米金的数量以及与纳米金间的相对位置,实现了对量子点荧光寿命的调整,并与模拟结果符合较好.Pellegrotti等[74]则利用纳米金与荧光分子之间的作用,研究了在激光照射下荧光分子的漂白过程受纳米金粒径的影响.他们在柱状DNA折纸上标记了一个荧光分子和一个金纳米颗粒,两者的距离保持在8.5 nm,通过改变纳米金的粒径,记录了荧光漂白前发射光子数的变化,发现20 nm及以下的纳米金对于荧光漂白过程几乎没有影响,而80 nm的纳米金由于产生的电场增强较强,会使荧光分子在漂白前发射超过前者4倍数量的光子.
Kuzyk等[17]在柱状DNA折纸上组装纳米金的螺旋结构(图5(c)),构建出具有光学活性的结构,通过改变纳米颗粒的粒径和成分,可以对圆二色光谱进行调节,得到与模拟结果重合较好的圆二色谱信号.同样是构建光学活性器件,Lan等[75]则是在方块DNA折纸上下两面分别组装一个纳米金棒,两个金棒相互垂直,通过调节两个金棒间的相对位置可以得到不同的圆二色谱信号.Urban等[76]在DNA折纸的设计上做出了改进,他们合成了一种弧形DNA折纸,将四个弧形折纸拼接成一个环形,然后在环形结构上沿螺旋线杂交纳米金,他们通过这种方法组装出了具有不同光学活性的结构.2017年,Shen等[77]合成了一种包括纳米金球和金棒的新型手性结构,他们将纳米金棒包裹在卷曲的方块DNA折纸中,然后在DNA折纸表面沿螺旋线杂交一圈纳米金球,得到了纳米金球沿纳米金棒的螺旋排列,通过改变纳米金球螺旋排列的走向即可形成光学活性相反的结构.
Zhang等[78]在构建光学活性结构时采用了较为独特的方法.他们首先将三角DNA折纸每条边中点桥接上一段特定序列的DNA,然后通过链置换反应将这些DNA原位转印到一个大粒径金纳米颗粒上,接着利用该纳米金的转印DNA去分别杂交修饰互补DNA的不同粒径纳米金,这样便形成了一个纳米金的金字塔结构,因为每个顶点纳米金的粒径皆不相同,所以该结构具有光学活性,通过调节三角DNA折纸上伸出序列的相对位置,即可得到不同光学活性的结构.
此外,Kuzyk等[79]还制备出光学活性可变的金属纳米结构,实现了对于光的动态调控.他们将两根金棒分别组装在两个交叉的柱状DNA折纸上,通过链置换反应可以改变两个柱状DNA折纸的相对角度,随之改变两根金棒的相对构型,使表面等离子体的性质发生变化,从而产生不同的圆二色谱信号.Zhou等[80]则是在DNA折纸的一面组装一根金棒,然后在另外一面组装另一根金棒,并通过链置换反应驱动一根金棒的滚动,来不断改变结构的手性,得到不断变化的圆二色谱.而Urban等[81]基于同样的原理,在一面组装金棒的同时,实现了两根金棒在另一面的同时滚动,由此不断改变结构的构型来实现光谱的调节.这些工作都通过DNA折纸为模板的自组装形成独特的金属纳米结构,在衍射极限以下通过表面等离子体的作用观察到了纳米结构的细微变化.
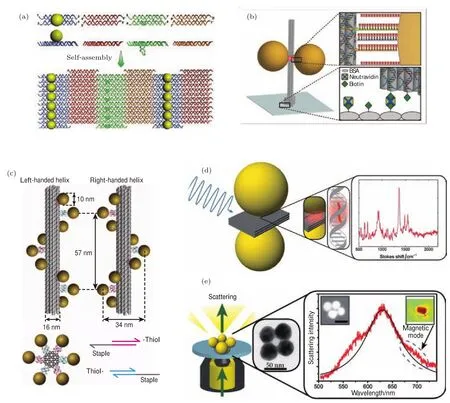
图5 DNA结构指导金属纳米结构自组装及其纳米光子学研究 (a)基于DNA tile的纳米金螺旋排列[66];(b)荧光增强纳米金二聚体[11];(c)纳米金在DNA折纸上的螺旋排列[17];(d)纳米金二聚体及其SERS研究[82];(e)基于DNA折纸自组装形成的金四聚体结构[19]Fig.5.Nanophotonic devices based on DNA tiles or DNA origami:(a)AuNPs spirals formed with DNA tile arrays[66]; (b)DNA origami-templated Au dimers for fl uorescence enhancement[11];(c)AuNPs spirals on DNA origami[17];(d)DNA origami-templated Au dimers for SERS[82];(e)self-assembly of Au tetramers on DNA origami[19].
通过表面等离子体形成的局域增强来实现表面增强拉曼散射也是构建DNA折纸自组装结构的目的之一.Thacker等[18]在DNA折纸上组装一对40 nm的纳米金颗粒,在入射光作用下纳米金之间的缝隙区域会出现局域增强的电场,通过对染料分子和不同序列寡聚核苷酸拉曼散射信号的检测,他们发现了几个数量级的超强拉曼散射增强.Kuhler等[82]在DNA折纸的两侧分别组装一个金纳米颗粒构建出纳米天线(图5(d)),在DNA折纸内嵌入染料分子,通过纳米天线的增强作用染料分子的拉曼散射信号被放大,而且他们发现放大的效果和入射光的偏振有关,当激光偏振沿纳米天线轴向时增强效果达到峰值,而当偏振与纳米天线轴向垂直时增强效果最弱.基于与Kuhler等[82]同样的结构, Simoncelli等[83]实现了从单分子到四个分子的定量拉曼散射信号检测,他们通过激光产热来调节纳米金之间DNA折纸模板的尺寸,并跟踪了这种尺寸的细微变化对染料分子拉曼散射信号的影响,这是首次实现定量分子拉曼散射增强的检测.
通过DNA折纸自组装还可以调控金属纳米结构的瑞利散射,在暗场显微镜下可以观察散射的变化.Roller等[19]设计了一种环形DNA折纸,并在DNA折纸上杂交不同数目、不同粒径的纳米金,形成了复杂的纳米金环形排列(图5(e)).他们选用40 nm的纳米金四聚体结构为主要研究对象,观察了这种结构的暗场散射光谱,发现缝隙大小对于四聚体对称结构的散射光谱有重要的影响.此外,当该结构处于干燥环境中时,DNA折纸在脱水后形状发生细微变化,导致四聚体结构偏离了设计的对称性,在暗场显微镜下的散射光谱发生红移,并出现了新的散射峰.他们还在DNA折纸两侧组装一对纳米金构成纳米天线[84],研究了纳米天线的等离子体共振与结构散射的耦合现象.Weller等[85]则通过DNA折纸分别组装了纳米金/金、金/银和银/银二聚体,实现了对金属纳米结构组分的调控,并研究了二聚体的间隙大小和入射光偏振角度对结构散射光谱的影响.2017年,Zhan等[86]在三脚架状DNA折纸的每条棱上分别组装了一根纳米金棒,然后通过链置换反应改变DNA折纸每条棱之间的夹角,从而调控纳米金棒的构象,由此对该纳米金棒三聚体的紫外可见吸收光谱和散射光谱进行调节.
基于DNA模板的自组装,尤其是基于DNA折纸的自组装,已经实现了高度复杂的金属纳米粒子的有序排列,并且通过这种有序排列构建出多种用途的纳米光子学器件,随着更多DNA模板的出现,该领域仍具有广阔的发展前景.
4.3 不依赖DNA结构模板的金属纳米结构
有些金属纳米结构的组装并不依靠DNA模板,而是依靠金属纳米颗粒表面修饰的DNA相互杂交形成有序的纳米结构,结构中的纳米颗粒表面等离子体之间发生耦合,从而产生独特的光学性质.
Lim等[87]通过控制探针链与保护链在纳米金上的比例,降低了探针链在纳米金上的修饰密度,在靶标链的连接下,修饰两种探针链的纳米金会形成二聚体结构,在二聚体中央区域会形成局域增强的电场(图6(a)).他们在这种结构表面生长了一层银膜以进一步实现局域增强,由于一种纳米金颗粒上的探针链标记有拉曼分子,因此一旦有靶标分子引导的二聚体形成,即可以观察到其增强的特征拉曼散射信号.Yan等[88]通过金属纳米颗粒的自组装构建了不同的手性结构,他们首先制备了单修饰的纳米银、量子点以及两种粒径的纳米金,然后通过四种纳米颗粒的自组装形成纳米金字塔结构(图6(b)).由于每个定点纳米颗粒的性质不同,整个结构呈现出独特的光学活性,通过改变顶点位置的纳米颗粒可以对光的偏振进行调节.Li等[89]则通过金属纳米结构表面等离子体的变化研究单颗粒催化过程,他们将具有催化活性的小纳米金颗粒组装在大纳米金颗粒表面形成光晕结构,由于小纳米金表面的催化反应改变了其介电性质,会对光晕结构的表面等离子体产生影响,进而改变结构的散射光谱,他们在暗场显微镜下观察到了光晕结构散射光谱随着催化反应进行的变化.
此外,DNA自组装的金属纳米结构还被应用于细胞成像中.Lee等[90]用可与特定mRNA互补的DNA修饰纳米金作为探针,当遇到特定mRNA时探针会杂交在mRNA上形成金纳米二聚体,但对于该mRNA的不同变体,所形成的二聚体其空隙的距离不同,造成的耦合强度也不同,由此可以产生不同的散射光谱,基于此可以实现细胞中特定mRNA剪接变体的定量观察.
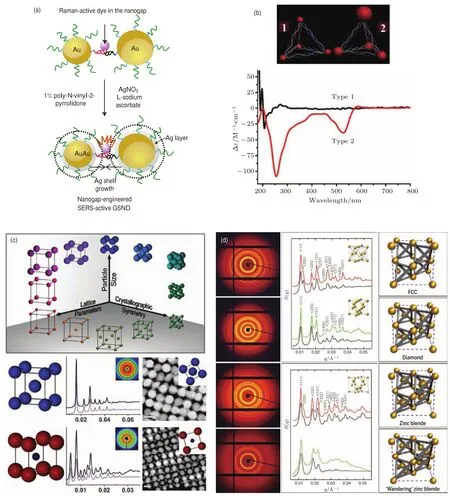
图6 无DNA模板的DNA自组装金属纳米结构及其纳米光子学性质 (a)纳米金二聚体SERS探针[87];(b)具有光学活性的金字塔纳米结构[88];(c)Mirkin组的DNA-纳米颗粒超晶格结构[91];(d)Gang组基于四面体的DNA-纳米颗粒超晶格结构[99]Fig.6.DNA template-free nanophotonic devices:(a)Au dimers as SERS probes[87];(b)optically active nanopyramids[88]; (c)DNA-nanoparticles superlattices from Mirkin’s group[91];(d)diamond family of superlattices from Gang’s group[99].
Mirkin组基于纳米金之间的自组装发展出了独特的DNA-纳米颗粒超晶格结构[91](图6(c)),这种结构是由DNA修饰的金属纳米颗粒通过相互杂交形成的长程有序结构,通过调节修饰DNA的序列或者金属纳米颗粒的形状组分等可以形成各式各样的超晶格结构[92].Jones等[93]分别用DNA修饰的纳米金棒、纳米金三角和纳米金十二面体构建了不同的超晶格结构,并用X射线小角散射对形成的超晶格进行观察,发现对于不同的连接方式,其小角散射的结果对应不同的晶体结构.Macfarlane等[91]则以DNA修饰的纳米金球为基本单元,构建了很多种不同晶体结构和晶格参数的超晶格,并总结出形成超晶格结构的基本规律.Auyeung等[94]进一步发现,对于相同的连接方式,通过刻蚀掉特定某种DNA修饰纳米金的内核而仅仅保留DNA,也可以改变所形成超晶格的晶体结构.他们还通过缓慢的退火使结晶过程始终处于热平衡状态,得到了类似原子结晶过程中伍尔夫多面体的超晶格结构[95].最近Kim等[96]又通过在纳米金表面修饰多种DNA,使纳米金之间具有多种连接方式的可能性,通过激活不同的连接方式,纳米金可以形成不同的超晶格结构.
Gang课题组也在DNA-纳米颗粒超晶格结构方面做出了杰出工作.Maye等[97]在纳米金的DNA连接间插入环状结构,通过链置换反应改变纳米金之间的距离,通过小角散射观察到所形成的超晶格结构晶格参数的变化.Zhang等[98]通过调节纳米金间的DNA连接方式实现了对于超晶格晶体结构的可控转变.最近,Liu等[99]在超晶格自组装中创新性地引入DNA四面体模板,将纳米金单元组装在四面体模板中,由于四面体模板提供了固定的价态和键角,从而形成类似于有机分子中的基本单元四价碳键的结构(图6(d)).基于此,他们不仅构建了面心立方结构,还构建了独特的金刚石和闪锌矿结构,并在小角散射中得到了验证.
依靠金属纳米粒子表面的DNA相互杂交形成有序结构,是DNA模板出现以前通过DNA引导形成有序结构的主要方法.由于缺少DNA模板,通过这种方法得到的结构在有序范围上受到限制(超晶格除外),但较为灵活,多通过形成固定数目的聚集体构建特殊的纳米光子学器件,具有广阔的应用空间.
5 结论与展望
基于DNA的纳米光子学是通过DNA对金属纳米结构形貌和组分的调控来影响入射光下金属纳米结构中表面等离子体发生的区域和强度,从而对光场进行调控.由于金属纳米结构的尺寸在纳米尺度,所以该方法突破了光的衍射极限,即使是纳米级的结构变化也可以在光谱中得到明显的反映,如纳米天线中缝隙宽窄的细微变化会强烈影响缝隙中荧光分子的荧光增强程度.而借助于这种表面等离子体引起的局域电场增强作用,在金属纳米结构的电场增强区域已经可以实现对单分子荧光和单分子拉曼的检测.得益于这些无可比拟的优势,基于DNA的纳米光子学具有巨大的应用潜力和广泛的发展前景.然而目前的研究中尚存在一些难以解决的问题,如大粒径纳米粒子在DNA折纸模板上难以精确定位,以及DNA模板尺寸上的限制,此外,对三维的金属纳米结构进行精确调控也一直没有实现.
随着DNA纳米技术的发展,DNA对金属纳米结构的调控愈加精确,尤其是随着新型DNA折纸的不断涌现,通过DNA自组装有望形成更加复杂的金属纳米结构.而基于DNA为模板的金属化,作为一种仍在发展中的金属纳米结构构建方式,也将受益于DNA折纸的不断进步,未来有望用于构建有特殊光学性质的金属纳米结构.与此同时,DNA自组装作为一种重要的自下而上方法,也正在与自上而下的微纳加工技术相结合,用以构建更大范围的有序结构[100,101],二者的相互补充将促进相关纳米光子学研究的进一步发展.
[1]Schuller J A,Barnard E S,Cai W,Jun Y C,White J S, Brongersma M L 2010 Nat.Mater.9 193
[2]Braun E,Eichen Y,Sivan U,Ben-Yoseph G 1998 Nature 391 775
[3]Wang Z,Tang L,Tan L H,Li J,Lu Y 2012 Angew. Chem.Int.Ed.51 9078
[4]Lee J H,Kim G H,Nam J M 2012 J.Am.Chem.Soc. 134 5456
[5]Song T,Tang L,Tan L H,Wang X,Satyavolu N S,Xing H,Wang Z,Li J,Liang H,Lu Y 2015 Angew.Chem. Int.Ed.54 8114
[6]Alivisatos A P,Johnsson K P,Peng X,Wilson T E, Loweth C J,Bruchez M P,Schultz Jr P G 1996 Nature 382 609
[7]Mirkin C A,Letsinger R L,Mucic R C,Storho ffJ J 1996 Nature 382 607
[8]Pinheiro A V,Han D,Shih W M,Yan H 2011 Nat.Nanotechnol.6 763
[9]Chao J,Zhang Y,Zhu D,Liu B,Cui C,Su S,Fan C, Wang L 2016 Sci.China:Chem.59 730
[10]Lan X,Lu X,Shen C,Ke Y,Ni W,Wang Q 2015 J. Am.Chem.Soc.137 457
[11]Acuna G,Moller F,Holzmeister P,Beater S,Lalkens B, Tinnefeld P 2012 Science 338 506
[12]Murphy C J,Thompson L B,Chernak D J,Yang J A, Sivapalan S T,Boulos S P,Huang J Y,Alkilany A M, Sisco P N 2011 Curr.Opin.Colloid Interf.Sci.16 128
[13]Feng L,Romulus J,Li M,Sha R,Royer J,Wu K T,Xu Q,Seeman N C,Weck M,Chaikin P 2013 Nat.Mater. 12 747
[14]Hedrick J L,Brown K A,Kluender E J,Cabezas M D, Chen P C,Mirkin C A 2016 ACS Nano 10 3144
[15]Kumar A,Hwang J H,Kumar S,Nam J M 2013 Chem. Commun.49 2597
[16]Tan S J,Campolongo M J,Luo D,Cheng W 2011 Nat. Nanotechnol.6 268
[17]Kuzyk A,Schreiber R,Fan Z,Pardatscher G,Roller M, Hogele A,Simmel F,Govorov O,Liedl T 2012 Nature 483 311
[18]Thacker V V,Herrmann L O,Sigle D O,Zhang T,Liedl T,Baumberg J J,Keyser U F 2014 Nat.Commun.5 3448
[19]Roller E M,Khorashad L K,Fedoruk M,Schreiber R, Govorov O,Liedl T 2015 Nano Lett.15 1368
[20]Kallenbach N R,Ma R I,Seeman N C 1983 Nature 305 829
[21]Seeman N C 2003 Nature 421 427
[22]Rothemund P W 2006 Nature 440 297
[23]Nangreave J,Han D,Liu Y,Yan H 2010 Curr.Opin. Chem.Biol.14 608
[24]Chen J,Seeman N C 1991 Nature 350 631
[25]Fu T,Seeman N C 1993 Biochemistry 32 3211
[26]Mao C D,Sun W,Seeman N C 1997 Nature 386 137
[27]Ma R I,Kallenbach N R,Sheardy R D,Petrillo M L, Seeman N C 1986 Nucl.Acids Res.14 9745
[28]Wang X,Seeman N C 2007 J.Am.Chem.Soc.129 8169
[29]LaBean T H,Yan H,Kopatsch J,Liu F R,Winfree E, Reif J H,Seeman N C 2000 J.Am.Chem.Soc.122 1848
[30]Yan H,Park S H,Finkelstein G,Reif J H,LaBean T H 2003 Science 301 1882
[31]Yin P,Hariadi R F,Sahu S,Choi H M,Park S H,Labean T H,Reif J H 2008 Science 321 824
[32]Douglas S M,Dietz H,Liedl T,Hogberg B,Graf F,Shih W M 2009 Nature 459 414
[33]Ke Y,Douglas S M,Liu M,Sharma J,Cheng A,Leung A,Liu Y,Shih W M,Yan H 2009 J.Am.Chem.Soc. 131 15903
[34]Liedl T,Hogberg B,Tytell J,Ingber D E,Shih W M 2010 Nat.Nanotechnol.5 520
[35]Veneziano R,Ratanalert S,Zhang K,Zhang F,Yan H, Chiu W,Bathe M 2016 Science 352 1534
[36]Benson E,Mohammed A,Gardell J,Masich S,Czeizler E,Orponen P,Hogberg B 2015 Nature 523 441
[37]Wang Z,Zhang J,Ekman J M,Kenis P J,Lu Y 2010 Nano Lett.10 1886
[38]Tan L H,Yue Y,Satyavolu N S,Ali A S,Wang Z,Wu Y,Lu Y 2015 J.Am.Chem.Soc.137 14456
[39]Wu J,Tan L H,Hwang K,Xing H,Wu P,Li W,Lu Y 2014 J.Am.Chem.Soc.136 15195
[40]Satyavolu N S,Tan L H,Lu Y 2016 J.Am.Chem.Soc. 138 16542
[41]Shen J,Xu L,Wang C,Pei H,Tai R,Song S,Huang Q, Fan C,Chen G 2014 Angew.Chem.Int.Ed.53 8338
[42]Lee J H,You M H,Kim G H,Nam J M 2014 Nano Lett. 14 6217
[43]Shen J,Su J,Yan J,Zhao B,Wang D,Wang S,Li K, Liu M,He Y,Mathur S,Fan C,Song S 2014 Nano Res. 8 731
[44]Xu L,Wang G,Shen J,Geng H,Li W,Wu L,Gao S, Wang J,Wang L,Fan C,Chen G 2016 Nanoscale 8 9337
[45]Lim D K,Jeon K S,Hwang J H,Kim H,Kwon S,Suh Y D,Nam J M 2011 Nat.Nanotechnol.6 452
[46]Zhao B,Shen J,Chen S,Wang D,Li F,Mathur S,Song S,Fan C 2014 Chem.Sci.5 4460
[47]Hu C,Shen J,Yan J,Zhong J,Qin W,Liu R,Aldalbahi A,Zuo X,Song S,Fan C,He D 2016 Nanoscale 8 2090
[48]Li J,Wei C,Ma W,An Q,Guo J,Hu J,Wang C 2012 J.Mater.Chem.22 12100
[49]Monson C F,Woolley A T 2003 Nano Lett.3 359
[50]Gu Q,Cheng C,Haynie D T 2005 Nanotechnology 16 1358
[51]Liu D,Park S H,Reif J H,LaBean T H 2004 Proc.Natl. Acad.Sci.USA 101 717
[52]Liu J,Geng Y,Pound E,Gyawali S,Ashton J R,Hickey J,Woolley A T,Harb J N 2011 ACS Nano 5 2240
[53]Geng Y,Pearson A C,Gates E P,Uprety B,Davis R C, Harb J N,Woolley A T 2013 Langmuir 29 3482
[54]Pilo-Pais M,Goldberg S,Samano E,Labean T H, Finkelstein G 2011 Nano Lett.11 3489
[55]Pal S,Varghese R,Deng Z,Zhao Z,Kumar A,Yan H, Liu Y 2011 Angew.Chem.Int.Ed.50 4176
[56]Xiao S J,Liu F R,Rosen A E,Hainfeld J F,Seeman N C,Musier-Forsyth K,Kiehl R A 2002 J.Nanopart.Res. 4 313
[57]Zheng J,Constantinou P E,Micheel C,Alivisatos A P, Kiehl R A,Seeman N C 2006 Nano Lett.6 1502
[58]Sharma J,Chhabra R,Liu Y,Ke Y,Yan H 2006 Angew. Chem.Int.Ed.45 730
[59]Le J D,Pinto Y,Seeman N C,Musier-Forsyth K,Taton T A,Kiehl R A 2004 Nano Lett.4 2343
[60]Zhang J,Liu Y,Ke Y,Yan H 2006 Nano Lett.6 248
[61]Zhang C,Li X,Tian C,Yu G,Li Y,Jiang W,Mao C 2014 ACS Nano 8 1130
[62]Li Y,Liu Z,Yu G,Jiang W,Mao C 2015 J.Am.Chem. Soc.137 4320
[63]Aldaye F A,Sleiman H F 2007 J.Am.Chem.Soc.129 4130
[64]Elbaz J,Cecconello A,Fan Z,Govorov A O,Willner I 2013 Nat.Commun.4 2000
[65]Ding B,Cabrini S,Zuckermann R,Bokor J 2009 J.Vac. Sci.Technol.B 27 184
[66]Sharma J,Chhabra R,Cheng A,Brownell J,Liu Y,Yan H 2009 Science 323 112
[67]Sharma J,Chhabra R,Andersen C S,Gothelf K V,Yan H,Liu Y 2008 J.Am.Chem.Soc.130 7820
[68]Ding B,Deng Z,Yan H,Cabrini S,Zuckermann R, Bokor J 2010 J.Am.Chem.Soc.132 3248
[69]Pal S,Deng Z,Ding B,Yan H,Liu Y 2010 Angew.Chem. Int.Ed.49 2700
[70]Pal S,Deng Z,Wang H,Zou S,Liu Y,Yan H 2011 J. Am.Chem.Soc.133 17606
[71]Schreiber R,Do J,Roller E M,Zhang T,Schuller V J, Nickels P C,Feldmann J,Liedl T 2014 Nat.Nanotechnol.9 74
[72]Puchkova A,Vietz C,Pibiri E,Wunsch B,Sanz M, Acuna P,Tinnefeld P 2015 Nano Lett.15 8354
[73]Ko S H,Du K,Liddle J A 2013 Angew.Chem.Int.Ed. 52 1193
[74]Pellegrotti J V,Acuna G P,Puchkova A,Holzmeister P, Gietl A,Lalkens B,Stefani D,Tinnefeld P 2014 Nano Lett.14 2831
[75]Lan X,Chen Z,Dai G,Lu X,Ni W,Wang Q 2013 J. Am.Chem.Soc.135 11441
[76]Urban J,Dutta K,Wang P,Duan X,Shen X,Ding B, Ke Y,Liu N 2016 J.Am.Chem.Soc.138 5495
[77]Shen C,Lan X,Zhu C,Zhang W,Wang L,Wang Q 2017 Adv.Mater.29 1606533
[78]Zhang Y,Chao J,Liu H,Wang F,Su S,Liu B,Zhang L, Shi J,Wang L,Huang W,Wang L,Fan C 2016 Angew. Chem.Int.Ed.55 8036
[79]Kuzyk A,Schreiber R,Zhang H,Govorov O,Liedl T, Liu N 2014 Nat.Mater.13 862
[80]Zhou C,Duan X,Liu N 2015 Nat.Commun.6 8102
[81]Urban J,Zhou C,Duan X,Liu N 2015 Nano Lett.15 8392
[82]Kuhler P,Roller M,Schreiber R,Liedl T,Lohmuller T, Feldmann J 2014 Nano Lett.14 2914
[83]Simoncelli S,Roller E M,Urban P,Schreiber R,Turberfield A J,Liedl T,Lohmuller T 2016 ACS Nano 10 9809
[84]Roller M,Argyropoulos C,Hogele A,Liedl T,Pilo-Pais M 2016 Nano Lett.16 5962
[85]Weller L,Thacker V,Herrmann O,Hemmig A,Lombardi A,Keyser F,Baumberg J 2016 ACS Photon.3 1589
[86]Zhan P,Dutta P K,Wang P,Song G,Dai M,Zhao S X, Wang Z G,Yin P,Zhang W,Ding B,Ke Y 2017 ACS Nano 11 1172
[87]Lim D K,Jeon K S,Kim H M,Nam J M,Suh Y D 2010 Nat.Mater.9 60
[88]Yan W,Xu L,Xu C,Ma W,Kuang H,Wang L,Kotov N A 2012 J.Am.Chem.Soc.134 15114
[89]Li K,Wang K,Qin W,Deng S,Li D,Shi J,Huang Q, Fan C 2015 J.Am.Chem.Soc.137 4292
[90]Lee K,Cui Y,Lee L P,Irudayaraj J 2014 Nat.Nanotechnol.9 474
[91]Macfarlane R J,Lee B,Jones M R,Harris N,Schatz G C,Mirkin C A 2011 Science 334 204
[92]Senesi A J,Eichelsdoerfer D J,Macfarlane R J,Jones M R,Auyeung E,Lee B,Mirkin C A 2013 Angew.Chem. Int.Ed.52 6624
[93]Jones M R,Macfarlane R J,Lee B,Zhang J,Young K L,Senesi A J,Mirkin C A 2010 Nat.Mater.9 913
[94]Auyeung E,Cutler J I,Macfarlane R J,Jones M R,Wu J S,Liu G,Zhang K,Osberg K D,Mirkin C A 2012 Nat. Nanotechnol.7 24
[95]Auyeung E,Li T I,Senesi A J,Schmucker A L,Pals B C,de la Cruz M O,Mirkin C A 2014 Nature 505 73
[96]Kim Y,Macfarlane R J,Jones M R,Mirkin C A 2016 Science 351 579
[97]Maye M M,Kumara M T,Nykypanchuk D,Sherman W B,Gang O 2010 Nat.Nanotechnol.5 116
[98]Zhang Y,Pal S,Srinivasan B,Vo T,Kumar S,Gang O 2015 Nat.Mater.14 840
[99]Liu W,Tagawa M,Xin H L,Wang T,Emamy H,Li H, Yager K G,Starr F W,Tkachenko A V,Gang O 2016 Science 351 582
[100]Gopinath A,Miyazono E,Faraon A,Rothemund P W 2016 Nature 535 401
[101]Hung A M,Micheel C M,Bozano L D,Osterbur L W, Wallra ffG M,Cha J N 2010 Nat.Nanotechnol.5 121
PACS:71.45.Gm,71.55.Ak,82.39.Pj,82.35.Np DOI:10.7498/aps.66.147101
DNA self-assembly-based fabrication of metallic nanostructures and related nanophotonics∗
Zhang Yi-Nan1)2)Wang Li-Hua1)Liu Hua-Jie1)†Fan Chun-Hai1)‡
1)(Division of Physical Biology and Bioimaging Center,Shanghai Synchrotron Radiation Facility;CAS Key Laboratory of Interfacial Physics and Technology;Shanghai Institute of Applied Physics,Chinese Academy of Sciences,Shanghai 201800,China)
2)(University of Chinese Academy of Sciences,Beijing 100049,China)
23 January 2017;revised manuscript
19 April 2017)
Nanophotonics focuses on the study of the behavior of light and the interaction between light and matter on a nanometer scale.It has often involved metallic nanostructures which can concentrate and guide the light beyond the di ff raction limit due to the unique surface plasmons(SPs).Manipulation of light can be accomplished through controlling the morphologies and components of metallic nanostructures to incur special surface plasmons.However,it is still a severe challenge to achieve exquisite control over the morphologies or components of metallic nanostructures: chemical methods can provide anisotropic but highly symmetric metallic nanostructures;lithographic methods have a limited resolution,especially for three-dimensional metallic nanostructures.By comparison,DNA self-assembly-based fabrication of metallic nanostructures is not restricted to these con fi nements.With the high- fi delity Waston-Crick base pairing,DNA can self-assemble into arbitrary shapes ranging from the simplest double strands to the most sophisticated DNA origami.Due to the electrostatic interactions between negatively charged phosphate backbones and positively charged metal ions,as well as the sequence-dependent DNA-metal interactions,DNA can a ff ect the metal ions to a certain degree.Depending on the shape and sequence,DNA self-assembly nanostructures can exert di ff erent in fl uences on the growth of metallic nanoparticles,which in turn gives rise to deliberately controllable metallic nanostructures. Besides,DNA self-assembly nanostructures can act as ideal templates for the organization of metallic nanoparticles to construct special metallic nanostructures.In this case,DNA-modi fi ed metallic nanoparticles are immobilized on DNA self-assembly nanostructures carrying complementary sticky ends.The geometry and component arrangements of metallic nanostructures both can be precisely dictated on the DNA nanostructures by programming the sticky end arrays.Complicated metallic nanostructures which can be hardly fabricated with conventional chemical or lithographic methods have been readily prepared with the DNA self-assembly-based fabrication method,thereby greatly promoting the development of nanophotonics.Therefore,the studies of DNA self-assembly-based fabrication of metallic nanostructures and related nanophotonics have received rapidly growing attention in recent years.This review fi rst gives a brief introduction of the mechanism for breaking the di ff raction limit of light with metallic nanostructures based on SPs.Then we give a systematic review on DNA self-assembly-based fabrication of metallic nanostructures and related nanophotonics, which is divided into several parts according to the di ff erent pathways by which DNA self-assembly can in fl uence the morphologies or components of metallic nanostructures.Finally,the remaining problems and limitations for the existing DNA self-assembly-based fabrication of metallic nanostructures are presented and an outlook on the future trend of the f i eld is given as well.
DNA,nanophotonics,surface plasmons,metallic nanostructures
:71.45.Gm,71.55.Ak,82.39.Pj,82.35.Np
10.7498/aps.66.147101
∗国家重点基础研究发展计划(批准号:2013CB932803)、国家自然科学基金(批准号:21473236,31371015)和中国科学院青年创新促进会资助的课题.
†通信作者.E-mail:liuhuajie@sinap.ac.cn
‡通信作者.E-mail:fchh@sinap.ac.cn
©2017中国物理学会Chinese Physical Society
http://wulixb.iphy.ac.cn
*Project supported by the National Basic Research Program of China(Grant No.2013CB932803),the National Natural Science Foundation of China(Grant Nos.21473236,31371015),and the Youth Innovation Promotion Association of Chinese Academy of Sciences.
†Corresponding author.E-mail:liuhuajie@sinap.ac.cn
‡Corresponding author.E-mail:fchh@sinap.ac.cn

