结构光照明显微中的偏振控制∗
赵天宇周兴但旦千佳汪召军雷铭†姚保利‡
1)(中国科学院西安光学精密机械研究所,瞬态光学与光子技术国家重点实验室,西安 710119)
2)(中国科学院大学,北京 100049)
结构光照明显微中的偏振控制∗
赵天宇1)2)周兴1)但旦1)千佳1)汪召军1)雷铭1)†姚保利1)‡
1)(中国科学院西安光学精密机械研究所,瞬态光学与光子技术国家重点实验室,西安 710119)
2)(中国科学院大学,北京 100049)
(2017年5月16日收到;2017年6月13日收到修改稿)
结构光照明显微(structured illumination microscopy,SIM)作为一种宽场超分辨光学显微成像技术,具有成像速度快、光漂白和光毒性弱等优点,是目前主流超分辨成像方法之一.在SIM技术中,正弦强度分布的条纹结构光场的对比度决定了SIM超分辨图像的质量.低的条纹对比度将导致样品中超衍射极限的高频信息被噪声掩盖,从而无法解析出超分辨信息.结构照明入射光的偏振态调控决定了干涉条纹的对比度,是SIM的关键技术.鉴于此,本文总结对比了几种典型的SIM系统偏振控制方法,同时提出了一种使用零级涡旋半波片的偏振控制方法.实验证明,与其他方法相比,采用零级涡旋半波片法可以获得更高效的偏振控制效果,具有系统结构简单、易使用、可将光能利用率提升到接近100%的优点.
结构光照明显微,超分辨,偏振控制,零级涡旋半波片
1 引 言
自十七世纪荷兰人列文虎克发明光学显微镜以来,光学显微镜一直是研究活细胞生命现象的主流方法.这一发明极大地推动了人类文明的进程,将人类的观察视野由宏观世界延伸至微观领域.然而,传统光学显微镜的空间分辨率受到光学衍射极限的限制,空间分辨率最高只能达到大约半个波长,故而对低于200 nm的细节信息无能为力,制约了其在亚细胞水平观测中的应用[1-3].以无损光学成像进一步探索生命活动的构想似乎在阿贝的预言下戛然而止.然而近几十年伴随着荧光探针技术的发展,提出了一系列超分辨光学显微成像方法,使得光学显微镜的空间分辨率突破了阿贝极限.其中最具代表性的技术包括受激发射损耗显微技术(stimulated emission depletion microscopy,STED)[4,5]、光激活定位显微技术(photo-activation localization microscopy, PALM)[6,7]、随机光学重构显微技术(stochastic optical reconstruction microscopy,STORM)[8,9],结构光照明显微技术(structured illumination microscopy,SIM)[10-12]等.在这些技术的推动下,超分辨显微镜已经可以观察纳米尺度范围内的生物体结构及其变化过程,为现代生物学提供了强有力的研究工具,将相关领域的研究推向了新的高度.
由于SIM是成像速度最快的超分辨成像技术,自该技术出现伊始,就受到了国内外的广泛关注. SIM技术最初由Heintzmann和Cremer[10]于1999年提出,通过将光栅经由物镜投影在样品上产生的正弦强度分布的条纹结构光场,利用四步相移法重构超分辨图像,得到近100 nm空间分辨率的超分辨图像.在此基础上,Gustafsson等[11]于2000年采用三步相移法进一步提高了SIM 的时间分辨率.随着研究的深入,SIM技术也得到进一步的改进与拓展.2008年,Schermelleh等[13]使用三光束干涉,成功地记录到细胞核膜上核孔复合体的精细三维结构,其横向分辨率达到100 nm,纵向分辨率200 nm.同年,Shao等[14]使用六光束干涉并结合非相干光干涉照明干涉成像显微技术(incoherent interference illumination image interference microscopy,I5M),实现了纵向及横向空间分辨率均为100 nm的三维结构光照明显微,使得从三维上精确定位细胞内部各种细胞器及观测活体细胞内的活动及反应成为可能.线性SIM最大可以将光学显微系统的空间分辨率提高一倍.2005年Gustafsson[15]利用荧光分子的非线性响应,进一步将空间分辨率提升至50 nm.Li等[16]于2015年使用铁电液晶空间光调制和相位延迟器提升了SIM的时间分辨率,他们对细胞内吞作用和细胞骨架动力学的研究极大地推动了SIM在生物学领域的应用.
以线性SIM为例,将其超分辨成像原理概述如下.显微物镜的空间分辨率取决于它能采集到的最大空间频率f0=2NA/λ(其中NA是物镜的数值孔径).当样品包含的高频信息f>f0时,将难以分辨样品的细节.如果使用空间频率为f1的正弦条纹结构光照明样品,则会产生空间频率为fm=|f-f1|的低频莫尔条纹(Moiré fringes).莫尔条纹实际上是样品与结构光的拍频信号,它包含有样品超衍射分辨的高频信息f.当fm<f0时,可以在显微物镜下观察到莫尔条纹,通过解码,可以提取出样品的超分辨率信息,进而重构出样品的高分辨率图像.为保证结构光照明显微系统光学传递函数(OTF)的各向同性,实验中需要旋转照明光场在多个方向上对称地对样品照明.通常在每一个成像平面旋转3个位置,两两夹角60°,如图1所示.从频域来看,结构光照明拓展了显微系统的OTF从f0提高到了f0+f1.因此f1越大,SIM显微的空间分辨率就越高.但是结构照明光场的空间频率f1同样受衍射极限限制,即f1≤f0,所以线性SIM显微技术至多可以将光学显微系统的空间分辨率提高一倍.

图1 (a)普通宽场频谱;(b)单一频率方向结构光扩展了这一方向的频谱;(c)三个方向结构光得到近各向同性的频谱Fig.1.(a)Wide- field spectrum;(b)extended spectrum with single frequency direction;(c)extended nearly isotropic spectrum with three frequency directions.
产生高空间频率正弦强度分布条纹结构光场是SIM的核心.大多数的结构光照明显微系统都使用线偏振的激光束照明衍射光栅或者空间光调制器产生±1级衍射光,再将两束衍射光干涉产生周期性正弦干涉条纹照明样品.改变干涉条纹的相位和旋转方向需要通过电控平移台和旋转台移动衍射光栅来实现,这将不可避免地带来机械振动并降低系统的时间分辨率.因此目前大多数的SIM 系统都采取液晶空间光调制器(spatial light modulator,SLM)代替衍射光栅的方案,通过编程控制SLM上加载的光栅结构可以实时改变正弦干涉条纹的旋转方向和相位,整个显微系统的时间分辨率和稳定性都得到了极大的提高.实验中双光束干涉条纹的对比度受两束光偏振态影响,只有在线偏振入射光偏振方向与条纹方向呈特定角度时条纹对比度才能达到最高.为保证结构光照明显微系统OTF的各向同性,需要改变条纹光场对称地照明样品.因此在实验上必须同步控制入射线偏振光的偏振方向与加载在空间光调制器上的光栅方向,使二者始终保持平行.
本文针对几种典型的SIM偏振控制方法进行了对比,同时提出了一种使用零级涡旋半波片的偏振控制方法.实验证明零级涡旋半波片法可以对SIM系统进行更高效的偏振控制,并具有操作简单和光能利用率高等优点.
2 理论分析
2.1 偏振方向对干涉条纹对比度的影响
我们首先理论分析干涉条纹对比度与入射光偏振方向的关系,模拟因偏振引起的条纹对比度变化对最终超分辨图像重构质量的影响.

图2 双光束干涉示意图Fig.2.Sketch of two beam interference.
如图2所示,为了简化问题,设强度相同、关于z轴对称入射的两束相干平面波在空间xz平面相干叠加,其电场复振幅矢量分别为:

其中e1,e2分别表示E1,E2振动方向的单位矢量; k1,k2是波矢,|k1|=|k2|=k=2π/λ;r是位矢.设φ表示k与z轴夹角,φ∈(0,π/2);θ为e与xz平面夹角,θ∈(0,π);ex,ey,ez分别为x,y,z轴的单位方向矢量.则有
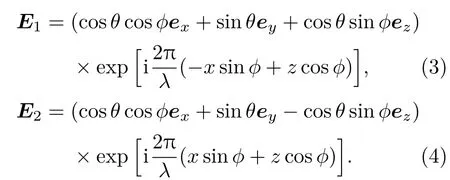
当两束光发生干涉时,由光波的叠加原理可知干涉场的复振幅分布为
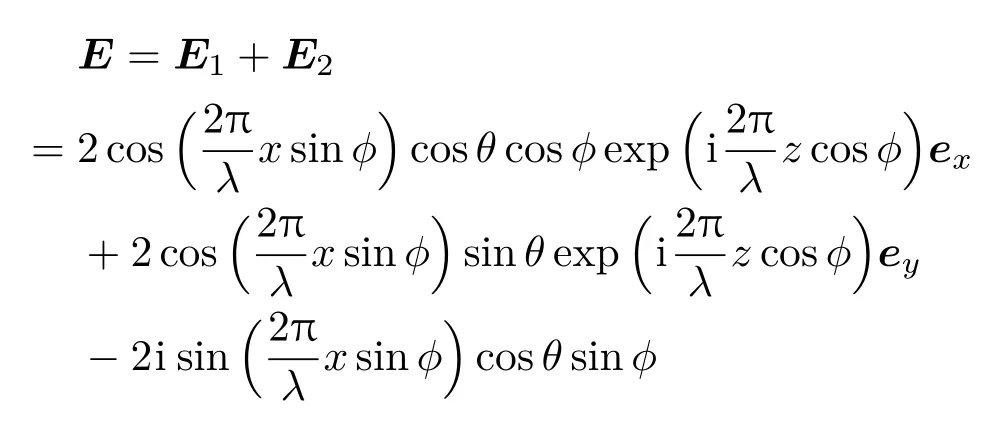

所以,干涉场的光强分布为
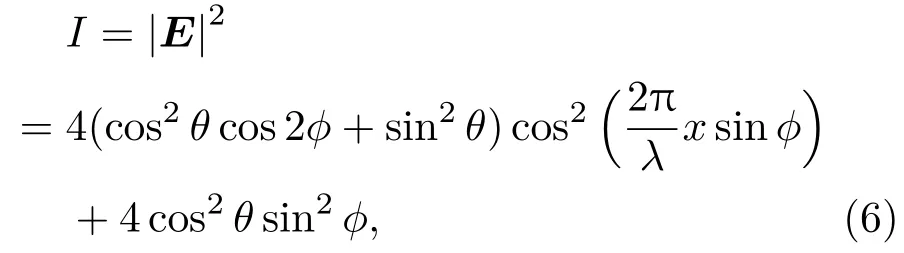

其图像如图3所示.
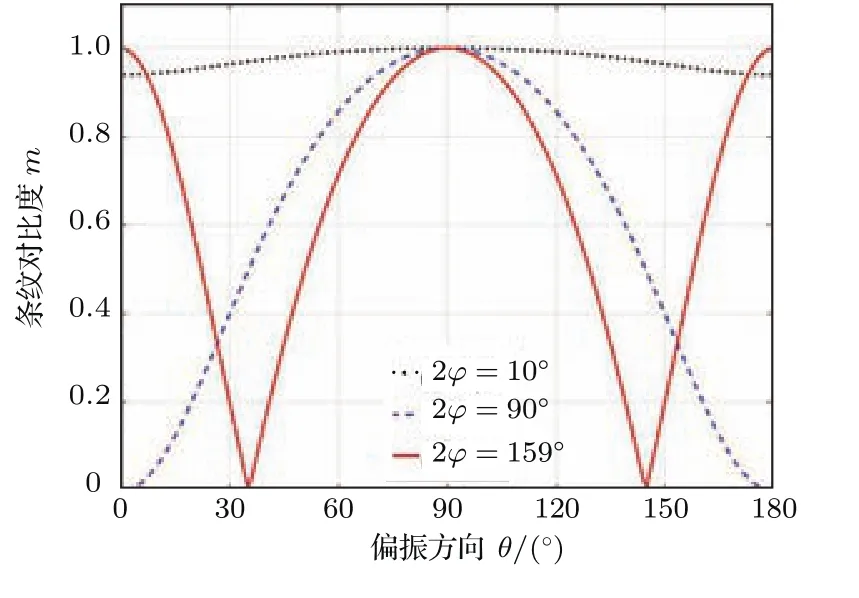
图3 干涉条纹对比度随偏振方向及双光束夹角的变化规律Fig.3.The variation of the interference fringe contrast with di ff erent polization angles and the cross angle between the two beams.
可以看出,当双光束偏振方向角θ=90°,即垂直于光束平面xz,亦即为s偏振时,干涉条纹具有最大对比度.而对于双光束夹角接近180°,如2φ=159°时,当双光束偏振方向平行于光束平面xz时(即为p偏振时),干涉条纹也可以接近最大对比度,而其他偏振方向条纹对比度则逐渐下降.因此为了获得更高的条纹对比度,就必须对偏振方向进行控制,以实现高质量的超分辨图像重构,一般都将双光束偏振方向调制为s偏振,即在xy观察平面内看,偏振方向与干涉条纹方向一致.
2.2 条纹对比度对重构图像的影响
目前,常用的SIM图像重构算法包括Shro ff等[17]提出的POP(phase of peaks)算法, Wicker[18]提出的ACR(auto-correlation reconstruction)算法,Zhou等[19]提出的IRT(image recombination transform)算法.在不同的条纹对比度下,三种算法分别呈现不同的图像重构效果.下面就这三种算法在不同条纹对比度情况下的重构结果进行对比.
模拟中为了与实验条件匹配,设置物镜的数值孔径为1.49,浸油折射率为1.515,同时,考虑到SIM系统中常选用高灵敏度的sCMOS相机作为探测器,设探测器分辨率为2048×2048像素,像素大小为6.5µm.如图4(a)所示,选用分辨率渐变的USAF1951分辨率测试板作为测试目标,该分辨率板空间频率在中心处达到最高,往外缘呈逐级减小趋势.在波长为500 nm时,模拟系统的衍射极限为168 nm.当条纹频率增至衍射极限时,算法估测误差将显著增大,且精度受到噪声干扰,因此模拟中加载的条纹周期为170 nm,并使用高斯噪声模拟退化图像.模拟重构图像结果如图4所示,其中图4(a)为宽场结果.在图4(b)—图4(d)中,当m=0.01时,由于高频信息被淹没在噪声中,三种算法均失效,无法提供重构结果.在图4(e)—图4(g)中,当m=0.1时,POP和ACR算法可以辨认出分辨率板上的图案,但是由于伪影存在,不能提供真实可靠的细节信息,而IRT算法已经可以得到良好的重构结果.在图4(h)—图4(j)中,当条纹对比度m=0.5时,三种算法均可以得到较好的重构图像,并且没有伪影产生.由此可见,对于不同的SIM图像重构算法,高的条纹对比度是获得高品质图像的必要条件.而偏振方向的变化将影响条纹对比度进而影响最终的图像重构质量,因此,为了得到高质量的超分辨结果,就必须对系统进行偏振控制.

图4 三种算法在不同条纹对比度情况下的重构结果对比 (a)普通显微镜结果;(b)—(d)m=0.01重构结果; (e)—(g)m=0.1重构结果;(h)—(j)m=0.5重构结果Fig.4.Comparison of reconstructed images of the simulated object by using three algorithms at di ff erent fringe contrast:(a)Wide- field;(b)–(d)reconstructed images with m=0.01;(e)–(g)reconstructed images with m=0.1;(h)–(j)reconstructed images with m=0.5.
3 结构光照明显微中的几种偏振控制方法
由于条纹对比度是SIM重构超分辨图像的重要参数,而上文的模拟显示干涉光束的偏振态决定了干涉条纹的对比度.这里选取具有代表性的3种方法,对SIM技术中的偏振控制方法进行详细介绍与对比.
3.1 相位延迟器法
在早期Gustafsson等机械式地旋转和平移衍射光栅的方式来控制干涉条纹的相位和方向时,需要在光路中加入一个可以同步旋转控制的半波片来实现双光束的偏振态的同步控制.然而机械转动的半波片已经无法满足高速成像实验对系统的速度与稳定性的要求.Kner等[20]在SIM系统中使用铁电液晶SLM时,同时还使用了一对铁电液晶相位延迟器(ferro-electric liquid crystal phase retarders,FLC)进行光束的偏振控制(如图5(a)所示).FLC由充满液晶分子的透明液晶盒组成,液晶分子在未加电压的情况下,其快轴方向竖直,对入射光束产生的相位延迟量为0.加载一定电压后,液晶分子快轴方向将会旋转45°, FLC对入射光束产生的相位延迟量和外加电压大小相关.
该系统的偏振控制原理如图5(b)所示,其中红色箭头表示系统中各个位置处激光的偏振方向,蓝线代表两个FLC和一个1/4波片(QWP)的快轴方向.入射光依次通过两个FLC和一个1/4波片,控制两个FLC的相位延迟量为λ/3,即每一个FLC相当于一个快轴方向可变的1/3波片.如图5(b)第一行所示,当所需条纹方向为0°时,两个FLC均不加载电压,则入射光没有旋转,出射光即为垂直偏振.如图5(b)第二行所示,当所需条纹方向为60°时,则第一个FLC不变,第二个加载电压,出射光即为60°线偏振.如图5(b)第三行所示,当所需条纹方向为-60°时,则两个FLC都加载电压,出射光为-60°线偏振.
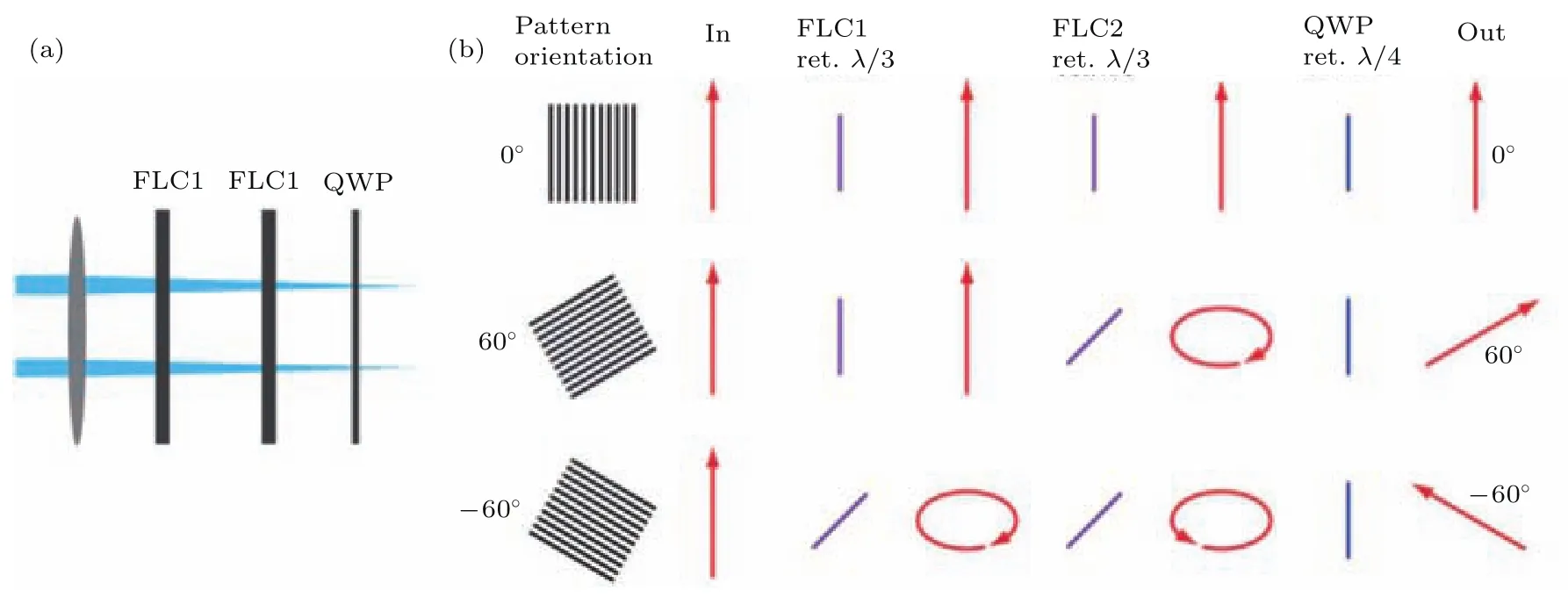
图5 (a)相位延迟器法装置示意图;(b)使用三个相位延迟器对光束进行偏振控制的示意图[20]Fig.5.(a)Schematic of polarization control by using phase retarders;(b)process of polarization control by using three phase retarders[20].
FLC最大的优点在于可以快速(<100µs)准确地对光束偏振方向进行调制.然而由于其变化过程需要编程控制,并需要同空间光调制器等器件进行同步,使得系统的复杂度增加.另外,由于需要使用两个FLC,实验系统的总透过率将小于90%.
3.2 分区偏振片法
为了解决FLC操作复杂的问题,2014年Förster等[21]设计了一个特殊的分区偏振片(segmented polarizer),其结构如图6所示.该分区偏振片是一个无源器件,由12个偏振片胶合而成,其中每一个小扇形代表一块偏振片,其偏振透光轴方向如箭头所示.实验时将由SLM衍射得到的两束线偏振光通过1/4波片调制为圆偏振光,当两束圆偏光沿图6中所示两个相同颜色的圆斑位置入射分区偏振片时,出射线偏光的偏振方向可以调制为圆斑内箭头所指的偏振方向,并且与两光束的干涉条纹方向平行,从而实现SIM系统的偏振控制.
分区偏振片的优点在于其本身为无源器件,调整好光路后不需要加入额外的同步控制,从而简化了SIM系统的操作.然而由于入射的圆偏光经过分区偏振片后,理论上将损失50%的光强,如果再考虑到偏振片材料的吸收特性,该方法的能量利用率将小于50%.

图6 分区偏振片结构示意图[21]Fig.6.Methord of polarization control by using segmented polarizer.
3.3 零级涡旋半波片法
针对前两种偏振调制技术的不足,本文提出了一种使用零级涡旋半波片进行偏振控制的方法.零级涡旋半波片(zero-order vortex half-wave retarder,VHR)是一种非均匀半波片,其快轴方向并不惟一,图7中的单箭头方向为该位置处半波片的快轴方向.图8是使用VHR进行偏振控制的原理示意图,如果需要产生方向如图8(d)所示的干涉条纹,首先将两束入射线偏光的偏振方向调节为图8(a)双箭头所示垂直方向,红色圆斑为两光束的入射位置,图8(b)中的单箭头代表零级涡旋半波片的快轴方向.当两光束通过VHR调制后,出射光的偏振方向为图8(c)中红色圆斑位置处的双箭头方向,即为所需的偏振方向.同理,其余两个方向的偏振控制原理如图8(e)—(l),从而实现了SIM偏振控制.
在能量利用率方面,VHR透过率与普通半波片类似,几乎没有能量损失,理论上接近100%,从而大大提高了系统的能量利用率.同时VHR与之前的分区偏振片一样,都是无源器件,不需要像液晶相位延迟器一样进行同步控制,可以简化SIM系统.
由以上分析可知,三种偏振控制方法均可对光束进行偏振控制,具体比较结果列于表1.可以看出,零级涡旋半波片法在系统复杂度和能量利用率方面有着明显的优势.

图7 零级涡旋半波片快轴方向分布示意图Fig.7.Distribution of the fast axis orientation of the zero-order vortex half-wave retarder.

图8 零级涡旋半波片偏振控制过程示意图Fig.8.Scheme of polarization control by using the zero-order vortex half-wave retarder.

表1 不同偏振控制方法的比较Table 1.Comparison of di ff erent polarization control methods.
4 实验结果
为了验证零级涡旋半波片的效果,我们搭建了如图9所示的SIM实验系统.波长532 nm激光器发出的水平线偏振光,通过偏振分光棱镜(PBS)和半波片,垂直入射铁电液晶空间光调制器(2048×1536 pixels,QXGA-3 DM,英国Forth Dimension Displays公司).利用Wen等[22]编写的程序计算衍射光栅图像,并加载到空间光调制器上.经空间光调制器衍射的光原路返回,再次通过半波片并由PBS反射进入后续光路.其中偏振分光棱镜、半波片和铁电液晶空间光调制器共同作用,相当于入射激光照射一个相位型衍射光栅[20],产生的垂直偏振±1级衍射光进入透镜1(焦距500 mm).实验中使用一个空间滤波器阻挡零级光,保留±1级衍射光通过.±1级衍射光经过零级涡旋半波片改变偏振态后,再通过透镜2(焦距175 mm)和透镜3(焦距125 mm)组成的共焦系统进入显微物镜(100×,NA=1.49,日本Nikon公司),两衍射光在物镜的焦平面附近上形成干涉条纹,激发样品产生荧光.荧光信号由物镜收集后通过二向色镜反射,经过筒镜,由sCMOS相机(2048×2048 pixels,ORCA- fl ash4.0,日本滨松公司)采集图像.
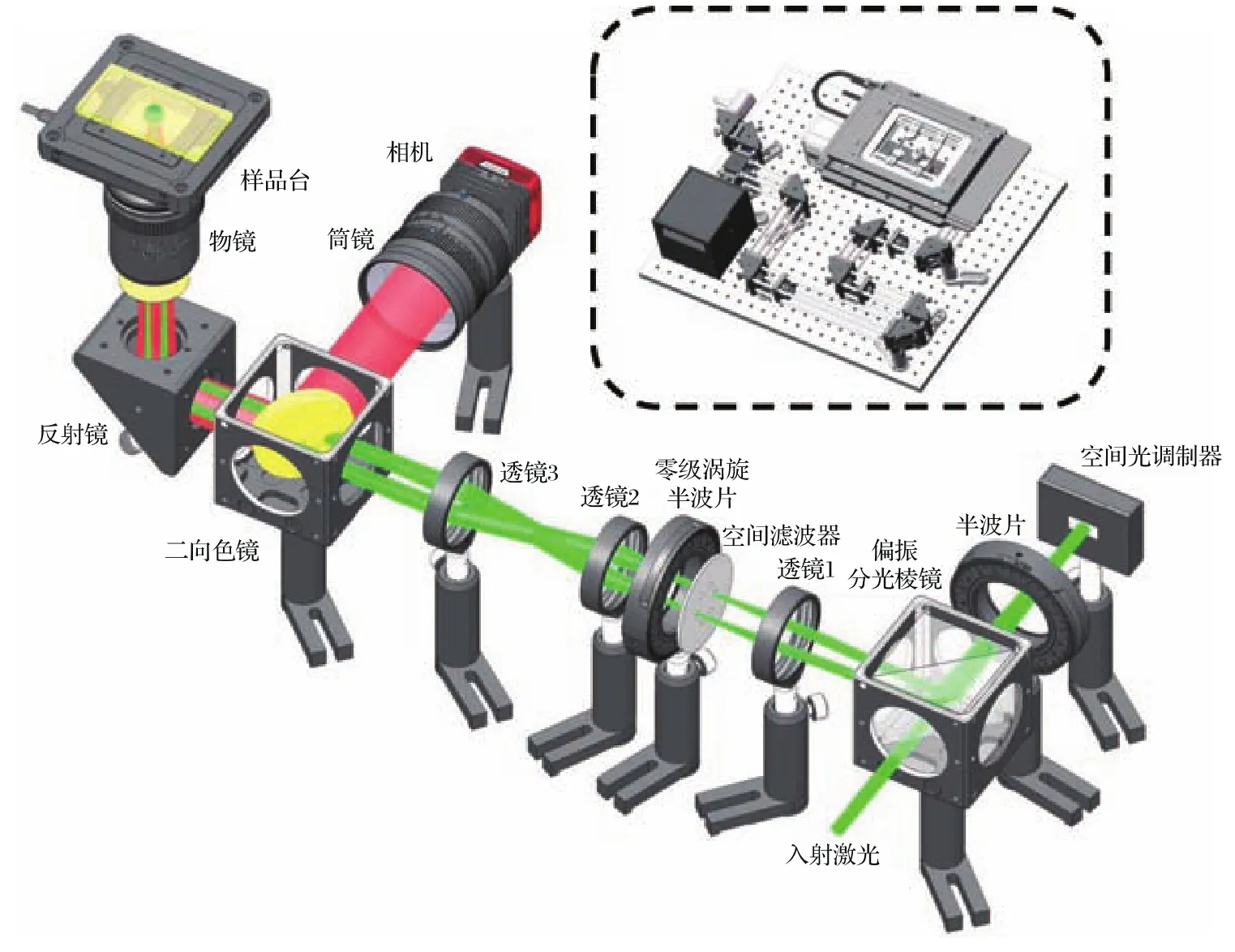
图9 使用零级涡旋半波片法进行偏振控制的SIM系统实验光路图Fig.9.Experimental setup of the interference-type structured illumination microscope by using the zeroorder vortex half-wave retarder for polarization control.
我们首先测试了偏振调制对作用在样品上的结构光干涉条纹对比度的影响.在这个实验中,为了调制±1级衍射光的偏振方向,将实验光路中的VHR换为一个半波片.实验以牛肺动脉内皮细胞(bovine pulmonary artery endothelial,BPAE)为测试样品,并选取了方向分别为0°,60°和-60°的条纹光场进行照明.为了更好地展示偏振控制对条纹对比度的影响,设置条纹的周期约为300 nm.图10显示了不同条纹方向下偏振方向对条纹对比度的影响.其中图10(a),(d),(g)为0°条纹时,条纹对比度随着偏振方向θ角的增大而增加,当θ=90°,即偏振方向为s偏振时,系统可获得最大的条纹对比度.图10(b),(e),(h)为条纹方向60°的情况;图10(c),(f),(i)为条纹方向-60°的情况.可见,使用零级涡旋半波片对偏振方向进行调制,保证了偏振方向始终为s偏振,从而可获取最大的条纹对比度.
接下来我们使用直径40 nm荧光小球对SIM系统进行了分辨率标定,结果如图11所示.图11(b)—图11(d)是两个近邻的小球成像结果.可以看出,在SIM下可以分辨的两个小球,由于两球相距180 nm,小于衍射极限,普通宽场下无法区分.同时,我们还测量了单个荧光小球的半高宽,如图11(e)—图11(g)所示,虚线表示普通宽场结果,其半高宽为240 nm,略大于衍射极限220 nm;实线表示SIM超分辨结果,半高宽为108 nm,比宽场结果分辨率提升一倍,实现了SIM技术可以达到的2倍分辨率提升效果.

图10 偏振方向对于不同方向条纹对比度的影响 对于0°,60°和-60°三个不同方向的条纹,偏振方向对样品上产生的干涉条纹对比度的影响:(a)—(c)θ=45°,(d)—(f)θ=60°,(g)—(i)θ=90°Fig.10.Comparison of the interference fringe contrast at di ff erent polarization directions.For di ff erent fringe orientations of 0°,60°and-60°,the variation of fringe contrast with the polarization directions:(a)–(c)θ=45°;(d)–(e)θ=60°,(g)–(i)θ=90°.
为了检验系统对生物样品的成像分辨能力,我们分别对大肠杆菌和人视网膜色素上皮细胞进行拍摄.图12是对大肠杆菌进行的超分辨成像结果.样品由Syto-64标记荧光,并吸附于经过poly-L-lysine处理后的盖玻片上.其中图12(a)左半边为普通宽场图像,右半边为SIM超分辨结果,可以清楚地看出,相对于宽场成像,我们的装置对图像分辨率有很大提升.图12(b)和图12(c)是图12(a)中虚线方框部分放大结果,图12(d)为图12(b)和图12(c)中直线标记位置的归一化强度分布,相对于虚线表示的宽场图像结果,实线表示的超分辨结果可以观察到大肠杆菌细胞质的分布变化.

图11 直径40 nm荧光小球超分辨结果 (a)结构光照明显微结果;(b)—(d)两个相邻小球的局部放大以及强度分布对比;(e)—(g)单个小球局部放大以及半高宽测量对比Fig.11.Super-resolution image of 40 nm-diameter fl uorescent beads:(a)SIM;(b)–(d)zoom-in of two beads and measurement of normalized intensity;(e)–(g)zoom-in of one bead and measurement of full width at half maximum.
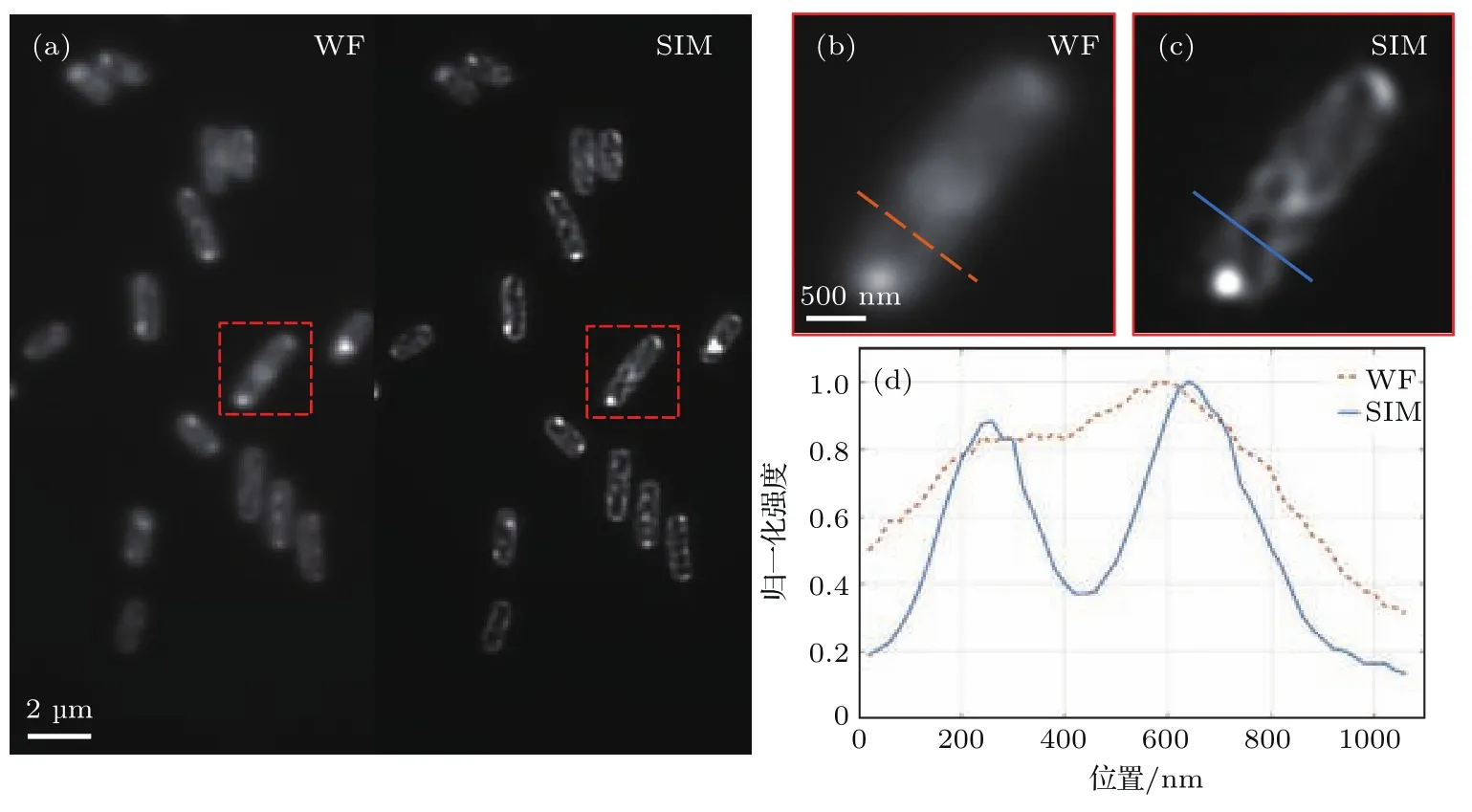
图12 大肠杆菌超分辨实验结果 (a)普通显微镜和结构光照明显微镜结果对比;(b)普通显微镜局部放大图; (c)结构光照明显微镜局部放大图;(d)局部放大图中直线标记处的归一化强度分布曲线Fig.12.Super-resolution image of E.coli:(a)Comparison of wide- field and SIM;(b)partly enlarged view of wide- field;(c)partly enlarged view of SIM;(d)normalized intensity pro fi les along the marked lines in(b) and(c).

图13 人视网膜色素上皮细胞超分辨结果 (a)普通显微镜和结构光照明显微镜结果对比;(b)普通显微镜局部放大图;(c)结构光照明显微镜局部放大图;(d)局部放大图中直线标记处的归一化强度分布曲线Fig.13.Super-resolution image of human retinal pigment epithelium:(a)Comparison of wide- field and SIM;(b)partly enlarged view of wide- field;(c)partly enlarged view of SIM;(d)normalized intensity pro fi les along the marked lines in(b)and(c).
图13是对人视网膜色素上皮细胞进行的超分辨成像结果,样品经过荧光免疫蛋白ab6160对细胞微管蛋白标记荧光.其中图13(a)左半边为普通宽场图像,右半边为SIM超分辨结果.图13(b)和图13(c)为图13(a)中红色虚线方框部分放大结果,相对于普通宽场结果,SIM图像可以更清晰地分辨细胞微管结构.图13(d)为图13(b)和图13(c)中直线标记位置处的归一化强度分布,可以看出在普通显微镜下无法分辨的两条微管结构,在SIM中可以清晰分辨.
5 结 论
在主流的远场超分辨光学显微成像技术中, SIM技术凭借高时间分辨率、低光毒性和低光漂白性等诸多优点,尤其适合对生物医学领域的活体样本进行超分辨动态观测.而激光干涉型SIM中的偏振控制是关键,决定了能否最终得到高质量的超分辨图像.本文详细对比了三种不同的偏振控制方法:相位延迟器法、分区偏振片法和零级涡旋半波片法.通过对三种方法的分析比较,证明了零级涡旋半波片法能对不同入射方向的光束进行偏振控制,并具有操作简单、光能利用率高的优点,对SIM技术的应用推广具有一定的意义.
感谢美国Bu ff alo大学Piero Bianco副教授提供大肠杆菌样品,感谢北京大学孙育杰课题组提供人视网膜色素上皮细胞样品.
[1]Abbe E 1873 Arc.F.Mikr.Anat.9 413
[2]Conchello J A,Lichtman J W 2005 Nat.Methods 2 920
[3]Wicker K,Sindbert S,Heintzmann R 2009 Opt.Express 17 15491
[4]Hell S W,Wichmann J 1994 Opt.Lett.19 780
[5]Klar T A,Hell S W 1999 Opt.Lett.24 954
[6]Betzig E,Patterson G H,Sougrat R,Lindwasser O W, Olenych S,Bonifacino J S,Davidson M W,Lippincott-Schwartz J,Hess H F 2006 Science 313 1642
[7]Huang F,Hartwich T M P,Riveramolina F E,Lin Y, Duim W C,Long J J,Uchil P D,Myers J R,Baird M A,Mothes W 2013 Nat.Methods 10 653
[8]Huang B,Wang W,Bates M,Zhuang X 2008 Science 319 810
[9]Rust M J,Bates M,Zhuang X 2006 Nat.Methods 3 793
[10]Heintzmann R,Cremer C G 1999 Proceedings of SPIE Stockholm,Sweden,January 19,1999 p1399
[11]Gustafsson M G,Agard D A,Sedat J W 2000 Proceedings of SPIE San Jose,USA,May 2,2000 p141
[12]Shao L,Kner P,Rego E H,Gustafsson M G 2011 Nat. Methods 8 1044
[13]Schermelleh L,Carlton P M,Haase S,Shao L,Winoto L, Kner P,Burke B,Cardoso M C,Agard D A,Gustafsson M G 2008 Science 320 1332
[14]Shao L,Isaac B,Uzawa S,Agard D A,Sedat J W, Gustafsson M G 2008 Biophys.J.94 4971
[15]Gustafsson M G 2005 Proc.Natl.Acad.Scis 102 13081
[16]Li D,Shao L,Chen B C,Zhang X,Zhang M,Moses B, Milkie D E,Beach J R,Pasham M 2015 Science 349 aab3500
[17]Shro ffS A,Fienup J R,Williams D R 2009 J.Opt. Soc.Am.A:Opt.Image Sci.Vis.26 413
[18]Wicker K 2013 Opt.Express 21 24692
[19]Zhou X,Lei M,Dan D,Yao B,Yang Y,Qian J,Chen G,Bianco P R 2016 J.Biomed.Opt.21 96009
[20]Kner P,Chhun B,Griffis E,Winoto L,Gustafsson M G 2009 Nat.Methods 6 339
[21]Föster R,Luwalther H W,Jost A,Kielhorn M,Kai W, Heintzmann R 2014 Opt.Express 22 20663
[22]Wen L H,Martin K,Föster R,Jost A,Kai W,Rainer H 2015 Methods Appl.Fluoresc.3 014001
PACS:87.64.M—,87.64.kv DOI:10.7498/aps.66.148704
Polarization control methods in structured illumination microscopy∗
Zhao Tian-Yu1)2)Zhou Xing1)Dan Dan1)Qian Jia1)Wang Zhao-Jun1)Lei Ming1)†Yao Bao-Li1)‡
1)(State Key Laboratory of Transient Optics and Photonics,Xi’an Institute of Optics and Precision Mechanics,Chinese Academy of Sciences,Xi’an 710119,China)
2)(University of Chinese Academy of Sciences,Beijing 100049,China)
16 May 2017;revised manuscript
13 June 2017)
Structured illumination microscopy(SIM)is one of the most promising super-resolution techniques,owing to its advantages of fast imaging speed and weak photo bleaching.The quality of the SIM image is greatly dependent on the contrast of the sinusoidal fringe illumination patterns.Low fringe contrast illumination will seriously a ff ect the super-resolution result and lead to additional artifacts.The generation of fringe patterns with high contrast is the key requirement in hardware for the SIM technique.This can be done by the interference of two laser beams di ff racted from the phase gratings addressed on a spatial light modulator.Meanwhile,for maximal interference contrast,precise polarization control to maintain s-polarization for di ff erent fringe orientations is critical.In this paper,we review several typical polarization control methods in SIM,and propose a new method by using a zero-order vortex half-wave retarder (VHR).Compared with the other methods,the presented VHR-based polarization control method is very efficient in terms of simple system con fi guration,ease of use,and high light energy utilization efficiency near to 100%.
structured illumination microscopy,super-resolution,polarization control,zero-order vortex half-wave retarder
:87.64.M—,87.64.kv
10.7498/aps.66.148704
∗国家自然科学基金(批准号:61522511,11404389,81427802,11474352)和陕西省自然科学基础研究计划(批准号:2016JZ020)资助的课题.
†通信作者.E-mail:leiming@opt.ac.cn
‡通信作者.E-mail:yaobl@opt.ac.cn
©2017中国物理学会Chinese Physical Society
http://wulixb.iphy.ac.cn
*Project supported by the National Natural Science Foundation of China(Grant Nos.61522511,11404389,81427802, 11474352)and the Basic Research Plan of Natural Science in Shaanxi Province,China(Grant No.2016JZ020).
†Corresponding author.E-mail:leiming@opt.ac.cn
‡Corresponding author.E-mail:yaobl@opt.ac.cn

