降服多反应体系试题的杀手锏
广东 周曼文
降服多反应体系试题的杀手锏
广东 周曼文
化学反应常有“平行反应”和“连串反应”两类,平行反应主要是指多个反应同时进行;而连串反应主要是指多个反应按一定的先后顺序逐次进行。高中阶段接触的平行反应如:实验室用乙醇、浓硫酸制乙烯(同时会生成乙醚);用碳棒作电极电解氧化铝的阳极反应生成O2(同时产生O3、CO、CO2);“连串反应”由于反应物性质的强弱而导致的先后顺序反应又叫“竞争反应”,如把Cl2通入含I-、Br-、Fe2+的溶液中,按照还原能力由强到弱的顺序,I-优先反应,其次是Fe2+,最后是Br-;再如把盐酸逐滴加入到含有NaOH、Na2CO3、NaHCO3的混合溶液中,按照碱性由强到弱的顺序,NaOH优先反应,其次是Na2CO3,最后是NaHCO3;当然也有由于物质出现的先后导致连串反应,如久置的氯水就是稀盐酸。其实,真实的化学实验和实际的化工生产中,由于反应物性质、反应环境和条件的共同影响,其反应实质可能更复杂(如共沉淀反应等),因此,以多反应体系为素材的高考试题,也备受高考命题者青睐;这样的试题往往是一套试卷的最难点,区分度高,选拔性强;能测出考生运用化学知识解决实际问题的能力。
这类试题的解答技巧,一般有三个关键:
一、找到多反应体系涉及的各个反应
例1 (2016北京,28节选)以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。

试剂实验现象滴管试管饱和Ag2SO4溶液Ⅰ.产生白色沉淀Ⅱ.溶液变绿,继续滴0.2mol·L-1Na2SO3溶液0.2mol·L-1CuSO4溶液加产生棕黄色沉淀Ⅲ.开始无明显变化,继续滴加产生白色2mL 0.1mol·L-1Al2(SO4)3溶液沉淀
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。

a.白色沉淀A是BaSO4,试剂1是_________________。
b.证实沉淀中含有Cu2+和S的理由是_________________________________________________________________。
【答案】(2)①加入稀硫酸后,有红色固体生成②a.HCl和BaCl2溶液 b.在I-的作用下,Cu2+转化为白色沉淀转化为


所以,试剂1为HCl和BaCl2溶液;白色沉淀CuI证明了Cu2+的存在,白色沉淀A(BaSO4)中的S由S氧化得到。
【点拨】考生理解“棕黄色沉淀中含有Cu+、Cu2+和S的前提是CuSO4溶液与Na2SO3溶液混合过程中出现的两反应:
二、厘清多反应体系中各反应的顺序
例2 (2013广东,31节选)大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(3)为探究Fe2+对氧化I-反应的影响(反应体如图1),某研究小组测定两组实验中浓度和体系pH,结果见图2和下表。

____编号____________反应物反应前pH反应后pH___第1组__________O3+I-5.2 11.0_____第2组______O3+I-+Fe2+5.2 4.1___
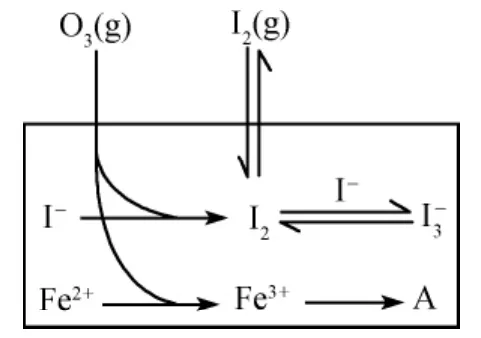
图1

图2
①第1组实验中,导致反应后pH升高的原因是_________________________。
②图1中的A为________,由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________________。
③第2组实验进行18s后,I3-下降。导致下降的直接原因有________(双选)。
A.c(H+)减小B.c(I-)减小
C.I2(g)不断生成D.c(Fe3+)增加
【答案】(3)①反应过程中消耗氢离子,溶液酸性减弱,pH增大,水电离出氢离子参与反应破坏水的电离平衡,氢氧根浓度增大,溶液呈碱性,pH增大 ②Fe(OH)3Fe3+生成Fe(OH)3的过程,降低了体系的pH,促进了总反应的完成,提高了I-的转化率 ③BC
【解析】(3)①由表格可以看出第一组溶液的pH由反应前的5.2变为反应后的11.0,其原因是反应过程中消耗H+,溶液酸性减弱,pH增大,水电离出H+参与反应,破坏水的电离平衡,OH-浓度增大,溶液呈碱性,pH增大。②Fe3+生成Fe(OH)3的过程,降低了体系的pH,促进了总反应正向移动,提高了I-的转化率。③由图1和“直接原因”信息提示可解。
【点拨】该题争议较大的是第③小题,有人认为选BD,理由:由于是持续通入O2+H2O,O2可以将Fe2+氧化为Fe3+,Fe3+可氧化I-,故I-消耗量增大,转化率增大,与I2反应的量减少,I-3浓度减小。用图1信息,厘清反应顺序关系,证实该反应体系中Fe3+几乎不会与I-反应,而是以水解反应为主,起调节pH作用,所以应选BC。
例3 (2014北京,28节选)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):

序号电压/V 阳极现象检验阳极产物_Ⅰ___x≥a__电极附近出现黄色,有气泡产生有Fe3+、有Cl 2_Ⅱ_a>x≥b电极附近出现黄色,无气泡产生_有Fe3+、无Cl 2_Ⅲ_b>x>0_________无明显变化无Fe3+、无Cl 2
(1)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应:_________________。
(2)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(3)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的0.2mol/L NaCl溶液做对照实验,记录如下:

__序号电压/V 阳极现象_______检验阳极产物___Ⅳ____a>x≥c___无明显变化有Cl2_______________Ⅴ____c>x≥b___无明显变化无Cl2___________
与Ⅱ对比,得出的结论:__________________________________________(写出两点)。
【答案】(1)2Cl-2Fe3++2Cl-
(2)还原
(3)①控制电压c>x≥b,可以实现Fe2+先于Cl-放电。②控制电压a>x≥c,产生Fe3+的两种原因都成立
【解析】(1)将“Cl-在阳极放电,生成的Cl2将Fe2+氧化”翻译成化学方程式。(2)将“Fe2+在阳极放电”翻译成电极反应“”,失电子表现粒子的还原性。(3)这是一个消除Fe2+干扰,控制c(Cl-)为0.2mol/L,测电压与Cl-放电关系的实验。通过实验Ⅳ、Ⅴ和Ⅱ的现象对比,得到结论:①控制电压c>x≥b,可以实现Fe2+先于Cl-放电。②控制电压a>x≥c,产生Fe3+的两种原因都成立。
【点拨】该题第(1)(2)小问是向考生提出了产生Fe3+的两种原因,也展示实验Ⅰ就是一个多反应体系,为了探清楚电压与Fe2+、Cl-放电顺序的关系而设置后面的实验。
三、弄清反应过程中各反应之间相互影响
例4 (2015全国Ⅱ,27节选)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:

回答下列问题:
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是______________________。下图中的压强由大到小为________,其判断理由是_______________________________。

【答案】(3)减小 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO浓度增大,反应③为吸热反应,平衡向右移动,也使CO的浓度增大,总结果:温度升高,CO的转化率降低 p3>p2>p1相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率,反应③为气体分子数不变的反应,加压平衡不移动,总结果:增大压强,有利于CO的转化率升高
【解析】温度对CO平衡转化率(α)的影响与反应①③有关,反应①为放热反应,升高温度时,平衡向左移动,反应③为吸热反应,升高温度时,平衡向右移动,都使得c(CO)增加,转化率降低。压强对CO平衡转化率(α)的影响也与反应①③有关,反应①为气体分子数减小的反应,加压有利于提升CO的转化率,反应③为气体分子数不变的反应,加压平衡不移动,两者因素叠加,增大压强,有利于CO的转化率升高。
【点拨】因为图中描述的是CO平衡转化率(α)与温度和压强的关系,所以,主要分析反应①③之间的相互影响。
(作者单位:广东省佛山市三水中学)

