高考化学计算型试题分类例析
陕西 马亚楼
高考化学计算型试题分类例析
陕西 马亚楼
计算型试题既能考查基础知识,又能考查计算能力,在近年的高考中占有较大比重,其考查方式主要有以下几类:
一、氧化还原反应的计算
例1 (2015新课标Ⅱ)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为________。
解析:本题主要考查氧化还原反应的有关计算,解题时依据电子得失相等即可。工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,在反应中氯元素的化合价从+5价降低到+4价,得到1个电子,氯酸钾是氧化剂。S元素的化合价从+4升高到+6价,失去2个电子,亚硫酸钠是还原剂,则根据电子得失相等可知该反应氧化剂与还原剂物质的量之比为2∶1。
答案:2∶1
例2 (2016上海)某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mL Cl2,恰好将Fe2+完全氧化。x值为( )
A.0.80B.0.85
C.0.90D.0.93
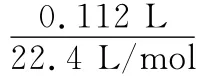
答案:A
【点评】进行氧化还原反应计算时,注意氧化还原反应中电子转移守恒原理的运用,注意平均化合价的应用,等等。氧化还原反应侧重考查学生的计算分析能力。
二、物质的量的计算
例3 (2015新课标Ⅰ)乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )

A.1∶1B.2∶3
C.3∶2D.2∶1
解析:本题主要考查有关物质的量的计算,由题给乌洛托品的结构简式可知该有机物的分子式为C6H12N4,根据元素守恒,则C元素来自甲醛,N元素来自氨,所以分子中的C与N原子的个数比即为甲醛与氨的物质的量之比为6∶4=3∶2,故选C。
答案:C
例4 (2016上海)称取(NH4)2SO4和NH4HSO4混合物样品7.24g,加入含0.1mol NaOH的溶液,完全反应,生成NH31 792mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )
A.1∶1 B.1∶2C.1.87∶1D.3.65∶1
解析:本题主要考查混合物的计算。解题时先利用极值法判断氢氧化钠过量情况,氢氧化钠不足时硫酸氢铵电离出的氢离子优先反应,然后铵根离子与氢氧化钠反应,根据氨气的物质的量可计算出硫酸氢铵的物质的量,然后利用总质量可计算出硫酸铵的质量,最后可计算出混合物中(NH4)2SO4和NH4HSO4的物质的量之比。

答案:C
【点评】有关物质的量的计算常常涉及微粒个数、混合物分析等,题目难度中等,正确分析微粒情况及发生反应的先后顺序是解题的关键。实际运用中注意掌握极值法等计算方法在化学计算中的应用,培养分析能力及化学计算能力。
三、反应热、燃烧热的计算
例5 (2016海南)油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:

已知燃烧1kg该化合物释放出热量3.8×104kJ,油酸甘油酯的燃烧热为( )
A.3.8×104kJ·mol-1B.-3.8×104kJ·mol-1
C.3.4×104kJ·mol-1D.-3.4×104kJ·mol-1
解析:本题主要考查由热量来计算反应热。由于燃烧热指的是燃烧1mol可燃物生成稳定的氧化物所放出的热量。燃烧1kg油酸甘油酯释放出热量3.8×104kJ,则1kg该化合物的物质的量为1 000g÷884g/mol,则油酸甘油酯的燃烧热ΔH=-3.8×104kJ÷(1 000g÷884g/mol)=-3.4×104kJ·mol-1,故选D。
答案:D
例6 (2016浙江)催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:

答案:+41.2
【点评】这类试题解题的关键是理解反应热、燃烧热的,熟练运用盖斯定律,并要注意燃烧物质的物质的量等数量关系。
四、化学平衡的计算
例7 (2016四川,节选)在一定条件下CO(g)+H2OH2(g),当CO与H2O(g)的起始物质的量之比为1∶5,达平衡时,CO转化了。若akg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1∶3混合,则在相同条件下达平衡时能产生H2______________kg。
解析:本题是有关化学平衡的计算,解题时根据题给数据利用三行式分析即可。设CO的起始浓度为1mol/L,则水蒸气的起始浓度为5mol/L。

相同条件下当CO与H2O(g)的起始物质的量之比为1∶3,平衡常数不变,设转化的CO为x。
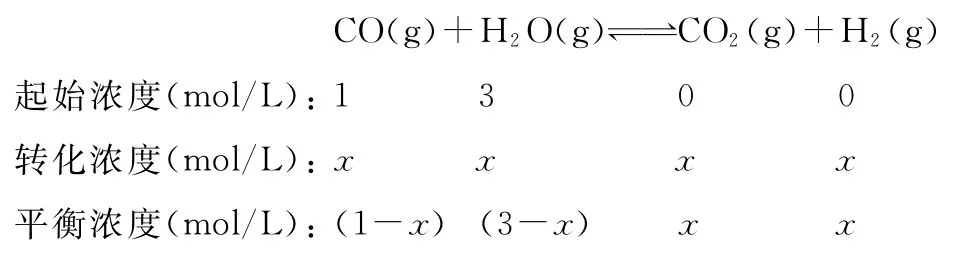
【点评】关于化学平衡的计算,需要注意理解平衡常数的意义,分析物质间转化的关系等,试题计算量一般较大,难度较大,但能够充分考查学生的分析、理解、运用及计算等能力。
五、综合性计算
例8 (2016上海)CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为________L(标准状况)。
(2)某H2中含有2.40mol CO2,该混合气体通入2.00LNaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为________。
(3)CO2和KO2有下列反应:

若9mol CO2在密封舱内和KO2反应后生成9mol O2,则反应前密封舱内H2O的量应该是多少?列式计算。

300mol CH4完全反应后的产物中,加入100mol CO2后合成甲醇。若获得甲醇350mol,残留氢气120mol,计算CO2的转化率。

(2)2.40mol CO2与NaOH完全反应,产物可能为Na2CO3或NaHCO3或二者都有,假设全部生成NaHCO3,则发生2.40mol,则c(NaOH)==1.20mol/L;假设全部生成Na2CO3,则发生2n(CO2)=4.80mol,则c(NaOH)=综合以上两种情况可知,NaOH溶液的浓度应该为1.20mol/L≤c(NaOH)≤2.40mol/L。
(3)可用两种方法解答:
方法一:依题意,9mol CO2在密封舱内和KO2反应后生成9mol O2,即n(CO2)∶n(O2)=1∶1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:所以有即反应前密封舱内H2O的物质的量为3mol。
方法二:设反应前密封舱内H2O的物质的量为n

根据题意生成氧气9mol,所以有1.5n+1.5(9-2n)=9mol,解得n=3mol,即反应前密封舱内H2O的物质的量为3mol。
(4)方法一:

设CO2的转化率为α,CO的转化率为β
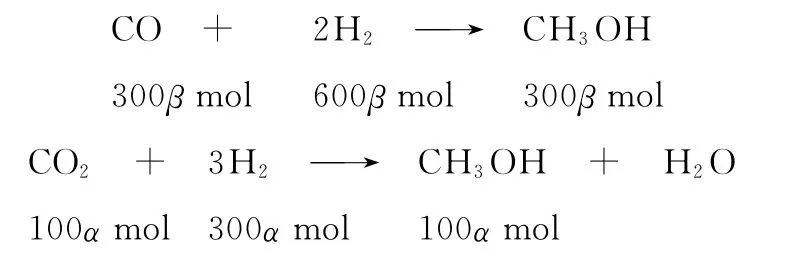
根据题意,共生成350mol甲醇,所以有300βmol+100αmol=350mol ①
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-120mol,所以有
600βmol+300αmol=900mol-120mol ②
由①②式可得α=0.8,即CO2的转化率为80%。
方法二:
在合成甲醇的反应中,氢元素在生成物中有两种存在形式,一是存在于甲醇中,二是存在于水中,设CO2的转化率为α,

根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-120mol,根据反应中氢元素的守恒可有900mol-120mol=350mol×2+100αmol,解得α=0.8,即设CO2的转化率为80%。
答案:(1)89.6 (2)2.4mol/L≥c≥1.2mol/L(3)反应前密封舱内H2O的量应该是3mol (4)CO2的转化率为80%
【点评】本题考查化学方程式的计算,综合考查学生的分析、计算能力,题目用到端值法和守恒法,难度较大,易错点为(4),答题时注意细心。
(作者单位:陕西省永寿县中学)

