化学实验,高考怎么考?
安徽 王 永
化学实验,高考怎么考?
安徽 王 永
化学是一门实验性的学科,近年化学实验在高考中均有考查,难度不大,是高频考点。该类题知识零散、覆盖面广泛,主要以选择题形式出现,往往是几项实验的拼盘,这就要求在复习时要能够全面、系统,才能顺利解决这类试题。
一、化学仪器、实验基本操作的考查
【例1】(2016海南)下列有关实验操作的叙述错误的是( )
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
【解析】本题主要考查实验基本操作。A.过滤操作中,漏斗的尖端应紧靠烧杯内壁,使液体顺利流下,正确;B.胶头滴管的尖嘴不能接触试管内壁,否则会造成试剂污染,错误;C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁,使残留在滴定管尖嘴的液体进入到锥形瓶,正确;D.向容量瓶转移液体时,导流用的玻璃棒的下端要接触容量瓶内壁(刻度线以下),防止产生误差,正确;答案为B。
【解题指导】学化学、做实验,都有一个使用仪器、规范操作等基本实验能力的考查,有时不仅需要定性实验,还需要进行定量实验。解题时,首先要对常见仪器的用途及使用方法有所了解、掌握,对一些化学基本操作如酸碱中和滴定、物质的量浓度的溶液配制过程中应该注意的问题、误差分析等有个统一地、准确地掌握。然后对各个选项考查的内容和知识逐一进行剖析,各个击破。
【知识储备】(1)明确三种仪器的精确度:托盘天平(0.1g)、10mL量筒(0.1mL)、滴定管(0.01mL)。
(2)牢记三种必须检漏的仪器:分液漏斗、容量瓶、滴定管。
(3)注意两种多用的仪器:①胶头滴管:量取一定体积液体和物质的量浓度溶液的配制;
②玻璃棒:过滤、蒸发和配制一定物质的量浓度溶液。
二、物质的分离、除杂、净化在化学实验中的考查
【例2】(2016课标Ⅰ)下列实验操作能达到实验目的的是( )
A.用长颈漏斗分离出乙酸与乙醇反应的产物
B.用向上排空气法收集铜粉与稀硝酸反应产生的NO
C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
【解析】本题考查的是分液、气体的收集、除杂以及水解原理的应用等实验内容的拼盘。A.乙酸与乙醇生成乙酸乙酯,该物质密度比水小且难溶于水,而未反应的乙酸和乙醇均易溶于水,分离互不相溶的液体要用分液漏斗,错误;B.NO的密度与空气接近且能与O2反应,故不能用排空气法,可以用排水法收集,错误;C.氯化铁是强酸弱碱盐水解生成少量难溶性氢氧化铁使溶液变浑浊,使溶液显酸性,将氯化铁溶解在较浓的盐酸中再加水稀释,可以有效抑制氯化铁的水解,正确;D.根据平衡原理饱和食盐水能够减少氯气的溶解,能够除去HCl气体,但不能除去水蒸气,故得不到纯净的Cl2,错误;答案为C。
【例3】(2016课标Ⅲ)下列有关实验的操作正确的是( )

______________实验操作先将浓硫酸加入烧杯中,后倒入A配制稀硫酸蒸馏水B排水法收集KMnO4分解产生的O2________________________________________________________________________先熄灭酒精灯,后移出导管气体产物先通过浓硫酸,后通过C浓盐酸与MnO2反应制备纯净Cl2饱和食盐水先从分液漏斗下口放出有机层,D CCl4萃取碘水中的I2后从上口倒出水层
【解析】本题考查浓硫酸的稀释,气体除杂,萃取操作。A.浓硫酸稀释时应将浓硫酸沿烧杯壁缓慢注入水中并不断搅拌,错误;B.实验后应先移出导管后再熄灭酒精灯,防止倒吸,错误;C.产生的氯气中含有HCl和H2O两种杂质,应先通过饱和食盐水除去HCl,再通过浓硫酸除去H2O蒸气,错误;D.CCl4密度大于水,有机层在下层,所以先从下口放出有机层,后从上层到出水层,正确;答案为D。
【解题指导】物质的除杂和提纯中我们经常是最后除去水,可以防止在后面的除杂过程中引入水蒸气。验证水蒸气时,先验证水蒸气的存在,防止引入水蒸气产生干扰,验证水蒸气常用无水硫酸铜,如果出现白色变为蓝色,证明水蒸气的存在。解题时需要掌握物质的物理性质、化学性质、常见的分离混合物的方法、常见的仪器的名称、使用,化学试剂的使用、分离方法及名称、操作的先后顺序等,这样才可以得心应手,做出正确的分析与判断。
【知识储备】(1)蒸发时有大量晶体析出时要停止加热,利用余热继续蒸干。
(2)过滤时,滤纸要紧贴并低于漏斗边缘,液面低于滤纸边缘,引流时玻璃棒靠在三层滤纸上,漏斗下端要紧靠烧杯内壁。
(3)萃取时,萃取剂与原溶剂要互不相溶,如可用苯、四氯化碳萃取溴水中的溴,而不能用酒精来萃取。
(4)分液时,下层液体先从下口放出,上层液体再从上口到出。
(5)蒸馏时,加碎瓷片防止暴沸,温度计水银球应在蒸馏烧瓶支管口处,冷却水应从下口进水上口出水。
(6)除杂时,不能引入新的杂质。
三、物质检验及元素化合物知识在化学实验中的考查
【例4】(2015天津)下列关于物质或离子检验的叙述正确的是( )
A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
【解析】本题考查常见物质及离子检验,侧重对基础知识的考查,注意对基础知识的掌握积累。A.Fe3+遇KSCN会使溶液呈现红色,Fe2+遇KSCN不反应无现象,如果该溶液既含Fe3+,又含Fe2+,滴加KSCN溶液,溶液呈红色,则证明存在Fe3+,并不能证明无Fe2+,错误;B.气体通过无水硫酸铜,粉末变蓝,发生CuSO4+5H2OCuSO4·5H2O,可证明原气体中含有水蒸气,故B正确;C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,并不能证明无K+,Na+焰色反应为黄色,可遮住紫光,K+焰色反应需透过蓝色的钴玻璃滤去黄光后观察到浅紫色火焰,故C错误;D.能使澄清石灰水变浑浊的气体有CO2、SO2等,故将气体通入澄清石灰水,溶液变浑浊,则原气体不一定是CO2,故D错误;答案为B。
【解题指导】物质的检验要注意两点:一是试剂的选择,检验的顺序;二是要排除其他离子的干扰。试剂的选择在平时学习时要注意积累,要特别注意如何排除其他离子的干扰。如怎样鉴别溶液中既有Fe2+又有Fe3+?Fe3+可以用硫氰酸钾溶液变红来检验,而Fe2+的检验就要另取少量溶液滴入酸性高锰酸钾或溴水看是否褪色。
【知识储备】常见部分物质或离子的检验:
(1)H2O:检验用无水硫酸铜(变蓝),除去用干燥剂如浓硫酸、碱石灰等。
(2)Cl2:能使湿润的KI-淀粉试纸变蓝。
(3)SO2:使品红溶液褪色,微热后又恢复红色。
(4)NH3:能使湿润的红色石蕊试纸变蓝,或靠近蘸有浓盐酸的玻璃棒有白烟生成。
(5)Fe2+:NaOH溶液(白色沉淀迅速变为灰绿色最终变为红褐色)或氯水、溴水、酸性高锰酸钾溶液等(溶液褪色)。
(6)Fe3+:NaOH溶液(红褐色沉淀)或硫氰酸钾溶液(变红)、苯酚溶液(显紫色)。
(7)苯酚:Fe3+(显紫色)、浓溴水(白色沉淀)。
(8)蛋白质:灼烧(烧焦羽毛气味)、浓硝酸(显黄色)。
四、气体的制备和性质在化学实验中的考查
【例5】(2016上海)下列气体的制备和性质实验中,由现象得出的结论错误的是( )
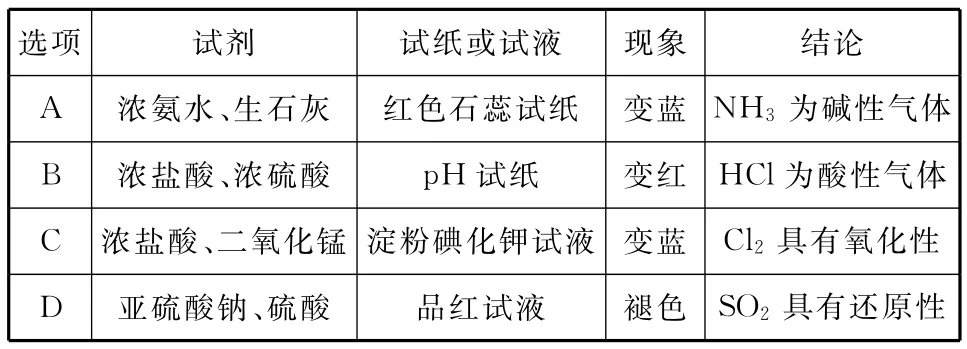
选项试剂试纸或试液现象结论_A___浓氨水、生石灰___红色石蕊试纸变蓝NH3为碱性气体_B___浓盐酸、浓硫酸_____pH试纸变红HCl为酸性气体_C__浓盐酸、二氧化锰淀粉碘化钾试液_变蓝Cl2具有氧化性__D___亚硫酸钠、硫酸_____品红试液褪色SO2具有还原性
【解析】本题考查常见气体的制备和性质实验。A.NH3制备可以采取浓氨水和生石灰制取,可用红色石蕊试纸检验,试纸变蓝则说明NH3为碱性气体,正确;B.利用浓硫酸的高沸点性,可以制取HCl气体,pH试纸变红,则说明气体为酸性气体,正确;C.浓盐酸和二氧化锰加热可以制取Cl2,Cl2可以用湿润的淀粉碘化钾试纸检验,试纸变蓝,说明KI转化为I2,则说明Cl2有强氧化性,正确;D.SO2使品红溶液褪色体现的是SO2的漂白性,错误;答案为D。
【解题指导】关于气体的制备和性质的思路可归纳为反应原理→气体发生装置→除杂提纯→干燥→收集→检验→尾气处理。至于各步所需要的仪器、试剂、操作方法等要依据物质的性质和反应条件进行选择,所以,熟练掌握物质的性质和反应原理是解答实验题的关键。
【知识储备】常见部分气体的净化、干燥和收集:
(1)Cl2:先通过饱和食盐水再通过浓硫酸,向上排空气法收集。
(2)NH3:利用碱石灰干燥,向下排空气法收集(注意瓶口塞一团棉花)。
(3)HCl:利用浓硫酸干燥,向上排空气法收集。
(4)SO2、CO2:除杂用对应的饱和酸式盐溶液,如分别用饱和NaHSO3溶液、饱和NaHCO3溶液,干燥可用浓硫酸或CaCl2,向上排空气法收集。
五、实验设计与评价在化学实验中的考查
【例6】(2016四川)根据下列实验操作和现象得出的结论正确的是( )
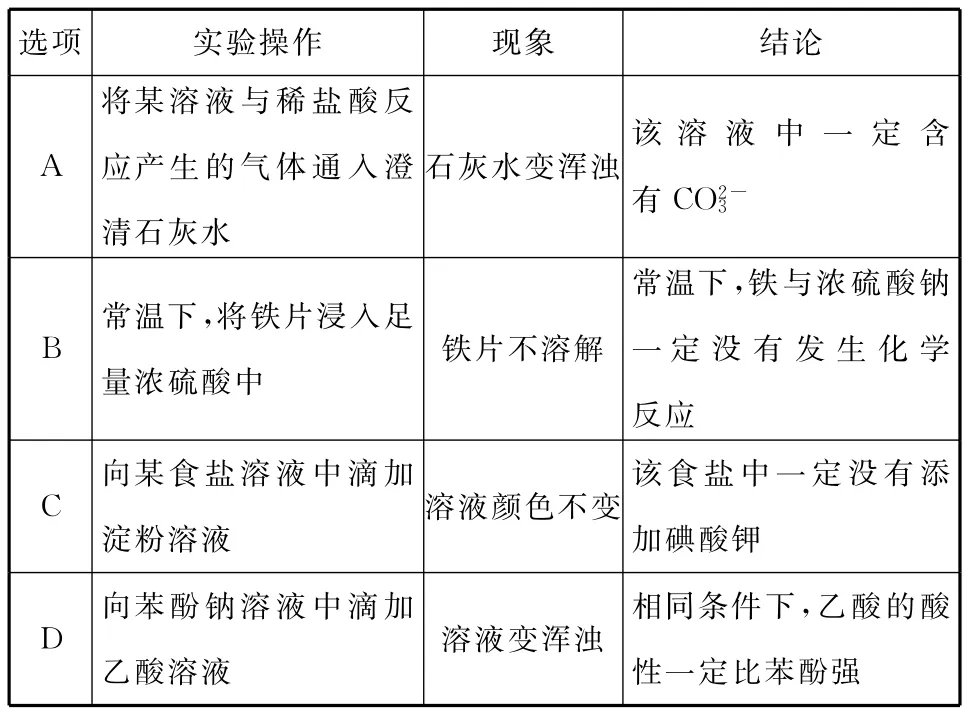
选项实验操作现象_____________结论A将某溶液与稀盐酸反应产生的气体通入澄_____清石灰水石灰水变浑浊该溶液中一定含有CO2-3B常温下,将铁片浸入足量浓硫酸中铁片不溶解常温下,铁与浓硫酸钠一定没有发生化学_________________________________________反应该食盐中一定没有添C向某食盐溶液中滴加淀粉溶液溶液颜色不变加碘酸钾相同条件下,乙酸的酸D向苯酚钠溶液中滴加______乙酸溶液溶液变浑浊性一定比苯酚强______
【解析】本题考查化学实验方案的分析、评价,离子检验,元素化合物知识。A.将某溶液与稀盐酸反应产生的气体通入澄清石灰水产生白色沉淀,该溶液中可能含有HCO-3、CO2-3、SO2-3、HSO-3等离子,错误;B.铁在常温下在浓硫酸中钝化,发生了化学反应,错误;C.碘酸钾和淀粉不反应,是碘单质遇到淀粉显蓝色,错误;D.苯酚钠和二氧化碳反应生成苯酚和碳酸氢钠,说明碳酸酸性比苯酚强,故正确;答案为D。
【解题指导】解答综合性实验设计与评价题的基本流程:原理→反应物质→仪器装置→现象→结论→作用意义→联想。具体分析如下:
①实验的原理和目的是什么?
②所用各物质名称、状态、代替物(根据实验目的和相关的化学反应原理,进行全面的分析比较和推理,并合理选择)。
③有关装置:性能、使用方法、适用范围、注意问题、是否有替代装置可用、仪器规格等。
④有关操作:技能、操作顺序、注意事项或操作错误的后果。
⑤实验现象:自下而上,自左而右全面观察。
⑥实验结论:直接结论或导出结论。
对实验方案的正确与错误、严密与不严密、准确与不准确的判断,主要从以下几个方面考虑:
①实验原理是否正确、可行。
②实验操作是否简单可行、合理。
③实验步骤是否简单、方便。
④实验现象效果是否明显等。
⑤反应原料是否易得、安全、无毒。
⑥反应速率的快慢。
⑦原料利用率以及合成物质的产率是否较高。
⑧合成过程是否造成环境污染。
⑨有无化学安全隐患,如倒吸、爆炸、吸水、泄漏、着火、溅液、破损等。
【知识储备】实验设计的四原则:
①科学性:实验原理准确,实验流程合理。
②安全性:保护人身,保护环境,保护仪器。
③可行性:条件允许,效果明显,操作简便可行。
④简约性:方案简单易行,尽可能采取简单的实验装置,用较少的步骤和药品完成实验。
方案评价六标准:
装置最简、原理简单、操作方便、安全无危险、环保无污染、现象最明显。
实验题的考查涉及知识零散、覆盖面广泛,复习过程中要做好有关专题总结、尽量多走进实验室进行基础实验训练,要注意教材中的演示实验要分析、理解到位,包括实验操作、现象和结论,要以做实验的心态面对实验题。
(作者单位:安徽省灵璧县第一中学)

