高考选择题命题热点
——物质的分离与提纯
安徽 尉言勋 李怀远
高考选择题命题热点
——物质的分离与提纯
安徽 尉言勋 李怀远
物质的检验、分离与提纯是化学实验中的重要内容,也是近年高考命题的必考热点。主要考查学生的实验能力和化学学科素养,知识点的覆盖面比较广,有时一个题目会对几个知识点同时进行考查。复习时,要注意指导学生总结归纳,构建网络,利用高考真题,探寻命题规律,力求做到“记住、理解、会用”。对基本分离、提纯方法,实验基本技能进行准确定位,以提高复习的针对性和实效性,既要全面复习,不留死角,更要突出重点。本文对高考中高频考点物质的分离与提纯进行了对比与分析,归纳了常见的分离与提纯方法,在对近四年典型高考真题分析的基础上,对每一道高考真题都进行了详细的解析,希望对同学们的学习有一定的帮助作用。
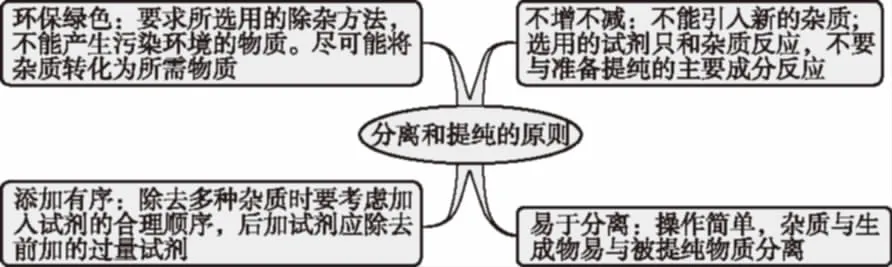
一、分离和提纯的原则
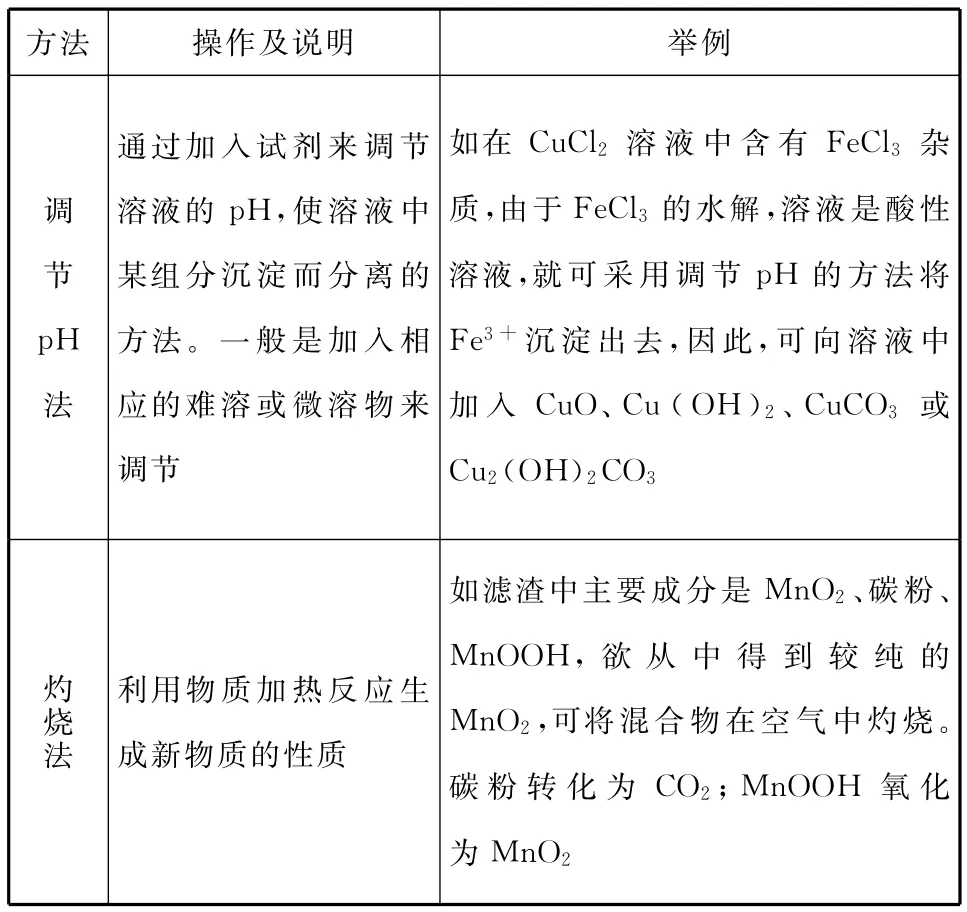
二、分离和提纯方法对比分析
混合物的分离、提纯方法有许多种,但根据其分离的本质可分为两大类,一类是化学方法,另一类就是物理方法。
1.化学分离、提纯法
根据物质的化学性质,进行分离、提纯的方法在高考中经常考查,下面把几组重要的方法进行举例说明。

方法 操作及说明 举例沉淀法在混合物中加入某种试剂,使其中一种以沉淀的形式分离出去的方法如N a2S O4溶液里混有少量的M g-SO4杂质。可先加入过量的NaOH溶液,然后过滤除去Mg(OH)2,再加入适量硫酸,调节pH为中性酸碱溶解法被提纯的物质不与酸碱反应,而杂质可与酸碱反应,用酸碱作除杂试剂。一般加酸产生气体、加碱发生溶解如Fe2O3里混有少量Al2O3杂质,可往混合物中加入足量的NaOH溶液,使其中的Al2O3转化为可溶性NaAlO2,然后过滤,洗涤难溶物,即为纯净的Fe2O3
续表
2.物理分离、提纯法
根据物质物理性质的差异,物理分析、提纯的方法有很多种,下面把几组学生容易混淆的方法进行对比分析。
(1)结晶法
结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物(原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出)。

分类 适用范围 举例 解释蒸发结晶(蒸发溶剂)溶解度受温度影响不大的固态物质的提纯提纯混有少量硝酸钾的氯化钠先将混合物溶于水配成热的饱和溶液,然后蒸发水分,会有氯化钠晶体析出,当有大量晶体析出时(不能蒸干),趁热过滤,滤纸上的晶体就是氯化钠,硝酸钾留在滤液中

续表
(2)蒸馏和分馏

蒸馏 分馏原理将沸点相差较大的液态混合物加热使沸点低的物质先沸腾(汽化),再使其冷凝(液化)的连续操作过程称为蒸馏根据混合物中各物质的沸点不同,把互相混溶的几种液态物质经加热而使混合液体汽化、冷凝的操作过程适用范围沸点相差较大的液态混合物的分离;提纯;回收溶剂等适合于分离提纯沸点相差不大的液态有机混合物不同点蒸馏只进行一次汽化和冷凝,分离出的物质一般较纯分馏分离出的物质依然是混合物,其沸点范围不同相同点都是分离液态混合物的方法,原理相同。蒸馏和分馏过程都是物理过程,没有生成新物质,只是将原来的物质进行了分离
(3)渗析和盐析
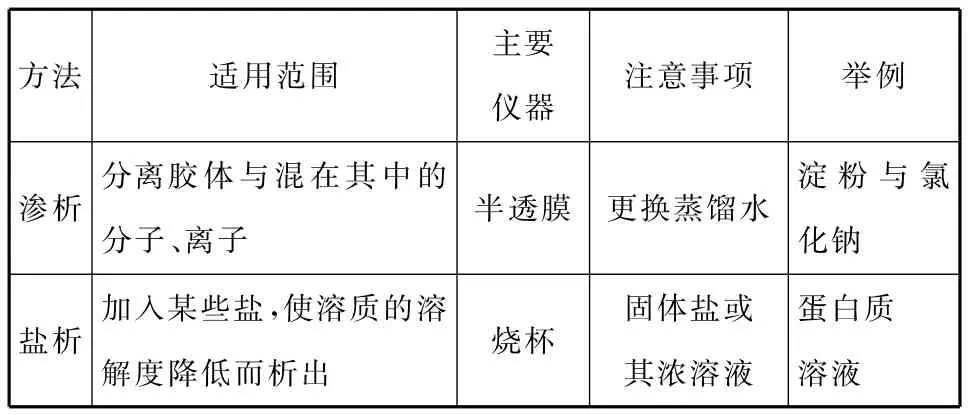
方法 适用范围主要仪器注意事项 举例淀粉与氯渗析分离胶体与混在其中的分子、离子半透膜 更换蒸馏水化钠蛋白质盐析加入某些盐,使溶质的溶解度降低而析出烧杯固体盐或其浓溶液溶液
三、考情分析
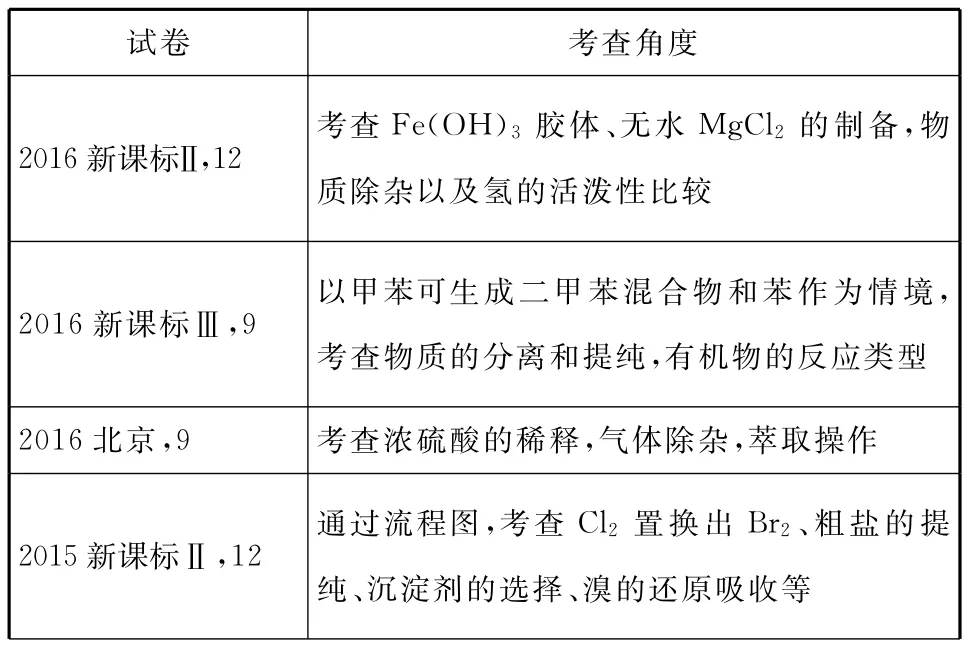
试卷 考查角度2016新课标Ⅱ,12考查Fe(OH)3胶体、无水 M g C l2的制备,物质除杂以及氢的活泼性比较2016新课标Ⅲ,9以甲苯可生成二甲苯混合物和苯作为情境,考查物质的分离和提纯,有机物的反应类型2016北京,9 考查浓硫酸的稀释,气体除杂,萃取操作2015新课标Ⅱ,1 2通过流程图,考查C l2置换出Br2、粗盐的提纯、沉淀剂的选择、溴的还原吸收等

续表
【分析与预测】纵观2013—2016年的典型高考化学试题,考查内容知识面比较广,综合性较强,主要有化学实验基础,物质的分离提纯、化学实验基本操作(分离和除杂)、离子的检验、简单实验方案的分析评价等,实际上就是综合考查学生分析解决化学问题的能力。实验难度一般为中等或较小。
仔细分析我们发现,单一因素的考查很少出现,一般是两种或三种因素间的因果关系、逻辑关系。试题基本取材于教材,充分体现了源于教材,高于教材。对学生实验现象、实验仪器的记忆能力要求降低,加大了对学生实验过程中分析问题、解决问题能力的考查。上述典型题目中均以语言叙述结合图表进行考查,预计2017年高考可能会在多因素的基础上,图表结合实验仪器装置进行辨析考查物质的分离和提纯。
四、高考真题解析
1.通过信息给予或流程图等,考查物理分离、提纯法
例1 (2016北京)在一定条件下,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如下:

对二甲苯 邻二甲苯 间二甲苯 苯沸点/℃ 1 3 8 1 4 4 1 3 9 8 0熔点/℃ 1 3 2 5 4 7 6
下列说法不正确的是 ( )
A.该反应属于取代反应
B.甲苯的沸点高于144℃
C.用蒸馏的方法可将苯从反应所得产物中首先分离出来
D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来
【解析】甲苯苯环上的氢被甲基取代生成二甲苯,属于取代反应,A正确;甲苯的相对分子质量比二甲苯小,沸点应该比二甲苯低,B错误;蒸馏主要用于两种物质沸点相差较大时的分离,可用于苯与二甲苯的分离,C正确;对二甲苯熔点较低,可用冷却结晶的方法将对二甲苯分离出来,D正确。
【答案】B
2.结合图象或因果关系等,考查物理分离、提纯法
例2 (2013新课标Ⅰ)下列实验中,所采取的分离方法与对应原理都正确的是 ( )

选项 目的 分离方法 原理A 分离溶于水的碘 乙醇萃取 碘在乙醇中的溶解度较大乙酸乙酯和乙醇的密度B 分离乙酸乙酯和乙醇 分液不同C除去KNO3固体中混杂的N a C l重结晶 N a C l在水中的溶解度很大丁醇与乙醚的沸点相差D 除去丁醇中的乙醚 蒸馏较大
【解析】萃取剂乙醇能和水任意比互溶,无法达到分层的目的,A错误;分离乙酸乙酯和乙醇,可以加入水,因为乙酸乙酯不溶于水,而乙醇易溶于水,然后再进行分液,原理应该是溶解度不同,B错误;除去固体硝酸钾中混有的氯化钠杂质,先在较高温度下制成硝酸钾的饱和溶液,然后逐步冷却,由于硝酸钾的溶解度随温度的升高而显著增大,温度降低,大部分硝酸钾成为晶体析出,而氯化钠的溶解度随温度的升高而增大得不显著,所以大部分氯化钠仍留在母液中,通过过滤把硝酸钾和氯化钠溶液分开,有时可以进行重结晶以增强分离效果,C错误;丁醇和乙醚的沸点相差较大,可以采用蒸馏法进行分离,D正确。
【答案】D
3.通过实验基本操作,考查化学分离、提纯法
例3 (2016新课标Ⅱ)下列实验操作能达到实验目的的是 ( )
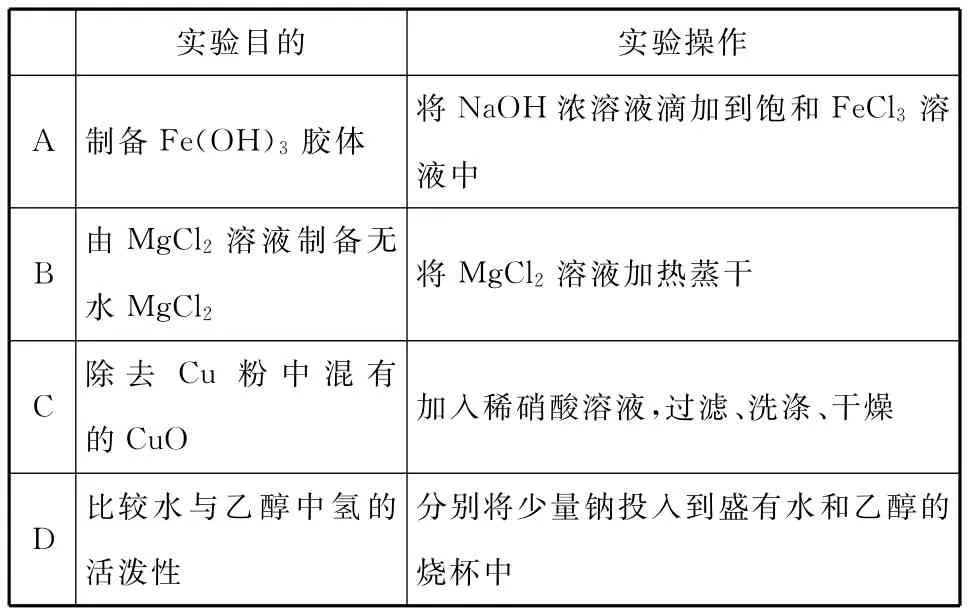
实验目的 实验操作A制备Fe(OH)3胶体将NaOH浓溶液滴加到饱和FeCl3溶液中B由MgCl2溶液制备无水MgCl2将MgCl2溶液加热蒸干C除去Cu粉中混有的CuO加入稀硝酸溶液,过滤、洗涤、干燥分别将少量钠投入到盛有水和乙醇的D比较水与乙醇中氢的活泼性烧杯中
【解析】应该向沸水中滴入饱和氯化铁溶液制备氢氧化铁胶体,A项错误;氯化镁是强酸弱碱盐,MgCl2溶液水解产生的HCl易挥发,所以由MgCl2溶液制备无水MgCl2要在HCl气流中加热蒸干,B项错误;使用酸碱溶解法进行除杂,但Cu和CuO均与稀硝酸会反应,应该选用稀HCl溶液,C项错误;分别将少量钠投入到盛有水和乙醇的烧杯中,反应剧烈的是水,反应平缓的是乙醇,可以比较水和乙醇中氢的活泼性,D项正确。
【答案】D
4.化学、物理方法的综合考查
例4 (2013全国)下列操作不能达到目的的是( )

选项 目的 操作将25gCuSO4·5H2O溶于100mL A配制100mL 1.0mol/LCuSO4溶液蒸馏水中B除去KNO3中少量NaCl将混合物制成热的饱和溶液,冷却结晶,过滤向酸性KMnO4溶液中滴加H2O2溶C在溶液中将MnO-4完全转化为Mn2+液至紫色消失取少量溶液滴加CaCl2溶液,观察是D确定NaCl溶液中是否混有Na2CO3否出现白色浑浊
【解析】配制100mL溶液,蒸馏水的体积应该小于100mL,A项错误;冷却热饱和溶液法提纯混有少量NaCl的KNO3,B正确;酸性KMnO4溶液与H2O2溶液发生氧化还原反应,C正确;若生成CaCO3为白色沉淀,则说明溶液中混有Na2CO3,D正确。
【答案】A
总之,通过对近四年除杂、提纯类高考真题的比较研究,我们发现根据物质的特性对常见物质及离子进行检验,综合运用物理、化学方法分离和提纯物质的考题逐渐增多。有些重点知识点在各省高考题和新课标卷中多次出现,比如:利用KNO3和NaCl溶解性进行分离两种物质或者除去其中一种杂质,在2013年新课标Ⅰ卷、2014广东卷、2015年浙江卷均作为一个选项进行考查。所以在学习的过程中要求学生要掌握每一种分离、提纯方法的基本原理;在复习时要利用好历年高考真题,在里面可能会有2016年高考题的影子。
(作者单位:安徽省砀山四中)

