CYP2C19、PON1基因多态性与脑梗死患者氯吡格雷治疗预后的相关性研究
郭朝群,孙建赟,袁莉莉,曹 灿,丁贤慧,黄显军,葛 良,周志明
(1.皖南医学院第一附属医院 弋矶山医院 神经内科,安徽 芜湖 241001;2.皖南医学院第二附属医院 肿瘤内科,安徽 芜湖 241000)
CYP2C19、PON1基因多态性与脑梗死患者氯吡格雷治疗预后的相关性研究
郭朝群1,孙建赟1,袁莉莉1,曹 灿2,丁贤慧1,黄显军1,葛 良1,周志明1
(1.皖南医学院第一附属医院 弋矶山医院 神经内科,安徽 芜湖 241001;2.皖南医学院第二附属医院 肿瘤内科,安徽 芜湖 241000)
目的:探讨大动脉粥样硬化型脑卒中(LAA)患者服用氯吡格雷短期预后与CYP2C19、PON1基因多态性的关系。方法:对最终入组的96例首发LAA患者给予阿司匹林联合氯吡格雷治疗30 d,后氯吡格雷单药长期治疗,治疗前及3个月后对患者进行改良RANKIN量表(mRS)评分,mRS≤2表示预后好,mRS>2表示预后差;使用非扩增荧光染色原位杂交技术进行基因分型。通过比较各种基因型与mRS评分的相关性,判断患者预后与上述两种基因的基因多态性之间的关系,mRS≤2表示预后好,mRS>2表示预后差。结果:治疗前,CYP2C19三种不同基因型与患者mRS评分无统计学差异,3个月后,CYP2C19三种基因型与mRS评分有统计学差异(P﹤0.05),携带有CYP2C19 EM型等位基因的患者预后较好(P﹤0.05),即未携带CYP2C19无功能等位基因的患者预后较携带者好。治疗前,PON1 (576G>A)三种基因型与患者mRS评分无统计学差异,3个月后预后改善在三种基因型之间亦无统计学差异(P>0.05)。结论:大动脉粥样硬化性卒中患者服用氯吡格雷后短期预后与 CYP2C19基因多态性有关。
CYP2C19;PON1 (576G>A);基因多态性;大动脉粥样硬化性脑卒中;氯吡格雷
急性缺血性脑卒中是神经科常见疾病,具有高发病率、致残率等特点[1]。按TOAST分型,缺血性脑卒中可分为:大动脉粥样硬化性卒中(large artery atherosclerotic,LAA)、心源性脑栓塞(cardioembolism,CE)、小动脉闭塞性卒中或腔隙性卒中(small-artery occlusion lacunary,SAA)、不明原因的缺血性卒中(stroke of other undetermined etiology,SUE)、其他原因性卒中(acute stroke of other determined etiology,SOE)。其中,LAA型临床最多见,建议口服抗血小板药物预防脑卒中复发及其他心血管事件发生(ⅠA)[2]。 迄今为止,抗血小板最佳推荐药物为阿司匹林或氯吡格雷[2],氯吡格雷较阿司匹林在减少急性缺血性脑卒中风险方面更占优势[3]。然而,常规剂量氯吡格雷治疗时,并非所有患者都能达到很好临床效果,可能由氯吡格雷抵抗[4]所致。氯吡格雷经肠道吸收入血后需经CYP2C19基因编码的肝脏细胞色素P450酶系氧化,再经对氧磷酶-1(PON1)等水解形成活性产物从而发挥抗血小板聚集作用。本研究旨在探讨CYP2C19、PON1 (576G>A)基因多态性与LAA患者接受氯吡格雷治疗后神经功能的恢复之间的关系。
1 资料与方法
1.1 对象 本研究所有患者为2016年1~9月弋矶山医院神经内科收治的96例首发的LAA患者(男69例,女27例,年龄18~80岁)。入组标准:①发病时间<7 d;②符合2010 年《中国急性缺血性脑卒中诊治指南》提出的急性缺血性脑卒中标准;③经心电图、心脏彩超、头颅CT、头颅MRI及脑血管造影术等相关检查排除其他缺血性脑卒中亚型;④3个月随访,并顺利完成mRS评分[5];⑤均签订知情同意书。排除标准为:①对阿司匹林或氯吡格雷过敏或不可耐受者;②患有血液系统疾病、出血性疾病或存在出血倾向者;③严重肝肾功能障碍者;④合并其他严重躯体疾病者,如肿瘤、严重的冠心病、某一脏器功能不全者等。
1.2 方法
1.2.1 药物治疗方法 所有患者首次给予氯吡格雷联合阿司匹林治疗 30 d(氯吡格雷首日负荷量 300 mg,继之 50 mg /d,阿司匹林 100 mg/d),1个月后以氯吡格雷单药治疗(50 mg / d),总疗程为90 d。
1.2.2 分组(神经功能恢复情况) 对入组患者治疗前及治疗3个月后改良Rankin量表(Modified RANKIN scale,mRS)评分[5],根据评分结果,mRS≤2分为良好组(good prognosis);3≤mRS≤6分为不良组(poor prognosis)。
1.2.3 CYP2C19、PON1 (576G>A)基因型测定 使用非扩增的荧光染色原位杂交技术(“北京精准医学平台”分析软件)检测方法对患者静脉血进行CYP2C19及PON1 (576G>A)基因型测定。①血液样本制备:先将预处理液(10×NH4Cl)与双蒸水按1∶9比例配置成1×NH4Cl的工作液,取若干1.5 mL离心管,然后将EDTA抗凝管采集到的临床静脉血液150~200 μL及1.2 mL的上述工作液中分别加入至离心管中,3000 r/min离心后弃上清,沉淀加入30~50 μL耀金保(核酸纯化试剂,北京华夏时代基因科技发展有限公司),得到白细胞混悬液。取1.5 μL白细胞混悬液加到1支耀金染试剂(地高辛染色液,北京华夏时代基因科技发展有限公司)中,充分混均并短暂离心,完成后盖紧管盖,置入荧光检测仪;②采用荧光染色原位杂交及染色体核型分析系统自动判读荧光信号值,获取荧光曲线图,进行CYP2C19*2(681G>A)、CYP2C19*3(636G>A)、PON1 (576G>A)基因分型,并作阳性质控。
1.2.4 临床分型 据CYP2C19基因检测结果,将CYP2C19编码的药物代谢酶CYP2C19分为弱代谢型(PM型CYP2C19*2/*2、CYP2C19*2/*3、CYP2C19*3/*3)、中间代谢型(IM型CYP2C19*1/*2、CYP2C19*1/*3)及强代谢型(即正常代谢型)(EM 型,CYP2C19*1/*1)[6];据PON1 (576G>A)基因检测结果,将PON1编码的药物水解酶PON1分为:野生型(GG)、突变杂合型(GA)、突变纯合型(AA)[7]。
1.2.5 统计学方法 采用SPSS 17.0软件分析数据。卡方检验用来比较患者在入院时及随访3个月时 mRS 评分与CYP2C19、PON1 (576G>A)基因每三种变异型的关系。如患者mRS评分与上述基因有统计学意义时,再分别将上述三种变异基因型的预后率进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 本研究入组患者130例,存在出血倾向13例,合并其他疾病8例,无法完成随访及mRS评分13例,最终共96例(男69例,女27例,年龄18~80岁)LAA患者入组,根据mRS评分分为良好(mRS≤2:治疗前24例/治疗后3个月71例),不良(3≤mRS≤6:治疗前72例/治疗后3个月25例)。
2.2 基因检测结果 据CYP2C19基因检测结果,CYP2C19*2和 CYP2C19*3分为野生纯合型(GG)、突变杂合型(GA)和突变纯合型(AA)[8],据PON1 (576G>A)基因检测结果,将PON1编码的药物水解酶PON1分为:野生型(GG)、突变杂合型(GA)、突变纯合型(AA)[7]。患者荧光曲线图分别见图1~3。
图1 CYP2C19*2基因分型及荧光曲线图

图2 CYP2C19*3基因分型及荧光曲线图

图3 PON1 (576G>A)基因分型及荧光曲线图
2.3 CYP2C19 基因多态性与患者预后 治疗前,mRS≤2组中EM、IM、PM 所占比例分别为28.6%、21.6% 、23.5%,CYP2C19三种不同基因型患者 mRS 评分比较无统计学差异(P>0.05)。3个月后,mRS≤2组中EM、IM、PM 所占比例分别为 90.5%、59.5%、64.7%,3组患者mRS评分比较差异有统计学意义(P<0.05,表1);EM组患者的预后良好率与IM、PM组相比,差异均有统计学意义(P<0.05),见图4。
表1 不同CYP2C19 基因型mRS 评分比较

时间EM(good/poor)IM(good/poor)PM(good/poor)χ2P治疗前12/30(28.6%)8/29(21.6%)4/13(23.5%)0.5310.7673个月后38/4(90.5%)22/15(59.5%)11/6(64.7%)10.7440.005

注:*P<0.05,**P<0.01。
图4 CYP2C19 三种基因型预后良好率之间的比较
2.4 PON1 (576G>A)与患者预后治疗前及治疗3个月后,PON1 (576G>A)三种基因型 mRS评分无统计学差异(表2)。
表2 不同PON1 (576G>A) 基因型mRS 评分比较
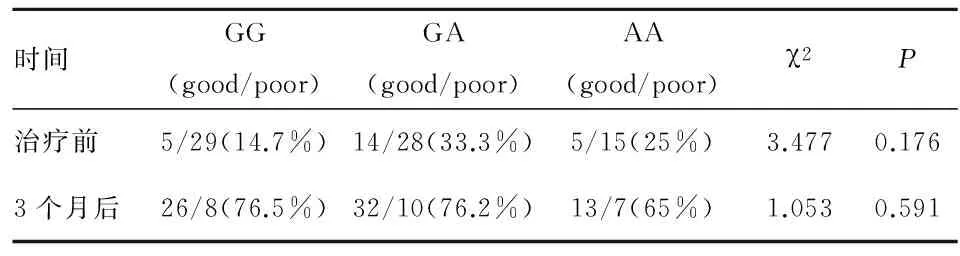
时间GG(good/poor)GA(good/poor)AA(good/poor)χ2P治疗前5/29(14.7%)14/28(33.3%)5/15(25%)3.4770.1763个月后26/8(76.5%)32/10(76.2%)13/7(65%)1.0530.591
3 讨论
我们通过比较患者在入院及治疗3个月后mRS评分与CYP2C19、PON1 (576G>A)三种基因型的关系,探究LAA的短期预后与CYP2C19、PON1 (576G>A)基因多态性的关系。携有CYP2C19 EM型等位基因的患者预后较好,而携带IM等位基因患者预后较PM者无显著不同。而治疗前及治疗3个月后PON1 (576G>A)的三种基因型预后均无明显差异。
氯吡格雷经肠道吸收、肝脏代谢活化、有所选择的且不可逆地阻断了ADP与血小板膜表面ADP受体(P2Y12)的结合,进而发挥抑制血小板聚集的作用[9]。其低反应性是多因素的,如患者的依从性、吸收或代谢功能、药物反应等,然而基因多态性占有较大比重,且其潜在机制不明[10]。它在体内的生物转化是在各种酶的参与下共同完成,包括PON1、CYP2C19、ABCB1、CYP3A4、CYP3A5酶等,而CYP2C19、PON1基因多态性对氯吡格雷代谢的影响越来越受重视。氯吡格雷疗效欠佳可能与CYP2C19基因多态性有关[11]。CYP2C19*2基因型是CYP2C19第5外显子在第681位的突变(681G/A),可造成外显子5′端40 bp碱基缺失,改变mRNA阅读框架,产出无功能蛋白(CYP2C19*2)酶[12]。CYP2C19*3基因型是第4外显子在第636位的突变(636G/A)造成终止码提前,产生出代谢功能极低的CYP2C19*3酶[12]。这两种蛋白均难以将氯吡格雷代谢转化为活性代谢产物,严重影响其抗血小板功能。亚洲人群常见等位基因是CYP2C19*1,CYP2C19*2及CYP2C19*3,野生型为CYP2C19*1,突变型为CYP2C19*2及CYP2C19*3。研究发现,携带1个或大于1个CYP2C19等位基因(*2或*3)的变异性基因,可明显降低氯吡格雷抗血小板聚集效果,发生更高比率的心脑血管不良事件[13]。故Parég等[6]将只有野生型等位基因的 CYP2C19* 1 /* 1 来定义为EM 型,携带一种无功能等位基因的CYP2C19*1/*2或CYP2C19*1/*3来定义为 IM型,而携带两种无功能等位基因的CYP2C19* 2 /* 3,CYP2C19* 2 / * 2,CYP2C19 * 3 / * 3 来定义为 PM型。我们对CYP2C19基因多态性的研究与上述研究结果一致。也有学者指出PON1 (576G>A)基因多态性与氯吡格雷疗效有关[14]。PON1由肝脏合成,其在血清中和载脂蛋白A1紧密结合是借助于极端疏水的N端,是氯吡格雷代谢关键酶,参与调控PON1转录与翻译。Bouman等[14]发现PON1是氯吡格雷生物代谢的关键酶,在氯批格雷由中间产物代谢转化为有活性的硫醇终产物过程中起重要作用。PON1QQ192纯合子个体相对于RR192纯合子有着更高的支架血栓形成风险,更低的PON1活性产物及抗血小板聚集效果,故他们认为PON1是氯吡格雷的主要决定因素,多项研究支持这些结果[15]。但另有研究提出相反结论[16]。Hulot等[17]研究发现PON1基因突变体并不会影响到氯吡格雷药物代谢动力学、药效学及心肌梗死患者的临床效果。Dirk等[18]在欧美人群中同样发现 PON1 基因 Q192R 多态位点与 CR 发生无明显相关关系。本试验的研究结果与Dirk的研究成果一致,PON1 (576G>A)多态性和氯吡格雷抵抗无关系。
我们的研究观察了氯吡格雷与预后的关系,为氯吡格雷用药提出了指导性建议,同时支持了既往的研究结果。但本研究样本较少,未来尚需进一步研究。
[1] SMITH S J,ALLEN J,BLAIR S N,etal.AHA/ACC guidelines for secondary prevention for patients with coronary and other atherosclerotic vascular disease: 2006 update: endorsed by the National Heart,Lung,and Blood Institute[J].Circulation,2006,113(19): 2363-2372.
[2] WALTER N KERNAN,BRUCE OVBIAGELE,HENRY R BLACK,etal.Guidelines for the Prevention of Stroke in Patients With Stroke and Transient Ischemic Attack[J].Stroke,2014,45: 2160-2236.
[3] CAPRIE Steering Committee.A randomised,blinded,trial ofclopidogrel versus aspirin in patients at risk of ischaemic events(CAPRIE) [J].Lancet,1996,348(9038):1329-1339.
[4] WIVIOTT SD,ANTMAN EM.Clopidogrel resistance: a new chapter in a fast-moving story[J].Circulation,2004,109(25):3064-3067.
[5] JIA DONGMEI,CHEN ZHIBIN,ZHANG MEIJUAN,etal.CYP2C19 Polymorphisms and Antiplatelet Effects of Clopidogrel in Acute Ischemic Stroke in China[J].Stroke,2013,44:1717-1719.
[6] PARÉG,MEHTA SR,YUSUF S,etal.Effects of CYP2C19 genotype on outcom es of clopidogrel treatmenl [ J ].N Engl J Med,2010,363 :1704-1714.
[7] 杨振华,王文惠,应雅韵,等.脑梗死与对氧磷酶1基因192G/A位点多态性的关系[J].诊断学理论与实践,2011,10(1):50-54.
[8] YI XINGYANG,WANG YANFEN,LIN JING,etal.Interaction of CYP2C19,P2Y12,and GPIIIa Variants Associates With Efficacy of Clopidogrel and Adverse Events on Patients With Ischemic Stroke[J/OL].Clinical and Applied Thrombosis/Hemostasis,2016.DOI: https: //doi.org/10.1177 /1076029616648408.
[9] MARTINEZ-QUINTANA E,TUGORES A.Clopidogrel: a multifaceted affair[J].Clinical Pharmacology, 2015,55(1):1-9.
[10] SIBBING D,MORATH T,STEGHERR J,etal.Impact of proton pumpinhibitors on the antiplatelet effects of clopidogrel[J].Thromb Hae-most,2009,101(4):714-719.
[11] BUONAMICI M ARCUCCI R,MIGLIORIRII A,etal.Impact of platelet reactivity after clopiclogrel adm inistration on drug-eiuting stent throm bosis[J].J Am Coll Cardiol,2007,49 :2312.
[12] PHARM GKB.Variant in CYP2C19[D].Stanford University,2012.
[13] WALLENTIN L,JAMES S,STOREY RF,etal.PLATO investigators.Effect of CYP2C19 and ABCB1 single nucleotide polymorph-isms on outcomes of treatment with ticagrelor versus clopidogrelfor acute coronary syndromes: a genetic substudy of the PLATOtrial[J].Lancet,2010,376(9749):1320-1328.
[14] BOUMAN HJ,SCHOMIG E,WERKUM JW VAN,etal.Paraoxonase-1 is a major determinant of clopidogrel efficacy[J].Nat Med,2011,17(1):110.
[15] WU H,QIAN J,XU J,etal.Besides CYP2C19,PON1 genetic variant influencespost-clopidogrel platelet reactivity in Chinese patients[J].Int J Cardiol,2013, 165(1):204-206.
[16] ZHANG L,CHEN Y,JIN Y,etal.Genetic determinants of high on-treatment platelet reactivity in clopidogrel treated Chinese patients[J].Thromb Res, 2013,132(1):81-87.
[17] HULOT JS,COLLET JP,CAYLA G,etal.CYP2C19 but not PON1 genetic variants influence clopidogrel pharmacokinetics,pharmacodynamics,and clinical efficacy in post-myocardial infarction patients[J].Circ Cardiovasc Interv,2011,4(5):422-428.
[18] SIBBING D,KOCH W,MASSBERG S,etal.No association of paraoxonase-1 Q192R genotypes with platelet response to clopidogrel and risk of stent thrombosis after coronary stenting[J].Eur Heart J, 2011, 32: 1605-1613.
Correlation analysis between the CYP2C19 and PON1 gene polymorphism and prognosis of cerebral infraction patients following clopidogrel therapy
GUO Chaoqun,SUN Jianyun,YUAN Lili,CAO Can,DING Xianhui,HUANG Xianjun,GE Liang,ZHOU Zhiming
Department of Neurology,The First Affiliated Hospital of Wannan Medical College,Wuhu 241001,China
Objective:To investigate the relationship between CYP2C19 and PON1 gene polymorphisms and the prognosis in patients with large artery atherosclerotic stroke following medication of clopidogrel.Methods: Ninety-six patients with first large artery atherosclerotic stroke attack were included and given clopidogrel plus aspirin medication for 30 days,followed by simple chronic clopidogrel regimen.Modified RANKIN scale(mRS)was used before and 3 months after medication to assess the therapeutic effects.Patients with mRS scoring ≤ 2 were considered as ′good prognosis′,and those with mRS scoring>2 were considered as ′poor prognosis′.The genotypes of CYP2C19 and PON1 (576G>A) were detected with non-amplified fluorescent dyes in situ hybridization technique,and compared with the mRS scoring for estimating the relationship between the CYP2C19 and PON1 (576G>A) polymorphisms and prognosis following medication.Results: The difference was not significant between mRS scores and different three genotypes of CYP2C19 in patients before therapy,yet the difference was significant 3 months after medication(P<0.05),and patients with CYP2C19 EM alleles had better prognosis than those with CYP2C19 with loss-of-functional alleles(P<0.05).The three genotypes for PON1 (576G>A) remained no statistical difference with mRS scores before therapy 3 months after medication(P>0.05).Conclusion: The prognosis appears to be associated with CYP2C19 gene polymorphism in patients with large artery atherosclerotic stroke following short use of clopidogrel.
CYP2C19;PON1 (576G>A);gene polymorphisms;large artery atherosclerotic stroke;clopidogrel
1002-0217(2017)04-0329-04
国家自然科学基金项目(81171110)
2016-12-12
郭朝群(1990-),女,2015级硕士研究生,(电话)18895375296,(电子信箱)18895375296@163.com; 周志明,男,主任医师,副教授,硕士生导师,(电子信箱)neuro_depar@hotmail.com,通信作者。
R 543;R 743.3
A
10.3969/j.issn.1002-0217.2017.04.007

