固定化混合菌利用戊糖和己糖共发酵制备乙醇
江枫,房伶晏,王浩,朱均均,范一民,宋向阳
(南京林业大学化学工程学院,南京210037)
固定化混合菌利用戊糖和己糖共发酵制备乙醇
江枫,房伶晏,王浩,朱均均,范一民,宋向阳*
(南京林业大学化学工程学院,南京210037)
为研究固定化混合菌种对戊糖和己糖同步发酵生产燃料乙醇的影响,以海藻酸钙为固定化载体,采用包埋法固定化休哈塔假丝酵母(Candidashehatae)和酿酒酵母(Saccharomycescerevisiae)混合菌发酵生产燃料乙醇,并对固定化混合菌种的发酵条件进行优化。结果表明:固定化混合菌种发酵可以快速利用葡萄糖,解除葡萄糖代谢对木糖代谢的抑制作用,提高发酵效率,发酵时间从固定化单菌发酵的24 h缩短至20 h,发酵时间缩短16.67%。乙醇产量从13.28 g/L增加至14.89 g/L,升高了12.12%。固定化混合菌种的优化条件为:混合糖(葡萄糖和木糖)质量浓度为45 g/L,发酵温度为30℃,摇床转速为170 r/min,休哈塔假丝酵母和酿酒酵母菌体的比例为4∶1。在此条件下得到最佳乙醇产量为15.21 g/L,较优化前(13.74 g/L)提高了10.70%。本研究结果可为固定化混合菌发酵生产燃料乙醇的工业化提供理论依据。
休哈塔假丝酵母;酿酒酵母;固定化细胞;混菌发酵;优化
近年来,石油资源短缺问题日益严重,从可再生资源中生产燃料乙醇受到较多关注[1]。农林废弃物和工业废渣中获得的木质纤维原料,由于其资源丰富、价格低廉、环保清洁等特性,是较为理想的用以生产燃料乙醇的原材料[2-4]。木质纤维原料主要由纤维素、半纤维素和木质素组成,由于其结构致密,存在天然抗降解屏障,对生物酶具有阻抗作用,直接酶解效率低,因此必须对原料进行一定程度的预处理,增加纤维表面与酶的结合程度[5]。木质纤维原料经过预处理、酶解后水解液中主要成分为葡萄糖和木糖[6],其中葡萄糖可以被酿酒酵母快速利用[7],而木糖代谢较葡萄糖代谢复杂,自然界中高效的木糖发酵菌种数量有限,主要有假丝酵母,毕赤酵母和管囊酵母3个属[8-9],且最好的木糖发酵菌株利用葡萄糖或木糖发酵生产乙醇的效率仅为酿酒酵母用葡萄糖生产乙醇效率的五分之一[10],使得木糖发酵成为阻碍木质纤维原料生产燃料乙醇商业化的一个重要因素[6]。燃料乙醇生产主要分为游离细胞发酵和固定化细胞发酵[11]。固定化细胞较游离细胞具有提高产量,容易分离,不易染菌,可重复循环利用等优势[12],被广泛应用于生物科技、环境、食品等领域,并取得了显著成果[13]。Chandel等[14]研究了固定化酿酒细胞对甘蔗渣发酵的影响,最大乙醇产率达0.45 g/g,可重复发酵8批次。Pacheco等[15]研究了固定化酿酒酵母发酵苹果渣,发现乙醇浓度、产率和乙醇转化率均得到提高。
目前,有关固定化细胞发酵生产燃料乙醇的研究主要集中于单菌发酵方面,而对混合菌种固定化发酵的相关研究尚少。Lebeau等[16]将休哈塔假丝酵母和酿酒酵母固定化于琼脂板上研究了在生物反应器中的发酵情况,结果表明葡萄糖能完全被利用而木糖仅被利用20%。李艳华等[17]研究了嗜单宁管囊酵母和酿酒酵母固定化于海藻酸钙中发酵玉米秸秆水解液工艺,结果表明,固定化混合菌种能同时利用木糖和己糖共同发酵,乙醇转化率可达0.4 g/g。固定化混合菌种发酵主要存在代谢产物的抑制作用和混菌发酵条件的协调两方面问题[18]。本研究以纯糖模拟液为碳源,以海藻酸钙为材料分别固定化休哈塔假丝酵母和休哈塔假丝酵母与酿酒酵母的混合菌进行乙醇发酵试验,并对固定化混合菌种发酵条件进行优化,以期解决葡萄糖发酵对木糖的阻遏作用,探索最适的混合菌种发酵条件,为固定化混合菌种发酵生产燃料乙醇的工业化提供理论依据。
1 材料与方法
1.1 试验材料
休哈塔假丝酵母(Candidashehatae)ATTC 122984,该菌种能同步发酵戊糖和己糖;酿酒酵母(Saccharomycescerevisiae) NL22,己糖发酵菌株。两种菌均保藏于南京林业大学生物化工研究所。
1.2 试验方法
1.2.1 培养基
休哈塔假丝酵母活化培养基(g/L):木糖20.00,蛋白胨10.00,酵母浸膏5.00。酿酒酵母活化培养基(g/L):葡萄糖20.00,蛋白胨5.00,酵母浸膏3.00。增殖培养基[19](g/L):葡萄糖30.00,木糖30.00,蛋白胨3.00,酵母浸膏2.50,KH2PO42.50,MgSO4·7H2O 0.25,CaCl20.25。发酵培养基(g/L):葡萄糖30.00,木糖15.00,(NH4)2SO45.00,KH2PO43.00,MgSO4·7H2O 0.50。
1.2.2 菌种的活化
保藏的斜面菌株经接种环接2环到装有50 mL活化培养基的250 mL锥形瓶中,在30℃、170 r/min的恒温摇床中活化24~36 h。再经过增殖培养基增殖到一定量,离心(3 000 r/min,10 min)所得的酵母菌泥存放于4℃冰箱中,待用。
1.2.3 固定化细胞的制备与增殖
将一定量3%的海藻酸钠在70℃的水浴中溶解后,于高压蒸汽灭菌锅中121℃下灭菌15 min。灭菌结束后放入超净工作台中冷却至室温。按一定比例加入相应质量浓度制备好的休哈塔假丝酵母和酿酒酵母的菌泥,玻璃棒搅拌均匀后使用5 mL的医用注射器滴入到2%的CaCl2水溶液中,制备成2~3 mm的凝胶颗粒,然后放入4℃的冰箱中固化12 h,过滤掉溶液,用无菌水将固定化颗粒洗涤3次,待用。
将制备好的凝胶小球用无菌水洗涤后接入到新鲜的增殖培养基中,在30℃、170 r/min的摇床中进行增殖培养,24 h后更换新的增殖培养基,共增殖48 h。
1.2.4 固定化细胞的乙醇发酵
将增殖过的凝胶小球用无菌水洗涤2~3次,接入到新鲜的发酵培养基中。其中,发酵液的体积为50 mL,固液比为3∶2。将固定化小球置于30℃、170 r/min条件下进行发酵培养。
1.2.5 糖和乙醇质量浓度的测定
糖和乙醇质量浓度采用高效液相色谱(HPLC) 法测定[19]。测定试样在 10 000 r/min条件下离心5 min,上清液经 0.22 μm 的滤膜过滤,然后在Agilent1260 型高效液相色谱仪上,用 Bio-Rad HPX-87H柱(7.8 mm×300 mm),0.005 mol/L 的H2SO4作为流动相,流速为0.6 mL/min,色谱柱温为55℃,检测器采用示差折光检测器(RID)。采用外标法测定试样中组分。糖利用率和乙醇得率采用以下公式计算。
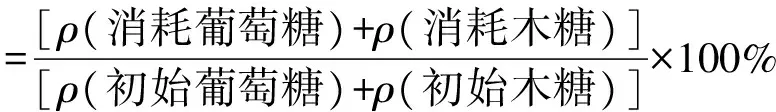
(1)
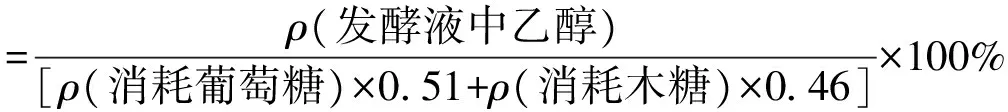
(2)
2 结果与分析
2.1 休哈塔假丝酵母和酿酒酵母发酵过程
在酵母细胞的混合糖发酵过程中,木糖的代谢途径比葡萄糖的代谢途径更为复杂,一般酵母细胞优先利用葡萄糖进行发酵[7]。图1、图2和图3分别为固定化休哈塔假丝酵母、固定化酿酒酵母和固定化混合菌种在纯糖模拟液中的发酵过程图。
由图1可以看出,质量浓度为30.95 g/L葡萄糖和14.45 g/L木糖的发酵液中,发酵前12 h,葡萄糖代谢速率较木糖代谢速率快。这主要是由于木糖代谢比葡萄糖复杂,在酵母菌代谢过程中,木糖在木糖还原酶作用下转化为木糖醇,然后在木糖醇脱氢酶作用下转化为木酮糖,木酮糖经过磷酸化作用进入磷酸戊糖循环,经过一系列生化反应生成乙醇[20]。在12 h时,葡萄糖质量浓度为3.89 g/L,木糖代谢逐渐加快,说明葡萄糖对木糖的抑制作用减弱,发酵到24 h时,乙醇质量浓度达到最大值为13.28 g/L,此时糖利用率为93.50%。在24 h后进一步发酵,乙醇浓度逐渐下降,这可能是由于发酵液中的糖浓度较低,酵母细胞开始利用乙醇作为营养物质。
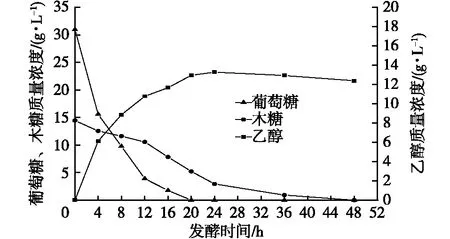
图1 固定化休哈塔假丝酵母戊糖和己糖发酵代谢过程Fig. 1 Metabolism course of pentose and hexose fermentated by immobilized Candida shehatae
图2为固定化酿酒酵母在混合糖中的发酵过程。从图2可以看出,酿酒酵母能够快速有效利用葡萄糖,质量浓度为31.13 g/L 葡萄糖在4 h内利用完全,木糖未呈现明显变化,这是由于酿酒酵母只能代谢葡萄糖而不能代谢木糖。从图1可知,葡萄糖的存在会对木糖利用产生抑制作用,而酿酒酵母能够快速利用葡萄糖,解除葡萄糖对木糖的抑制作用,可通过固定化休哈塔假丝酵母和酿酒酵母混合菌戊糖和己糖同步发酵生产乙醇,加快葡萄糖代谢速率,从而缩短其对木糖代谢的抑制作用,进而提高休哈塔假丝酵母对木糖利用效率。

图2 固定化酿酒酵母戊糖和己糖发酵代谢过程Fig. 2 Metabolism course of pentose and hexose fermentated by immobilized Saccharomyces cerevisiae
为进一步分析固定化混合菌相互作用,对固定化混合菌戊糖和己糖的发酵过程进行了研究,结果见图3。由图3可知,质量浓度为31.36 g/L葡萄糖和13.77 g/L木糖的发酵液中,葡萄糖在4 h内基本被利用,仅余2.06 g/L。对比图1结果可知,固定化混合菌发酵较固定化单菌发酵木糖消耗快,这是因为固定化混合菌种发酵时酿酒酵母可快速利用葡萄糖,有效解除葡萄糖对木糖代谢的抑制作用。固定化混合菌种发酵到20 h时,木糖剩余2.55 g/L,而固定化单菌发酵到24 h时木糖剩余2.95 g/L。碳源质量浓度为45 g/L时,固定化混合菌发酵时间从固定化休哈塔假丝酵母单菌发酵的24 h缩短至20 h,发酵时间缩短16.67%。这可能是由于固定化混合菌种发酵时,4 h利用完葡萄糖,增加了木糖发酵时间,从而提高了木糖利用效率。在24 h时,糖利用率为96.59%,此时乙醇质量浓度达到最大值14.89 g/L,比固定化休哈塔假丝酵母单菌发酵提高12.12%。在24 h后进一步发酵,乙醇质量浓度开始下降,这是由于发酵液中碳源基本被利用完,酵母细胞开始利用乙醇为底物进行生长。
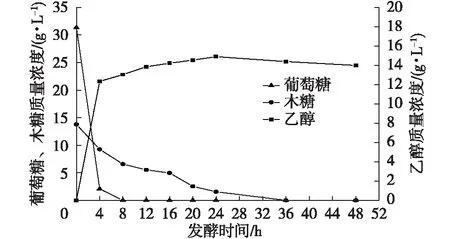
图3 固定化休哈塔假丝酵母和酿酒酵母混合菌戊糖和己糖发酵代谢过程Fig. 3 Metabolism courses of pentose and hexose fermentated by immobilized C. shehatae and S. cerevisiae
2.2 固定化混合菌种发酵条件优化
2.2.1 初始碳源质量浓度对固定化混合菌种发酵的影响
碳源质量浓度能够直接影响酵母菌的发酵性能。为确定固定化混合菌种发酵最适初始碳源质量浓度,本试验采用的初始碳源质量浓度分别为30,45,60,75和90 g/L,葡萄糖和木糖比例为2∶1,在30℃、170 r/min条件下发酵24 h,结果如图4所示。随碳源质量浓度增加,糖利用率从96.42%下降为84.67%,这可能是由于随碳源质量浓度增加,葡萄糖对木糖的抑制作用加强,导致酵母菌对糖的利用效率下降。乙醇得率随碳源质量浓度增加先增加后逐渐减少,当碳源质量浓度为45 g/L时,糖利用率为92.05%,此时乙醇得率最大,为68.98%。综合考虑糖利用率和乙醇得率,根据试验结果可知最适初始碳源质量浓度为45 g/L。

图4 初始碳源质量浓度对固定化混合菌发酵性能影响Fig. 4 Effect of initial carbon source concentration on fermentation by immobilized mixed yeast
2.2.2 休哈塔假丝酵母和酿酒酵母比例对固定化混合菌发酵的影响
发酵液中含有葡萄糖和木糖,休哈塔假丝酵母能同步利用葡萄糖和木糖,酿酒酵母则只能利用葡萄糖,有效确定休哈塔假丝酵母和酿酒酵母比例对固定化混合菌发酵具有重要作用。本试验中休哈塔假丝酵母和酿酒酵母的比例(体积比)分别为1∶1,2∶1,3∶1,4∶1和5∶1,初始碳源质量浓度为45 g/L,在30℃、170 r/min条件下发酵24 h,结果如图5所示。从图5可知,休哈塔假丝酵母和酿酒酵母比例对糖利用率影响较小,均保持在93%左右,其中,当休哈塔假丝酵母和酿酒酵母的比例为4∶1时,糖利用率最高,为94.87%。乙醇得率随休哈塔假丝酵母菌增加呈先增加后减小趋势,这可能是因为酿酒酵母细胞只能利用葡萄糖,而休哈塔假丝酵母可同步利用葡萄糖和木糖,由于休哈塔假丝酵母比例增大,提高了木糖利用效率。在休哈塔假丝酵母和酿酒酵母的比例为4∶1时,乙醇得率最高,为64.65%。综合考虑糖利用率和乙醇得率,根据试验结果可知两种菌的最适比例为4∶1。
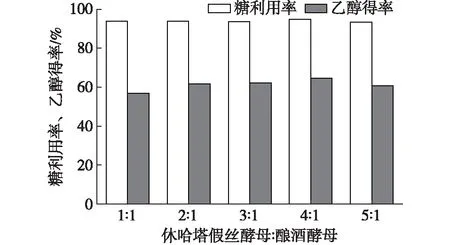
图5 休哈塔假丝酵母和酿酒酵母比例对固定化混合菌发酵性能的影响Fig. 5 Effect of proportion of C. shehatae andS. cerevisiae on fermentation byimmobilized mixed yeast
2.2.3 摇床转速对固定化混合菌发酵的影响
由于休哈塔假丝酵母和酿酒酵母发酵时对氧气需求量不同,本试验通过改变摇床转速以控制两种酵母菌的需氧量。初始碳源质量浓度为45 g/L,休哈塔假丝酵母和酿酒酵母比例为4∶1,摇床转速分别为150,170,190 和210 r/min,在30℃条件下发酵24 h,结果见图6。随摇床转速增加,发酵液中通氧量增加,加快了酵母菌对糖的利用效率。当摇床转速为190 r/min时,糖利用率达最大值,为97.07%,乙醇得率为65.53%。乙醇得率随摇床转速增加呈先增加后减少趋势,这是因为过大氧气量使得酵母菌利用更多底物来生长酵母菌。当摇床转速为170 r/min时,糖利用率95.18%,乙醇得率最高,可达69.83%。综合考虑糖利用率和乙醇得率,根据试验结果可知最适摇床转速为170 r/min。
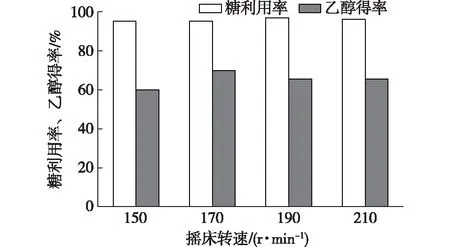
图6 摇床转速对固定化混合菌发酵性能的影响Fig. 6 Effect of shaking speed on fermentation by immobilized mixed yeast
2.2.4 发酵温度对固定化混合菌发酵的影响
休哈塔假丝酵母和酿酒酵母的最适发酵温度不同,一般认为,酵母细胞的最适发酵温度为27~35℃[21]。为确定固定化混合菌的最适发酵温度,本试验研究了固定化混合菌在温度分别为28,30,32和34℃条件下的发酵效果。初始碳源质量浓度为45 g/L,两种菌的比例为4∶1,摇床转速为170 r/min条件下发酵24 h,结果见图7。随温度升高,糖利用率从95.10%下降至92.19%;乙醇得率在发酵温度为30℃时达到最大值,为68.34%,随后乙醇得率逐渐下降。这可能是因为随温度升高,酵母菌在发酵过程中受到抑制作用。综合考虑糖利用率和乙醇得率,根据试验结果可知30℃为最适发酵温度。
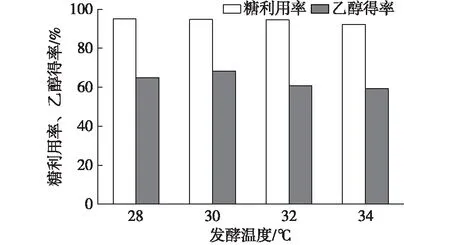
图7 发酵温度对固定化混合菌发酵性能的影响Fig. 7 Effect of temperature on fermentation by immobilized mixed yeast
2.3 优化前后固定化混合菌戊糖和己糖同步发酵比较分析
优化前后固定化混合菌戊糖和己糖同步发酵的比较结果见图8。优化后的固定化混合菌在发酵4 h时葡萄糖基本被利用完,碳源质量浓度仅剩2.13 g/L,葡萄糖代谢速率加快,从而减少了对木糖的抑制效果,提高了木糖利用效率。发酵24 h时,优化后的固定化混合菌发酵乙醇的质量浓度为15.21 g/L,比优化前提高了10.70%。
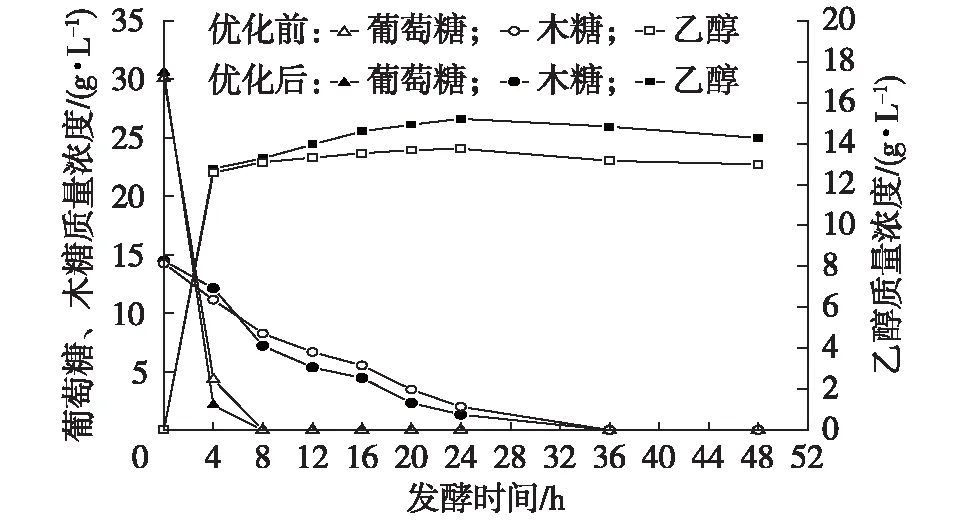
图8 优化前后固定化混合菌戊糖和己糖同步发酵过程比较Fig. 8 Comparison of pentose and hexose simultaneous fermentation by immobilized mixed yeast before and after optimization
3 结 论
笔者以海藻酸钙为固定化载体,通过比较固定化混合菌种和固定化休哈塔假丝酵母单菌发酵效果,研究了固定化混合菌种对戊糖和己糖同步发酵生产燃料乙醇的影响。固定化混合菌发酵时,酿酒酵母细胞能够快速利用葡萄糖,从而解除了发酵过程中葡萄糖代谢对木糖代谢的抑制作用,增加木糖的利用时间,与固定化单菌发酵相比,发酵时间缩短了16.67%,乙醇质量浓度提高了12.12%。对固定化混合菌戊糖和己糖同步发酵的条件进行了优化,并比较了优化前后固定化混合菌戊糖和己糖同步发酵效果。优化后固定化混合菌发酵乙醇的质量浓度为15.21 g/L,比优化前提高了10.70%。本研究利用固定化混合菌戊糖和己糖同步发酵生产燃料乙醇,木糖代谢速率慢,发酵时间长,且容易积累中间产物,影响了木糖的发酵效率,在今后的工作中将通过对木糖发酵菌驯化或构建高效代谢的木糖发酵菌以提高木糖发酵效率。
[ 1 ]BÖRJESSON P. Good or bad bioethanol from a greenhouse gas perspective—What determines this?[J]. Applied Energy, 2009,86(5):589-594.
[ 2 ]HASUNUMA T, OKAZAKI F, OKAI N, et al. A review of enzymes and microbes for lignocellulosic biorefinery and the possibility of their application to consolidated bioprocessing technology[J]. Bioresource Technology, 2013,135:513-522.
[ 3 ]MENON V, RAO M L. Trends in bioconversion of lignocellulose:biofuels, platform chemicals & biorefinery concept[J]. Progress in Energy and Combustion Science,2012,38(4):522-550.
[ 4 ]赖晨欢, 高子琦, 唐硕, 等. 木质素基表面活性剂对玉米秸秆纤维素酶水解的促进作用[J]. 林业工程学报, 2016, 1(6):102-107. LAI C H, GAO Z Q, TANG S, et al. Enhancement of lignin-based surfactants on the enzymatic hydrolysis of corn stover[J]. Journal of Forestry Engineering, 2016, 1(6):102-107
[ 5 ]游艳芝, 吉骊, 秦书百川, 等. 碱性亚硫酸盐耦合低压蒸汽预处理对慈竹转化乙醇得率的影响[J]. 林业工程学报, 2016, 1(6):95-101. YOU Y Z, JI L, QIN S B C, et al. Effect of alkaline sulfite coupling low pressure steam pretreament on ethanol production from bamboo(Neosinocalamusaffinis)[J]. Journal of Forestry Engineering, 2016,1(6):95-101.
[ 6 ]MISHRA A, SHARMA A K, SHARMA S, et al. Lignocellulosic ethanol production employing immobilizedSaccharomycescerevisiaein packed bed reactor[J]. Renewable Energy, 2016,98:57-63.
[ 7 ]李晴, 宋向阳, 范晓阳, 等. 混菌戊糖己糖发酵产乙醇的研究[J]. 林产化学与工业, 2015,35(2):111-116. LI Q, SONG X Y, FAN X Y, et al. Production of ethanol by fermentation of glucose and xylose using mixed yeasts[J]. Chemistry and Industry of Forest Products, 2015,35(2):111-116.
[ 8 ]BOTHAST R J, SAHA B C. Ethanol production from agricultural biomass substrates[J]. Advances in Applied Microbiology, 1997, 44:261-286.
[ 9 ]LYND L R, WYMAN C E, GERNGROSS T U. Biocommodity engineering[J]. Biotechnology Progress, 1999,15(5):777-793.
[10]CHANDRAKANT P, BISARIA V. Simultaneous bioconversion of cellulose and hemicellulose to ethanol[J]. Critical Reviews in Biotechnology, 1998,18(4):295-331.
[11]RAZMOVSKI V, VUCUROVIC V. Ethanol production from sugar beet molasses byS.cerevisiaeentrapped in an alginate-maize stem ground tissue matrix[J]. Enzyme and Microbial Technology, 2011,48(4-5):378-385.
[12]CHAN E, RUDRAVARAM R, NARASU M L, et al. Economics and environmental impact of bioethanol production technologies:an appraisal[J]. Biotechnology and Molecular Biology Reviews, 2007,2(1):14-32.
[13]JUNTER G A, JOUENNE T. Immobilized viable microbial cells:from the process to the proteome… or the cart before the horse[J]. Biotechnology Advances, 2004,22(8):633-658.
[14]CHANDEL A K, NARASU M L, CHANDRASEKHAR G, et al. Use ofSaccharumspontaneum(wild sugarcane) as biomaterial for cell immobilization and modulated ethanol production by thermotolerantSaccharomycescerevisiaeVS3[J]. Bioresource Technology, 2009,100(8):2404-2410.
[15]PACHECO A M, GONDIM D R, GONCALVES L R. Ethanol production by fermentation using immobilized cells ofSaccharomycescerevisiaein cashew Apple bagasse[J]. Applied Biochemistry and Biotechnology, 2010,161(1-8):209-217.
[16]LEBEAU T, JOUENNE T, JUNTER G A. Long-term incomplete xylose fermentation, after glucose exhaustion, withCandidashehataeco-immobilized withSaccharomycescerevisiae[J]. Microbiological Research, 2007,162(3):211-218.
[17]李艳华, 张雯, 房彩琴, 等. 固定化混合菌种发酵玉米秸秆水解液的研究[J]. 北京化工大学学报(自然科学版), 2008,35(5):74-77. LI Y H, ZHANG W, FANG C Q, et al. Fermentation of corn stalk hydrolysate by co-immobilized multi-microorganisms[J]. Journal of Beijing University of Chemical Technology (Natural Science Edition), 2008,35(5):74-77.
[18]付小全, 周新萍. 植物纤维混菌发酵产酒精的研究进展[J]. 食品研究与开发, 2011,32(2):183-186. FU X Q, ZHOU X P. Research progress on ethanol production by plant fiber mixed fermentation[J]. Food Research and Development, 2011,32(2):183-186.
[19]宋向阳, 李全, 欧阳嘉, 等. 树干毕赤酵母和酿酒酵母混合糖发酵产乙醇[J]. 生物加工过程, 2012,10(6):1-6. SONG X Y, LI Q, OUYANG J, et al. Co-fermentation of mixture of glucose and xylose to ethanol byPichiastipitisandSaccharomycescerevisiae[J]. Chinese Journal of Bioprocess Engineering, 2012,10(6):1-6.
[20]JEFFRIES T W, JIN Y S. Metabolic engineering for improved fermentation of pentoses by yeasts[J]. Applied Microbiology and Biotechnology, 2004,63(5):495-509.
[21]李聪. 酿酒酵母培养条件及发酵培养基的优化[J]. 中国农学通报, 2014,30(9):302-306. LI C. Optimization of culturing conditions and fermentation culture media ofSaccharomycescerevisiae[J]. Chinese Agricultural Science Bulletin, 2014,30(9):302-306.
Co-fermentation of pentose and hexose to ethanol byimmobilized mixed yeasts method
JIANG Feng, FANG Lingyan, WANG Hao, ZHU Junjun, FAN Yimin, SONG Xiangyang*
(CollegeofChemicalEngineering,NanjingForestryUniversity,Nanjing210037,China)
To study the effect of immobilized multi-microorganisms method on ethanol fermentation, strains ofCandidashehataeandSaccharomycescerevisiaewere immobilized on calcium alginate by embedding technology for the simultaneous fermentation of pentose and hexose. Meanwhile, the fermentation conditions of immobilized mixed multi-microorganisms were optimized. The results showed that the immobilization ofC.shehataeandS.cerevisiaerapidly increased the rate of glucose consumption and effectively relieved the inhibition of xylose consumption caused by glucose metabolism. Specifically, compared with that of individually immobilizedC.shehatae, the fermentation time of immobilized mixed yeast decreased from 24 h to 20 h, which reduced by 16.67%. The yield of ethanol increased from 13.28 g/L to 14.89 g/L, which increased by 12.12%. The optimal conditions of immobilized mixed yeast are as follows: 45 g/L of mixed sugar (glucose and xylose) as carbon source, fermentation temperature of 30℃, shaking speed of swing bed at 170 r/min, and the inoculation ratio ofC.shehataeandS.cerevisiaeat 4∶1. Under the above fermentation conditions, the maximum yield of 15.21 g/L total ethanol was achieved from the simultaneous fermentation of pentose and hexose. The yield of ethanol increased by 10.70% with the immobilized mixed multi-microorganisms method. The results of this study could provide some basic information for the industrialization of produce ethanol by immobilized mixed yeast method.
C.shehatae;S.cerevisiae; immobilized cells; fermentation of mixed yeasts; optimization
2016-11-30
2017-01-12
国家自然科学基金(30871992);江苏高校优势学科建设工程资助项目(PAPD)。
江枫,男,研究方向为发酵工程。通信作者:宋向阳,男,教授。E-mail:xiangyangsong@hotmail.com
TQ920.6
A
2096-1359(2017)04-0090-06

