酸解巴沙鲶鱼油制备富含OPO的人乳替代脂
黄 磊,邹孝强,郑 莉,金青哲,王兴国
(江南大学食品学院,食品科学与技术国家重点实验室,江苏省食品营养与安全协同创新中心,江苏 无锡 214122)
综合利用
酸解巴沙鲶鱼油制备富含OPO的人乳替代脂
黄 磊,邹孝强,郑 莉,金青哲,王兴国
(江南大学食品学院,食品科学与技术国家重点实验室,江苏省食品营养与安全协同创新中心,江苏 无锡 214122)
以巴沙鲶鱼油为原料、高油酸葵花籽油来源的游离脂肪酸为酰基供体,采用Lipozyme RM IM脂肪酶为催化剂催化酸解反应制备富含OPO的人乳替代脂。并采用液质联用对巴沙鲶鱼油、酸解巴沙鲶鱼油、市售BetapolTM的sn-OPO含量进行分析。结果表明,最佳制备条件为:底物摩尔比1∶6,酶用量12%,反应温度60℃,水分含量3.5%(基于酶质量),反应时间3 h。在最佳条件下,酸解产物中sn-2棕榈酸分布和sn-1,3油酸含量分别为73.18%和71.11%。酸解产物中sn-OPO含量从23.35%提高到34.28%,高于市售BetapolTM的33.24%。
1,3-二油酸-2-棕榈酸甘油三酯(OPO);巴沙鲶鱼油;酸解;Lipozyme RM IM
母乳在婴幼儿成长发育过程中扮演着非常重要的角色,像一个“营养池”几乎提供了婴幼儿生长所需的所有营养物质。乳脂肪被认为是最重要的组成成分,其含量只有3%~5%,但提供了50%~60%能量。乳脂肪主要成分为甘油三酯,占到总量的98%[1-2],与植物油相比,乳脂肪具有特殊的脂肪酸结构[3-4],超过60%的棕榈酸分布在sn-2位,油酸等不饱和脂肪酸主要分布在sn-1,3位。所以乳脂肪中甘油三酯以USU(U不饱和,S饱和)构型为主。大量文献证实,母乳中sn-OPO含量高,且和婴幼儿消化、吸收、代谢和发育息息相关[5-7]。
乳脂肪进入小肠,在胰脂肪酶(sn-1,3特异性脂肪酶)作用下,大部分甘油三酯被水解成sn-2单甘酯和游离脂肪酸。sn-2单甘酯直接被小肠吸收,而高熔点的长链饱和脂肪酸容易与钙、镁离子结合形成皂,引起能量和钙丢失,导致婴儿产生便秘等不良反应[8-9]。因此,乳脂肪中大多数棕榈酸在sn-2 位可以避免这些情况发生。正如Aoe等[10]报道,sn-OPO在婴幼儿体内的吸收运输速率要高于sn-OOP。
母乳的特殊结构给奶粉市场带来了巨大商机,许多厂家致力于模拟母乳成分。OPO能够改善婴儿对配方奶粉中各营养成分的吸收情况,也对婴儿胃肠功能成熟等方面有一定的促进作用[11]。文献中合成OPO报道很多,原料可以分为3种:棕榈硬脂,猪油,巴沙鲶鱼油。对于棕榈硬脂,虽然sn-2棕榈酸含量高,但其sn-1,3的棕榈酸含量也很高,合成时需要很多的油酸来取代sn-1,3棕榈酸,增加了成本。卫生部批准的唯一进入我国市场的产品BetapolTM正是通过此方法合成。猪油在其脂肪酸组成上和母乳有很多相似之处,且OPO含量也较为丰富[12],是作为人乳脂替代品的天然原料。但伊斯兰信徒不食用猪油,在应用覆盖面上存在一定的局限性。巴沙鲶鱼是湄公河流域中一种特有的优质经济鱼,也是越南水产品中加工出口量最大的品种。早前,实验室[13]对巴沙鲶鱼油采用先分提后酸解的方式得到了富含OPO的产品。只使用了产品固脂部分,液脂部分未被使用;另一方面,由于OPO熔点较低,相当一部分OPO存在于液脂之中,造成了资源利用率低的情况。同时,实验室利用巴沙鲶鱼油与植物油进行混合,制备了与母乳相近的人乳脂替代品[14]。事实证明巴沙鲶鱼油由于其特殊的脂肪酸组成及分布是制备人乳替代脂的良好原料。
本文以巴沙鲶鱼油为原料、高油酸葵花籽油来源的游离脂肪酸为酰基供体,采用Lipozyme RM IM脂肪酶为催化剂催化酸解反应制备富含OPO的人乳替代脂。之后采用液质联用技术对OPO中同分异构体进行定量分析,确定其sn-OPO含量,同时与市售的BetapolTM进行对比分析,以期为母乳替代脂生产实践提供理论基础。
1 材料与方法
1.1 实验材料
巴沙鲶鱼油(BCFO),重庆巴沙鲶鱼油有限公司;高油酸葵花籽油,益海嘉里集团;Lipozyme RM IM,诺维信(中国)投资有限公司;猪胰脂酶、Supelco 37种脂肪酸甲酯混标、sn-OOP标品、sn-OPO标品,Sigma-Aldrich(上海)贸易有限公司;60GTLC硅胶板(10 cm×20 cm);正己烷、异丙醇、甲醇,色谱纯;乙醚三氟化硼溶液、浓硫酸、冰醋酸、乙醚。
AR2140电子精密天平, SHA-CA水浴恒温振荡器, HH-4数显恒温水浴锅, XW-80A微型旋涡混合仪, RE-52旋转蒸发器,SHB-B95型循环水式多用真空泵,TGL-16B离心机,GC-14B气相色谱仪(日本Shimadzu公司),KDL1型分子蒸馏设备(德国UIC公司)。
1.2 实验方法
1.2.1 游离脂肪酸的制备
游离脂肪酸的制备参考Senanayake等[15]的方法。25 g高油酸葵花籽油中加入5.75 g 氢氧化钾、11 mL蒸馏水和66 mL 95%乙醇,在80℃和200
r/min下冷凝回流反应1 h。冷却后向体系中加入50 mL蒸馏水和100 mL正己烷,充分振荡后除去含有不皂化物的有机相。采用3 mol/L盐酸溶液调节含有皂化物的无机相至pH为1,释放脂肪酸。最后采用无水Na2SO4对所得游离脂肪酸进行脱水处理。
1.2.2 人乳替代脂的制备
将巴沙鲶鱼油和由高油酸葵花籽油制备的游离脂肪酸以一定的摩尔比混合,加入脂肪酶Lipozyme RM IM,以及占酶质量3.5%的水分,在磁力搅拌500 r/min、一定温度下反应一定时间后,得到含有产物和游离脂肪酸的混合物。
1.2.3 产物的分离
分子蒸馏除去反应后体系中的游离脂肪酸得到最终产物。分子蒸馏条件为:蒸发器温度185℃;冷凝器温度40℃;换热器温度60℃;旋转刮膜速率120 r/min;进料速度2 mL/min,绝对压力2 Pa。蒸发器的加热源来自夹套中循环的加热硅油。
1.2.4 检测方法
1.2.4.1 脂肪酸组成分析
取样品50 μL点板,在展开剂为正己烷-乙醚-乙酸(体积比80∶20∶1)条件下进行薄板分离,用2,7二氯荧光素乙醇溶液显色,在紫外照射条件下把甘油三酯条带刮下,用乙醚提取2次,向氮气浓缩后的油样加入2 mL正己烷及500 μL KOH-甲醇溶液(2 mol/L),用旋涡振荡仪振荡2 min,多次振荡,静置。取出上层有机相并采用无水Na2SO4进行脱水处理,10 000 r/min离心3 min,取上层进气相色谱分析。
脂肪酸组成分析采用配备火焰离子化检测器的GC-14B气相色谱仪,分析柱为熔融石英毛细管柱(PEG-20M,30 m×0.32 mm×0.5 μm)。色谱条件为:100℃保留4 min,并以15℃/min升温至180℃,保留4 min,并最终以4℃/min升温至215℃;进样口温度及检测器温度均为250℃。通过标准品的保留时间鉴定脂肪酸种类。
1.2.4.2 sn-2脂肪酸组成分析
根据Zou等[16]的方法,对薄层色谱法分离获得的甘油三酯进行水解获得sn-2单甘酯。用2 mL乙醚提取1.2.4.1所得的甘油三酯带2次,并用氮气进行浓缩。向甘油三酯中加入1 mL 1 mol/L Tris-HCl缓冲液(pH 8.0)、0.25 mL 0.05%胆盐、0.1 mL 2.2%氯化钙以及10 mg胰脂肪酶,在40℃下振荡反应3 min,向体系中加入1 mL 6 mol/L的盐酸和2 mL乙醚,振荡后以10 000 r/min离心5 min。取出乙醚层,并用无水Na2SO4对其进行脱水处理,采用氮气将其浓缩至200 μL。将水解产物上样至薄板,并用正己烷-乙醚-乙酸(体积比50∶50∶1)的扩展液分离获得sn-2单甘酯。sn-2单甘酯的甲酯化参照1.2.4.1所述进行。
1.2.4.3 液质联用定性测定甘油三酯组成
超高效液相色谱(UPLC)条件:色谱柱为Acquity UPLC BEH C18分析柱(2.1 mm×50 mm, 1.9 μm);流动相A为乙腈-异丙醇(体积比1∶9),流动相B为乙腈-水(体积比4∶6),同时流动相A、B中均添加乙酸铵(每升流动相加入10 mmol乙酸铵);进样量1.0 μL;柱温45℃,样品室温度4℃。流动相洗脱条件如表1所示。

表1 UPLC洗脱程序
MS条件:ESI电离源,正离子模式;毛细管电压3.0 kV,锥孔电压30 V;离子源温度100℃,脱溶剂温度400℃;碰撞气体为氩气,去溶剂化气体(氮气)流速700 L/h;扫描时间间隔0.2 s,扫描范围(m/z)200~1 500;碰撞电压35 V。
1.2.4.4 高效液相色谱定量测定甘油三酯含量
色谱条件:检测器温度55℃,空气流速1.8 mL/min,增益为1;样品质量浓度10~20 mg/mL;Lichrospher C18分析柱(5 μm,4.6 mm×250 mm);流动相A乙腈,流动相B异丙醇-正己烷(体积比1∶1),洗脱程序为0~20 min,60%A;20~60 min,60%~56%A;60~70min,56%~60%A;流速0.8 mL/min。
2 结果与讨论
2.1 巴沙鲶鱼油脂肪酸组成
巴沙鲶鱼油脂肪酸组成分析结果如表2所示。
从表2可以看出,巴沙鲶鱼油中棕榈酸和油酸含量较高,其中,棕榈酸含量为27.26%,油酸为44.01%,同时sn-2棕榈酸含量高达44.27%,这是其构建高含量OPO的基础。而sn-2棕榈酸分布(表示sn-2棕榈酸占总棕榈酸的比值)为54.13%。然而据文献报道,母乳中sn-2棕榈酸分布最低值为60%[17],所以巴沙鲶鱼油并不符合要求,这就意味着在用巴沙鲶鱼油制备人乳替代脂时需要降低其sn-1,3棕榈酸含量。
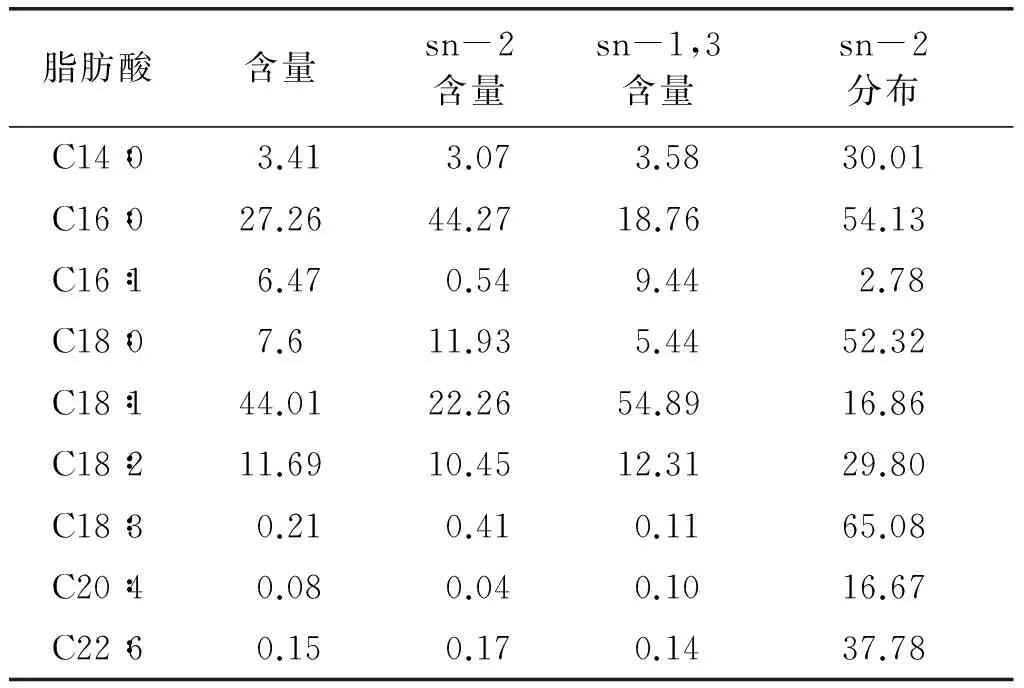
表2 巴沙鲶鱼油脂肪酸组成分析 %
注:sn-2脂肪酸分布=sn-2脂肪酸含量/(3×脂肪酸含量),sn-1,3脂肪酸含量=(3×脂肪酸含量-sn-2脂肪酸含量)/2。
2.2 巴沙鲶鱼油甘油三酯的种类和含量
为确定巴沙鲶鱼油甘油三酯组成和含量,采用液质联用和高效液相色谱技术分别对巴沙鲶鱼油进行测定。结合液质联用出峰时间、高效液相色谱出峰时间以及高效液相色谱甘油三酯出峰规律(碳当量小的先出峰;碳当量相同时,不饱和程度高的先出峰),判断甘油三酯类型,结果见表3,高效液相色谱图如图1所示。

表3 巴沙鲶鱼油的甘油三酯组成
注:M,(肉)豆蔻酸;P,棕榈酸;Po,棕榈油酸;S,硬脂酸;O,油酸;L,亚油酸。下同。
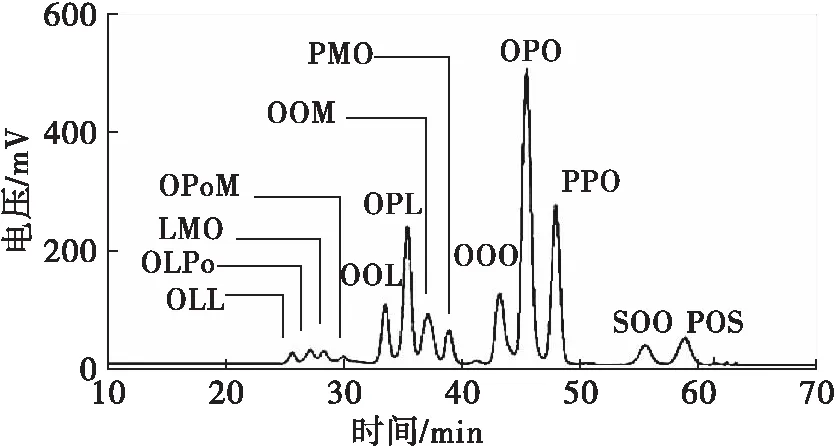
图1 巴沙鲶鱼油甘油三酯组成的HPLC谱图
从表3可以看出,巴沙鲶鱼油中主要甘油三酯组成为OPO (32.18%)、PPO (11.60%)、OOO (8.35%)、OPL (13.12%)、SOO (5.46%)、OOL (7.17%)等,这些甘油三酯均为母乳的组成成分。巴沙鲶鱼油sn-2棕榈酸含量高,所以OPO、PPO、POS多数以sn-2棕榈酸的甘油三酯形式存在,在后续反应中PPO和POS均可以转变为OPO,既可以提高OPO含量,又可以降低这些饱和度高的甘油三酯,更有利于婴幼儿生长发育。
2.3 酸解巴沙鲶鱼油制备人乳替代脂
实验将巴沙鲶鱼油和从高油酸葵花籽油中制备的游离脂肪酸(棕榈酸3.96%,硬脂酸3.03%,油酸81.53%,亚油酸10.55%)反应。选择反应过程中的棕榈酸含量、油酸含量、sn-2棕榈酸含量、sn-2油酸含量作为衡量指标确定反应的最适条件,从而提高OPO含量的同时提高sn-2棕榈酸分布来达到人乳替代脂要求。根据文献报道[18-20],水分含量对产品的特性影响很小,但高水分反而会加剧反应过程中的酰基转移,从而降低sn-2棕榈酸含量的同时增多甘油二酯的含量,综合考虑,选择水分含量为酶质量的3.5%作为反应条件。
2.3.1 底物摩尔比的影响
此酶法酸解反应是可逆反应[21],底物摩尔比决定着反应达到平衡的时间。实验选用反应条件为酶用量(以底物质量计)10%,反应温度50℃,水分含量为酶质量的3.5%。底物摩尔比(游离脂肪酸与巴沙鲶鱼油摩尔比)对棕榈酸含量、油酸含量、sn-2棕榈酸含量、sn-2油酸含量的影响如图2所示。
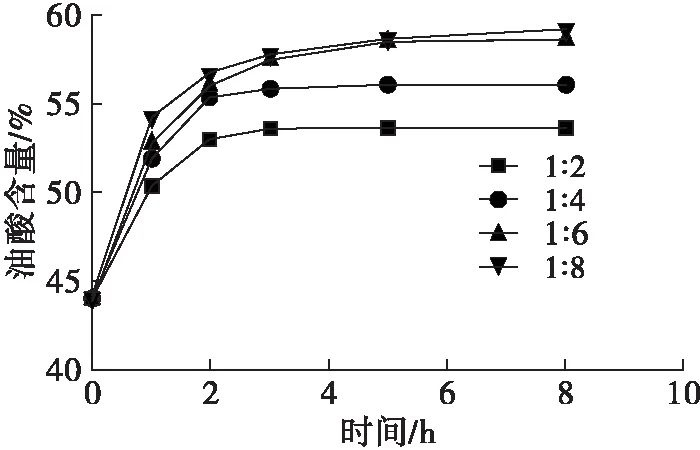

从图2可以看出,当底物摩尔比在1∶4和1∶2时,反应平衡时间为3 h;底物摩尔比为1∶8和1∶6时,反应平衡时间为5 h。对于底物摩尔比为1∶2和1∶4来说,棕榈酸被油酸取代的速度较慢,当反应达到平衡时,油酸含量明显低于1∶6和1∶8条件下的油酸含量。因为酰基转移的存在,随着反应时间的延长,sn-2棕榈酸含量呈下降趋势。另一方面,随着底物摩尔比的增加导致酰基转移增加,在底物摩尔比1∶6和1∶8时,反应平衡时得到的产品棕榈酸含量分别为20.21%和19.80%,sn-2棕榈酸含量分别为40.10%和39.51%,油酸含量分别为58.47%和58.69%,sn-2油酸含量分别为31.22%和32.34%,经过计算sn-2棕榈酸分布分别为66.14%和66.52%,sn-1,3油酸含量分别为72.09%和71.87%。因此,底物摩尔比1∶6和1∶8在结果上差别并不是很大,但是1∶6条件下反应耗用了更少的脂肪酸,选择底物摩尔比1∶6作为进一步研究的条件。
2.3.2 酶用量的影响
高酶用量可以减少反应达到平衡的时间来减少酰基转移,也会使得体系中甘油二酯含量增加导致酰基转移增加[22]。实验条件选择底物摩尔比为1∶6、反应温度为50℃、水分含量为酶质量的3.5%。酶用量对棕榈酸含量、油酸含量、sn-2棕榈酸含量、sn-2油酸含量的影响如图3所示。


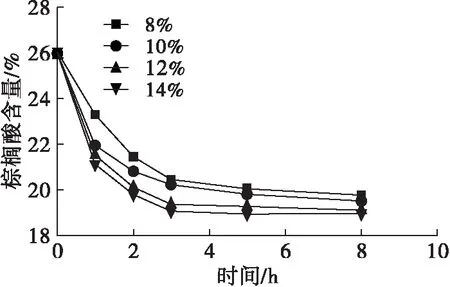
从图3可以看出,当酶用量为8%和10%时,平衡时间为5 h;当酶用量为12%和14%时,平衡时间为3 h。8%和10%的酶用量下产物油酸含量低于12%和14%的油酸含量。随着反应时间的延长,sn-2油酸含量增加而sn-2棕榈酸含量降低;另一方面,随着酶用量的增多,这种变化速率不断增加。当反应达到平衡时,12%和14%酶用量下sn-2油酸含量分别为30.25%和30.95%,sn-2棕榈酸含量分别为40.35%和39.72%。计算得到sn-1,3油酸含量分别为69.69%和69.32%;sn-2棕榈酸分布分别为72.97%和73.04%。12%和14%酶用量得到的反应结果相近,12%酶用量成本更低。综合考虑,选择12%酶用量作为后续反应的条件。
2.3.3 反应温度的影响
在酶法酸解反应中,高温可以降低体系的黏度,增加反应物的有效碰撞,从而提高反应速率。然而,高温也可以提高酰基转移速率,从而降低反应产物的纯度,甚至可能破坏酶的结构,导致其不可逆的失活[23]。实验条件为底物摩尔比1∶6、酶用量12%、水分含量为酶质量的3.5%。反应温度对棕榈酸含量、油酸含量、sn-2棕榈酸含量、sn-2油酸含量的影响如图4所示。


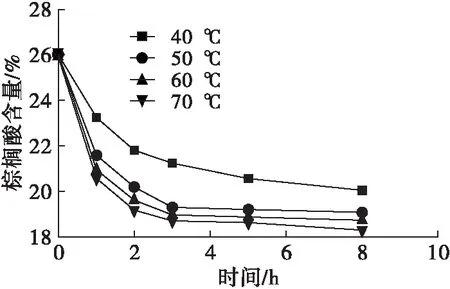
从图4可以看出,反应温度50、60、70℃下反应达到平衡时间为3 h,而40℃下反应达到平衡时间超过5 h。随着反应温度升高,酰基转移速率明显提高。当反应达到平衡时,计算可得在反应温度40、50、60、70℃下对应的sn-1,3油酸含量和sn-2棕榈酸分布分别为66.50%, 70.60%, 71.11%和69.50%;69.02%, 70.60%, 73.18%和72.96%。在60℃下,sn-1,3油酸含量和sn-2棕榈酸分布明显优于其他条件。因此,选择60℃为实验的反应温度。
2.4 酸解巴沙鲶鱼油的甘油三酯组成
综合选择实验条件为:底物摩尔比1∶6,酶用量12%,反应温度60℃,水分含量为酶质量的3.5%,反应时间3 h。采用上述条件进行大规模反应,反应产物通过分子蒸馏去除游离脂肪酸,最终产品得率为93.7%(得率=产品/巴沙鲶鱼油)。产品的甘油三酯组成见表4。产物sn-1,3油酸含量从 54.89% 增长到71.11%,sn-2棕榈酸含量为40.35%,sn-2棕榈酸分布从54.13%提高到73.18%,OPO含量也增加到43.95%(见表4)。
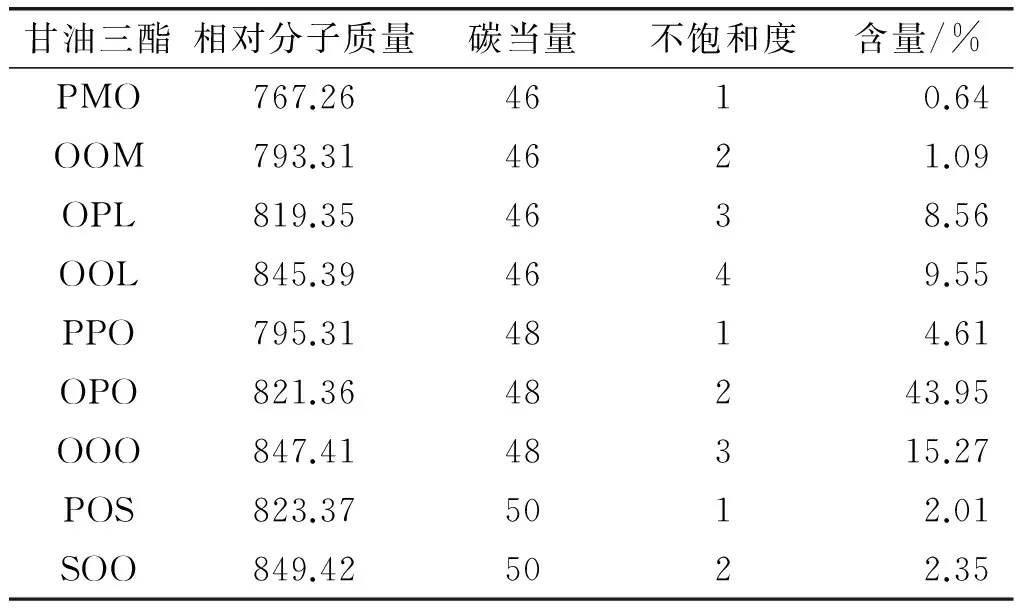
表4 酸解后巴沙鲶鱼油主要甘油三酯组成
2.5 OPO同分异构体分离测定
高效液相色谱难以对同分异构体进行分离,色谱图中OPO峰为sn-OPO和sn-OOP混合物。在质谱体系中,sn-OPO产生[OP]+离子能力大于sn-OOP[24]。文献报道,将sn-PPO和sn-POP按照不同比例混合,测定在不同混合条件下[OP]+和[OO]+的相对丰度的变化。实验结果同sn-PPO和sn-POP单独分析产生[OP]+和[OO]+的相对丰度所计算的理论值进行比较,在没有校正因子的情况下,实验值同理论值之间的差异为1%~2%[25-27]。因此,采用液质联用可以对sn-OPO进行定量。表5为sn-OOP和sn-OPO在不同混合条件下质谱后产生的[OO]+/[OP]+比值,sn-OPO纯度越高,[OO]+/[OP]+的比值就越小。
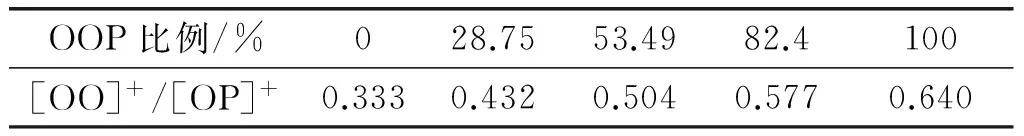
表5 液质联用测定不同比例sn-OOP和
根据这种出峰特点得到sn-OOP定量标准曲线方程:y=333.8x-113.1,R2=0.997(式中:x为[OO]+/[OP]+比值,y为sn-OOP比例)。对巴沙鲶鱼油、酸解反应产物、BetapolTM的sn-OPO进行定量,结果见表6。
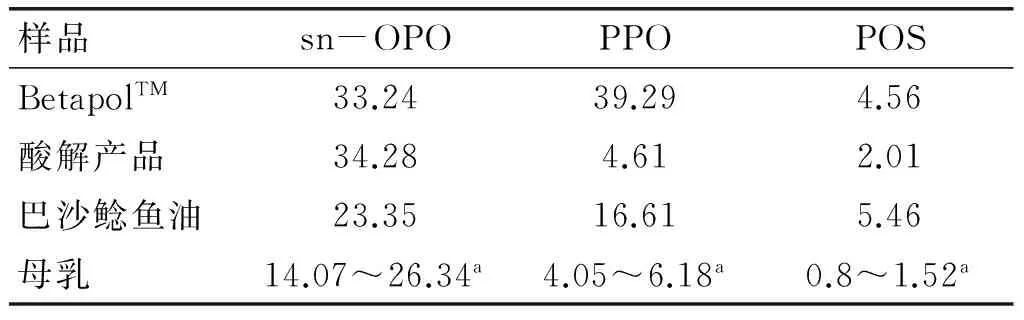
表6 BetapolTM、巴沙鲶鱼油、酸解巴沙鲶鱼油、
注:a指数据来源于文献[28]。
从表6可以看出,酸解后巴沙鲶鱼油产品的sn-OPO 含量高达34.28%,高于市售BetapolTM,同时其PPO和POS含量更接近母乳水平。
3 结 论
本文通过直接酶法酸解巴沙鲶鱼油合成了富含sn-OPO的人乳替代脂。通过单因素实验得到最佳反应条件为:底物摩尔比1∶6,酶用量12%,反应温度60℃,水分含量为酶质量的3.5%,反应时间3 h。在最佳条件下,sn-2棕榈酸、sn-1,3油酸含量以及sn-2棕榈酸分布分别为40.35%、71.11%和73.18%,sn-OPO含量达34.28%。直接利用巴沙鲶鱼油进行合成反应,简单直接,可有效缓解棕榈硬脂的成本问题和猪油使用的宗教问题,同时其sn-OPO含量高于市售BetapolTM,且PPO、POS等甘油三酯含量更接近母乳水平,在人乳替代脂市场具有广阔的前景。
[1] JENSEN R G. Lipids in human milk[J]. Lipids, 1999, 34(12): 1243-1271.
[2] JENSENR R G, LEBENTHAL E. Lipids in human milk-composition and fat-soluble vitamins[J]. Textbook Gastroenterol Nutr Infancy, 1989(2): 157-208.
[3] CARNIELLI V P, LUIJENDIJK I H, VAN GOUDOEVER J B, et al. Structural position and amount of palmitic acid in infant formulas: effects on fat, fatty acid, and mineral balance[J]. J Pediatric Gastroenterol Nutr, 1996, 23(5): 553-560
[4] 夏袁,项静英,曹晓辉,等. 无锡地区人乳脂肪脂肪酸组成及sn-2位脂肪酸分布[J]. 中国油脂,2015,40(11):44-47.
[5] MU H, HØY C E. The digestion of dietary triacylglycerols[J]. Progr Lipid Res, 2004, 43(2): 105-133.
[6] TOMARELLI R M, MEYER R J, WEABER J R, et al. Effect of positional distribution on the absorption of the fatty acids of human milk and infant formulas[J]. J Nutr,1968,95: 583-590.
[7] FILER L J Jr, MATTSON F H, FOMON S J. Triglyceride configuration and fat absorption by the human infant[J]. J Nutr, 1969, 99: 293-298.
[8] CARNIELLI V P, LUIJENDIJK I H, VAN GOUDOEVER J B, et al. Feeding premature newborn infants palmitic acid in amounts and stereoisomeric position similar to that of human milk: effects on fat and mineral balance[J]. Am J Clin Nutr, 1995, 61(5): 1037-1042.
[9] KENNEDY K, FEWTRELL M S, MORLEY R, et al. Double-blind, randomized trial of a synthetic triacylglycerol in formula-fed term infants: effects on stool biochemistry, stool characteristics, and bone mineralization[J]. Am J Clin Nutr, 1999, 70(5): 920-927.
[10] AOE S, YAMAMURA J, MATSUYAMA H, et al. The posi-tional distribution of dioleoyl-palmitoyl glycerol influences lymph chylomicron transport, composition and size in rats[J]. J Nutr, 1997, 127(7): 1269-1273.
[11] FERREIRA-DIAS S, TECELO C. Human milk fat substi-tutes: advances and constraints of enzyme-catalyzed production[J]. Lipid Technol, 2014, 26(8): 183-186.
[12] 张晓鹏,孟宗,李进伟,等. 猪油溶剂法分提产物性质分析[J]. 中国油脂,2014,39(2):37-40.
[13] ZOU X Q, JIN Q Z, GUO Z, et al. Preparation of 1, 3-dioleoyl-2-palmitoylglycerol-rich structured lipids from basa catfish oil: combination of fractionation and enzymatic acidolysis[J]. Eur J Lipid Sci Technol, 2015,118(5):708-715.
[14] 邹孝强,张晋芳,金青哲,等. 改性巴沙鲶鱼油制备人乳替代脂的研究[J]. 中国油脂,2016,41(1):27-32.
[15] SENANAYAKE S P J N, SHAHIDI F. Enzymatic incorporation of docosahexaenoic acid into borage oil[J]. J Am Oil Chem Soc, 1999, 76(9): 1009-1015.
[16] ZOU X Q, HUANG J H, JIN Q Z, et al. Preparation of human milk fat substitutes from palm stearin with arachidonic and docosahexaenoic acid: combination of enzymatic and physical methods[J]. J Agric Food Chem, 2012, 60(37): 9415-9423.
[17] ZOU X Q, GUO Z, HUANG J H, et al. Human milk fat globules from different stages of lactation: a lipid composition analysis and microstructure characterization[J]. J Agric Food Chem, 2012, 60(29): 7158-7167.
[18] ZOU X Q, HUANG J H, JIN Q Z, et al. Lipase-catalyzed preparation of human milk fat substitutes from palm stearin in a solvent-free system[J]. J Agric Food Chem, 2011, 59(11): 6055-6063.
[19] ZOU X Q, HUANG J H, JIN Q Z, et al. Preparation of human milk fat substitutes from palm stearin with arachidonic and docosahexaenoic acid: combination of enzymatic and physical methods[J]. J Agric Food Chem, 2012, 60(37): 9415-9423.
[20] 朱东奇,李道明,王卫飞,等. 两步酶法合成富含EPA/DHA甘油酯的研究[J]. 中国油脂,2016,41(12):46-49.
[21] XU X. Engineering of enzymatic reactions and reactors for lipid modification and synthesis[J]. Eur J Lipid Sci Technol, 2003, 105(6): 289-304.
[22] DU W, XU Y Y, LIU D H, et al. Study on acyl migration in immobilized lipozyme TL-catalyzed transesterification of soybean oil for biodiesel production[J]. J Mol Catal B: Enzym, 2005, 37(1): 68-71.
[23] VIKBJERG A F, MU H, XU X. Parameters affecting incorporation and by-product formation during the production of structured phospholipids by lipase-catalyzed acidolysis in solvent-free system[J]. J Mol Catal B: Enzym, 2005, 36(1): 14-21.
[24] FAUCONNOT L, HAU J, AESCHLIMANN J M, et al. Quantitative analysis of triacylglycerol regioisomers in fats and oils using reversed-phase high-performance liquid chromatography and atmospheric pressure chemical ionization mass spectrometry[J]. Rapid Commun Mass Spectrom, 2004, 18(2): 218-224.
[25] HSU F F, TURK J. Structural characterization of triacylglycerols as lithiated adducts by electrospray ionization mass spectrometry using low-energy collisionally activated dissociation on a triple stage quadrupole instrument [J]. J Am Soc Mass Spectrom, 1999, 10: 587-599.
[26] NEFF W E, BYRDWELL W C. Triacylglycerol analysis by high performance liquid chromatography-atmospheric pressure chemical ionization mass spectrometry: crepis alpina and vernonia galamensis seed oils [J]. J Liquid Chromatogr, 1995, 18: 4165-4181.
[27] BYRDWELL W C, EMKEN E A. Analysis of triglycerides using atmospheric pressure chemical ionization mass spectrometry [J]. Lipids, 1995, 30: 173-175.
[28] 邹孝强. 人乳脂替代品的评价模型建立及其酶法制备[D]. 江苏 无锡: 江南大学, 2013.
Production of structured lipids rich in 1,3-dioleoyl-2-palmitoylglycerol from basa catfish oil as human milk fat substitutes by enzymatic acidolysis
HUANG Lei, ZOU Xiaoqiang, ZHENG Li, JIN Qingzhe, WANG Xingguo
(Synergetic Innovation Center of Food Safety and Nutrition, State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China)
Lipozyme RM IM-catalyzed acidolysis of basa catfish oil with free fatty acids from high oleic acid sunflower seed oil to increase the content of OPO was conducted. The sn-OPO contents of basa catfish oil, enzymatic product and BetapolTMwere determined by UPLC-MS. The results showed that the optimal preparation conditions were obtained as follows: molar ratio of substrate 1∶6, enzyme dosage 12%, reaction temperature 60℃, water content 3.5%(on the basis of enzyme mass) and reaction time 3 h. Under these conditions, the distribution of sn-2 palmitic acid and the content of sn-1,3 oleic acid in the acidolysis product were 73.18% and 71.11%, respectively. The content of sn-OPO in the acidolysis product increased from 23.35% to 34.28%, higher than 33.24% in BetapolTM.
1, 3-dioleoyl-2-palmitoylglycerol(OPO); basa catfish oil; acidolysis; Lipozyme RM IM
2016-09-20;
2017-03-09
国家自然科学基金(31601433);江苏省自然科学基金(BK20140149)
黄 磊(1992),男,在读硕士,研究方向为脂质科学与技术(E-mail)jndx_huanglei@163.com。
邹孝强,副教授(E-mail)xiaoqiangzou@163.com。
TS225.1;TS222
A
1003-7969(2017)05-0116-07

