响应面优化酶法酯交换催化合成中长链结构甘三酯
陆继源,王小三,金青哲,王兴国
(江南大学 食品学院,江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122)
油脂深加工
响应面优化酶法酯交换催化合成中长链结构甘三酯
陆继源,王小三,金青哲,王兴国
(江南大学 食品学院,江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122)
采用响应面法对脂肪酶Lipozyme 435在无溶剂体系中催化中链甘三酯(MCT)和大豆油酯交换反应合成中长链甘三酯的反应条件进行优化,并采用超高压液相色谱-飞行时间质谱在正离子模式下对反应产物的甘三酯构型进行分析。结果表明:反应温度和反应时间对中长链甘三酯含量具有极显著性影响(P<0.01)。最佳反应条件为大豆油与MCT质量比60∶40,反应时间4.36 h,反应温度89 ℃,加酶量(以底物质量计)5.5%。在此条件下,中长链甘三酯含量达到84.15%。CyCyL、CyCyLn、LOCy、LPCy、OOCy和LOCa为反应产物的主要甘三酯构型。
中长链结构甘三酯;Lipozyme 435;酯交换;响应面;甘三酯构型
中长链结构甘油三酯(MLCT)是指一个甘油骨架同时含有中碳链脂肪酸和长碳链脂肪酸的甘三酯。MLCT具有快速供能,减少脂肪积累的营养代谢优势[1-3],同时具有烟点低,不易起泡的优良煎炸特性[4-5],在食品、医药行业需求与日俱增,市场潜力巨大。
目前,国内外合成MLCT的方法主要有酶法和化学法。与化学法相比,酶法催化反应条件温和、节省能源、脂肪酶专一性强、副反应少、产品容易回收、对环境没有污染,所得产物的安全性更高[6]。近年来学者们对于酶法制备MLCT的研究重点在酸解和酯化上,而对酶法酯交换合成的研究报道很少,多集中在新资源油料上。Zhao等[7]利用脂肪酶Lipozyme RM IM催化香樟籽油和山茶油酯交换反应合成MLCT含量55.81%的结构脂。Khodadadi等[8]研究了有机溶剂体系下,Novozym 435催化亚麻籽油和辛酸甘油三酯的酯交换合成工艺,合成了MLCT含量46.21%的产品。
本研究以大豆油和中链甘三酯(MCT)为原料,采用响应面法优化脂肪酶Lipozyme 435催化合成MLCT的反应条件,旨在减少酶的用量,缩短反应时间,为酶法制备MLCT的工业化推广奠定基础。
1 材料与方法
1.1 实验材料
大豆油:中粮东海粮油(张家港)有限公司;中链甘三酯:浙江建德千岛化工有限公司;Lipozyme 435:诺维信生物技术有限公司;正己烷、甲醇、异丙醇、乙腈,均为色谱纯;无水乙醇、氯化钠、氢氧化钠、Tris缓冲液、胆酸钠、盐酸、乙醚,均为分析纯。
Agilent 7820A气相色谱仪、Agilent 1260高效液相色谱仪,安捷伦科技有限公司;ELSD 3300蒸发光散射检测器,美国Grace公司;Waters Acquity UPLC、Waters Xevo G2-S Q-TOF质谱仪,沃特世科技有限公司。
1.2 实验方法
1.2.1 MLCT的催化合成
将大豆油和MCT按一定质量比混合,加入到密闭的容器中,加入脂肪酶Lipozyme 435,在一定温度下,磁力搅拌反应一段时间后,停止加热,反应物转入离心管中,4 000 r/min 离心5 min,将脂肪酶和油分离,得到含有中长链结构甘三酯的产物。
1.2.2 分析方法
产物脂肪酸组成的测定:参考文献[9]。
产物甘三酯结构测定采用超高压液相色谱-飞行时间质谱。超高压液相色谱条件:色谱柱为Thermo Hypersil Gold柱(2.1 mm×100 mm,粒径1.9 μm);流动相A为乙腈-甲醇-水(体积比19∶19∶2),流动相B为异丙醇(流动相A、B中均添加5 mmol/L乙酸铵和0.1%甲酸);柱温35℃;进样量1 μL;流动相洗脱条件见表1。
质谱条件:ESI电离源,正离子模式;毛细管电压3.1 kV,锥孔电压40.0 V,离子源温度120℃,脱溶剂温度450℃;锥孔气流速80.0 L/h,脱溶剂气流速600 L/h;扫描方式MSE,一级碰撞电压6 V,二级碰撞电压20~40 V;扫描间隔时间0.3 s;扫描范围100~1 200;采集时间15 min,碰撞气体为氩气。
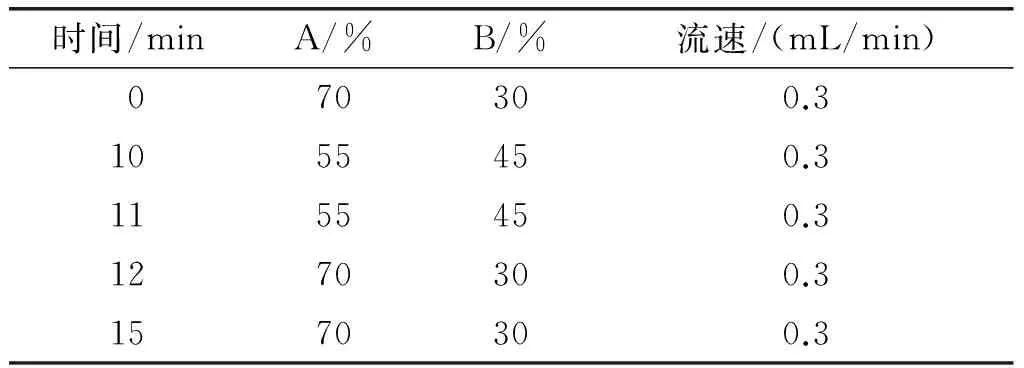
表1 超高压液相色谱-飞行时间质谱洗脱条件
产物中MLCT含量的测定:参考文献[10]。
2 结果与讨论
2.1 响应面实验设计及结果
采用Design Expert 8.0.6软件进行响应面设计,根据Central Composite Design原理,在前期单因素实验基础上,以影响MLCT含量的3个重要因素反应时间(A)、反应温度(B)和加酶量(以底物质量计)(C)为自变量,以产物中MLCT含量(Y)为响应值,进行响应面优化设计。因素水平见表2,响应面实验设计及结果见表3。

表2 因素水平

表3 响应面实验设计及结果
运用Design Expert软件进行回归拟合,并进行手动优化后, 获得回归方程:Y=58.03+12.92A+34.47B+2.99C+8.51AB+0.038AC+3.258E-003BC-5.13A2-18.75B2-2.14C2。
回归方程方差分析见表4。

表4 回归方程方差分析
2.2 响应面分析
图1为4%加酶量的反应条件下,反应温度和反应时间交互作用对中长链甘三酯含量的影响。从图1可以看出,中长链甘三酯含量的最大值出现在90~105℃和1.5~5.5 h的范围内。在较高温度下,中长链甘三酯含量随反应时间的延长升到极大值后出现下降趋势;在反应时间较长的情况下,中长链甘三酯含量随反应温度的变化也呈现类似的趋势,这主要与酶的催化活性有关。反应温度的控制非常重要,由于酶促催化反应是一个热动力学过程,影响着酶的催化活性、底物的溶解状态及黏度、底物和产物的传质速度等[11]。反应温度升高,可使酯交换程度和反应速度提高。但反应温度过高时,也会导致酶变性失活。
图2为反应时间3 h条件下,反应温度和加酶量交互作用对中长链甘三酯含量的影响。从图2可以看出,中长链甘三酯最高含量出现在90~105℃和2%~7%加酶量的范围内。随着反应温度的不断升高,中长链甘三酯含量上升。这主要是由于反应温度升高导致脂肪酶的活性升高,脂肪酶Lipozyme 435具有高的热稳定性,适合在90℃以上的高温体系下催化酯交换反应。反应速度与加酶量符合动力学关系[12];当加酶量增加时,反应速度亦随之增大;当加酶量增大到一定程度,底物和产物的传质阻力的影响已开始大于酶催化反应速度的影响,其反应速度的增量减少,酶的催化效率降低。
图3为反应温度70℃条件下,加酶量和反应时间交互作用对中长链甘三酯含量的影响。从图3可以看出,较高的加酶量和较长的反应时间得到较高的中长链甘三酯含量。加酶量和反应时间对中长链甘三酯含量的交互作用不显著,反应时间影响的显著性要高于加酶量。总体来看,在加酶量为3%~7%时,相同的反应时间条件下中长链甘三酯含量较高。
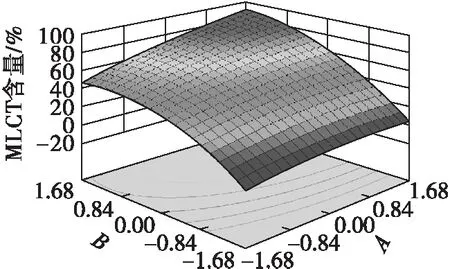
图1 反应温度和反应时间交互影响

图2 反应温度和加酶量交互影响

图3 反应时间和加酶量交互影响
2.3 反应条件优化及模型验证
利用Design Expert软件对酶催化MCT和大豆油酯交换反应合成中长链甘三酯的最佳反应条件进行预测,得到最佳的反应条件为:大豆油与MCT质量比60∶40,反应时间4.36 h,反应温度88.8℃,加酶量5.5%(以底物质量计)。考虑到实际操作的局限性,将工艺参数中的反应温度调整为89℃。在此优化条件下进行3次平行验证实验,中长链甘三酯含量分别为84.78%、83.96%和83.71%,平均含量为84.15%,模型预测值为84.36%,实验结果与预测值相近,说明该响应面模型预测是有效的。
2.4 产物脂肪酸组成分析
表5为酯交换产物及原料物理混合油的脂肪酸组成。其中中碳链脂肪酸C8∶0、C10∶0来自原料MCT,其余脂肪酸来自原料大豆油。酯交换产物的具体反应条件为上述最佳反应条件。

表5 原料物理混合油及酯交换产物的脂肪酸组成 %
从表5可以看出,酯交换反应前后的总脂肪酸组成无显著性差异,主要是酯交换反应过程中,脂肪酸在甘三酯分子内和分子间碳链骨架上发生转移,因此总脂肪酸组成基本不发生变化。但是脂肪酸在甘三酯碳链骨架上的位置重新分布会造成物理混合油和酯交换产物不同位置脂肪酸组成的显著变化。酯交换反应后,sn-2位上中碳链脂肪酸(MCFA)含量下降,而不饱和脂肪酸(UFA)含量则提高到 65.16%。sn-2位上的不饱和脂肪酸能够在体内被快速地消化和吸收,为人体提供必需脂肪酸,有益人体健康。同时sn-1,3位上的MCFA可以实现快速供能和降低体内脂肪积累的生理功能。因此,酯交换合成的MLCT结构脂能够提供食用油的基本营养,同时具有独特的营养代谢优势,在食用领域具有良好的应用前景。
2.5 产物甘三酯组成
采用常规HPLC-ELSD法对原料物理混合油和自制中长链结构甘三酯的甘三酯组成进行初步分析,结果如图4所示。
从图4可以看出,16 min之前出峰为MCT,32 min 之后出峰为长链甘三酯,中间峰为MLCT。由图4a可知,原料物理混合油中不含MLCT,图4b显示酯交换后有大量MLCT生成。
HPLC不能准确提供甘三酯构型信息,因此进一步采用超高压液相色谱-飞行时间质谱(UPLC/Q-TOFMS)在正离子模式下分析了酯交换产物的甘三酯构型,结果见表6。


注:Cy, C8∶0; Ca, C10∶0; P, C16∶0; S, C18∶0; O, C18∶1; L, C18∶2; Ln, C18∶3。下同。

图4 原料物理混合油(a)和酯交换产物(b)
续表6

TAG[M+NH4]+ [DAG]+碎片离子CENsCyCaLn650.61489.50461.46355.3630CyCyL624.61463.47327.3230CyCyP600.61439.48327.3332CyCyS627.61465.49327.3234CyCaL652.61491.48463.44355.3332CaCaLn678.61489.51383.432CaCyP628.61467.52439.48355.3634CaCyO654.61493.53465.49355.3634CaCyS656.71495.52467.49355.3636LnLnCy756.72595.59461.4732LCaCa680.71491.52383.3934LLnCy758.72597.63463.47461.4734CaCaP656.71467.51383.3936CaCaO682.71493.54383.3936CyLL760.72599.64463.4836LnPCy734.72573.61461.46439.4836LnLCa786.82597.62491.52489.4936SCaCa684.71495.54383.3938LPCy736.72575.64463.48439.4738LOCy762.82601.64465.49463.4838LLCa788.82599.64491.5238PPCy712.72551.61439.4840OPCy738.82577.64465.49439.4740OOCy764.82603.67465.540LOCa790.82601.63493.54491.5240PPCa740.82551.61467.5142OPCa766.82577.64493.54467.5142LnLnO894.94599.65597.6244OOCa792.83603.67493.5442LLL896.94599.6442LLnP870.93597.62575.62573.6242SPCa768.82579.66495.54467.5144SOCa794.83605.68495.55493.5344LLO898.94601.65599.6344LLP872.93599.65575.6344OOL900.94601.64603.6746LOP874.93601.64577.66575.6146LPP848.93575.62551.6146OOO920.94603.6748OOP876.93603.67577.6548OPP850.93577.66551.6248SOP878.93605.66579.65577.6450
从表6可以看出,MLCT结构脂中共检测到45种构型的甘三酯(不包含异构体),MCT的主要甘三酯构型为CyCyCy、CyCyCa和CyCaCa,大豆油则为LLL、LLnP、LLP、LLO和LOP。结合图4可知,经过酯交换反应,产物中甘三酯的种类发生明显变化,CyCyL、CyCyLn、LOCy、LPCy、OOCy和LOCa成为主要甘三酯构型,而原料物理混合油中的主要甘三酯LLL、LLO、LLP、CyCyCy和CyCyCa的含量则大幅降低。
3 结 论
响应面法优化得到Lipozyme 435催化酯交换合成中长链甘三酯的最佳反应条件为:反应时间4.36 h,反应温度89℃,加酶量5.5%,大豆油与MCT质量比60∶40。最佳条件下中长链甘三酯平均含量为84.15%。采用超高压液相色谱-飞行时间质谱分析了酯交换产物的甘三酯构型,结果表明CyCyL、CyCyLn、LOCy、LPCy、OOCy 和LOCa为其主要甘三酯构型。
[1] PAPAMANDJARIS A A, MACDOUGALL D E, JONES P J H. Medium chain fatty acid metabolism and energy expenditure: obesity treatment implications[J]. Life Sci, 1998, 62(14): 1203-1215.
[2] MU H, PORSGAARD T. The metabolism of structured triacylglycerols[J]. Progr Lipid Res, 2005, 44(6): 430-448.
[3] KASAI M, NOSAKA N, MAKI H, et al. Effect of dietary medium-and long-chain triacylglycerols (MLCT) on accumulation of body fat in healthy humans[J]. Asia Pac J Clin Nutr, 2003, 12(2): 151-160.
[4] KOH S P, LONG K, TAN C P, et al. The use of enzymatically synthesized medium-and long-chain triacylglycerols (MLCT) oil blends in food application[J]. Int Food Res J, 2011, 18(1): 355-366.
[5] NEGISHI S, ITAKURA M, ARIMOTO S, et al. Measurement of foaming of frying oil and effect of the composition of TG on foaming[J]. J Am Oil Chem Soc, 2003, 80(5): 471-474.
[6] 何玥, 赵金利, 张参, 等. 酶催化酯交换制备零反式脂肪酸食品专用油脂基料的性质研究[J]. 中国油脂, 2016, 41(9): 36-40.
[7] ZHAO M L, HU J N, ZHU X M, et al. Enzymatic synthesis of medium-and long-chain triacylglycerols-enriched structured lipid fromCinnamomumcamphoraseed oil and camellia oil by Lipozyme RM IM[J]. Int J Food Sci Technol, 2014, 49(2): 453-459.
[8] KHODADADI M, KERMASHA S. Optimization of lipase-catalyzed interesterification of flaxseed oil and tricaprylin using response surface methodology[J]. J Am Oil Chem Soc, 2014, 91(3): 395-403.
[9] 李志晓, 金青哲, 叶小飞, 等. 制油工艺对油茶籽油品质的影响[J]. 中国油脂, 2015, 40(4):47-51.
[10] 彭亮, 宋志华, 腾传震, 等. 甲醇钠催化酯交换制备中/长链结构甘三酯[J]. 中国油脂, 2011, 36(3):5-9.
[11] NAGACHINTA S, AKOH C C. Production and characterization of DHA and GLA-enriched structured lipid from palm olein for infant formula use[J]. J Am Oil Chem Soc, 2013, 90(8): 1141-1149.
[12] 戚以政, 汪叔雄. 生化反应动力学与反应器[M]. 北京: 化学工业出版社, 1999:10-51.
Optimization of Lipozyme 435-catalyzed synthesis of medium-and long-chain triglycerides using response surface methodology
LU Jiyuan, WANG Xiaosan, JIN Qingzhe, WANG Xingguo
(Synergetic Innovation Center of Food Safety and Nutrition, School of Food Science and Technology,Jiangnan University, Wuxi 214122, Jiangsu,China)
The synthesis conditions of medium- and long-chain triglycerides by Lipozyme 435-catalyzed interesterification of soybean oil and medium-chain triglycerides in a solvent-free system was optimized by response surface methodology. The triglycerides structure of the product was analyzed by ultra-performance liquid chromatography (UPLC) coupled with quadrupole time of flight mass spectrometry under positive ion model. The results showed that reaction temperature and reaction time had extremely significant influence on medium-and long-chain triglycerides content. The optimal reaction conditions were obtained as follows: mass ratio of soybean oil to medium-chain triglycerides 60∶40, reaction time 4.36 h, reaction temperature 89℃, and enzyme dosage 5.5%(based on the mass of substrate). Under these conditions, medium- and long-chain triglycerides content was 84.15%. The main triglycerides in the products were CyCyL, CyCyLn, LOCy, LPCy, OOCy and LOCa.
medium-and long-chain triglycerides; Lipozyme 435; interesterification; response surface methodology; triglycerides structure
2016-09-04;
2017-01-17
江苏省自然科学基金——青年基金项目(BK20150137);政策引导类计划(产学研合作)——前瞻性联合研究项目(BY2016022-33)
陆继源(1989),男,在读硕士,研究方向为功能性油脂(E-mail)lujiyuan@live.cn。
王小三,副教授,博士(E-mail)wxstongxue@163.com。
TS225.6;TQ641
A
1003-7969(2017)05-0015-05

