Notch1信号通路调控银屑病模型小鼠Th17细胞分化和功能①
马 蕾 高梅兰 舒春梅 于 娟 张玉杰 王忠永 薛海波
(滨州医学院附属医院,滨州256603)
Notch1信号通路调控银屑病模型小鼠Th17细胞分化和功能①
马 蕾 高梅兰 舒春梅 于 娟 张玉杰 王忠永 薛海波②
(滨州医学院附属医院,滨州256603)
目的:探讨Notch1信号通路对银屑病模型小鼠Th17细胞分化和功能的调控作用。方法:以5%咪喹莫特外涂联合α-2b干扰素腹腔注射的方法制备20只银屑病模型小鼠,免疫磁珠分离小鼠脾脏CD4+T淋巴细胞,流式细胞术检测Th17细胞比例,实时荧光定量RT-PCR检测Th17细胞特异性转录因子RORγt、效应性细胞因子IL-17A、Notch1信号分子及其靶基因Hes-1的mRNA表达水平,并与10只对照组小鼠相比较。将银屑病模型小鼠CD4+T淋巴细胞分为未干预对照组和Notch1抑制剂组(γ-分泌酶抑制剂DAPT),检测DAPT阻断Notch1信号对银屑病模型小鼠Notch1信号分子及Hes-1、Th17细胞比例、RORγt及IL-17A表达水平的影响。结果:银屑病模型小鼠CD4+T淋巴细胞中Th17细胞比例,RORγt、IL-17A、Notch1及Hes-1的mRNA表达水平均显著高于对照小鼠[分别为(2.97±0.86)%比(0.65±0.11)%,t=15.083;(5.75±0.61)比(1.57±0.43),t=21.630;(7.83±0.97)比(1.63±0.31),t=25.348;(7.10±1.37)比(1.47±0.34),t=17.386;(7.30±1.15)比(1.67±0.48),t=18.840,P均<0.01];与未干预对照组相比,银屑病模型小鼠CD4+T淋巴细胞各DAPT处理组中Notch1、Hes-1 mRNA表达水平,Th17细胞比例、RORγt与IL-17A mRNA表达水平及培养上清液中IL-17A含量均明显下降,组间比较差异具有统计学意义(F值分别为74.368、89.719、126.572、94.558、124.323和123.231,P均<0.01),且随DAPT浓度的增加呈剂量依赖性降低。结论:Notch1信号通路能够调控银屑病模型小鼠Th17细胞的分化和功能,对银屑病的免疫靶向治疗有潜在价值。
银屑病;Notch1;Th17细胞;IL-17A
银屑病是一种常见的自身免疫性、炎症性皮肤病,CD4+T淋巴细胞介导的异常免疫反应在银屑病疾病过程中发挥重要作用[1]。Th17细胞是高水平分泌和表达IL-17A效应性细胞因子的新型CD4+T淋巴细胞亚群,参与多种炎症性、自身免疫性疾病的发生发展过程,并在以银屑病为代表的自身免疫性皮肤病中发挥重要作用[1-3]。Notch信号通路是一种高度保守的信号转导通路,在细胞的分化、发育过程中尤其是在T淋巴细胞分化的命运中起关键作用。已有研究表明,在小鼠和人促Th17细胞分化的细胞因子环境中均有Notch1信号通路的活化[4,5]。本研究以银屑病模型小鼠CD4+T淋巴细胞为研究对象,采用γ-分泌酶抑制剂DAPT阻断Notch1信号,探讨Notch1对银屑病模型小鼠Th17细胞分化及功能的影响,为银屑病治疗寻找新的免疫靶向药物提供理论和实验基础。
1 材料与方法
1.1 材料 6周龄SPF级BALB/c小鼠30只,体重(18±2)g,雌鼠15只,雄鼠15只,购自北京维通利华实验动物技术有限公司;5%咪喹莫特乳膏(珠海联邦制药股份有限公司);3 000 000 U重组人干扰素α-2b注射液(北京凯因科技股份有限公司);小鼠CD4+T淋巴细胞阴性分选试剂盒(挪威Dynal公司);DATP、佛波酯(PMA)、离子霉素、布雷菲德菌素A(美国Sigma公司);重组IL-1β、TGF-β、IL-6、IL-23、抗IFN-γ抗体、抗IL-4抗体以及IL-17A 酶联免疫吸附试验(ELISA)试剂盒(美国R&D公司);异硫氰酸荧光素(FITC)标记的CD4单克隆抗体、藻红蛋白(PE)标记的IL-17A单克隆抗体(美国eBioscience公司);Trizol RNA提取试剂(美国Invitrogen公司);Quantscript RT Kit逆转录试剂盒、RealMaster Mix试剂盒(天根生化科技有限公司)
1.2 方法
1.2.1 动物分组和模型制备 将30只小鼠随机分为银屑病组20只和对照组10只,雌雄各半,参考文献建立银屑病小鼠模型[6]。小心剃去小鼠背部中央区域的被毛,温和型脱毛膏脱去毳毛,涂以保湿剂备用。将5%咪喹莫特乳膏按50 mg/cm2剂量均匀涂在脱毛部位,10 min后将重组人干扰素α-2b注射液按10 000 U/500 g剂量腹腔内注射,1次/d,连续6 d;对照组小鼠背部脱毛后仅涂保湿剂,1次/d,连续6 d。6 d后两组小鼠均脱臼处死,取脾脏分离CD4+T淋巴细胞。
1.2.2 小鼠皮肤组织病理检测 将小鼠处死后,剪取小鼠的皮肤组织,固定于10%甲醛中,制成石蜡切片,HE染色,观察银屑病模型小鼠与对照小鼠的皮肤组织病理变化。
1.2.3 小鼠脾脏CD4+T淋巴细胞分离 参考文献采用阴性分选试剂盒分离小鼠脾脏CD4+T淋巴细胞[7],流式细胞术评估CD4+T淋巴细胞纯度为93.07%±1.86%,台盼蓝染色检测细胞活力为94.44%±2.52%。
1.2.4 CD4+T淋巴细胞分组及干预 将CD4+T淋巴细胞分为未干预对照组和Notch1抑制剂组(γ-分泌酶抑制剂DAPT)分别接种于12孔板,0.5 ml/孔,细胞浓度为1×106ml;Notch1抑制剂组以DMSO溶解DAPT,RPMI1640培养液调整DAPT终浓度分别为2.5、5、10和20 μmol/L,未干预对照组为含等量DMSO的RPMI1640培养液;37℃、5%CO2条件下培养72 h后收获细胞。
1.2.5 CD4+T淋巴细胞极化 将CD4+T淋巴细胞置于含有5 μg/ml包被的anti-CD3单克隆抗体及10 μg/ml可溶性anti-CD28单克隆抗体的培养板中,加入Th17细胞极化刺激因子:10 ng/ml重组IL-1β、2 ng/ml重组TGF-β、30 ng/ml重组IL-6、20 ng/ml重组IL-23以及5 μg/ml抗IFN-γ、5 μg/ml抗IL-4抗体,37℃、5% CO2条件下培养96 h。
1.2.6 流式细胞术检测Th17细胞比例(CD4+IL17A+T细胞/CD4+T细胞×100%) 将CD4+T淋巴细胞在含10%胎牛血清的RPMI1640培养液中调整浓度至2×106ml,分别加入50 ng/ml PMA、1 μg/ml离子霉素共刺激培养4 h后,按照1∶500比例加入布雷菲德菌素A作用2 h。细胞膜FITC-CD4单克隆抗体标记,透膜、固定后PE-IL17A单克隆抗体胞内染色;应用FACSCalibur流式细胞仪(美国BD公司)检测标本。
1.2.7 实时定量RT-PCR(Real-time RT-PCR)检测IL-17A、RORγt、Notch1及Hes-1的mRNA表达水平 采用Trizol法提取总RNA,Quantscript RT Kit逆转录试剂盒合成cDNA第一链;设计合成IL-17A、RORγt、Notch1、Hes-1及β-actin引物(表1),采用RealMaster Mix试剂盒于Rotor-Gene 3000 real-time PCR仪上进行检测,检测数据应用双标准曲线相对定量分析法进行分析。
1.2.8 ELISA法检测CD4+T淋巴细胞培养液上清中IL-17A的含量 按照说明书的操作标准进行。
2 结果
2.1 银屑病模型小鼠皮肤组织病理改变 比较银屑病模型小鼠和对照小鼠皮肤组织HE病理切片。对照小鼠的皮肤表皮层较薄,仅由1~2层表皮细胞构成(图1A、B);银屑病模型小鼠表皮层明显增厚,可见角化过度和角化不全,部分区域可见Munro微脓肿,表皮层细胞数量增加,表皮突向下延伸,真皮炎细胞大量浸润(图1C、D),与人银屑病皮损改变基本相同。
2.2 银屑病模型小鼠CD4+T淋巴细胞中Th17细胞比例显著升高 银屑病模型小鼠脾脏CD4+T淋巴细胞中Th17细胞比例明显高于对照小鼠,2.97%±0.68%比0.65%±0.11%,t=15.083,P<0.01(图2)。
2.3 银屑病模型小鼠RORγt、IL-17A、Notch1、Hes-1的mRNA水平显著升高 银屑病模型小鼠脾脏CD4+T淋巴细胞中Th17细胞特异性转录因子RORγt及其效应性细胞因子IL-17A的mRNA表达水平显著高于对照小鼠,t值分别为21.630、25.348,P均<0.01(图3);Notch1及其靶基因Hes-1的mRNA表达水平显著高于对照小鼠,t值分别为17.386和18.840,P均<0.01(图3)。
表1 Notch1、Hes-1、IL-17A、RORγt及β-actin引物序列
Tab.1 Primer sequences for Notch1,Hes-1,IL-17A,RORγt and β-actin

NamePrimersequenceLengthofproduct(bp)Notch15'-TGCCAGTATGATGTGGATGAG-3'1115'-GGTCCCTGTGTAACCTTCTGT-3'Hes-15'-AGCCCACCTCTCTCTTCTGA-3'1875'-AGGCGCAATCCAATATGAAC-3'IL-17A5'-TTTAACTCCCTTGGCGCAAAA-3'1655'-CTTTCCCTCCGCATTGACAC-3'RORγt5'-AGTGTAATGTGGCCTACTCCT-3'1985'-GCTGCTGTTGCAGTTGTTTCT-3'β-actin5'-CCAGCCTTCCTTCTTGGGTAT-3'1025'-TTGGCATAGAGGTCTTTACGG-3'

图1 银屑病模型小鼠与对照小鼠皮肤组织病理改变(HE,×200)Fig.1 Pathological changes in skin tissues of murine psoriasis model and control mouse(HE,×200)Note: A,B.Control mouse;C,D.Murine psoriasis model.
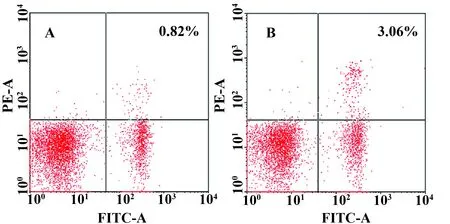
图2 银屑病模型小鼠与对照小鼠FITC-CD4、PE-IL17A染色流式细胞图Fig.2 FITC-CD4 and PE-IL17A flow cytometry staining of murine psoriasis model vs control mouseNote: A.Control mouse;B.Murine psoriasis model.

图3 银屑病模型小鼠与对照小鼠CD4+ T淋巴细胞中RORγt、IL-17A、Notch1、Hes-1的mRNA表达水平Fig.3 mRNA expression levels of RORγt,IL-17A,Notch1 and Hes-1 in CD4+ T lymphocytes of murine psoriasis model vs.control mouse
表2 DAPT对银屑病模型小鼠CD4+T淋巴细胞Notch1、Hes-1 mRNA表达水平的影响
Tab.2 Effect of DAPT on Notch1 and Hes-1 mRNA expression in CD4+T lymphocytes of murine psoriasis model

mRNAexpressionlevelsControl2.5μmol/LDAPT5μmol/LDAPT10μmol/LDAPT20μmol/LDAPTFPNotch11.23±0.290.85±0.050.61±0.050.44±0.040.30±0.0574.368<0.01Hes-11.18±0.210.90±0.090.64±0.060.48±0.060.38±0.0389.719<0.01
表3 DAPT对银屑病模型小鼠CD4+T淋巴细胞Th17细胞比例、RORγt与IL-17A mRNA表达水平、培养液上清中IL-17A含量的影响
Tab.3 Effect of DAPT on Th17 cell percentage,RORγt and IL-17A mRNA,and IL-17A concentration in cell-free supernatant in CD4+T lymphocytes of murine psoriasis model
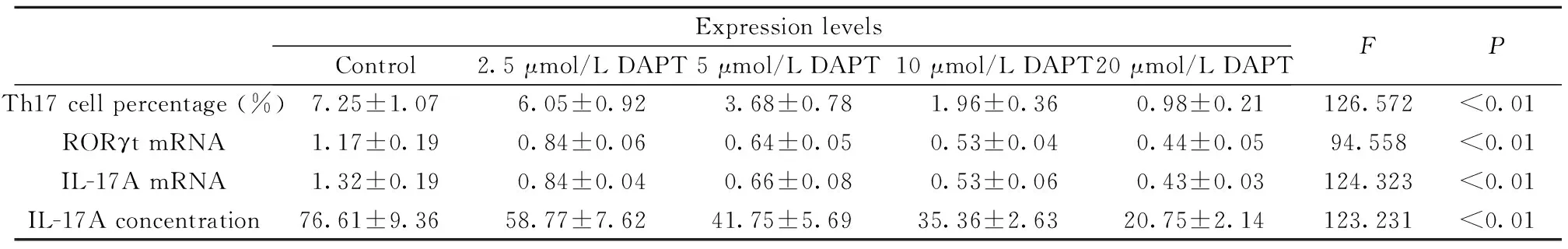
ExpressionlevelsControl2.5μmol/LDAPT5μmol/LDAPT10μmol/LDAPT20μmol/LDAPTFPTh17cellpercentage(%)7.25±1.076.05±0.923.68±0.781.96±0.360.98±0.21126.572<0.01RORγtmRNA1.17±0.190.84±0.060.64±0.050.53±0.040.44±0.0594.558<0.01IL-17AmRNA1.32±0.190.84±0.040.66±0.080.53±0.060.43±0.03124.323<0.01IL-17Aconcentration76.61±9.3658.77±7.6241.75±5.6935.36±2.6320.75±2.14123.231<0.01

图4 银屑病模型小鼠CD4+ T淋巴细胞不同浓度DAPT组与未干预对照组间Notch1、Hes-1 mRNA表达Fig.4 mRNA expression of Notch1 and Hes-1 among DAPT groups and control group in CD4+ T lymphocytes of murine psoriasis model
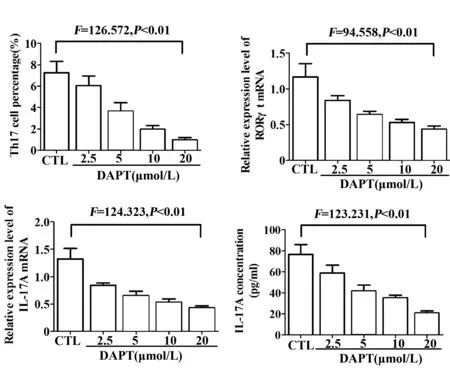
图5 银屑病模型小鼠CD4+ T淋巴细胞不同浓度DAPT组与未干预对照组间Th17细胞比例、RORγt与IL-17A mRNA表达水平、培养液上清中IL-17A含量Fig.5 Expression levels of Th17 cell percentage,RORγt and IL-17A mRNA,and IL-17A concentration in cell-free supernatant among DAPT groups and control group in CD4+ T lymphocytes of murine psoriasis model
2.4 DAPT抑制银屑病模型小鼠Notch1、Hes-1的表达 体外培养银屑病模型小鼠脾脏CD4+T淋巴细胞,以γ-分泌酶抑制剂DAPT干预处理细胞,DAPT各处理组Notch1及其靶基因Hes-1的mRNA表达水平均较未干预对照组(DMSO组)显著降低,组间比较差异具有统计学意义(F值分别为74.368和89.719,P均<0.01),且随DAPT作用浓度的增加,Notch1与Hes-1的mRNA表达水平呈剂量依赖性降低(表2,图4)。
2.5 DAPT下调银屑病模型小鼠Th17细胞比例及RORγt、IL-17A的表达与分泌 体外培养银屑病模型小鼠脾脏CD4+T淋巴细胞,以γ-分泌酶抑制剂DAPT干预处理细胞,与未干预对照组(DMSO组)相比,DAPT各处理组中Th17细胞比例、Th17细胞特异性转录因子RORγt及效应性细胞因子IL-17A mRNA表达水平、培养上清液中IL-17A含量均明显下降,组间比较具有统计学差异(Th17细胞比例F=126.572;RORγt mRNAF=94.558;IL-17A mRNAF=124.323;IL-17A含量F=123.231,P均<0.01),且随DAPT作用浓度的增加,上述指标表达水平呈剂量依赖性降低(表3,图5)。
3 讨论
银屑病是一种常见的慢性、复发性、自身免疫介导的炎症性皮肤病,发病率为2%~3%[8]。CD4+T淋巴细胞活性异常对银屑病的发生、发展、转归发挥重要作用,银屑病皮损组织中大量的T淋巴细胞及其分泌的细胞因子形成异常的免疫微环境,导致表皮角质细胞异常分化[1,2];Th17细胞是以分泌IL-17A为特点的新型CD4+T淋巴细胞亚群,RORγt是其特异性转录因子,IL-17A与IL-17A受体结合作用于靶细胞,诱导炎性细胞因子产生,触发炎症递质释放,进而在炎症性及自身免疫性疾病过程中发挥重要作用[9,10]。Th17细胞在以银屑病为代表的自身免疫性皮肤病中发挥重要作用,银屑病患者外周血中Th17细胞比例、RORγt及IL-17A表达水平均明显增高,且与疾病严重程度呈正相关[11]。本研究结果显示,以5%咪喹莫特外涂联合α-2b干扰素腹腔注射制备银屑病模型小鼠显示其皮肤组织病理改变与人银屑病病理改变基本相同,银屑病模型小鼠CD4+T淋巴细胞中Th17细胞及其特异性转录因子、效应性细胞因子均显著增高,进一步说明该模型是目前银屑病Th17细胞相关研究的理想模型[12,13]。
T淋巴细胞的分化受多种信号传导通路的调控,Notch信号在T淋巴细胞的增殖、分化及功能调节方面均具有重要的作用[4,14]。Notch信号通路由Notch受体(Notch1-Notch4)、Notch配体(Delta-like 1、3、4,Jagged 1、2)、CSL(CBF-1,Suppressor of hairless,Lag的合称)DNA结合蛋白、其他的效应物和Notch的调节分子等组成。Notch配体与相邻细胞的Notch受体结合后,将在Notch受体分子的S2和S3两个位点发生连续切割,S3被依赖早老素(PS)包含γ-分泌酶的复合物切割后,释放出具有核定位信号的胞质区(Notch intracellular domain,NICD),NICD转移至细胞核激活靶基因(如Hes)发挥生物学效应。γ-分泌酶抑制剂DAPT能够作用于PS分子而阻断γ-分泌酶的作用,减少NICD的产生,下游信号分子由于缺少或减少NICD的启动作用而处于静止或下调状态[15,16]。有研究表明Notch1信号分子在银屑病皮损组织中高表达,并参与了角质形成细胞的分化调控[17,18]。本研究结果显示,Notch1信号分子及其靶基因Hes-1在银屑病模型小鼠CD4+T细胞中均明显高表达,表明Notch1信号分子参与银屑病的疾病发生发展过程。
动物实验研究结果表明在小鼠促Th17分化的细胞因子环境中有Notch1信号分子的活化,阻断Notch1信号通路则明显下调Th17细胞相关细胞因子的产生,减轻Th17细胞及其效应细胞因子IL-17A介导的炎症,Notch1亦能调控Th17细胞特异性转录因子RORγt的表达[5,19]。本研究结果显示γ-分泌酶抑制剂DAPT能够剂量依赖性降低银屑病模型小鼠CD4+T淋巴细胞中Notch1信号分子及其靶基因Hes-1、Th17细胞及其特异性转录因子RORγt、效应性细胞因子IL-17A的表达与分泌,表明Notch1信号分子能够发挥对银屑病Th17细胞分化的调控作用。银屑病患者外周血及皮损组织中、银屑病模型小鼠脾脏、外周血及皮损组织中Th17细胞及其效应性细胞因子IL-17A均呈高表达状态,且与疾病活动度、严重程度相关[11,20,21],表明脾脏、外周循环与皮损组织中Th17细胞的功能状态具有一定的相关性。以银屑病模型小鼠脾脏分离CD4+T淋巴细胞为研究对象探讨Notch1信号对Th17细胞的调控能够在一定程度上反映皮损组织中Th17细胞的变化和功能状态,高表达的Notch1信号分子能够通过促进Th17细胞的分化和功能增强进而介导银屑病的炎症反应过程。
因此, Notch1信号通过调控Th17细胞的分化和功能在银屑病疾病过程中发挥作用;阻断Notch1信号通路,减轻Th17细胞在银屑病中的致炎效应,为银屑病的免疫靶向治疗提供了思路。
[1] 王 英,王丽丽,韩 朔.CD4+T淋巴细胞亚群与银屑病关系的研究进展[J].细胞与分子免疫学杂志,2016,32(6):834-836.
[2] Nograles KE,Zaba LC,Guttman-Yassky E,etal.Th17 cytokines interleukin (IL)-17 and IL-22 modulate distinct inflammatory and keratinocyte-response pathways[J].Br J Dermatol,2008,159(5):1092-1102.
[3] Fotiadou C,Lazaridou E,Sotiriou E,etal.IL-17AA,IL-22,and IL-23 as markers of psoriasis activity:a cross-sectional,hospital-based study[J].J Cutan Med Surg,2015,19(6):555-560.
[4] Amsen D,Helbig C,Backer RA.Notch in T Cell Differentiation:All Things Considered[J].Trends Immunol,2015,36(12):802-814.
[5] Keerthivasan S,Suleiman R,Lawlor R,etal.Notch signaling regulates mouse and human Th17 differentiation[J].J Immunol,2011,187(2):692-701.
[6] 董颖颖,钟世玉,王 琼,等.银屑病小鼠模型建立的新方法[J].中国皮肤性病学杂志,2016,30 (11):1127-1131.
[7] 聂 颖,杨邦坤,盛安群,等.PI3K和Notch信号通路对哮喘小鼠CD4+T淋巴细胞活化及增殖的协同调控作用[J].中华医学杂志,2013,93(44):3532-3536.
[8] Christophers E.Psoriasis-epidemiology and clinical spectrum[J].Clin Exp Dermatol,2001,26(4):314-320.
[9] Bettelli E,Oukka M,Kuchroo VK.T(H)-17 cells in the circle of immunity and autoimmunity[J].Nat Immunol,2007,8(4):345-350.
[10] Toussirot E.The IL23/Th17 pathway as a therapeutic target in chronic inflammatory diseases[J].Inflamm Allergy Drug Targets,2012,11(2):159-168.
[11] 陈永锋,常树霞,郑道城.寻常性银屑病患者外周血和皮损中Th17细胞及相关因子的表达[J].中华皮肤科杂志,2011,44 (1):11-14.
[12] Flutter B,Nestle FO.TLRs to cytokines:mechanistic insights from the imiquimod mouse model of psoriasis[J].Eur J Immunol,2013,43(12):3138-3146.
[13] Alunno A,Carubbi F,Cafaro G,etal.Targeting the IL-23/IL-17A axis for the treatment of psoriasis and psoriatic arthritis[J].Expert Opin Biol Ther,2015,15(12):1727-1737.
[14] Amsen D,Antov A,Flavell RA.The different faces of Notch in T-helper-cell differentiation[J].Nat Rev Immunol,2009,9(2):116-124.
[15] Morohashi Y,Kan T,Tominari Y,etal.C-terminal fragment of presenilin is the molecular target of a dipeptidic gamma-secretase-specific inhibitor DAPT (N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester) [J].J Biol Chem,2006,281(21):14670-14676.
[16] Geling A,Steiner H,Willem M,etal.A gamma-secretase inhibitor blocks Notch signaling in vivo and causes a severe neurogenic phenotype in zebrafish[J].EMBO Rep,2002,3(7):688-694.
[17] Rooney P,Connolly M,Gao W,etal.Notch-1 mediates endothelial cell activation and invasion in psoriasis[J].Exp Dermatol,2014,23(2):113-118.
[18] Ota T,Takekoshi S,Takagi T,etal.Notch signaling may be involved in the abnormal differentiation of epidermal keratinocytes in psoriasis[J].Acta Histochem Cytochem,2014,47(4):175-183.
[19] Mukherjee S,Schaller MA,Neupane R,etal.Regulation of T cell activation by Notch ligand,DLL4,promotes IL-17A production and Ror cactivation[J].J Immunol,2009,182(12):7381-7388.
[20] 赵京霞,底婷婷,王 燕,等. IL-23/IL-17炎症轴在咪喹莫特诱导的小鼠银屑病样皮肤损害中的作用[J].中国病理生理杂志,2013,29 (6):1086-1094.
[21] Lowes MA,Kikuchi T,Fuentes-Duculan J,etal.Psoriasis vulgaris lesions contain discrete populations of Th1 and Th17 T cells[J].J Invest Dermatol,2008,128(5):1207-1211.
[收稿2017-02-17 修回2017-05-03]
(编辑 张晓舟)
Notch1 signaling pathway regulates Th17 cell differentiation and function in murine psoriasis model
MALei,GAOMei-Lan,SHUChun-Mei,YUJuan,ZHANGYu-Jie,WANGZhong-Yong,XUEHai-Bo.
BinzhouMedicalUniversityHospital,Binzhou256603,China
Objective:To determine the effect of Notch1 signaling pathway on the differentiation and function of Th17 cells in murine psoriasis model.Methods: BALB/c mice were randomly divided into psoriasis model group and control group.Murine psoriasis model was established by topical 5% imiquimod application in combination with intraperitoneal injection of α-2b interferon.The CD4+T lymphocytes were isolated by magnetic activated cell sorter (MACS).Flow cytometric analysis (FCM) was performed to detect the percentage of Th17 cells.Real-time RT-PCR was employed to measure the mRNA levels of RORγt,IL-17A,Notch1 and Hes-1.The CD4+T lymphocytes were then divided into γ-secretase inhibitor DAPT groups and control group,and the expression differences of Notch1 signaling molecule and its target gene Hes-1 mRNA levels,Th17 cell percentage,RORγt and IL-17A mRNA levels,and IL-17A concentrations in cell-free supernatant were detected.Results: The expression levels of Th17 cell percentage and RORγt,IL-17A,Notch1 and Hes-1 mRNA in CD4+T lymphocytes of murine psoriasis model were significantly higher than control mouse[(2.97±0.86)% vs.(0.65±0.11)%,t=15.083;(5.75±0.61) vs.(1.57±0.43),t=21.630;(7.83±0.97) vs.(1.63±0.31),t=25.348;(7.10±1.37) vs.(1.47±0.34),t=17.386;(7.30±1.15) vs.(1.67±0.48),t=18.840,respectively,allP<0.01].Compared with control group,Th17 cell percentage,mRNA expression levels of Notch1,Hes-1,RORγt and IL-17A,and IL-17A concentrations in cell-free supernatant from cultured CD4+T lymphocytes of murine psoriasis model were dramatically decreased in DAPT treated groups in a dose-dependent way (F=74.368,89.719,126.572,94.558,124.323 and 123.231 respectively,allP<0.01).Conclusion: Notch1 signaling pathway can regulate the differentiation and function of Th17 cells in murine psoriasis model,and may have potential value for the target immunotherapy of psoriasis.
Psoriasis;Notch1;Th17 cells;IL-17A
10.3969/j.issn.1000-484X.2017.07.006
①本文受山东省医药卫生科技发展计划项目(2016WS0045)资助。
马 蕾(1978年-),女,博士,副主任医师,副教授,主要从事皮肤病的分子免疫研究,E-mail:doctor_malei@126.com。
R75
A
1000-484X(2017)07-0985-06
②通讯作者,E-mail:xuehaibo@sina.com。

