重组Ad-SOCS1介导的树突状细胞源外泌体对银屑病样小鼠模型的影响
曾凡杞 冉灵芝 胡鹏飞 刘鹄荫
·论著·
重组Ad-SOCS1介导的树突状细胞源外泌体对银屑病样小鼠模型的影响
曾凡杞 冉灵芝 胡鹏飞 刘鹄荫
目的: 明确重组腺病毒(Ad-SOCS1)介导的树突状细胞(DCs)分泌的外泌体对银屑病样小鼠模型的影响。方法: Ad-SOCS1腺病毒感染小鼠骨髓来源的DCs,分离纯化培养物中的外泌体,Western blot分析鉴定外泌体中的CD63、SOCS1和ICAM-1蛋白。咪喹莫特(IMQ)诱导10只银屑病样小鼠模型,其中5只给予外分泌体治疗(外分泌体组)组,5只作为对照(IMQ组)。RT-PCR检测小鼠外周血IL-17A、IL-22和IL-23 mRNA的表达水平。结果: 外泌体中能够鉴定到SOCS1、CD63和ICAM-1蛋白。外分泌体组小鼠的银屑病样表现较IMQ组轻。外分泌体组小鼠外周血IL-17A和IL-23 mRNA的表达低于IMQ组(P<0.01),IL-22水平两组间无显著差异(P>0.05)。结论: Ad-SOCS1感染DC后培养物分离的外泌体可改善银屑病的症状,其机制可能与外泌体SOCS1抑制IL-17A有关。
SOCS1; 银屑病; 树突状细胞; 外泌体; IL-17A
银屑病是一种多基因遗传背景下的免疫异常疾病,因其具有发病率较高和主要累及青壮年等特点而在皮肤科临床倍受重视。从病理学上看,角质形成细胞增殖和分化的异常、角质层Munro微脓疡以及真皮浅层血管周围以淋巴细胞为主的炎症细胞浸润是银屑病的三个最主要的特点[1]。近年来许多研究表明白细胞介素(interleukin,IL)中IL-23/IL-17炎症反应轴在银屑病皮损发展中起重要作用[2]。树突状细胞分泌的IL-23与受体结合后诱导T辅助细胞17(T helper 17,Th17)活化并分泌IL-17、IL-22等多种细胞因子[3],Th17细胞是IL-17家族细胞因子的主要来源,IL-17被认为是建立和维持银屑病表型的关键细胞因子[4]。目前治疗银屑病的药物主要有维A酸类药物、传统免疫抑制剂以及新型免疫抑制剂,但这些药物仍不能有效根治银屑病,因此探索银屑病新的治疗方法或药物非常必要。
细胞因子信号抑制因子(suppressor of cytokine signaling1, SOCS1)是信号传导通路JAK/STAT的一个负性调控分子,通过SH2结构域与细胞因子受体胞内段与Janus激酶(Janus kinases,JAK)结合,泛素化后降解,从而阻滞干扰素(interferon,IFN)中的IFN-α、IFN-7、IL-2、IL-6、IL-7、IL-12和IL-15等多种因子信号,抑制树突状细胞(dendritic cells,DCs)和其他细胞内JAK-STAT信号通路[5]。因此,SOCS1可能对银屑病的治疗具有一定的作用。前期我们利用腺病毒介导SOCS1治疗银屑病样小鼠模型取得了一定疗效,但腺病毒含有其他蛋白能刺激宿主产生中和抗体,影响再次使用。因此,探寻新的载体非常必要。
外泌体(exosome,Exo)是直径约50~100 nm的小囊体,产生于血细胞或非血细胞的多囊体。含许多重要的生物活性分子,如MHC-I,MHC-II,CD80(B7-1)、CD86(B7-2)和miRNAs,Exo靶向受体细胞的各种不同黏附分子起免疫调节作用[6]。此外,Exo因为其纳米大小,较细胞稳定,具有良好的生物依从性,是国际纳米医学研究的前沿和热点,是天然的纳米载体。研究表明IL-10处理不成熟的DCs获得的Exo能够抑制小鼠胶原蛋白诱导的关节炎(CIA)和减少关节炎炎症程度[7]。用表达FasL或IL-4的腺病毒载体转导的DCs产生的Exo抑制小鼠迟发型超敏反应(DTH)炎症,以MHC-II依赖而不是MHC-I依赖的机制能部分逆转关节炎[8,9]。该研究证明了通过外源基因修饰的DCs获得的外泌体具有免疫抑制的功能。
在本研究中,用重组Ad-SOCS1病毒感染DCs后获得的Exo治疗用咪喹莫特(imiquimod,IMQ)诱导银屑病样的小鼠模型,并研究其可能的机制。
1 材料和方法
1.1 小鼠模型 Bal/C小鼠(雄性,18~20克,8周龄)购自广东省实验动物中心20只,分成对照组、IMQ组、IMQ+DCs-Exo-s组,每组5只,小鼠背部用脱毛机去毛2 cm×2 cm,对照组背部涂凡士林21 mg,1次/2 d,。其余两组小鼠背部用含5% IMQ软膏,剂量为62.5 mg涂抹,1次/2d,连续4次。同时IMQ+DCs-Exo-s组于IMQ涂抹后第2 d于皮损处以1.0 μg/kg剂量多点皮下注射,1次/2 d,连续4次。对照组和IMQ组用等量的PBS代替Exo。皮损的严重性用修正的人评分系统PASI分级评价[7]。累积得分的多少表明炎症的严重性,得分越多表明炎症越重。第8 d用断颈方法处死小鼠,收集皮损标本和血液标本。所有动物的操作按照医院伦理学委员会制定的指导手册进行。
1.2 Ad-SOCS1和Ad-EGFP病毒的构建和鉴定 Ad-SOCS1和Ad-EGFP重组病毒由本院中心实验室保存,用Adeno-X Rapid Titer kit(BD Clontech)检测病毒滴度。操作按BD Company试剂盒说明书进行。
1.3 小鼠DCs的培养 小鼠DCs的培养参照文献[11],具体如下。Bab/C小鼠(体重20~25 g,年龄4~6周)处死后在75%酒精中浸泡10 min,取后腿骨和胫骨,用无血清培养基冲洗骨髓后,用0.83%氯化铵破碎红细胞,离心去上清,再用无血清培养基洗涤细胞2次,然后用含10%胎牛血清的RMPI 1640培养基培养,6 h后除去未贴壁细胞,继续在含rm-IL-4(10 ng/mL)、白血病抑制因子(LIF)(5 ng/mL)和rm-GM-CSF(10 ng/mL)的完全培养中继续培养3 d,加入重组Ad-SOCS1或Ad-EGFP病毒(感染复数为10)到DCs培养物中,48 h后,收集细胞培养物。
1.4 Exo的分离纯化和鉴定 Exo用梯度离心分离得到[7],具体方法如下。被收集的培养上清液以300 g离心10 min,1200 g离心20 min,10 000 g离心30 min;上清液再以100 000 g超速离心1 h。Exo用生理盐水洗涤,再以100 000 g超速离心1 h,以120 μL磷酸盐缓冲液(PBS)重悬,Exo蛋白浓度用微量Bradford蛋白实验定量(Bio-Rad,CA)。每批用蛋白定量进行标准化,1 μg Exo蛋白溶解在20 μL PBS后用于小鼠体内研究。分离后的Exo用电子显微镜鉴定其大小,用Western blot分析鉴定Exo中的蛋白,如CD63、ICAM-1和SOCS1。
1.5 Western blot分析Exo 用Western blot分析鉴定Exo。蛋白样品用12% SDS-PAGE胶电泳后转膜到0.22 μm PVDF膜上。膜用含5%脱脂牛奶的TBST(10 mM Tri-HCL,150 mM NaCl,0.25% Tween-20,pH 7.5)室温下封闭1 h,然后加入一抗孵育过夜。一抗是兔抗小鼠多克隆抗体SOCS1(Santa Cruz)、抗-ICAM-1、HSP70(所有一抗以1∶1000稀释),用TBST洗涤后,膜在室温下与羊抗兔的IgG-HRP二抗孵育1 h,用加强的化学荧光(ECL)显色。
1.6 外周血细胞因子的检测 外周血细胞因子的浓度用Th1/Th2/Th17 CBA试剂盒(BD Pharmingen,USA)检测。
1.7 病理分析 石蜡包埋的皮损组织用冰冻切片机制成4 μL薄片,按照常规的病理进行H&E染色,在普通光学显微镜下观察皮损的病理变化。
1.8 实时定量RT-PCR 用TRIzol试剂盒(Invitrogen,USA)从皮损提取总RNA,用NucleoSpin RNA试剂盒(Macherey-Nagel,Germany)纯化。用AcDNA合成试剂盒(Agilent Technologies,USA)和特异引物产生互补cDNA,用实时定量RT-PCR检测基因的相对表达水平(Roche,USA)。与β-Actin比较进行归一化处理,mRNA的表达用相对倍数表示。
1.9 统计学方法 采用SSPS 17.0统计软件分析。计量资料用均值±标准差表示,用t检验比较两组之间的差异,P<0.05表示差异有统计学意义。
2 结果
2.1 DC和DC来源的Exo的鉴定 以前我们已证明Ad-SOCS1感染DCs表达SOCS1[10]。由于未成熟的DCs具有免疫抑制功能,我们在培养DCs的过程中加入LIF、IL-4,一方面促进DCs的培养,另一方面抑制DCs的成熟。透射电镜观察显示自DCs培养物分离纯化的Exo直径为50 nm左右,Western blotting分析表明Exo含SOCS1、CD63和ICAM-1蛋白,而没有感染Ad-SOCS1的DCs细胞获得的Exo含SOCS1蛋白较少Ad-SOCS1和Ad-EGFP病毒感染的DCs来源的Exo均含CD63、ICAM-1蛋白。这些结果表明我们成功地从Ad-SOCS1和Ad-EGFP病毒感染DCs后培养物中分离和纯化了Exo,Ad-SOCS1感染DCs后培养物的Exo中含SOCS1蛋白(图1)。
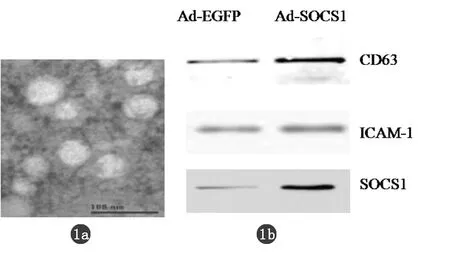
a:用透射电镜观察Exo;b:Western blot分析Ad-SOCS1感染和未感染的DC分离的Exo中蛋白CD63、ICAM-1和SOCS1。
图1 DC培养物分离纯化的Exo的鉴定
2.2 Exo对银屑病样小鼠模型的治疗观察 从图2可以看出对照组皮损无鳞屑、无增厚,呈正常皮肤外观。IMQ组从第2 d开始出现红斑、皱褶,并随着时间的推移皮损加重,至8 d皮损深红,大量的鳞屑,呈层状增厚,鳞屑脱落可见点状出血,呈典型银屑病样外观。IMQ+DCs-Exo-s组可见少许红斑、鳞屑,皮肤轻度增厚。我们采用修正的PASI评分系统对小鼠皮损进行评价,结果发现三组在PASI总分、红斑、鳞屑及浸润增厚程度方面具有显著差异(P<0.05),见表1。H&E染色结果表明对照组皮肤薄,细胞形态正常,IMQ组的皮损棘细胞角化不全,棘层肥厚,有延长
的“网状”背脊,真皮浅层血管周围炎症细胞浸润,呈现银屑病样的典型表型,但IMQ+DCs-Exo-s组显著减少表皮层厚度,减轻IMQ诱导的银屑病。病理分析进一步支持DCs-Exo-s能够改善角质形成细胞角化,颗粒层增加,棘层减少,真皮浅层血管周围淋巴细胞浸润减少(图3)。这些结果表明Ad-SOCS1感染的DC来源的Exo对银屑病样的小鼠模型皮损有显著的改善作用。
表1 不同处理对IMQ诱导的银屑病小鼠模型后第7 d的得分、鳞屑、厚度和红斑指标
注:与对照组比较,*P<0.01;与IMQ组比较,#P<0.05
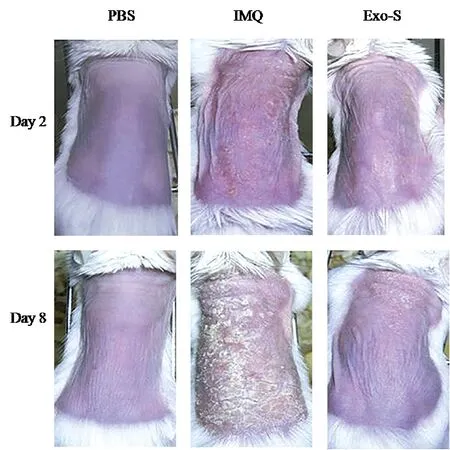
图2 不同处理的皮肤表观
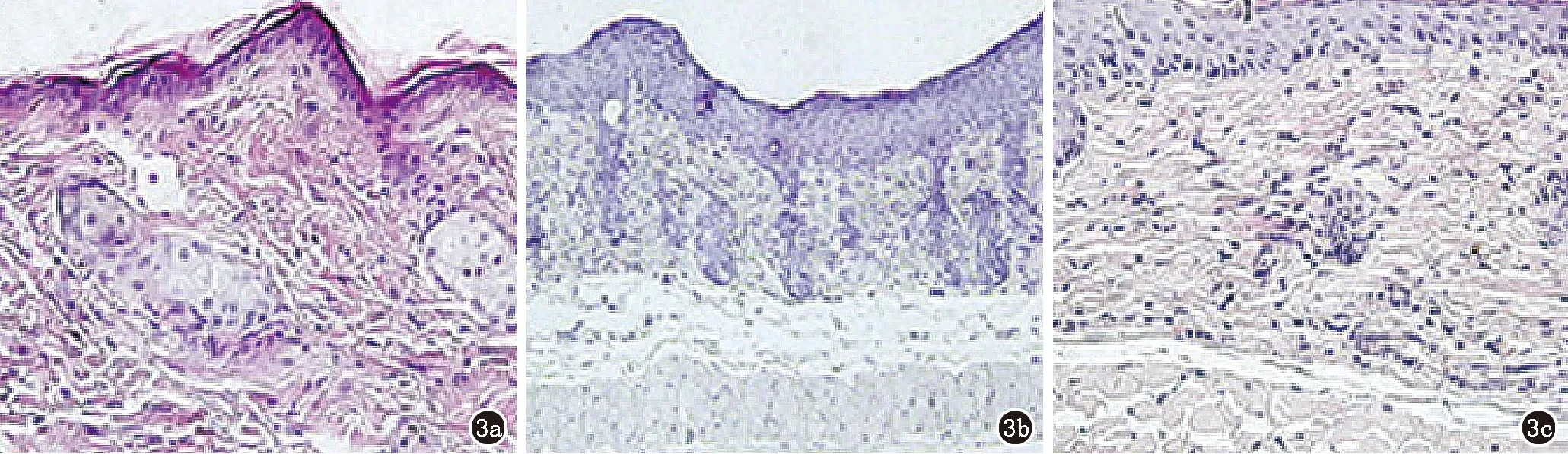
a:对照组;b:IMQ组;c:IMQ+DCs-Exo-s组
图3 Exo治疗IMQ诱导小鼠的银屑病样组织的病理分析(HE,×100)
2.3 外周血细胞因子水平的检测 与对照组比较,IMQ组小鼠外周血中IL-17A、IL-10、IL-4、IL-2、IL-6、IFN-γ和TNF-α水平分别提高5.1、9.0、8.3、6.5、6.1、3.6和3.3倍。与对照组比较DCs-Exo-s组外周血中IL-17A、IL-10、IL-4、IL-2、IL-6、IFN-γ和TNF-α水平分别为2.8、6.4、5.3、2.8、3.0、1.3和1.4。这些结果表明IMQ的反复涂抹小鼠皮肤能够激活免疫系统,而Ad-SOCS1感染DCs的Exo能够抑制IMQ诱导的免疫激活(表2)。
2.4 皮损组织中IL-17A、IL-22和IL-23 mRNA的表达 为了更清楚研究Exo的作用,我们根据前面的实验,用RT-PCR分析比较对照组、IMQ组和IMQ+DCs-Exo-s组小鼠皮损中IL-17A、IL-22和IL-23的表达。结果表明DCs-Exo-s能显著抑制IL-17A和IL-23的表达,各处理组对IL-22的表达没有明显差异(P>0.05),见图4。

表2 IMQ组和IMQ+DCs-Exo-s组细胞因子水平较对照组提高的倍数
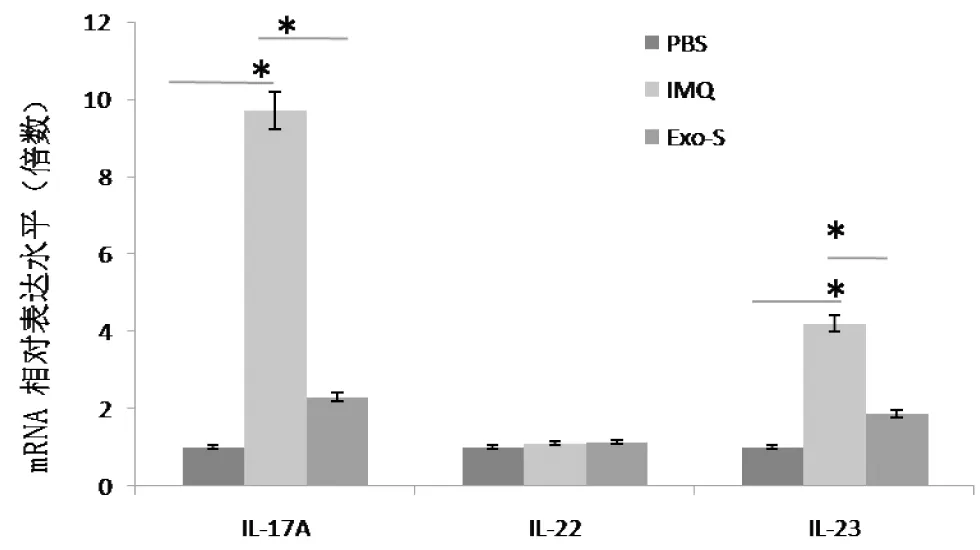
与同组对照组和IMQ+DCs-Exo-s组比较,*P<0.01
3 讨论
SOCS1是各种不同细胞因子刺激细胞后细胞内的负反馈因子,为JAK/Stat信号途径中JaK激酶的假底物,从而抑制JAK/Stat信号途径。DCs细胞在先天免疫和获得性免疫中处于中心地位,由不同的亚群组成,不同亚群所起的作用也不完全相同。临床上一般从外周血分离的单个核细胞在IL-4/Flt3和rm-GM-CSF诱导成未成熟的DCs,用抗原脉冲,用LPS或TNF-α使DCs成熟制备DCs细胞疫苗,用于肿瘤或病毒的治疗。近年来研究发现,未成熟的DCs表明具有免疫抑制功能,对自身免疫性疾病具有一定的治疗作用。但是,体外培养的DCs难以保存。研究表明DCs或Tregs分泌的Exo与其母体一样具有免疫调节作用,主要因为Exo含有各种生物活性分子,如mRNA、microRNA、lncRNA、酶和蛋白质等[12]。在本研究中,我们从未成熟的DCs培养物中通过多次离心获得了Exo,其直径约50 nm,用Western blotting分析证明了这些Exo含CD63和ICAM-1特征性标记物。Ad-SOCS1感染的DC培养物Exo中含SOCS1蛋白。含生物活性的Exo被细胞摄取后,生物活性分子在受体细胞中发挥其功能。
用IMQ诱导的小鼠银屑病样模型能模拟人类银屑病,包括红斑、过度角化、鳞屑、表皮中性粒细胞的微脓疡和真皮浅层血管周围炎症细胞浸润,是研究银屑病较为理想的模型[7]。在本研究中,我们研究了表达SOCS1的腺病毒感染树突状细胞后获得的Exo,能显著改善角质形成细胞的增殖和炎性细胞浸润,抑制Th17细胞分化和IL-17A的分泌,这可能与Ad-SOCS1感染DC细胞后获得的Exo中含SOCS1蛋白有关,因为Ad-SOCS1感染的DCs来源的Exo对银屑病样小鼠模型的表观改善更为显著,更能抑制IL-17A的分泌。因此,Ad-SOCS1感染DCs获得的Exo能抑制Th17/IL17信号轴。尽管Th1细胞是银屑病的主要细胞类型,但目前认为Th17/IL-23在银屑病免疫致病中起关键作用[12]。而IL-23是推动初始T细胞分化成Th17的关键细胞因子,是架设先天性免疫和获得性免疫所必需的细胞因子,并启动早期局部免疫反应;IL-23结合受体后可激活JAK-STAT3信号途径,有研究表明在银屑病患者皮损及外周血IL-23的mRNA和分子水平均有较高水平表达[14,15],在本研究中,IMQ组皮损中IL-23的mRNA显著升高(P<0.01),IMQ+DCs-Exo-s组皮损中IL-23的mRNA较IMQ组显著降低(P<0.01),但仍高于对照(P<0.05)。因此,我们推断并支持IL-23在银屑病的致病机制中起主要作用,靶向IL-23的药物(如Tildrakizumab和Guselkumab)有助于治疗银屑病[16]。Th17细胞与各种自身免疫病和炎症性疾病(如类风湿关节炎、哮喘、实验自身免疫脑膜炎)相关[17]。IL-23是从初始CD4+T细胞在TGF-β和IL-6诱导下分化和维持致病Th17关键的上游细胞因子。DCs和巨噬细胞产生的IL-23结合到被激活的Th17细胞上的IL-23受体,强化极化的Th17主要转录因子-孤儿核受体c-t(orphan nuclear receptor c-t,RORc-t)的表达。RORc-t和IL-6相互作用共同诱导STAT3信号刺激效应细胞因子IL-17A、IL-17F、IL-21和IL-22的产生[18,19]。在本研究中,源自Ad-SOCS1感染的DCs后分泌的Exo能减少皮损和外周血中的IL-17A的表达,可能直接减少CD4+IL-17A细胞的百分比,抑制IL-17A的表达,表明Ad-SOCS1感染的DCs后分泌的Exo不仅能抑制Th17细胞分化而且抑制Th17细胞功能。Th17细胞和其它炎症细胞分泌前炎症细胞因子TNF-α,该细胞因子被认为是银屑病治疗的重要靶点[20,21]。在IMQ诱导的小鼠银屑病模型中,DCs后分泌的Exo减少TNF-α的表达,而且减少Th1相关细胞因子IFN-γ的表达。此外,DCs后分泌的Exo抑制IMQ诱导的IL-10表达。我们推测增加IL-4表达保护Th1/Th2平衡,IL-10表达增加前炎症细胞因子的分泌,因而抑制银屑病样小鼠模型的Th17/Treg平衡。因为DCs后分泌的Exo抑制IL-17A,IL-10的表达。
总之,我们证明了Ad-SOCS1感染DCs后分泌的Exo通过抑制Th17细胞的分化和IL-17A的分泌减轻IMQ诱导的银屑病样炎症。该结果表明Ad-SOCS1感染DCs后分泌的Exo能作为抑制银屑病局部炎症的潜在制剂。
[1] Nestlef O, Kaplan DH, Barker J. Psoriasis[J]. N Engl J Med,2009,361(5):496-509.
[2] Blauvelt A. T-helper 17 cells in psoriatic plaques and additional genetic links between IL-23 and psoriasis[J]. J Invest Dermatol,2008,128(5):1064-1067.
[3] DI cesare A, DImeglio P, Nestlef O. The IL-23/Th17 axis in the immunopathogenesis of psoriasis[J]. J Invest Dermatol,2009,129(6):1339-1350.
[4] Rébé C, Végran F, Berger H, et al. STAT3 activation:A key factor in tumor immunoescape[J]. JAKSTAT,2013,2(1):23010-23019.
[5] Yandava CN, Pillari A, Drazen JM. Radiation hybrid and cytogenetic mapping of SOCS1 and SOCS2 to chromosomes 16pl3 and 12q, respectively[J]. Genomics,1999,61(1):108-110.
[6] Alenquer M, Amorim MJ. Exosome biogenesis,regulation,and function in viral infection[J]. Viruses,2015,7(9):5066-5083.
[7] Kim SH, Lechman ER, Bianco N, et al. Exosomes derived from IL-10-treated dendritic cells can suppress inflammation and collagen-induced arthritis[J]. J Immunol,2005,174(10):6440-6448.
[8] Robbins PD, Dorronsoro A, Boo ker CN. Regulation of chronic inflammatory and immune processes by extracellular vesicles[J]. J Clin Invest,2016,126(4):1173-1180.
[9] Kim SH, Bianco NR, Shufesky WJ, et al. Effective treatment of inflammatory disease models with exosomes derived from dendritic cells genetically modified to express IL-4[J]. J Immunol,2007,179(4):2242-2249.
[10] 曾凡杞,廖明,张志云,等.腺病毒介导的SOCS1对模拟银屑病小鼠模型的影响[J].华中科技大学学报(医学版),2014,43(2):223-226.
[11] Zhu Y, Zheng Y, Mei L, et al. Enhanced immunotherapeutic effect of modified HPV16 E7-pulsed dendritic cell vaccine by an adeno-shRNA-SOCS1 virus[J]. Int J Oncol,2013,43(4):1151-1159.
[12] Cai Z, Zhang W, Yang F, et al. Immunosuppressive exosomes from TGF-β1 gene-modified dendritic cells attenuate Th17-mediated inflammatory autoimmune disease by inducing regulatory T cells[J]. Cell Res,2012,22(3):607-610.
[13] 周淑华,宋亚丽,金德蕙,等.银屑病发病机制中细胞因子研究的某些进展[J]中国麻风皮肤病杂志,2011,27(9):628-630.
[14] 贺勤,涂亚庭,熊瑛,等.IL -23 在寻常型银屑病皮损角质形成细胞中的表达[J]中国麻风皮肤病杂志,2008,24(4):250-252.
[15] 林玲,罗权,周欣,等.寻常型银屑病患者Th17细胞及相关细胞因子的检测[J].中国麻风皮肤病杂志,2012,28(3):168-170.
[16] Agarwal A, Fanelli G, Letizia M, et al. Regulatory T cell-derived exosomes:possible therapeutic and diagnostic tools in transplantation[J]. Front Immunol,2014,5:555.
[17] Kollipara R, Downing C, Gordon R, et al. Interleukin-23 in the pathogenesis and treatment of psoriasis[J]. Skin Therapy Lett,2015,20(2):1-4.
[18] Harden JL, Krueger JG, Bowcock AM. The immunogenetics of Psoriasis: A comprehensive review[J]. J Autoimmun,2015,64:66-73.
[19] Marinoni B, Ceribelli A, Massarotti MS, et al. The Th17 axis in psoriatic disease:pathogenetic and therapeutic implications[J]. AutoImmun Highlights,2014,5(1):9-19.
[20] Gottlieb AB, Chamian F, Masud S, et al. TNF inhibition rapidly down-regulates multiple proinflammatory pathways in psoriasis plaques[J]. J Immunol,2005,175(4):2721-2729.
[21] 李瑾,韩维宜.银屑病与白介素-23 和白介素-12[J].中国麻风皮肤病杂志,2008,24(7):549-551
(收稿:2017-01-08 修回:2017-03-09)
Effects of Ad-SOCS1 infected DCs-secreted exosome on the therapy of psoriasis-like murine models
ZENGFanqi,RANLingzhi,HUPengfei,LIUHuyin.
ShenzhenGuangmingNewDistrictPeople'sHospital518106,Guangdong,China
Correspondingauthor:ZENGFanqi,E-mail:zeng-2005@126.com
Objective: To determine the effect of exosome derived from the dendritic cells (DCs) induced by Adenovirus-Suppressor of cytokine signaling1 (Ad-SOCS1) on the psoriasis-like murine models. Methods: The exosomes of murine DCs were infected by Ad-SOCS1. The levels of SOCS1, CD63 and ICAM-1 from exosome were detected by Western Blot. The psoriasis-like murine models were induced by imiquimod (IMQ) and were divided into the DC-exo(s) group and IMQ-group. The mRNA levels of IL-17A, IL-22 and IL-23 in peripheral blood were detected by RT-PCR. Results: SOCS1, ICAM-1 and CD63 proteins in exosomes were detected. The symptoms of the psoriasis-like mouse in the DC-exo(s) group were better than that in the control group. The level of IL-17A and IL-23 mRNA were higher in the DC-exo-S group than that in the control group. There was no significant difference in the IL-22 level between the DC-exo-S group and control group. Conclusion: Exosome from Ad-SOCS1-infected DCs culture can improve the psoriasis-like murine models. The mechanisms may be associated with the inhibition of IL-17A and IL-23.
suppressor of cytokine signaling1 (SOCS1); psoriasis, dendritic cells (DCs); exosome; IL-17A
深圳市科技计划项目(编号:201103214)
深圳市光明新区人民医院皮肤科,广东深圳,518106
曾凡杞,E-mail:zeng-2005@126.com

