RhoA/ROCK信号通路在骨质疏松大鼠BMSCs成骨分化中的研究
徐亮 陶树清 文刚 李超 陶天遵
哈尔滨医科大学附属第二医院骨二科,黑龙江 哈尔滨 150081
骨质疏松症(osteoporosis,OP)是一种以骨量减少、骨的微观结构退化为特征的,导致骨的脆性增加,易发生骨折的全身性疾病。目前公认的骨质疏松症的主要发病机制是成骨细胞和破骨细胞在骨重塑过程中失衡,成骨细胞数量和活性降低,而破骨细胞数量增加,功能活跃,导致骨形成减少,骨吸收增加,从而使骨吸收速率超过骨形成速率,造成骨质疏松。而骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)作为成骨细胞和成脂肪细胞的前体细胞,其向成骨和成脂方向的分化失衡可能是导致骨质疏松的关键因素之一[1]。在BMSCs成骨分化过程中,细胞骨架将发生改变,而RhoA/ROCK信号通路是调控细胞骨架的关键信号通路之一[2]。近年来,大量研究表明,RhoA/ROCK信号通路通过改变细胞骨架,进而影响BMSCs的成骨分化[3]。目前关于RhoA在骨质疏松发病机制中的研究尚未完全明确,RhoA/ROCK信号通路在骨质疏松发病机制中的研究仍待完善。本实验拟建造骨质疏松大鼠模型,体外培养骨质疏松鼠BMSCs,观察RhoA/ROCK信号通路在BMSCs成骨分化中的作用,为临床骨质疏松的治疗提供新的靶点。
1 材料和方法
1.1 实验材料
实验用纯系SD大鼠(购于哈尔滨医科大学动物实验中心),DMEM-F12(美国Gibco公司),胎牛血清(美国Gibco公司),Rockl/2、RhoA抗体(美国Santa Cruz公司),Trizol试剂盒、PCR和Westem Blot试剂(北京中山生物技术有限公司),PCR引物(上海生工生物工程技术服务有限公司)。
1.2 实验方法
1.2.1大鼠骨质疏松模型的建立:以10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉;于背侧沿脊柱两侧剃毛;常规2%碘伏消毒,以双下肢屈曲位膝关节与脊柱侧方10 mm交叉点为中心,取长约10~20 mm纵行切口,切开皮肤、皮下筋膜,寻找出包裹于脂肪组织中的卵巢,止血钳分离、结扎输卵管及其伴行血管,切除卵巢;逐层缝合,青霉素干粉涂抹切口。术后首日禁食水,而后改为正常饮食并单独饲养,术后1~3 d肌注青霉素(8 iu/d)预防感染。
1.2.2BMSCs的培养:实验分A、B两组,A组细胞为骨质疏松模型组,B组为3月龄大鼠细胞组。取各组SD大鼠,颈椎离断处死,置于75%乙醇浸泡10 min;无菌条件下剪开皮肤、暴露后肢,剪开中间膝关节、去除韧带与多余组织,于髋关节和踝关节分别剪切,分离取出胫骨和股骨;在PBS溶液中去除股骨、胫骨周围肌组织、剪去两侧骺板及骨骺端,反复冲洗3次;用注射器吸取5 mL无血清培养基,反复冲洗骨髓腔,直至骨颜色变白、髓腔内干净为止;夹碎骨并滤掉大块组织,收集冲洗液;1000 rpm室温离心10 min,弃上清,收集细胞制成单细胞悬液;取少量细胞悬液与等量4%乙酸混合,显微镜下血球计数板计数有核细胞,重悬细胞;以5×104/mL的细胞密度接种于含完全培养基的25 cm2的培养瓶中,置于饱和湿度培养箱(37 ℃,5% CO2)中培养。取生长状态良好的二代BMSCs,经0.25%胰蛋白酶1 mL消化,1000 rpm室温离心5 min,弃上清,收集细胞,补加一定量完全培养基制成细胞悬液;以1×104/mL的细胞密度分别接种于含完全培养基的6孔板(2 mL/孔)、96孔板(100 μL/孔)以及培养瓶中,于96孔板中取一无培养基孔设为空白对照;置于饱和湿度培养箱(37 ℃,5% CO2)中培养;24 h后换液,并定期在倒置显微镜下观察细胞生长形态。
1.2.3BMSCs成骨分化矿化结节观测:取6孔板中添加成骨诱导剂培养基培养的A、B组大鼠的BMSCs,培养3 w后弃培养基,PBS液冲洗2次,加适量4%多聚甲醛固定15 min,PBS液冲洗2次,加入适量1%茜素红溶液置于室温5 min,PBS液冲洗,倒置显微镜下观察矿化结节。100×倒置显微镜下任选10个视野,观察后计算细胞分化后的钙化面积平均值与载玻片的总面积比值,并计算钙化率。
1.2.4Western blot分析蛋白表达:各组细胞经消化离心后,加入蛋白裂解液RIPA,冰上放置40 min,12 000 r/min于4 ℃下离心40 min,取上清。以BSA为标准,用Bradford 法对上清进行蛋白定量。取20μg蛋白样品,10% SDS-PAGE电泳,100 V转移1 h至硝酸纤维素薄膜,放入封闭液中37 ℃封闭1 h;一抗 4 ℃过夜。同时,另1张用不含抗体TBS-T液孵育,作为阴性对照。洗膜后,将膜与碱性磷酸酶标记的抗IgG抗体孵育,室温轻摇1 h,洗膜后采用ECL系统感光显像观察结果。计算机成像扫描分析靶蛋白条带,以其灰度值作为蛋白表达的相对水平。
1.2.5RT-PCR检测软骨细胞RhoA、ROCKl的表达:取第3代BMSCs细胞以1×105个/mL的密度接种于6孔板,每孔2 mL,72 h后以Trizol法提取总RNA,并逆转录为cDNA。取上述细胞提取总RNA的提取参照Trizol试剂盒说明书进行操作。取总RNA 1 g,应用逆转录试剂盒进行逆转录反应。反应条件:95 ℃变性,60~65 ℃退火,20~37个循环。PCR反应产物5 uL在琼脂糖凝胶上电泳图像分析仪采集图像,以β-actin为基准,做半定量分析,即以扩增目的片段β-actin的灰度比值表示所扩增的目的基因片段的相对表达水平。
1.3 统计学分析

2 实验结果
2.1 BMSCs的显微镜观察
刚刚接种的培养瓶中原代细胞内含有大量的悬浮、未贴壁的骨髓基质细胞。随着细胞液的更换,弃去培养液中的悬浮细胞,剩下贴壁细胞进行原代培养。原代培养约12~24 h可见细胞呈球形贴壁。培养24 h后换液见大部分悬浮细胞被弃掉,细胞贴壁,呈圆形、多角形、梭形等多种形态存在,贴壁细胞胞体对光的通透性及折射性较好。原代培养72 h后见长梭形细胞集落式生长,培养4 d后贴壁细胞开始增值(图1),原代培养5~6 d后可见大部分细胞贴壁,几乎布满瓶底,细胞呈现鱼群样。原代培养约6 d后分布在瓶底的细胞群互相接近、细胞形态发生变化,呈现旋涡状(图2)。原代培养约9 d后可见细胞融合为一层平铺于瓶底。原代培养约12 d时,可见贴壁细胞呈现细丝样改变(成纤维样外观),其中B组细胞贴壁率明显高于A组。
贴壁细胞原代培养约8~12 d即可以进行传代培养。在无菌条件下进行消化与传代,与原代细胞相比,子代细胞生长迅速,传代培养4~6 h即可见细胞贴壁生长,培养24 h后子代细胞就能完全贴壁生长。贴壁细胞初期呈圆形、短梭形或多角形,同时贴壁细胞胞体对光的通透性及折射性也比较好,细胞形态逐渐趋于一致,表现为长梭形(图3、4)。
图1 BMSCs 4 d(倒置相差显微镜100×)Fig.1 BMSCs 4 d (inverted phase contrast microscope 100 ×)
图2 BMSCs 7 d(倒置相差显微镜100×)Fig.2 BMSCs 7 d (inverted phase contrast microscope 100 ×)

图3 BMSCs 2代(倒置相差显微镜100×)Fig.3 The 2nd generation of BMSCs (inverted phase contrast microscope 100 ×)

图4 BMSCs 3代(倒置相差显微镜100×)Fig.4 The 3rd generation of BMSCs (inverted phase contrast microscope 100 ×)
细胞传至第3代以后,各子代细胞在倒置显微镜下观察生长情况基本相同。笔者所提取的原代骨髓间充质干细胞大致传代10代左右,贴壁细胞的形态基本一致,传代3~4 d细胞生长活跃、增值迅速。传代次数与细胞活性呈现反比。传至3代以后BMSCs可见细胞变形能力以及贴壁所用的时间明显改变,能力下降。实验数据证明第3代的骨髓间充质干细胞的活性最强。
2.2 矿化结节的观测
细胞茜素红染色后于两组细胞内均可观测到矿化结节(图5),A组细胞矿化率(50.02±0.05)%较B组细胞(38.50±0.05)%有明显差异(P<0.05)。提示骨质疏松大鼠BMSCs成骨分化能力减低。
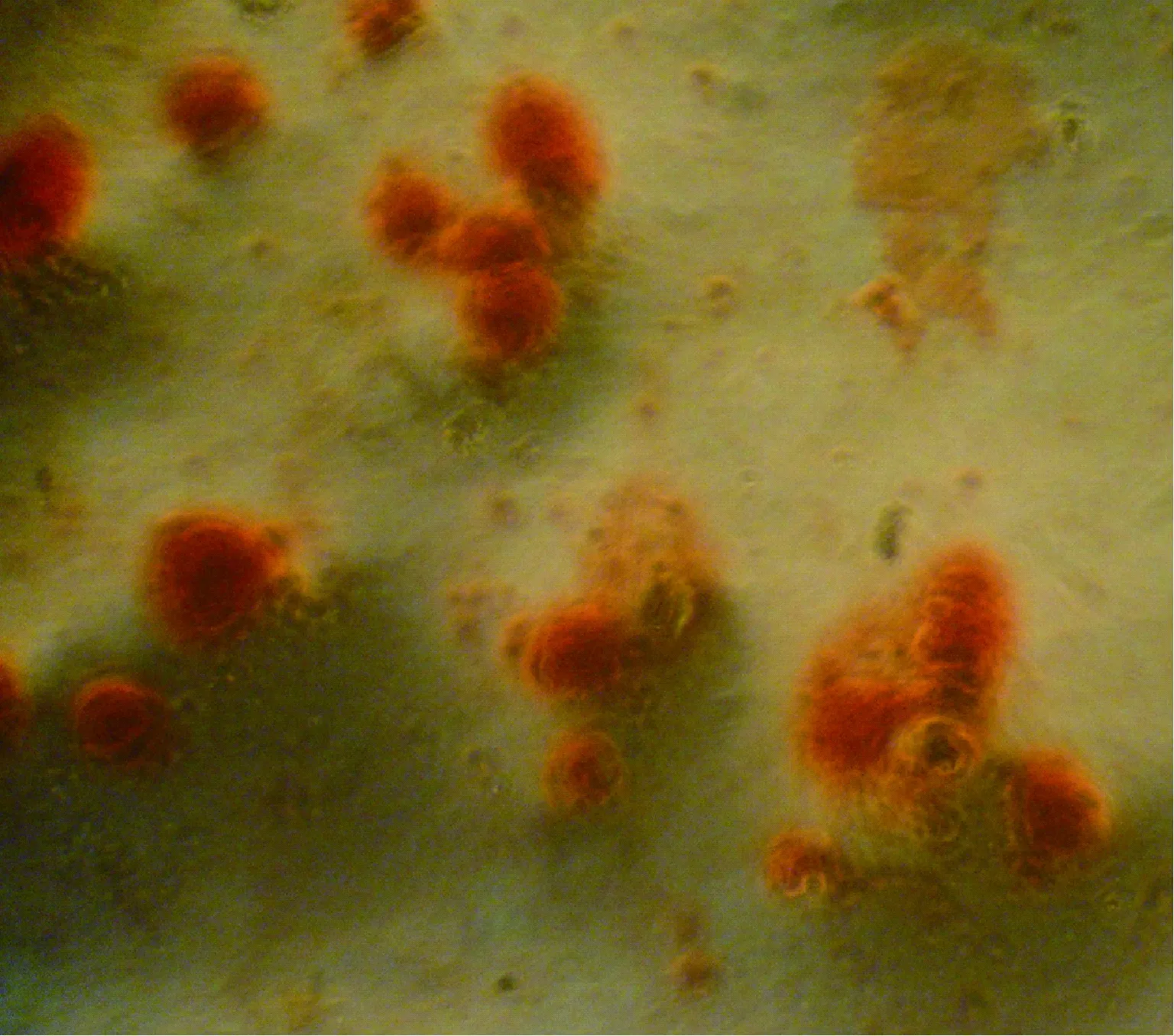
图5 成骨细胞茜素红染色(100×)Fig.5 Alizarin red staining of osteoblasts (100×)
2.3 各组蛋白表达情况
A、 B两组BMSCs中均可见RhoA、ROCK1表达,其中3月龄组细胞RhoA、ROCK1的表达较骨质疏松组明显增高(图 6),差异具有统计学意义(P<0.05)。
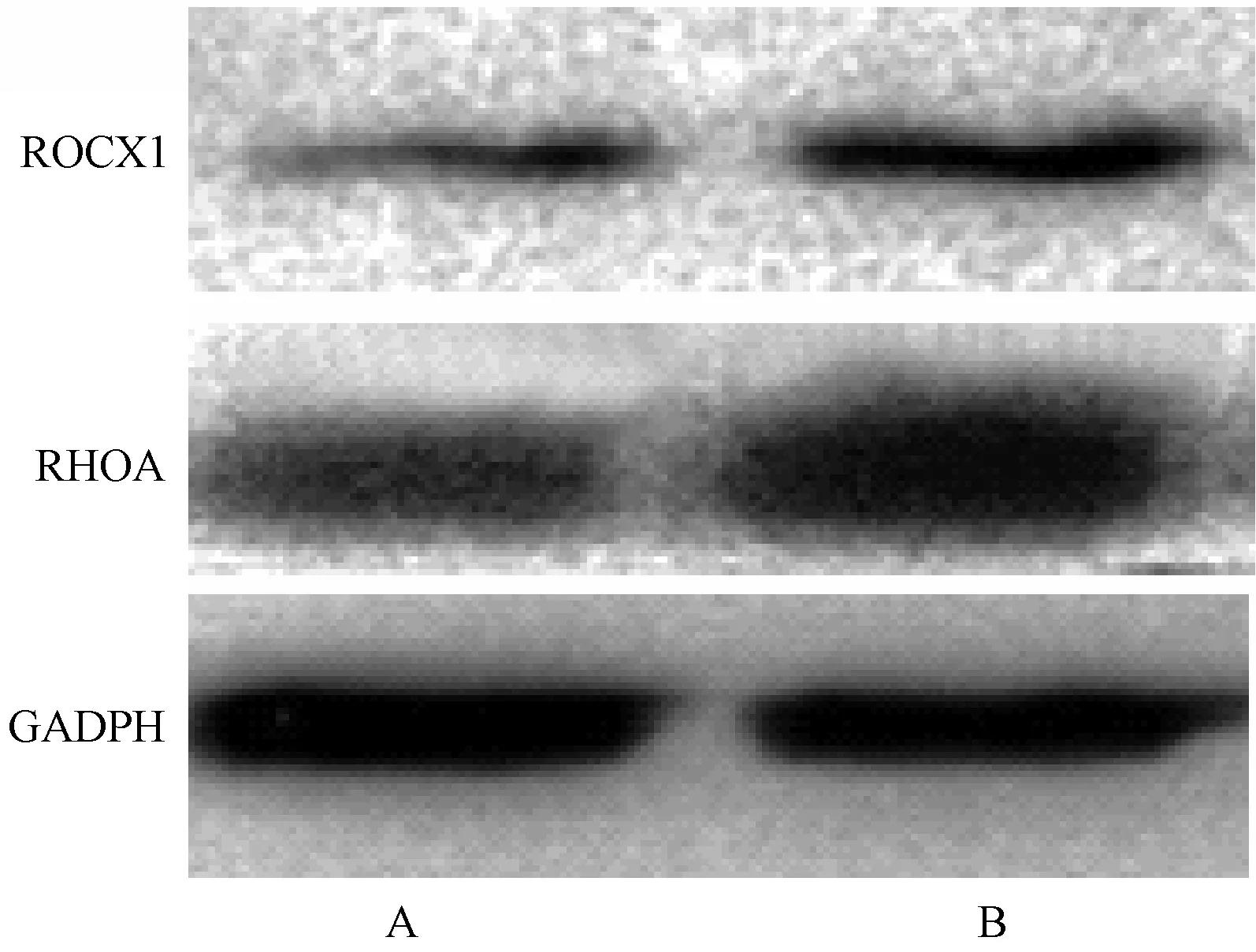
图6 两组细胞RHOA、ROCK1蛋白表达Fig.6 Expression of RHOA and ROCK1 proteins in cells of two groups
2.4 各组细胞RhoA、ROCK1 mRNA的表达
A、B两组BMSCs中均可见RhoA、ROCK1表达,其中3月龄组细胞RhoA、ROCK1的表达较骨质疏松组明显增高(图7),差异具有统计学意义(P<0.05)。
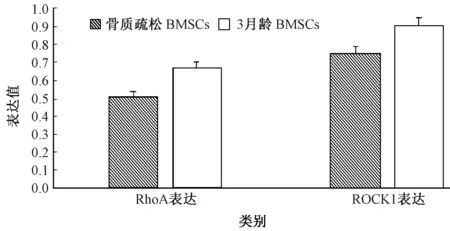
图7 各组细胞RhoA、ROCK1 mRNA表达情况Fig.7 Expression of RhoA and ROCK1 mRNA in each group
3 讨论
BMSCs是目前骨质疏松症研究的热点,目前认为骨质疏松的发病机制与BMSCs成骨分化能力减低有关。细胞之间生物学信号的传导是一切生理、病理过程的基础,对细胞信号转导的研究一直是医学及生物学领域的热点。从细胞膜表面受体接受信息开始、至细胞内生成信息物质的生成,标志着细胞外信号完成向细胞内的转导过程。该过程中G蛋白对跨膜信号转导发挥了重要作用。现已发现的G蛋白家族共有3类,其中有两类分别参与膜受体信息转导与蛋白质合成过程;另一类为小G结合蛋白(small GTP-bindingproteins),简称小G蛋白(small G proteins),其功能与细胞分裂、增殖、分化等活动关系密切。
Rho是小G蛋白亚家族之一,其又包括RhoA、RhoB、RhoC、RhoD、RhoE蛋白,其中RhoB、RhoC与RhoA具有高度同源性[4],Rho蛋白的GDP结合形式处于非活化状态,而GTP结合则被启动激活。活化的Rho蛋白其效应分子大多是激酶,可通过磷酸化细胞内靶分子调控细胞功能,主要包括PAKs (p21-activatedkinases,可与激活的Cdc42或Racl结合)和ROCKS(Rho-associatedcoiled-coil-forming kinases,可与激活的RhoA结合)[5]。目前,针对Rho家族的研究主要集中在RhoA、Rac1、Cdc42和TC10。目前Rho的下游底物研究较为深入的是ROCK。RhoA/ROCK信号通路在多种疾病的病理生理过程中发挥重要的作用[6]。Takeshita等通过建立大鼠骨性关节炎模型,证实在骨性关节炎软骨中ROCK的表达明显增加[7]。近年来,RhoA/ROCK信号通路在细胞分化中的作用越来越受到重视。有研究发现Y-27632对BMSCs向神经细胞分化方面具有抑制作用[8],而Y-27632是ROCK的特异性抑制剂,因此推论RhoA/ROCK信号通路在BMSCs向神经细胞分化方向具有重要作用。并且有报道称在牵张应力的作用下,人牙膜细胞的成骨分化能力增强,且这种作用可能是通过RhoA/ROCK信号通路实现的[9]。在骨组织工程领域,激活RhoA/ROCK信号通路能够促进间充质干细胞成骨分化能力已得到证实[10-11]。Xu等[12]也证实当RhoA/ROCK信号通路受移植时,干细胞可向成软骨和成脂方向分化,而当信号通路激活时,干细胞可向成骨方向分化。在骨质疏松领域,因细胞内微环境改变,干细胞向成骨、成脂方向分化受多种因素调节,同时破骨细胞活性也受RhoA/ROCK信号通路的调节[13]。
本实验通过体外培养骨质疏松大鼠BMSCs和正常大鼠BMSCs,发现在正常月龄情况下骨髓间充质干细胞的成骨分化能力强,对外界刺激的反应能力较强,而在骨质疏松状态下,细胞的成骨分化能力减低,对外界刺激的反应能力减弱。经Western blot及PCR实验证明,在骨质疏松大鼠BMSCs中RhoA/ROCK信号通路的表达相对较弱,而这与骨质疏松大鼠BMSCs成骨分化能力减低有关,为临床治疗骨质疏松提供了新的研究方向。

