hsa-miR-655靶向CLCF1基因对人成骨肉瘤MG63细胞 OPG/RANKL系统表达的影响
陈娟 谢丽华 李生强 许惠娟 陈赛楠 叶云金 葛继荣
福建省中医药研究院骨质疏松证候基因组学重点研究室,福建 福州 350003
绝经后骨质疏松症(postmenopausal osteoporosis,POP)是中老年女性的常见多发病,以骨量低下、骨微结构破坏,导致骨脆性增加、易发生骨折为特征的全身性骨病,其发生与遗传、内分泌和免疫等因素密切相关[1]。miRNAs是一类内源性、长度约19~26个核苷酸的非编码短小RNA,对骨代谢和骨的发育重建起着重要作用[2]。课题组前期研究发现,hsa-miR-655通过靶向结合CLCF1 mRNA的3'UTR区,在转录后水平负性调控绝经后骨质疏松症关联基因CLCF1的表达[3],但hsa-miR-655介导CLCF1基因参与POP的具体机制尚不清楚。
CLCF1是B淋巴细胞的催化剂,可刺激B细胞活化,参与体液免疫[4]。“骨免疫学”理论认为,骨骼系统与免疫系统之间存在密切关系,免疫失调可导致骨代谢异常[5]。OPG/RANKL/RANK 系统作为连接骨代谢与免疫系统之间的桥梁,是调节骨重建的一类重要的信号通路。本研究通过在人成骨肉瘤MG63细胞系中过表达hsa-miR-655,研究hsa-miR-655通过靶向调控CLCF1基因表达,对细胞增殖和骨免疫重要通路OPG/RANKL/RANK系统的影响。
1 材料与方法
1.1 试剂与仪器
人成骨肉瘤细胞 MG63(中国科学院上海生命科学研究院细胞资源中心);MEM培养基(GIBCO公司);胎牛血清(fetal bovine serum,FBS,GIBCO公司);青链霉素(Invitrogen公司);hsa-miR-655表达慢病毒(上海吉凯基因化学技术有限公司,货号MI0003677);hsa-miR-655引物、U6引物(广州市锐博生物科技有限公司);microRNA提取试剂盒(Qiagen公司);miRNA反转录试剂盒、miRNA定量试剂盒(广州市锐博生物科技有限公司);Trizol试剂(Invitrogen公司);PrimeScript 逆转录试剂盒(Fermentas公司);CLCF1、OPG、RANKL引物(宝生物工程有限公司);CLCF1、OPG、RANKL、GAPDH抗体(Abcam公司);Cell Counting Kit-8试剂盒(日本同仁公司);SYBR©PremixExTaqTMGC Kit(TaKaRa公司);PCR仪(ABI 7500 Fast);核酸检测仪(NanoDrop 2000/2000c 分光光度计,Thermo公司);Annexin V-PE/7-AAD双染细胞凋亡盒、细胞周期检测试剂盒(BD公司);FACS Calibur流式细胞仪(BD公司)。
1.2 方法
1.2.1MG63细胞培养和慢病毒感染:MG63细胞用MEM培养基,含10%FBS、1%双抗,置于5% CO2孵箱中37 ℃恒温培养箱培养。转染前先将MG63细胞接种于6孔板中,分2组:阴性对照组(NC组)和hsa-miR-655过表达组(OE组)。OE组和Vector组按照感染复数50(multiplicity of infection,MOI),分别感染hsa-miR-655表达慢病毒及相应阴性对照慢病毒。24 h后换正常培养液,转染72 h后荧光显微镜及流式细胞术(flow cytometry,FCM)观察感染效率,并收取细胞进行相关检测。
1.2.2实时荧光定量PCR:根据试剂盒说明分别提取细胞microRNA和总RNA。定量后利用逆转录试剂盒进行逆转录获得定量 PCR模板。引物序列见表1,荧光定量PCR反应条件如下:①预变性:95 ℃ 10 s,②变性:95 ℃ 5 s,③退火、延伸:60 ℃ 31 s,40个循环。每组均做3个重复,取均数。miR-655相对定量计算以U6作为内参,CLCF1、OPG、RANKL相对定量计算以GAPDH作为内参,采用2-ΔΔCt法进行相对定量分析。
1.2.3细胞增殖实验:收集各组MG63细胞,以2×103/孔的细胞数接种于96孔板,各实验组均设3个复孔,每孔添加培养液100 μL。分别于0、24、48、72、96 h行CCK8检测。每孔加入CCK8试剂10 μL,避光孵育3 h。酶标仪检测450 nm 处各孔的吸光度值(OD450),用空白对照调零去除背景值。
1.2.4流式细胞术分析细胞周期分布:收集各组细胞,将约1×106个细胞移入离心管中,1000 rpm离心5 min,弃去上清,PBS溶液清洗一次。加入70%冰乙醇5 mL混匀固定,4 ℃放置48 h以上。检测前加入0.5 mLPI/RNase(BD公司,货号550825)染色液,室温避光染色15 min,流式细胞仪检测细胞周期时相。

表1 引物序列Table 1 Primer sequences
1.2.5Western blot 检测蛋白水平:RIPA 裂解法提取转染后各组MG63细胞总蛋白,定量蛋白浓度。40μg蛋白样品,SDS-PAGE胶分离蛋白。采用湿转系统,100 V恒压转膜60 min,5%脱脂奶粉室温封闭1 h;分别加入CLCF1抗体(1∶1000)、OPG抗体(1∶1000)、RANKL抗体(1∶500)和GAPDH抗体(1∶2000)。4 ℃孵育过夜;1×TBST 漂洗3次,加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(1∶4000),常温孵育1 h;1×TBST 漂洗4次,避光条件下化学发光检测,并进行灰度值分析。以GAPDH作为内参计算目的蛋白相对灰度比值。

2 结果
2.1 hsa-miR-655过表达后上调MG63细胞miR-655水平
慢病毒感染MG63细胞,72 h后荧光显微镜和流式细胞术观察细胞中绿色荧光蛋白(green fluorescent protein,GFP)的表达情况,结果显示,MOI=50时,感染效率为80%以上(图1A、1B)。qRT-PCR检测hsa-miR-655在MG63细胞中的相对表达水平,与对照组相比,过表达组hsa-miR-655表达水平显著升高,差异有统计学意义(P=0.0004,图1C),提示成功建立hsa-miR-655过表达的MG63细胞株。
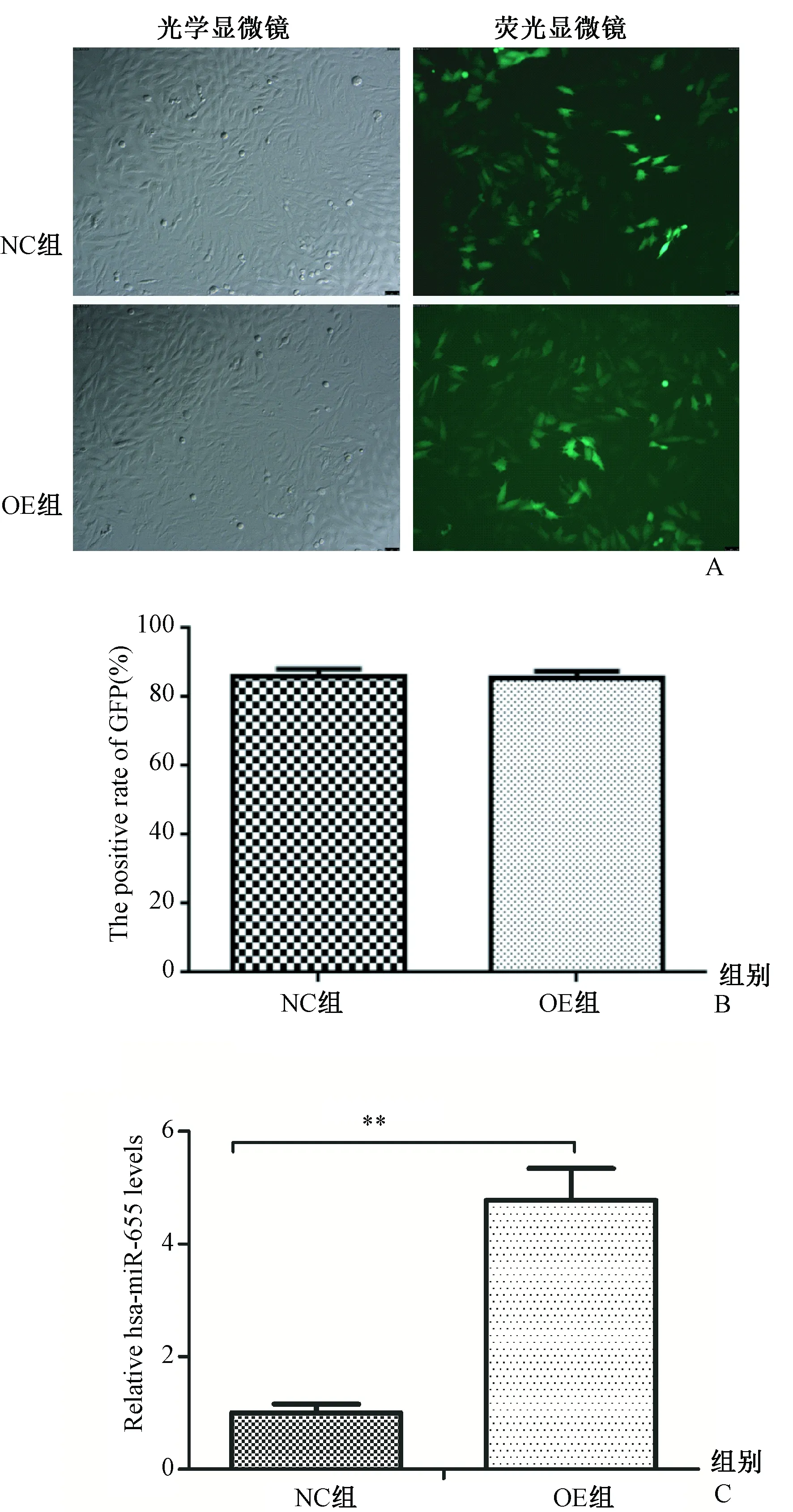
图1 hsa-miR-655过表达后MG63细胞miR-655水平的检测。A:荧光显微镜观察GFP阳性MG63细胞;B:流式细胞术检测细胞GFP阳性率;C:qRT-PCR 检测hsa-miR-655表达水平Fig.1 Expression of hsa-miR-655 in MG63 cells. A: GFP positive MG63 cells were observed with fluorescence microscopy; B: GFP positive rate was detected with flow cytometry; C: qRT-PCR was used to detect hsa-miR-655 expression level.
2.2 hsa-miR-655抑制CLCF1基因的表达
为探讨hsa-miR-655对CLCF1基因的调控作用,笔者分别在mRNA水平和蛋白水平检测CLCF1基因的表达变化。发现与对照组相比,hsa-miR-655过表达组CLCF1蛋白水平明显下调(P=0.0053,图2),而mRNA水平未见明显变化(P=0.0986,图2)。说明hsa-miR-655在转录后水平抑制CLCF1基因的表达。
2.3 过表达hsa-miR-655抑制MG63细胞增殖
与对照组相比,过表达组MG63细胞增殖能力明显降低,差异具有统计学意义(0 h:P=0.203;24 h:P<0.0001;48 h:P<0.0001;72 h:P<0.0001;96 h:P=0.0005)。说明hsa-miR-655在MG63中有抑制增殖作用,见表2。
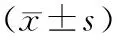
表2 CCK8实验检测hsa-miR-655过表达对MG63细胞的增殖调控作用Table 2 Inhibitory effect of hsa-miR-655 on MG63 cell growth detected with CCK8 assay
注:***表示与对照组比较,差别有统计学意义(P<0.001)。
2.4 hsa-miR-655抑制MG63细胞周期的进展
流式细胞术检测周期分布,结果提示,hsa-miR-655过表达组较对照组MG63细胞 G0/G1期细胞比例增加(P=0.0048),S期细胞比例减少(P=0.0133),差异具有统计学意义(图3),由此可见,hsa-miR-655可以使细胞阻滞在G1期,延缓细胞周期进程。
2.5 hsa-miR-655对OPG和RANKL表达的影响
qRT-PCR检测hsa-miR-655过表达后OPG、RANKL mRNA的变化发现,与对照组比较,过表达组OPG(P=0.0384)、RANKL(P=0.0007)mRNA均有所上调,差异具有统计学意义(图4A);Western blot检测蛋白水平,经图像分析软件计算RANKL和OPG相对灰度比值,结果显示,与对照组比较,过表达组OPG、RANKL蛋白均上调,而OPG/RANKL比值却降低,差异具有统计学意义(图4B,表3)。
3 讨论
miRNA在骨质疏松的发生和进展中发挥了重要的调控功能。课题组前期研究发现hsa-miR-655能靶向调控绝经后骨质疏松症关联基因CLCF1的表达,但hsa-miR-655介导CLCF1基因参与POP的具体机制尚不明确。人成骨肉瘤MG63细胞株具有人成骨细胞表型特征,是最常用的成骨细胞模型之一[6]。本实验在MG63细胞系中过表达hsa-miR-655,观察hsa-miR-655对MG63细胞增殖、细胞周期及CLCF1、OPG和RANKL基因表达的影响。结果显示,过表达 hsa-miR-655显著抑制MG63细胞的增殖,使MG63细胞G1期阻滞,S期比例减少,从而延缓细胞周期进程。同时,过表达miR-655后,CLCF1蛋白水平明显下调,而OPG和RANKL表达水平虽然上调,但OPG/RANKL比值却降低。说明miR-655能通过负调控CLCF1基因的表达,抑制成骨样细胞MG63的增殖,并下调OPG/RANKL的比值。
图2 hsa-miR-655抑制CLCF1基因的表达Fig.2 Up-regulation of hsa-miR-655 inhibited CLCF1 expression
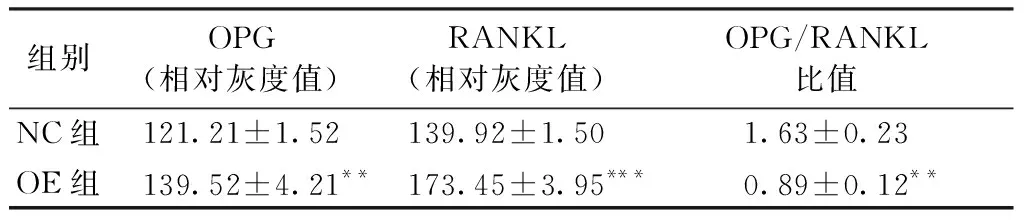
组别OPG(相对灰度值) RANKL(相对灰度值)OPG/RANKL比值NC组121.21±1.52139.92±1.501.63±0.23OE组139.52±4.21**173.45±3.95***0.89±0.12**
注:**表示与对照组比较差异有统计学意义(P<0.001);***表示与对照组比较差异有统计学意义(P<0.0001),OPG(P=0.0021),RANKL(P=0.0002),OPG/RANKL(P=0.0078)。
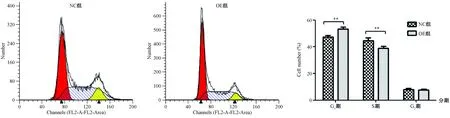
图3 FCM测定hsa-miR-655过表达后MG63细胞周期的变化Fig.3 Changes of cell cycle after up-regulation of hsa-miR-655 detected with FCM
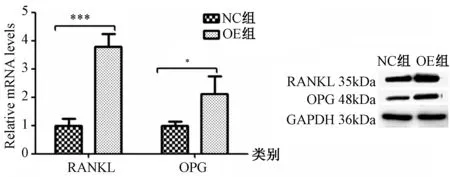
图4 hsa-miR-655过表达对OPG、RANKL表达的影响Fig.4 Up-regulation of hsa-miR-655 increased OPG and RANKL expression
作为一类内源性非编码小RNA分子,miRNAs通过对靶基因转录后水平的调控,在骨代谢中具有重要的调控作用。文献报道,miR-26 a在骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)成骨分化过程中表达上调,并通过调控 Wnt信号通路促进 BMSCs的成骨分化[7]。Gao等[8]发现miR-210在人间充质干细胞成骨分化过程表达下调,通过对miR-210的抑制可促进人间充质干细胞成骨分化进程。此外,通过对miRNA表达谱的观察,发现 miR-21在破骨细胞的分化过程中呈高表达,而其高表达可触发级联反应起到促破骨细胞分化的作用,因此miR-21可被认为是早期破骨细胞分化的关键调节miRNA[9]。本研究中的hsa-miR-655基因定位于人14q32.31染色体上,自2005年hsa-miR-655首次被发现以来,越来越多的研究对hsa-miR-655基因及其在各种生物学功能中发挥的作用进行了报道。miR-655在癌症的发生、发展和转移中起重要作用[10-11]。肝癌中miR-655表达较高的患者生存期短于miR-655表达低的。多变量分析显示,miR-655是肝癌的独立危险因素[12]。Kitamura等[13]报道miR-134/487b/655簇能促进TGF-β1诱导的上皮间质转化现象,并通过直接靶向MAGI2来影响肺癌细胞的耐药性。笔者前期研究发现,hsa-miR-655 可以靶向结合CLCF1 mRNA的3'UTR区,在转录后水平调控CLCF1基因表达。本研究结果进一步证实了miR-655能抑制CLCF1的表达,并对人成骨样细胞MG63的增殖起调控作用。
CLCF1是B淋巴细胞的催化剂,可通过gp130受体刺激B细胞活化,参与体液免疫。CLCF1属白细胞介素6(IL-6)细胞因子家族成员,IL-6是骨吸收的主要调节者,其主要通过激活 JAK2/STAT3 信号通路发挥作用[14]。研究表明IL-6 与成骨细胞、基质细胞、破骨细胞及其前体产生密切相关,能促进骨及骨髓中破骨细胞增加。文献报道[15]JAK2/STAT3是破骨细胞前体细胞分化成熟过程中的关键信号通路,三磷酸腺苷(adenosine triphosphate,ATP)竞争性JAK2激酶抑制剂AG490通过下调STAT3(Ser727)磷酸化水平,抑制核因子kB受体活化因子配体诱导的RAW264.7细胞向破骨细胞的分化。课题组前期研究发现,CLCF1在绝经后骨质疏松症中表达下调,且CLCF1基因过表达后可以激活JAK2/STAT3信号通路[16]。结合本实验结果,hsa-miR-655通过靶向调控CLCF1基因的表达,下调OPG/RANKL的比值。因此,笔者推测hsa-miR-655对OPG/RANKL的影响可能与JAK2/STAT3信号通路有关。
“骨免疫学”理论认为,骨骼系统与免疫系统之间存在密切关系,免疫失调可导致骨代谢异常。OPG/RANKL/RANK系统则是骨代谢与免疫系统之间的桥梁,OPG、RANKL和其唯一受体RANK形成了一个调节破骨细胞的信号系统,并且是影响破骨细胞分化、发育和功能的最终途径,在骨质疏松中起重要作用[17]。成骨细胞分泌RANKL,RANKL可激活破骨细胞和破骨细胞前体细胞膜表面RANK受体,引起破骨细胞的形成和活化。OPG/RANKL比例的变化对于维持成骨细胞与破骨细胞之间的平衡很重要[18]。研究表明,IL-6 可以通过各种因素对成骨细胞和破骨细胞之间的OPG/RANKL/RANK 信号通路产生影响[19-20]。IL-6 通过诱导成骨细胞上RANKL 表达,与前破骨细胞上所表达的 RANK 相互作用,经 RANK 信号通路促进破骨细胞分化。研究发现,hsa-miR-655过表达后,OPG和RANKL表达均上调,但OPG/RANKL的比值却下调。推测hsa-miR-655可能通过CLCF1调控成骨细胞OPG/RANKL系统,进而影响成骨细胞与破骨细胞之间的平衡。而OPG水平的增加可能是由于 RANKL和OPG都在成骨细胞中分泌,RANKL水平增加,OPG的水平进而代偿性地提高所导致。
综上所述,hsa-miR-655可以通过负调控CLCF1基因,抑制成骨样细胞MG63的增殖和细胞周期进展,促进RANKL、OPG表达并下调OPG/RANKL的比值。但对hsa-miR-655促进RANKL、OPG表达增加的分子机制仍待后续进一步研究。

