2型糖尿病患者下肢血管病变与血清25羟维生素D及骨密度的相关性
王贺 阳琰* 张国豪 王莲地 刘贝贝 李琪
1.遵义医学院附属医院内分泌科,贵州 遵义 563099 2.贵州茅台酒厂集团公司职工医院,贵州 遵义 564501
下肢血管病变与骨质疏松(osteoporosis,OP)均为2型糖尿病(type 2 diabetes mellitus,T2DM)患者的常见慢性并发症,严重时可能导致骨折、截肢等不良后果[1-2]。动脉粥样硬化是下肢血管病变的主要成因。近年有研究发现,动脉粥样硬化与骨质疏松往往好发于同一个体,二者可能属于同一内分泌过程,具有共同的病理生理机制,但具体机制尚未阐明[3]。血清25(OH)D是人体必需的脂溶性维生素,研究发现,它除了影响糖脂代谢、骨代谢等,还与动脉粥样硬化的发生密切相关[4-5]。但是关于T2DM患者下肢血管病变与血清25(OH)D、骨质疏松三者的关系如何,目前国内外未见相关研究报道。因此,本研究拟通过分析T2DM患者下肢血管病变与25(OH)D、骨密度(bone mineral density,BMD)之间的相关性,旨在初步探讨2型糖尿病患者下肢血管病变的危险因素,为早期联合防治糖尿病下肢血管病变及骨质疏松提供新的靶点。
1 对象与方法
1.1 研究对象
选取2016年8月至2017年1月在遵义医学院附属医院内分泌科住院的2型糖尿病患者235例,入选患者均符合1999年世界卫生组织的2型糖尿病诊断标准。检测所有患者的踝肱指数(ankle brachial index,ABI),根据ABI的数值将所有患者分为两组,下肢血管病变组(PAD,ABI<0.9)115例,年龄(57.52±1.33)岁,男60例,女55例;非下肢血管病变组(NPAD,ABI≥0.9)120例,年龄(55.23±1.71)岁,男62例,女58例。排除以下疾病及因素:患有心、肝、肾等严重器质性疾病及其他内分泌疾病;ABI>1.4的可疑动脉钙化患者;糖尿病急性并发症;有感染性及免疫性疾病、肿瘤等疾病;妊娠、哺乳期及准备妊娠的妇女;患有代谢性骨病、甲状腺及甲状旁腺疾病、肾上腺疾病、类风湿性关节炎;半年内服用影响骨代谢的药物(维生素D、钙剂、激素、氟化物等),大量吸烟及饮酒者;偏瘫、长期卧床、局部制动的患者。本研究已通过医院伦理委员会批准并取得所有受试者知情同意。
记录患者性别、年龄、病程、身高、体质量、收缩压(systolic blood pressure,SBP)/舒张压(diastolic blood pressure),计算体质量指数(body mass index,BMI)=体重(kg)/[身高(m)]2。
1.2 方法
1.2.1生化指标检测:禁食12 h后于清晨抽取所有受试者静脉血标本,采用日立全自动生化分析仪检测总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein,LDL-C)、血钙(Ca)、血磷(P);己糖氧化酶法测定空腹血糖(fasting blood glucose,FBG)、餐后2 h血糖(2hPG);高效液相层析法测定糖化血红蛋白(hemoglobin A1c,HbA1c);化学发光法测定空腹胰岛素(fasting bloodinsuline,FINS)水平,计算稳态模型胰岛素抵抗指数(HOMA-IR)=FPG×FINS/22.5;电化学发光法测定血清25(OH)D水平。
1.2.2采用超声多普勒血流探测仪测定ABI:患者取仰卧位,测定双侧前臂肱动脉血压,以高值为肱动脉压;双侧胫后动脉和足背动脉收缩压的高值为该侧的踝动脉压,计算ABI(ABI=肱动脉压/踝动脉压)。
1.2.3测定骨密度:采用法国MEDILINK公司生产的Medix90双能X线骨密度仪(DXA)测定腰椎(L1~4)、左侧股骨颈(Neck)、大转子(Troch)、华氏三角(Ward’s)的BMD。
1.3 统计学处理
2 结果
2.1 两组患者25(OH)D、各部位BMD及其他指标的比较
PAD组患者的糖尿病病程、SBP、HbA1c、TC、LDL-C明显高于NPAD组,而血清25(OH)D、Neck、Troch、Ward’s的BMD值明显低于NPAD组,差异均有统计学意义(P<0.05);两组患者的性别构成比、年龄、BMI、DBP、HDL-C、TG、Ca、P、L1~4的BMD差异均无统计学意义(P>0.05),见表1。
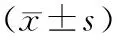

组别例数(男/女)年龄(岁)病程(月)BMI(kg/m2)SBP(mmHg)DBP(mmHg)HbA1C(%)FPG(mmol/L)FINS(mU/L)HOMA-IRTC(mmol/L)PAD组60/5557.52±1.3322.90±8.6723.77± 2.51150.20±9.6782.38±10.5811.88±2.0212.07±0.4924.29±12.672.32±1.344.93±0.16NPAD组62/5855.23±1.7120.10±7.9922.65± 2.37132.10± 7.2083.01±11.3310.02±1.8011.22±0.6522.83±12.322.10±0.784.63±0.14t值0.171.071.271.16 2.262.99 1.501.022.331.791.60 P值 0.736 0.291 0.0260.193 0.0290.4030.0340.3270.1260.2320.031
续表1 PAD组与NPAD组一般临床资料及生化指标的比较ContinuedTable 1 Comparison of clinical indices between PAD group and NPAD group
2.2 ABI与血清25(OH)D及各部位BMD的相关性分析
ABI与各变量的相关分析显示,ABI与25(OH)D、Neck、Troch、Ward’s的BMD呈正相关(r=0.62、0.70、0.53、0.45,P<0.05),ABI与年龄、糖尿病病程、SBP、TC、LDL-C、HbA1C呈负相关(r=-0.33、-0.42、-0.70、-0.68、-0.50、-0.53,P<0.05),见表2。

表2 ABI与骨密度、血清25(OH)D及其他指标的相关性分析Table 2 Linear regression analysis among ABI, BMD, 25(OH)D, and other indexes
2.3 Logistic回归分析
校正年龄、性别、糖尿病病程后,将上述指标继续进行Logistic回归分析,以有、无下肢血管病变为因变量,以HbA1c、SBP、TC、LDL-C、25(OH)D、Neck的BMD、Troch的BMD、Ward’s的BMD为自变量进行多因素Logistic回归分析,5个因素进入模型,见表3,提示高SBP、高水平HbA1c及TC,低水平25(OH)D、低Neck的BMD均为患者发生糖尿病下肢病变的危险因素。
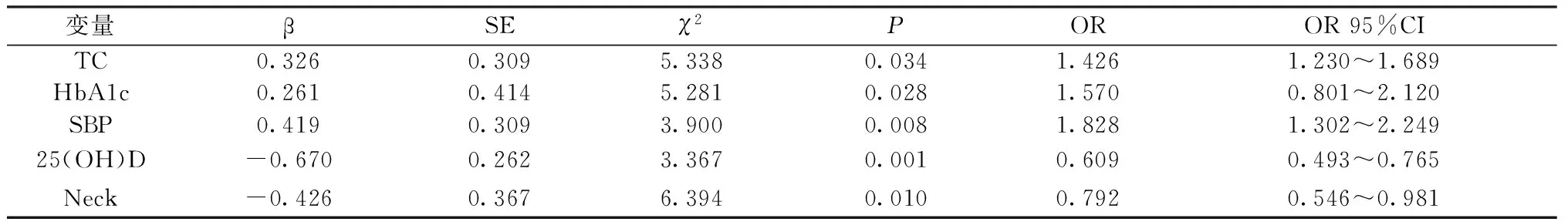
表3 T2DM患者下肢血管病变危险因素的Logistic回归分析Table 3 Logistic regression analysis of risk factors of lower limb peripheral arterial disease in diabetic patients
3 讨论
下肢血管病变是T2DM的常见并发症,也是最严重的并发症之一,可以致使下肢缺血、坏疽,严重时甚至需截肢,致残率较高[1]。另外,有研究发现下肢血管病变的存在也使T2DM患者心血管事件的发生率明显上升[6]。尽早对T2DM患者进行下肢血管病变的筛查,可能提高2型糖尿病患者的生活质量,降低患者的死亡风险。多普勒血流探测仪检测ABI是早期诊断下肢血管病变的首选和常规检查方法。动脉粥样硬化是血管病变的主要成因,Strong等[7]研究将ABI早期诊断周围动脉闭塞性疾病的切点定为0.9~1.4,ABI越低,动脉硬化的程度越严重。国内外有研究发现,动脉硬化与骨密度减低存在相关性[8],提示骨量减少、骨质疏松可能与血管病变的发生密切关联。本研究发现,T2DM患者PAD组(Neck、Troch、Ward’s)的BMD明显低于NPAD组(P<0.05),而ABI与(Neck、Troch、Ward’s)BMD均呈显著正相关(P<0.05),反映了T2DM患者的下肢血管病变与低骨量相关,Neck的骨密度下降是T2DM患者下肢血管病变的独立危险因素,而ABI越低,下肢骨的BMD越低,可能与T2DM患者下肢供血不足,运动后疼痛而致运动量减少有关。由此推测2型糖尿病患者下肢血管病变发生与骨量减少、骨质疏松具有密切关系,常常共存。而低下肢的骨密度在一定程度上较腰椎更能预测患者下肢血管病变,这也与近年来国内外研究部分一致[9]。
近年来研究还发现25(OH)D除了调节钙磷、影响骨代谢外,还具有调节免疫,调控细胞增殖、分化、凋亡及维持组织对胰岛素的敏感性等作用,与糖尿病发病及血糖控制也密切相关[10]。研究发现T2DM及其血管并发症患者常常存在维生素D的缺乏或不足,推测维生素D水平下降可能从多方面影响血管病变的发生、发展,但目前维生素D与动脉粥样硬化的关系尚存在争议。本研究显示,T2DM患者PAD组血清25(OH)D水平明显低于NPAD组(P<0.05),ABI与25(OH)D水平呈正相关,多因素 Logistic回归显示,血清25(OH)D水平降低是T2DM患者下肢血管病变发生的独立危险因素之一。国内外多项研究也支持维生素D缺乏与下肢血管病变密切相关[11-12]。此外,本研究还发现ABI与年龄、糖尿病病程、SBP、TC、LDL-C、HbA1C呈负相关(P<0.05),且HAb1C、TC、SBP最终进入回归方程,T2DM患者糖脂代谢紊乱,高收缩压以及25(OH)D、BMD水平下降,均为T2DM下肢血管病变的危险因素。低水平25(OH)D和低下肢BMD参与下肢血管病变可能的机制是:一方面,T2DM患者长期高血糖状态导致渗透性利尿,钙磷平衡遭到破坏,骨量大量丢失,钙离子沉积在血管和心瓣膜等处,引起内皮细胞损害,促进血管的钙化[13];另一方面,高血糖会抑制25(OH)D的合成和释放,而维生素D缺乏除了通过刺激血中甲状旁腺激素升高,激活成骨细胞,并刺激前破骨细胞分化为成熟的破骨细胞,促进骨胶原的降解,而致使骨量丢失外[14],还可通过影响糖脂代谢、炎性反应、凝血功能,促进平滑肌细胞的增殖、钙化,加速动脉斑块的形成[10,15]。
综上所述,糖脂代谢紊乱可能导致血清25(OH)D水平降低以及骨量的丢失,导致下肢血管动脉斑块的形成,而下肢血管病变会导致骨的血供减少影响骨重建,进而加重骨质疏松并形成恶性循环。因此,积极纠正糖脂代谢紊乱,并积极补充维生素D,早期进行ABI、BMD的联合检查可能可以尽早发现并打破这一恶性循环,但其具体作用途径尚待进一步研究探索。

