MicroRNA-221(miR-221)抑制p27 Kip1蛋白促进慢性粒细胞白血病的发生
秦 娜 李广波 郭树霞 张晓娟
(1.郑州人民医院血液内科,郑州 450003; 2.郑州市儿童医院肾脏风湿科,郑州 450003)
MicroRNA-221(miR-221)抑制p27Kip1蛋白促进慢性粒细胞白血病的发生
秦 娜1*李广波2郭树霞1张晓娟1
(1.郑州人民医院血液内科,郑州 450003; 2.郑州市儿童医院肾脏风湿科,郑州 450003)
目的 探讨microRNA-221(miR-221)与慢性粒细胞白血病(chronic myeloid leuklemia, CML)的相关性及其作用机制。方法 采用荧光实时定量PCR(quantificational real-time polymerase chain reaction,qRT-PCR)法检测35例CML病人与25例对照组病人骨髓中miR-221的表达情况。K562细胞转染miR-221模拟物和miR-221抑制剂48 h,qRT-PCR法检测miR-221的表达。分别用MTT法检测转染后的K562细胞增生能力,利用流式细胞仪检测转染后K562细胞周期和凋亡。利用数据库预测miR-221的调节基因为p27Kip1。qRT-PCR和Western blotting法检测miR-221对p27Kip1的mRNA和蛋白的表达的影响。结果 CML病人组miR-221表达明显高于对照组。转染miR-221抑制剂组K562细胞凋亡比例显著升高,细胞周期阻滞于G2SM期,细胞增生能力明显受到抑制。而miR-221过表达则明显促进了K562细胞的增生和细胞周期进程。抑制miR-221表达后K562细胞中p27Kip1蛋白表达显著升高,而当miR-221过表达后p27Kip1表达也随之明显降低。结论 miR-221在CML病人的骨髓中高表达,并抑制下游p27Kip1蛋白的表达从而促进白血病K562细胞增生,促进细胞进入细胞周期,可能是CML发生、发展的一个潜在靶点。
慢性粒细胞白血病;miR-221;K562细胞;p27Kip1
慢性粒细胞白血病(chronic myeloid leukemia, CML),是造血干细胞异常增生形成的疾病。约占成人白血病的20%,慢性粒细胞白血病在全球范围内的发病率为1~2/10万人。MicroRNAs(miRNAs)是长度约20~24个核苷酸的内源性非编码RNA,通过与靶基因的3′-UTRs相互作用,导致靶 mRNA降解或抑制其翻译,参与基因转录后调控。miRNAs可以表达在多种肿瘤中,调节肿瘤抑制基因或癌基因[1]。先前有研究[2]显示miR-221在急性粒细胞白血病的病人血浆中表达升高,但是miR221在CML病人中的表达及其作用尚少研究。本研究中,为了探讨了miR-221在CML的发生、发展中的作用及其机制,检测了miR-221在CML病人中和骨髓非增生性对照组人群中的表达水平,现报道如下。
1 材料与方法
1.1 样本的收集
本研究以2011年至2016年5年间郑州人民医院血液科及门诊收治的慢性粒细胞白血病病人为研究对象,收集其骨髓样本,其中慢性粒白血病慢性期(CML-CP)21例,慢性粒白血病急性期(CML-BP)14例,男性病人21例(14~45岁),女性病人14例,年龄19~49岁,中位年龄39岁,所有病人的诊断均符合《血液病诊断及疗效标准》第3版[3]中的诊断标准。以同期骨髓非增生性疾病作为对照,包括血小板减少症11例,缺铁性贫血14例,年龄22~66岁,中位年龄42岁。本研究已获得伦理委员会批准,所有病人知情同意。
1.2 荧光实时定量PCR(quantificational real-time polymerase chain reaction,qRT-PCR)法检测miR-221的表达
用人外周血淋巴细胞分离液(天津灏洋生物公司)分离骨髓细胞中单个核细胞,利用Trizol(Invitrogen公司,美国)法提取骨髓单个核细胞中的总RNA,通过检测A260/A280比值来检测RNA质量,选取在1.8~2.0的RNA样本,反转录并利用实时荧光定量PCR(qRT-PCR)检测样本中miR-221的表达情况,Mir-XTMmiRNA反转录试剂盒和Mir-XTMmiRNA qRT-PCR试剂盒均购自于Takara公司,按照说明书指示操作(Takara公司,日本),U6作为内参进行相对定量,U6和has-miR-221由广州锐博公司合成,miR-221上游引物为5′-AGCUACAUUGUCUGCUGGGUUUC-3′, 下游通用引物由试剂盒提供。U6上游引物为5′-CTCGCTT-CGGCAGCACA-3′, 下游引物为5′-AACGC-TTCACGAATTTGCGT-3′。所有的样本做3个重复孔,Real-time PCR-iQ5 检测仪 (Bio-Rad公司,美国)检测,结果用基因表达的变化通过相对CT的方法进行测定。实验结果用倍数变化(fold changes)表示,倍数变化为2-△△CT。
1.3 细胞培养和转染
白血病细胞系K562购自中科院上海药物所细胞库,用含10%(体积分数):胎牛血清的RPMI 1640培养基(Gibco公司,美国),在37 ℃,5%(体积分数)CO2条件下培养。取对数生长期K562细胞以2×105/mL浓度接种到24孔板中,无血清培养基继续培养6 h,转染miR-221 模拟物 (50 nmol/L), 和miR-221抑制剂 (100 nmol/L),以及转入无义序列作为阴性对照(negative control,NC),加入Lipofectamine 2000 (Invitrogen公司, 美国)转染试剂,按试剂盒操作说明进行转染。转染48 h后qRT-PCR检测各组细胞中miR-221的表达情况。miR-221 模拟物(mimics),miR-221抑制剂(inhibitor)和无义序列均购自广州锐博公司,序列设计如下: miR-221 模拟物: 5′-AGC UAC AUU GUC UGC UGG GUUUC-3′; miR-221 抑制剂: 5′-GAA ACC CAG TCT CAA TGT AGC TCC GGA AAC CCA GTC TCA ATG TAGCT-3′;无义序列:5′-UCU ACU CUU UCU AGG AGG UUG UGA-3′。
1.4 MTT检测miR-221对K562细胞增生的影响
取对数生长期K562细胞,将细胞浓度调整为5×104/mL,接种到96孔板中,每个孔接种100 μL,每组5个重复孔,将接种好的细胞置于37 ℃,5%(体积分数)CO2的恒温培养箱中培养。当细胞浓度达到50%左右,每个组细胞分别加入miR-221 mimic,miR-221 inhibitor和无义序列转染,在转染后24, 48, 72 和 96 h时每孔分别加入20 μL MTT(0.005 g/L公司)(上海,碧云天公司),37 ℃ 继续培养4 h,2 000 r/min 离心5 min,去掉上清,每孔加入150 μL DMSO(二甲基亚砜,Sigma公司,美国),轻轻震荡使紫色的甲臢完全溶解。在570 nm 波长下测吸光度值。空白对照调零,并用酶标仪(infinite 200,瑞士Tecan公司)测定570nm波长处吸光度值(A)。
1.5 流式细胞仪检测细胞周期和凋亡
细胞转染miR-221 模拟物(mimics),miR-221抑制剂(inhibitor)和阴性对照48 h,每组收集1×106个细胞,PBS 洗涤2次,弃净上清。细胞周期检测时每个样本加70%(体积分数)乙醇(-20 ℃预冷)固定,置于-20 ℃过夜,然后细胞用预冷的PBS洗2次,RNase(50 μg/mL)(上海励瑞生物科技有限公司)孵育15 min,之后每个样本加(propidium iodide,PI) (50 μg/mL) 孵育30 min。染色后的细胞用流式细胞仪检测(Arial, 美国BD公司,)。细胞凋亡实验按照凋亡检测试剂盒说明书操作(BD公司,美国),每组收集l×106个细胞,PBS 洗涤2次,弃净上清,进行细胞凋亡检测,每组加100 μL binding buffer重悬细胞,加入Annexin与PI 各5 μL,轻轻打匀,避光室温放置15 min,加入1 mL的binding buffer洗涤1次,1 400 r/min,400 g,5 min。洗涤后加入400 μL binding buffer后流式细胞仪检测平均荧光强度。
1.6 荧光实时定量PCR(qRT-PCR)法检测p27Kip1的表达
两步法RT-PCR专用试剂盒PrimeScriptTMRT reagent Kit(RR037A)购自于Takara(Takara公司,日本),按照说明书指示操作。p27Kip1上游引物:5′-GACTTGGAGAAGCACTGCAGAGA-3′;下游引物:5′-TGCCACTCGTACTTGCCCTC-3′。GAPDH为内参,上游引物:5′-CTTAGCACCCCTGGCCAAG-3′;下游引物: 5′-GATGTTCTGGAGAGCCCCG-3′。所有的样本做3个重复孔,Real-time PCR-iQ5 检测仪 (Bio-Rad公司,美国)检测,结果用基因表达的变化通过相对CT的方法进行测定。实验结果用倍数变化(fold changes)表示,位数变化为2-△△CT。
1.7 Western blotting 法检测p27Kip1蛋白的表达
细胞转染miR-221 模拟物(mimics),miR-221抑制剂(inhibitor)和阴性对照48 h,每组收集1×106个细胞,PBS 洗涤2次,弃上清。加入300 μL裂解液,静置5 min后收集细胞,4 ℃ 12 000 r/min离心10 min,取上清液,采用考马斯亮蓝(上海美吉生物医药有限公司)测定总蛋白浓度。取40 μg蛋白质进行聚丙烯酰胺凝胶电泳,蛋白质转运至PVDF膜,5%(质量分数)脱脂奶粉封闭非特异性抗原,1∶200稀释的抗p27Kip1单克隆抗体,1∶200稀释的山羊抗人β-actin作为阳性对照。4 ℃过夜,用含0.1%(体积分数) Tween 20的TBS洗膜后,加入辣根过氧物酶体标记的第二抗体,37 ℃作用1 h,洗膜后DAB显色。条带结果进行吸光度值分析,将p27Kip1与β-actin比值作为蛋白质表达水平的参数。
1.8 统计学方法
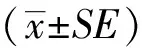
2 结果
2.1 miR-221在CML病人中的表达显著升高
qRT-PCR法测定miR-221在对照病人和CML病人中的含量,CML病人骨髓中的miR-221的mRNA水平显著高于对照组(4.667±1.169vs1.183±0.730,P<0.05)(图1)。
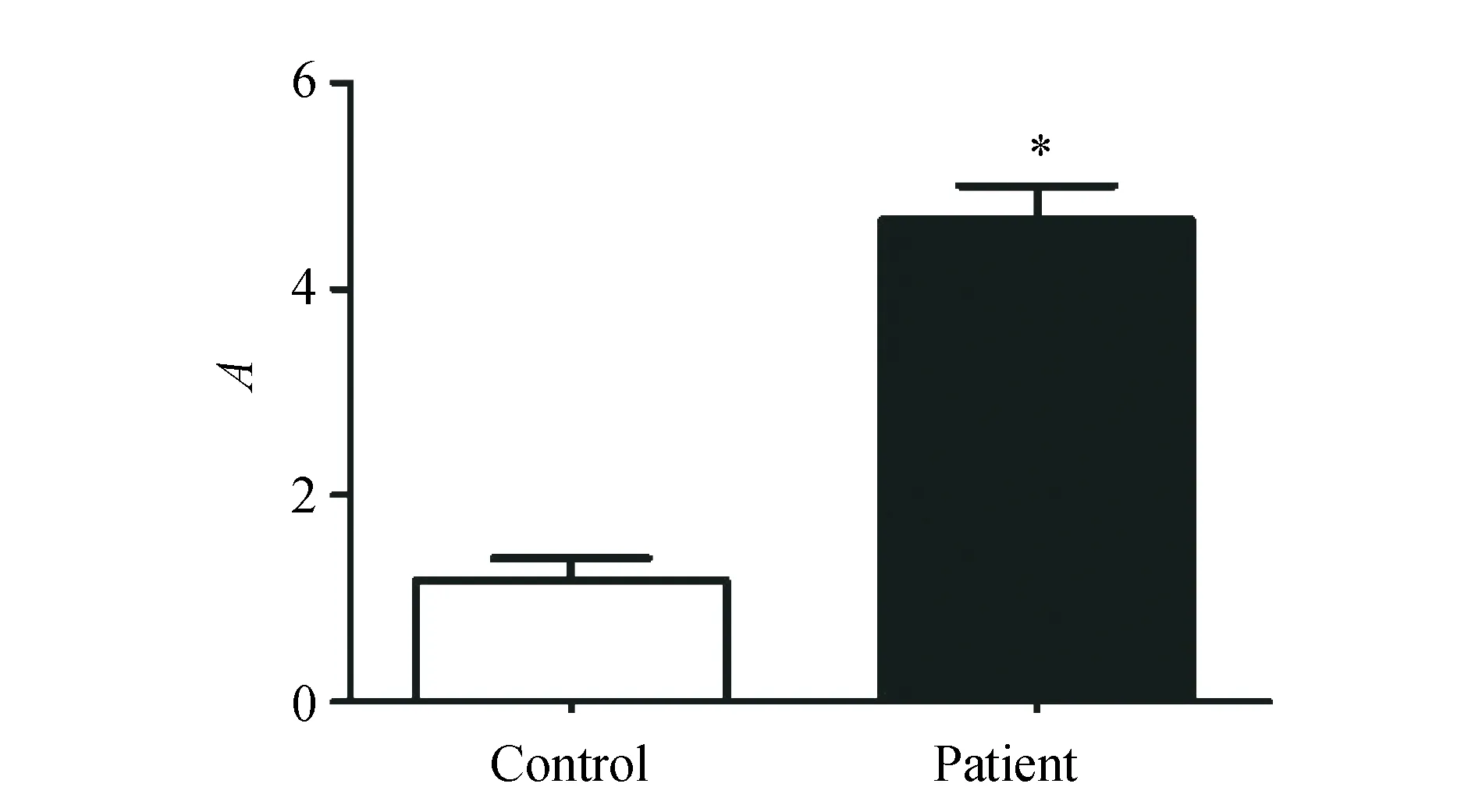
图1 miR-221在慢性粒细胞白血病的骨髓细胞中表达增加
*P<0.05vsControl group; miR-221 was detected by qRT-PCR in control group (n=25) and CML patients (n=35). The results were showed as mean ± SE; CML: chronic myeloid leukemia.
2.2 K562细胞转染后miR-221的表达显著增加
细胞转染miR-221 模拟物(mimics)和miR-221抑制剂(inhibitor)48 h后,转染无义序列的为阴性对照组。Trizol法提取细胞RNA,进行反转录并检测荧光定量PCR,结果利用Prism 软件进行单因素方差分析(one-way AVOVA)和Tukey多重比较法(Tukey’s Multiple Comparison Test)进行分析,结果显示,K562细胞转染miR-221模拟物的miR-221表达水平高于miR-221抑制剂组和阴性对照组(587.000±5.598vs0.240±0.040,P<0.05; 587.000±5.598vs1.000±0.001,P<0.05)(图2)。
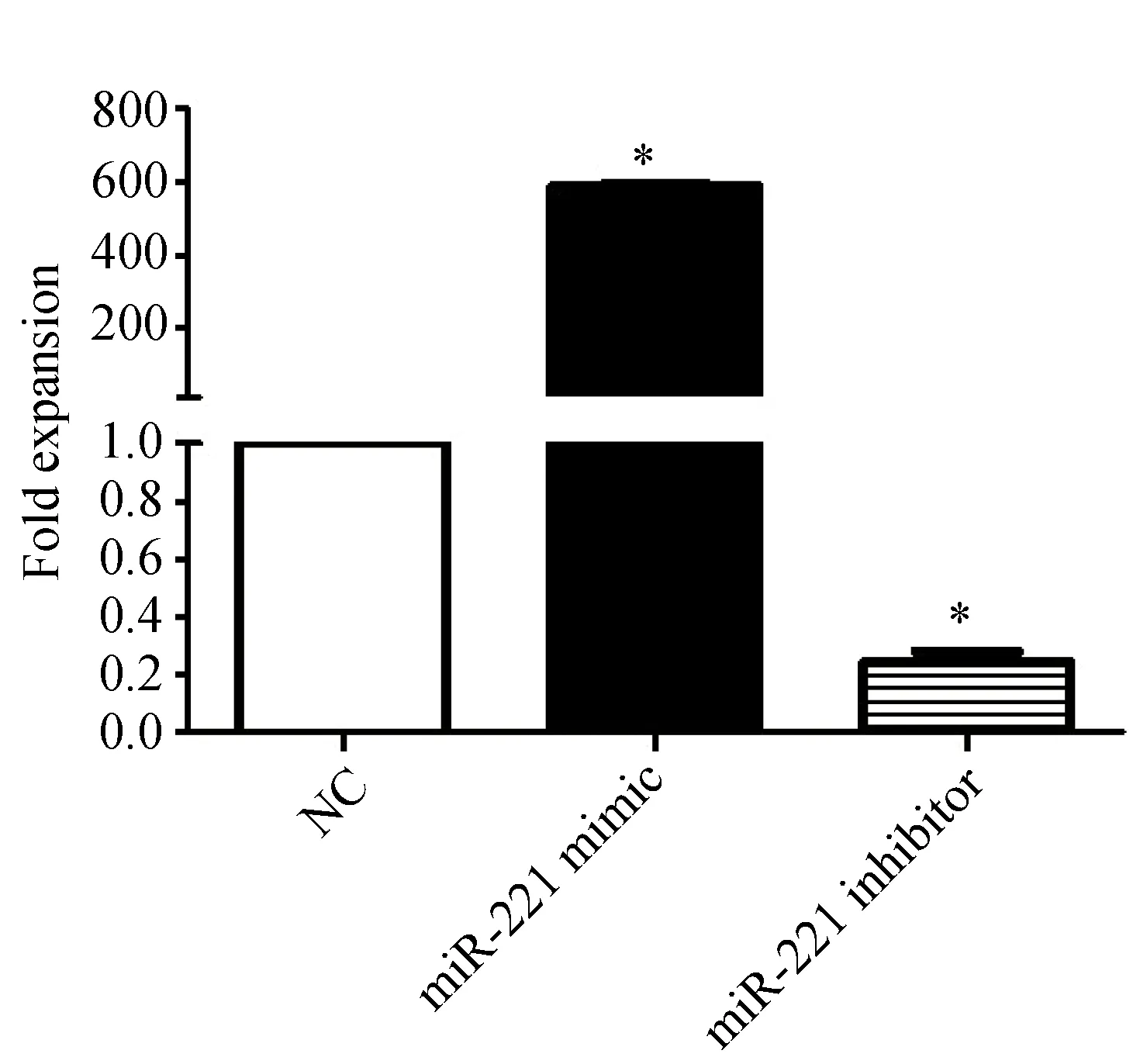
图2 miR-221在转染K562细胞中的表达
K562 cells were transfected with miR-221 inhibitor, mimic and negative control for 48 h, miR-221 expression was detected by QRT-PCR. Expression depicted as mean ± SE of experiments performed in triplicate.n=3,*P<0.05vsNC; NC: negative control.
2.3 miR-221表达抑制K562细胞凋亡和诱导细胞进入细胞周期
K562细胞转染48h后,流式细胞仪检测miR-221模拟物组,miR-221抑制剂组和阴性对照组细胞的凋亡和细胞周期,与阴性对照组相比,转染miR-221抑制剂的K562细胞凋亡率显著增加(20.570±2.103vs43.570±4.412,P<0.05),而结果转染miR-221模拟物的K562细胞凋亡率则明显降低,差异有统计学意义(20.570±2.103vs9.857±1.883, P<0.05),miR-221的过表达抑制了细胞凋亡。细胞周期结果显示,与阴性对照组和转染了miR-221模拟物组比较,转染miR-221抑制剂的K562细胞G0G1期比例显著升高(79.830±3.514vs63.870±2.503,P<0.05;79.830±3.514vs53.470±2.732,P<0.05),G2SM期细胞显著降低(18.570±0.908vs34.750±1.021,P<0.05;18.570±0.908vs42.870±1.007,P<0.05),miR-221表达增加促进了细胞由G1期向G2SM期转化,而抑制miR-221的表达则产生细胞周期阻滞(图3)。
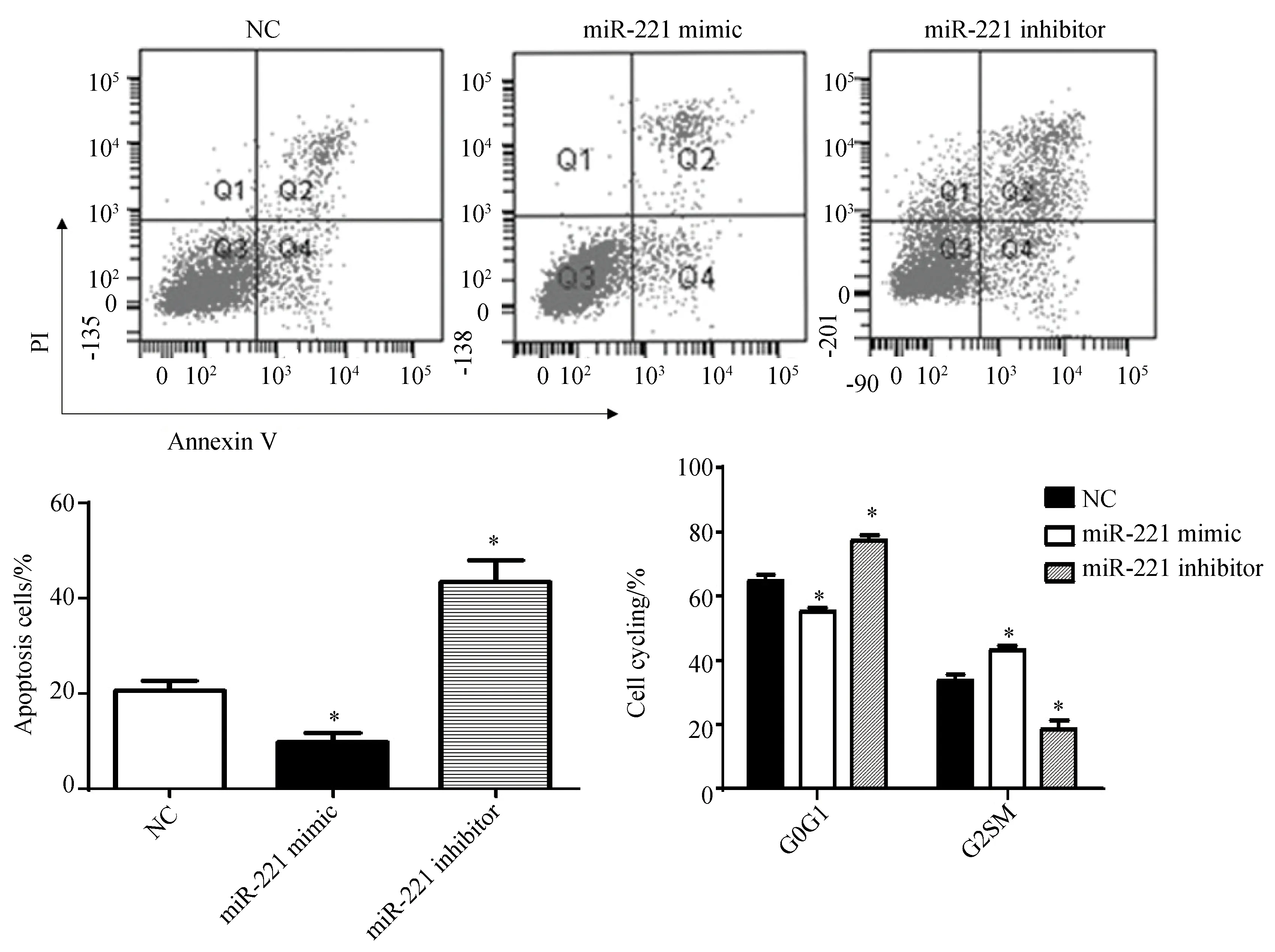
图3 miR-221过表达抑制K562细胞凋亡和促进细胞进入细胞周期
A: a representative gating strategy for apoptosis was analyzed by flow cytometry; B: The frequency of the apoptosis cells in miR-221 mimic, miR-221 inhibitor transfected group and NC group. C: The frequency of the cells in G0G1 phase or in G2SM phase. Expression depicted as mean ± SE,n=5,*P<0.05vsNC;NC:negative control.
2.4 miR-221增加K562细胞增生力
细细胞转染miR-221模拟物(mimics)和miR-221抑制剂(inhibitor)48 h后,转染无义序列的为阴性对照组。在24、48、72、96 h后MTT法分别测定细胞的增生情况,结果显示,在转染48,72,96h后,转染miR-221模拟物K562细胞与阴性对照相比,增生能力明显增加(0.602±0.017vs0.720±0.007,P<0.05),而抑制miR-221表达后,与阴性对照组相比K562细胞增生能力即受到了抑制(0.602±0.017vs0.456±0.015,P<0.05)(图4)。
2.5 miR-221抑制K562细胞p27Kip1蛋白的表达
收集转染后的细胞,在mRNA和蛋白水平检测miR-221过表达或抑制后p27Kip1的表达变化。过表达miR-221和抑制miR-221的表达对p27Kip1的mRNA影响差异无统计学意义(P>0.05, 图5A),而miR-221高表达的K562细胞,p27Kip1蛋白水平明显降低。而抑制了miR-221表达的细胞p27Kip1蛋白水平则明显增加。

图4 miR-221过表达促进K562细胞增生
A: absorbance; NC:negative control; K562 cells were transfected with miR-221 inhibitor, mimic and negative control for 24, 48, 72 and 96 h, and the cell viability was measured by MTT Assay.*P<0.05vsnegative control at the same time point.
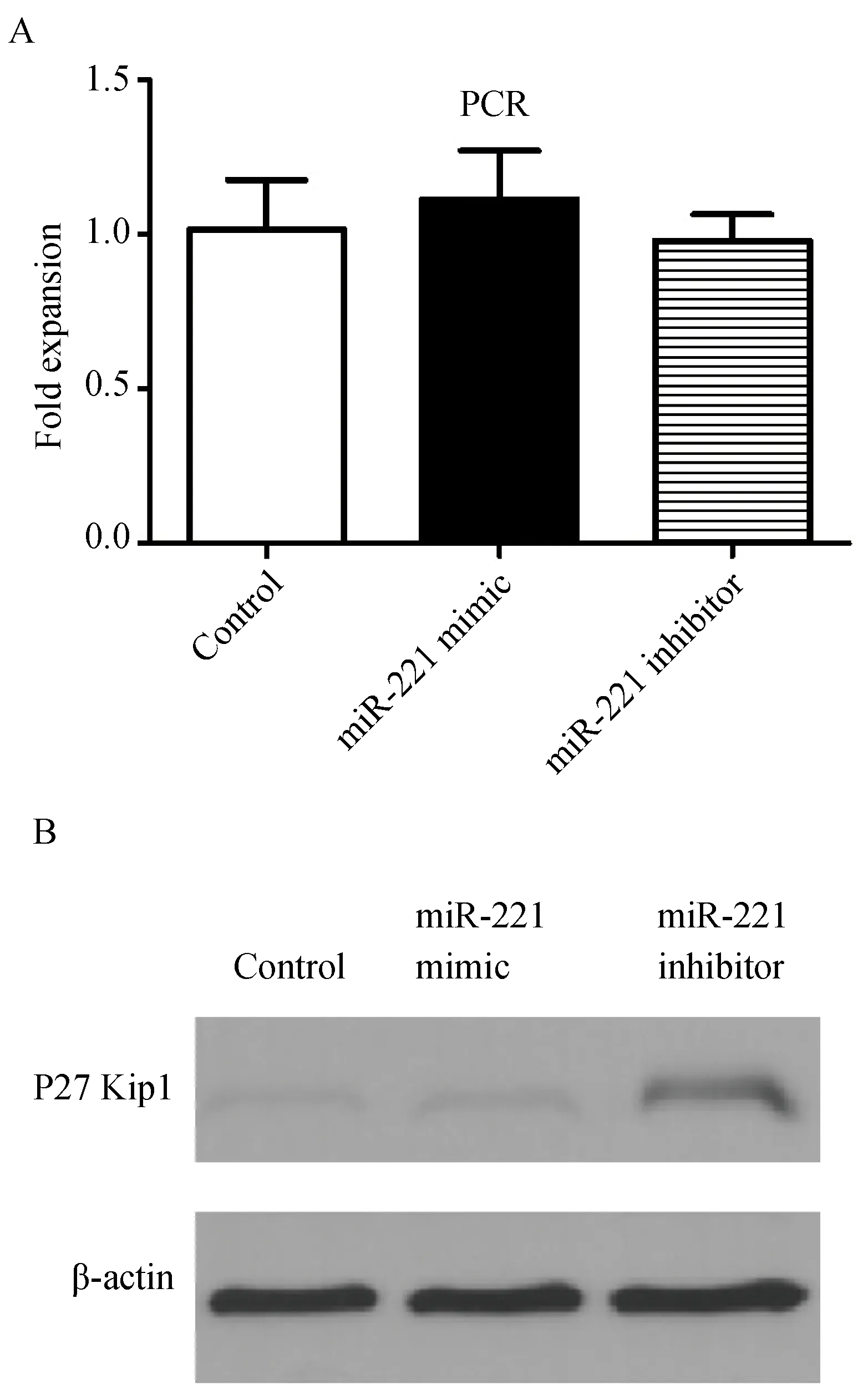
图5 miR-221过表达对p27Kip1表达的影响
p27Kip1expression was detected by qRT-PCR (A) and Western blotting (B). Expression depicted as mean ± SE,n=3, *P<0.05vsControl group; qRT-PCR:quantificational real-time polymerase chain reaction.
3 讨论
有研究[4]显示miR-221的作用类似癌基因,在多种癌症中表达上调,包括肝癌、前列腺腺癌、结直肠癌等,可以促进细胞的增生,增加癌细胞转移和侵袭能力。本研究的实验结果显示,CML病人骨髓样本中miR-221表达水平显著高于对照组人群,先前的研究显示,miR-221在多种实体肿瘤中表达增加并促进癌细胞的生长,包括胶质母细胞瘤、肝癌、胰腺癌细胞等,提示miR-221可能是一个促癌基因,在CML发生、发展中起到重要作用。Rong等[5]报道miR-221在原发性肝细胞癌组织中表达升高,并促进肝癌细胞生长和抑制细胞凋亡。本研究利用白血病细胞系K562,细胞转染miR-221模拟物(mimic)和miR-221抑制剂(inhibitor)使miR-221在细胞系中表达增加或降低,实验结果显示,miR-221模拟物(mimics)组的K562细胞miR-221表达水平显著高于miR-221抑制剂组和转染阴性对照组,转染miR-221抑制剂组K562细胞细胞凋亡比例显著升高,细胞周期阻滞于G2SM期,细胞增生能力明显受到抑制。而转染了miR-221模拟物的K562细胞则明显促进了K562细胞的增生,促进细胞周期从G1期向S期转化。实验结果表明miRNA-221的过表达对白血病细胞系有明显的促进作用,提示其影响CML的病人病程发展。
p27Kip1基因是Cip/Kip 细胞周期蛋白依赖性激酶抑制物(cyclin-dependent kinase inhibitors,CKI)家族中的一员,它可以通过与CDK2和cyclin结合阻止细胞通过G1/S期从而抑制细胞增生。p27Kip1可以作为一个肿瘤抑制因子在慢性粒细胞白血病中也有广泛报道。先前的研究[6]显示,在慢性粒细胞白血病中,BCR-ABL融合蛋白通过磷脂酰肌醇3-激酶(phosphatidyl inositol 3-kinase, PI3K)途径诱导Skp2的表达,促进蛋白酶降解泛素化的p27Kip1,降低p27Kip1表达,从而促进了慢性粒细胞白血病的发生、发展。p27Kip1也是格列卫作用于CML的一个重要靶点[7],促进细胞周期阻滞,降低癌症细胞存活。近年来也有研究[8]显示BCR-ABL1也可以通过改变p27Kip1在细胞中的分布,使其从细胞核中转移到细胞质中,很可能是Bcr-Ab1酪氨酸激酶抑制剂在临床上耐药性的一个重要机制。本研究利用生物信息学手段预测miR-221的下游靶基因,发现其中p27Kip1在肿瘤及CML中有广泛研究,预测miR-221很可能是通过调节下游p27Kip1从而促进K562细胞的增生和进入细胞周期。实验结果显示,过表达miR-221和抑制miR-221的表达对p27Kip1的mRNA影响差异无统计学意义(P>0.05, 图5A),说明了miR-221并不在转录水平调节p27Kip1的表达,随后的Western blotting法分析证实,转染了miR-221的K562细胞中p27Kip1蛋白水平显著下调,而抑制miR-221的表达则会促进p27Kip1的表达,进一步提示p27Kip1是miR-221的一个重要的下游调节蛋白,miR-221对p27Kip1的调节是在转录后水平发生。
CML疾病由复杂的网络调控机制调节,研究[9]显示,miR-221可以通过p53-puma途径调节细胞的凋亡。miR-221还可以通过激活核转录因子κB(nuclear factor kappa-light-chain-enhancer of activated B cells,NFκB)或PTEN/Akt 信号通路促进肿瘤细胞的增生和侵袭[10]。先前的研究显示,肿瘤中MAPK信号通路级联反应是一个重要的机制。在慢性粒细胞白血病中,BCR-ABL融合蛋白酪氨酸177磷酸化,进一步促进RAF激酶的激活。激活Raf通过丝苏氨酸激酶MEK1和MEK2和细胞外信号调节激酶(MAPK)启动信号级联反应,最终导致基因转录的激活[11]。miRNA 通过结合互补的靶基因的3′非编码区序列,从而调节蛋白的表达,有效地控制信号转导过程。前期的研究中显示miR-221在MAPK信号通路转导过程起到重要作用[11]。可见miR-221调节CML的发生,还可能通过其他的机制,需要更多地探索。
在本项研究中,结果提示miR-221可能作为慢性粒细胞白血病的促癌分子,miR-221在慢性粒细胞白血病病人的骨髓中表达明显升高,提示了miR-221对慢性粒细胞白血病具有促进作用。K562细胞中过表达miR-221,可以促进细胞增生,抑制凋亡,促进细胞进入细胞周期,而抑制了miR-221的表达后则可以抑制细胞增生,促进凋亡和诱导细胞周期阻滞,miR-221对白血病细胞的促进作用很可能是通过转录后水平调节下游p27Kip1的表达,从而影响慢性粒细胞白血病的发展。
[1] Eichelser C, Stückrath I, Müller V, et al. Increased serum levels of circulating exosomal microRNA-373 in receptor-negative breast cancer patients[J]. Oncotarget, 2014. 5(20): 9650-9663.
[2] Rommer A, Steinleitner K, Hackl H, et al. Overexpression of primary microRNA 221/222 in acute myeloid leukemia[J]. BMC Cancer, 2013. 13(1): 1-12.
[3] 张之南, 沈悌, 血液病诊断及疗效标准[M]. 北京: 科学出版社,2007.
[4] Grimmler M, Wang Y, Mund T, et al. Cdk-inhibitory activity and stability of p27Kip1are directly regulated by oncogenic tyrosine kinases[J]. Cell, 2007,128(2): 269-280.
[5] Rong M, Chen G, Dang Y. Increased miR-221 expression in hepatocellular carcinoma tissues and its role in enhancing cell growth and inhibiting apoptosis in vitro[J]. BMC Cancer, 2013,13(1): 21.
[6] Andreu E J, Lledó E, Poch E, et al. BCR-ABL induces the expression of Skp2 through the PI3K pathway to promote p27Kip1degradation and proliferation of chronic myelogenous leukemia cells[J]. Cancer Res, 2005,65(8): 3264-3272.
[7] Gómezcasares M T, Garcíaalegria E, Lópezjorge C E, et al. MYC antagonizes the differentiation induced by imatinib in chronic myeloid leukemia cells through downregulation of p27Kip1[J]. Oncogene, 2013,32(17): 2239-2246.
[8] Agarwal A, Mackenzie R J, Besson A, et al. BCR-ABL1 promotes leukemia by converting p27 into a cytoplasmic oncoprotein[J]. Blood, 2014, 124(22): 3260.
[9] Zhang C Z, Zhang J X, Zhang A L, et al. MiR-221 and miR-222 target PUMA to induce cell survival in glioblastoma[J]. Mol Cancer, 2010,9(1): 229.
[10]Liu Z C, Wang X, Jiao, et al. miR-221 promotes growth and invasion of hepatocellular carcinoma cells by constitutive activation of NFκB[J]. Am J Translat Res, 2016,8(11): 4764.
[11]Chakraborty C, Sharma A R, Patra B C, et al. MicroRNAs mediated regulation of MAPK signaling pathways in chronic myeloid leukemia[J]. Oncotarget, 2016,7(27):42683-42697.
编辑 慕 萌
Expression of microRNA-221 in chronic myeloid leukemia and its mechanism
Qin Na1*, Li Guangbo2, Guo shuxia1, Zhang Xiaojuan1
(1.DepartmentofHematology,People’sHospitalofZhengzhou,Zhengzhou450003,China; 2.DepartmentofRheumatismandRenalDisease,Children’sHospitalofZhengzhou,Zhengzhou450003,China)
Objective MicroRNAs (miRNAs, miRs) have emerged as critical regulators of tumor cell proliferation. This paper is to investigate how miR-221 is involved in the process of chronic myeloid leukemia (CML) and its working mechanisms.Methods Quantificational real-time polymerase chain reaction,qRT (qRT-PCR) was used to measure the expression of miR-221 in CML patients and control patients. K562 cells were transfected with miR-221 mimics, inhibitors, or negative controls. MTT assay was used to determine cell viability. Flow cytometry was used to measure the cell apoptosis and cell cycle. Bioinformatics was used to predict the target gene of miR-221, the qRT-PCR and Western blot were used to determine the expression of p27Kip1expression. Results The expression of miR-221 was increased significantly in the bone marrow cells in CML patients compared with control patients. Overexpression the miR-221 significantly increased cell vitality and promoted cell proliferation and G1-to-S phase transition of the cell cycle in K562 cells, while inhibition of miR-221 rescued the results.p27Kip1is the important target gene regulated by miR-221, the inhibition of the miR-221 promoted the p27Kip1expression, while miR-221 overexpression decreased thep27Kip1expression. Conclusion Our study suggested that miR-221 may be an oncogenic miRNA by inhibiting the protein expression of p27Kip1in CML.
chronic myeloid leukemia;miR-221;K562 cells; p27Kip1
时间:2017-07-16 17∶16 网络出版地址:http://kns.cnki.net/kcms/detail/11.3662.r.20170716.1716.012.html
10.3969/j.issn.1006-7795.2017.04.018]
R733.7
2017-02-17)
*Corresponding author, E-mail:qinna518@163.com

