人外周血单个核细胞体外重编程为少突胶质前体细胞研究
唐玺和 李 默 王淑艳 李鹏燕 张 愚 陈志国* 陈 惠
(1. 中国康复医学研究所,北京 100053; 2. 首都医科大学宣武医院细胞治疗室,北京 100053;3. 北京脑重大疾病研究院神经损伤和修复所,北京 100053; 4. 北京神经损伤和康复重点实验室,北京 100053)
人外周血单个核细胞体外重编程为少突胶质前体细胞研究
唐玺和1,2,3,4李 默2,3王淑艳2,3李鹏燕2,3张 愚2,3陈志国2,3*陈 惠1,3,4*
(1. 中国康复医学研究所,北京 100053; 2. 首都医科大学宣武医院细胞治疗室,北京 100053;3. 北京脑重大疾病研究院神经损伤和修复所,北京 100053; 4. 北京神经损伤和康复重点实验室,北京 100053)
目的 利用非整合质粒载体在体外将成人外周血中单个核细胞重编程为少突胶质前体细胞(oligodendrocyte progenitor cells, OPCs)。方法 经外周静脉采集志愿者血液5 mL,利用Ficoll-Paquem密度梯度离心法获得单个核细胞,体外扩增培养后,电转染携带外源基因(OCT4,SOX2,KLF4,C-myc,LIN28,Nanog)的质粒,然后在加有化学小分子的特定培养基中分三步培养。结果 转染后30 d左右,可以获得血小板衍生生长因子受体α(platelet-derived growth factor receptor-α, PDGFR-α)阳性的早期少突胶质前体细胞(Pre-OPC),该细胞能传20 代以上,继续分化30 d左右可以获得表达O4的少突胶质前体细胞。结论 利用非整合质粒载体携带外源基因可以将成人外周血单个核细胞在较短期时间内重编程为具有增生能力的早期少突胶质前体细胞,且能继续分化为少突胶质前体细胞。
外周血单个核细胞;重编程;少突胶质前体细胞
中枢神经系统少突胶质细胞损伤及脱髓鞘疾病,如多发性硬化、脊髓损伤等可以发生在婴儿及成人。脱髓鞘发生后将直接导致神经信号传导功能障碍及神经元凋亡,其致残率及致死率极高[1]。内源性少突胶质细胞再生或者移植外源少突胶质细胞进行髓鞘重建是可选的治疗方法,已有实验[2]证明内源性少突胶质细胞的再生能力及髓鞘重建能力有限,而移植外源的少突胶质前体细胞(oligodendrocyte progenitor cells, OPCs)能在小鼠体内形成髓鞘[3-4],因此,移植外源少突胶质细胞治疗脱髓鞘性疾病成为近年研究的热点,而如何获得有功能的可用于移植的人少突胶质前体细胞成为该研究的核心。
从流产胎脑中获取少突胶质前体细胞不但受伦理限制,而且获取的细胞量有限。2007年,Tatahashi等[5]将人皮肤成纤维细胞重编程为多能干细胞(induced pluripotent stem cells, iPSCs)使得自体细胞移植成为可能。目前,将iPSCs成功分化为少突胶质细胞已经实现[6-8],但是,经由iPSCs获取少突胶质前体细胞的周期较长,均在3个月以上,不利于临床应用;获取人成纤维细胞创伤性较大,有合并感染风险,病人不易接受。
本研究将利用非整合质粒载体携带外源基因及化学小分子将人外周血单个核细胞重编程为少突胶质前体细胞,缩短了诱导周期,该方法是一种无创,快捷的获取少突胶质前体细胞的方法。
1 材料与方法
1.1 外周血单个核细胞的获取及扩增
本研究已获得首都医科大学宣武医院伦理委员会批准。室温下,采集成人志愿者外周静脉血5 mL储存在含有肝素的抗凝管中,上下颠倒混匀5次。按1∶2使用PBS稀释,存放在50 mL离心管中,稀释后血液用PBS补足至35 mL。另取50 mL离心管盛15 mL Ficoll-Paque Premium,然后倾斜45°,将稀释的血液缓慢流入到盛Ficoll-Paque Premium管中。25 ℃,离心30 min,离心速度为750 g,离心时,离心机制动需关闭。 离心后在离心管中上层为血浆样物,中间云雾状细胞即为所需要的单个核细胞层。用巴斯特管吸去上层,然后使用移液管将中间的云雾状细胞层移至另外50 mL离心管中。在获得的细胞层中加入30 mL PBS,350 g,4 ℃,离心10 min,此时离心机制动要打开。吸去上清,将细胞重悬在25 mL PBS中。4 ℃,300 g,离心10 min。吸去上清,将细胞重悬在25 mL PBS中。4 ℃,300 g,离心10 min。去上清,将细胞重悬在5 mL PBS中,计数。继续在单个核细胞培养基中扩增,具体步骤如下:转染当日计为Day-0,采血当日为Day-14,Day-14将离心所得的单个核细胞以2×106/mL重悬在单个核细胞培养基中,37 ℃,5%(体积分数)CO2孵育2 d。Day-11收集细胞,离心,200 g,去上清,将细胞按1×106/mL重悬在单个核细胞培养基中,孵育3 d。 Day-8收集细胞,离心,200 g,去上清,将细胞按1×106/mL重悬在单个核细胞培养基中,孵箱中孵育4 d。Day-4收集细胞,离心,200 g,去上清,将细胞按1×106/mL 重悬在单个核细胞培养基中,孵育4 d。此时,单个核细胞数量略增加,细胞体积较前增大。
1.2 试剂
质粒oriP/EBNA-1购买于美国Addgenes公司;Ficoll-Paque Premium购自美国GE公司;Human CD34 + cell nucleofection kit购自瑞士Lonzawc ngk 公司。
1.3 仪器
肝素抗凝采血管购买自BD公司;可控制温度的高速离心机购自美国Beckman Coulter;50 mL离心管,6孔板,12孔板均购买自美国Corning公司;细胞计数板购自美国Invitroge公司;液氮冻存罐购自美国Thermo Fisher公司;细胞电转仪购自瑞士Amaxa/Lonza公司;激光共聚焦显微镜购自德国Lecias公司;倒置显微镜 Nikon TS100/100-F购自日本Nikon公司。
1.4 培养基配制
单个核细胞扩增培养基配制方法参见文献[9]。
1)第一阶段诱导培养基:DMEM/F12 48%,Neural basal 48%, N2 1%,B27 1% Glutamine 1%, 非必须氨基酸(non-essential amino acid, NEAA)1%,重组人白血病抑制因子(leukemia inhibitory factor, LIF)10 μg/L 购自美国Millpore公司;SB431542 2 μmol/L及CHIR99021 3 μmol/L 购自美国 Geneoperation公司。
2)第二阶段培养基:DMEM/F12 48%,Neural basal 48%, N2 1%,B27 1%,Glutamine 1%, NEAA 1%,SAG1 1 μmol/L 购自美国Enzo公司,重组人血小板衍生长因子AB(recombinant human platelet-derived growth factor-AB,PDGF-AB) 20ng/mL 购自Peprotech公司,反维甲酸(retinoic acid, RA) 1μmol/L 购自Sigma-Aldrich公司,bFGF10 μg/L。
3)第三阶段培养基:DMEM/F12 48%,Neural basal 48%,N2 1%,B27 1%,Glutamine 1%, NEAA 1%,T3 60 ng/mL 购自Sigma-Aldrich公司,cAMP 1 mmol/L,购自Sigma-Aldrich,SAG1 1 μmol/L,PDGF-AB 20 ng/mL。
1.5 外周血单个核细胞转染及少突胶质前体细胞诱导
收集扩增后的单个核细胞,将2×106单个核细胞重悬在5 mL PBS中,室温,离心5 min,200 g,去上清后重悬在100 μL的人CD34+细胞转染液。在以上混合液中加入3种质粒,每种质粒各2 μg。使用LONZA试剂盒中配的移液管将以上混合液转移至电转染杯中。将电转杯放置在电转仪中,使用T-160程序。电转程序结束后,使用LONZA试剂盒配的移液管将电转后的悬液移至事先在12孔板的1个孔中放置的2 mL单个核细胞培养基中,放置在孵箱中37 ℃,5%(体积分数)CO22 d。之后在诱导第一阶段培养基中培养至克隆出现后10 d左右。紧接着使用第二阶段诱导培养2周,取部分细胞染色鉴定;第三阶段培养基培养4周。
1.6 免疫组织化学染色
吸去细胞培养基,使用PBS洗3遍,冰冷的 4%(质量分数) 多聚甲醛固定 10 min,洗涤后用 0.03%(质量分数)Triton-X100破膜3次,每次5 min,室温下用 3%(体积分数)驴血清室温封闭 1 h 后,然后加入相应的第一抗体:兔源抗Ki-67 ( 1∶500,美国Millipore公司) 、小鼠源抗 O1 ( 1∶300,美国Ebioscience 公司) 、小鼠源抗 O4 ( 1∶200,美国Stanta Cruz 公司),兔源性抗PDGFR-α( 1∶200,美国Stanta Cruz 公司) 、小鼠源性抗 A2B5( 1∶200,美国Abcam 公司),兔源性抗GFAP(1∶500,美国 Dako公司)4 ℃ 过夜。PBS 清洗 3 次后,然后加入 Alexa Fluor 488 (绿)标记的驴抗兔 IgG( 1∶1 000,美国Invitrogen公司), Alexa Fluor 488 (绿)标记的驴抗小鼠 IgM ( 1∶1 000,美国Invitrogen公司 ),Alexa Fluor 594 (红)标记的驴抗小鼠IgG( 1∶ 800,美国Invitrogen公司 ), Alexa Fluor 594 (红)标记的驴抗小鼠IgM( 1∶ 800,美国Invitrogen公司 ),Alexa Fluor 647标记的驴抗兔IgG( 1∶ 800,美国Invitrogen 公司)的第二抗体,室温避光孵育2 h,然后加入 DAPI( 0.5 mg/L) 进行细胞核染色,室温避光孵育20 min,洗涤后以50%(体积分数)甘油溶液封片。
1.7 统计学方法

2 结果
2.1 转染后30 d内获得早期少突胶质前体细胞(Pre-OPCs)
外周血单个核细胞在体外扩增2周后形态均一(图1A、B),转染后第10 天,可以获得成团聚集的细胞(图1C),该细胞可以继续扩增,在转染20 d左右,更换为第二阶段培养基,继续培养2周左右,光镜下可见多个突起的细胞(图1D),进行免疫组织化学染色,可见PDGFR-α和A2B5阳性的细胞(图1E、F)。此时,PDGFR-α阳性细胞数比例为(26.2±2.7)%和A2B5阳性细胞数比例为(5.5±2.5)%(图1G)。
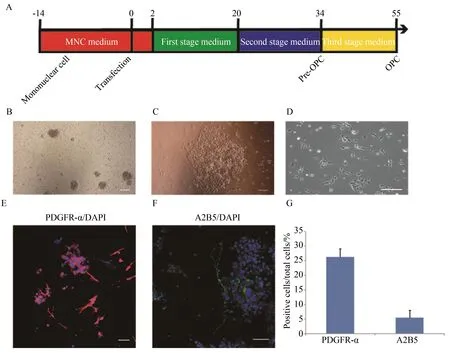
图1 将人外周血单个核细胞重编程为早期少突胶质前体细胞
A:schematic drawing of Pre-OPC generation procedure;B:adult human peripheral blood mononuclear cells were cultured for 14 days before transfection;C:a compacted colony appeared 10 days after transfection;D: Pre-OPC appeared 30 days after transfection;E: Pre-OPC express PDGFR-α;F: Pre-OPC express A2B5;G:percentage of PDGFR-α positive cells and A2b5 positive cells;Scale bars: 50 μm; OPCs:oligodendrocyte progenitor cells;PDGFR-α: platelet-derived growth factor receptor-α.
2.2 RA可以促进少突胶质前体细胞形成
在第二阶段培养基中不加RA组作为对照。在第二阶段培养基分化2周后,RA组PDGFR-α阳性的细胞数(21.0±1.5)%较无RA组(3.2±1.4)%明显增多(图2A、B)。
2.3 早期少突胶质细胞可以继续分化为具有增生能力的少突胶质前体细胞
第三阶段分化培养基分化4周后,可见O1阳性的少突胶质前体细胞(图3A~D),除了O1阳性的细胞,还有部分细胞表达GFAP (图3B)。同时部分O4阳性的细胞同时表达ki-67(图3E~H)。
3 讨论
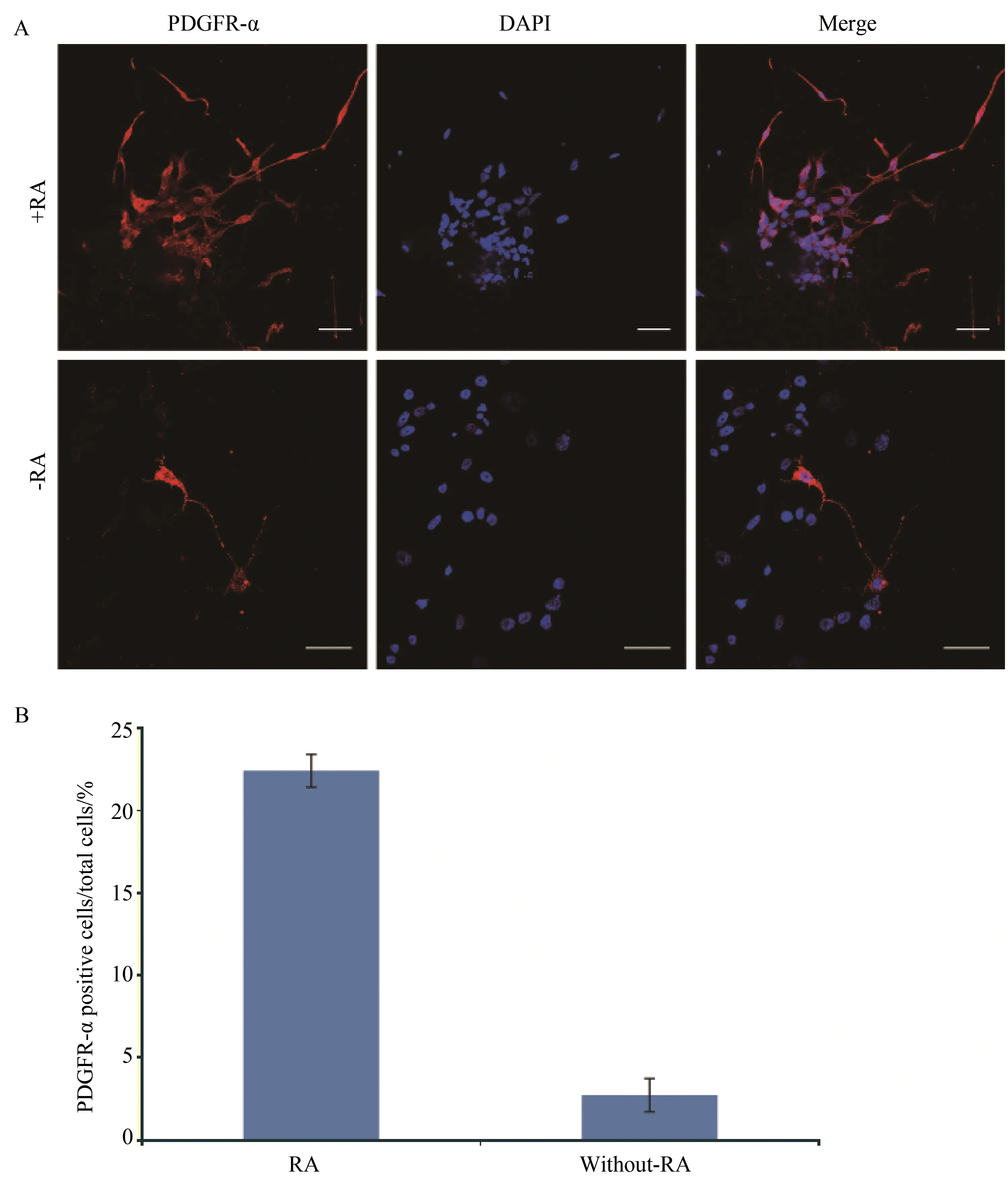
图2 反维甲酸可以促进血小板衍生生长因子受体-α(PDGFR-α)阳性的细胞产生
A:immunostaining of cells cultured in medium added with RA or without RA. Scale bars: 50 μm; B:percentage of PDGFR-αpositive cells grown in medium with RA or without RA;PDGFR-α: platelet-derived growth factor receptor-α.

图3 早期少突胶质前体细胞可分化为成熟的少突胶质前体细胞
A-D: OPC expresses O1 and partly are GFAP positive;E-H: OPC expresses O4 and partly are Ki-67 positive; Scale bars: 50 μm;OPCs:oligodendrocyte progenitor cells.
少突胶质细胞对神经系统正常功能的维护以及损伤后的修复有极其重要的意义,目前,将iPSCs分化为少突胶质前体细胞已经获得成功[10-11]。Wang等[7]用健康人iPSCs来源的少突胶质前体细胞治疗免疫缺陷小鼠的中枢神经系统脱髓鞘模型,有明显治疗作用。Douvaras等[8]将多发性硬化病人皮肤成纤维细胞重编程为iPSCs并分化为少突胶质前体细胞,移植到脱髓鞘小鼠模型中后发现其能成熟并形成髓鞘。以上结果均说明体细胞重编程技术获得的少突胶质细胞是具有功能的,有细胞治疗的潜力。但是从iPSCs分化为少突胶质细胞的周期很长,Wang等[7]将iPSCs分化为少突胶质前体细胞需要150 d。也有研究者[4,12-13]直接利用转分化技术获得少突胶质前体细胞:Yang等[4]在小鼠和大鼠的皮肤成纤维细胞中直接转入外源因子SOX10、Olig2和Zfp536可以将其转分化为少突胶质前体细胞,并继续分化为有功能的成熟少突胶质细胞;Najm等[12]应用Nkx6.2,SOX10,Olig2将小鼠肺成纤维细胞重编程为少突胶质细胞。但是均没有报道同样的方法在人源起始细胞中存在作用,而且,直接转分化很难逃脱“表观遗传记忆”现象[13]。本研究中,所转入的外源因子OCT4、SOX2、KLF4、C-MYC、LIN28、NANOG后是将成体细胞重编程为一个多能的状态,这样可见减弱“表观遗传记忆效应”,然后再利用化学小分子,将其诱导为少突胶质前体细胞。
一直以来,皮肤成纤维细胞被用做体细胞重编程的起始细胞被广泛接受,但是就实际应用来讲,皮肤成纤维细胞并不是最佳选择。首先,获取人成纤维细胞是一个有创的过程;第二,成纤维细胞在体外传代时会发生基因突变[14-16]。本研究所用的外周血单个核细胞取材方便,创伤小,用于重编程前在体外扩增时间短,更加适合用于重编程。
本研究获得的少突胶质前体细胞,有明显增生能力,表达Ki-67。PDGFR-α阳性的Pre-OPC可以体外传代,能为后期的移植实验提供足量细胞。实验[15]证明,在少突胶质细胞的诱导过程中,反维甲酸具有重要作用,这可能与其可以促进神经干细胞向后脑及脊髓交界处腹侧神经元分化的作用有关,而这个部位的神经前体细胞被认为是运动神经元及少突胶质细胞的祖细胞。本研究所获得的表达O1和O4的少突胶质前体细胞,在移植之前,可以使用流式细胞筛选,以获得纯度更高的少突胶质前体细胞。
总之,利用外周血单个核细胞作为起始细胞重编程为少突胶质前体细胞具有创伤小,周期短等特点,未来有一定的应用前景。
[1] Goldman S A, Nedergaard M, Windrem M S. Glial progenitor cell-based treatment and modeling of neurological disease[J]. Science, 2012,338(6106): 491-495.
[2] Franklin R J, Ffrench-Constant C. Remyelination in the CNS: from biology to therapy[J]. Nat Rev Neurosci, 2008,9(11): 839-855.
[3] Windrem M S, Schanz S J, Guo M, et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse[J]. Cell Stem Cell, 2008, 2(6): 553-565.
[4] Yang N, Zuchero J B, Ahlenius H, et al. Generation of oligodendroglial cells by direct lineage conversion[J]. Nat Biotechnol, 2013, 31(5): 434-439.
[5] Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J]. Cell, 2007, 131(5): 861-872.
[6] Hu B Y, Du Z W, Zhang S C. Differentiation of human oligodendrocytes from pluripotent stem cells[J]. Nat Protoc, 2009, 4(11): 1614-1622.
[7] Wang S, Bates J, Li X, et al. Human iPSC-derived oligodendrocyte progenitor cells can myelinate and rescue a mouse model of congenital hypomyelination[J]. Cell Stem Cell, 2013, 12(2): 252-264.
[8] Douvaras P, Wang J, Zimmer M, et al. Efficient generation of myelinating oligodendrocytes from primary progressive multiple sclerosis patients by induced pluripotent stem cells[J]. Stem Cell Reports, 2014, 3(2): 250-259.
[9] Dowey S N, Huang X, Chou B K, et al. Generation of integration-free human induced pluripotent stem cells from postnatal blood mononuclear cells by plasmid vector expression[J]. Nat Protoc, 2012, 7(11): 2013-2021.
[10]Douvaras V F, Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells[J]. Nat Protoc, 2015, 10(8): 1143-1154.
[11]Lu J, Liu H, Huang C T, et al. Generation of integration-free and region-specific neural progenitors from primate fibroblasts[J]. Cell Rep, 2013,3(5): 1580-1591.
[12]Najm F J, Lager A M, Zaremba A, et al. Transcription factor-mediated reprogramming of fibroblasts to expandable, myelinogenic oligodendrocyte progenitor cells[J]. Nat Biotechnol, 2013, 31(5): 426-433.
[13]Marro S, Pang Z, Yang N, et al. Direct lineage conversion of terminally differentiated hepatocytes to functional neurons[J]. Cell Stem Cell, 2011. 9(4): 374-382.
[14]Abyzov A, Mariani J, Palejev D, et al. Somatic copy number mosaicism in human skin revealed by induced pluripotent stem cells[J]. Nature, 2012, 492(7429): 438-442.
[15]Miller R H. Oligodendrocyte origins[J]. Trends Neurosci, 1996,19(3): 92-96.
[16]刘婷,华川.自身抗体与自身免疫性疾病预测的研究进展[J].临床误诊误治,2015,28(9):114-116.
编辑 慕 萌
Generation of oligodendrocyte progenitor cells from human peripheral blood mononuclear cells
Tang Xihe1,2,3,4, Li Mo2,3, Wang Shuyan2,3, Li Pengyan2,3, Zhang Y. Alex2,3, Chen Zhiguo2,3*, Chen Hui1,3,4*
(1.ChinaRehabilitationResearchCenter,Beijing100053,China; 2.CellTherapyDepartment,XuanwuHospital,CapitalMedicalUniversity,Beijing100053,China; 3.CenterofNeuralInjuryandRepair,BeijingInstituteforBrainDisorders,Beijing100053,China; 4.BeijingKeyLaboratoryofNeuralInjuryandRehabilitation,Beijing100053,China)
Objective To generate oligodendrocyte progenitor cells (OPCs) from peripheral blood mononuclear cells by episomal vectors.Methods Peripheral blood of a donor was collected by venipuncture and then mononuclear cells (MNCs) were isolated by density-based centrifugal separation. After a short period of expansion, the isolated MNCs were transfected with three plasmids expressingOCT4,SOX2,KLF4,C-MYC,LIN28,NANOG, and cultured in chemical defined medium with small molecules. Results Sixty days later, the O4 oligodendrocyte progenitor cells appeared and could be expanded more than 60 passages. Conclusion The peripheral blood MNCs can be converted to oligodendrocyte progenitor cells by non-integrative plasmid vectors.
peripheral blood mononuclear cells; cell reprogramming; oligodendrocyte progenitor cells
国家自然科学基金(81661130160),北京市科委计划项目 (Z151100001615055)。This study was supported by National Natural Science Foundation of China(81661130160), Beijing Municipal Science and Technology Commission (Z151100001615055).
时间:2017-07-16 17∶34 网络出版地址:http://kns.cnki.net/kcms/detail/11.3662.r.20170716.1734.048.html
10.3969/j.issn.1006-7795.2017.04.013]
R329.2
2016-06-14)
*Corresponding authors, E-mail:chenzhiguo@gmail.com, chenhui55299@163.com

