“ESKAPE”在神经外科医源性感染的流行病学研究
刘竞争 郑光辉 吕 虹 陈 燕 马瑞敏 张国军
(首都医科大学附属北京天坛医院检验科,北京 100050)
· 检验医学与临床 ·
“ESKAPE”在神经外科医源性感染的流行病学研究
刘竞争 郑光辉 吕 虹 陈 燕 马瑞敏 张国军*
(首都医科大学附属北京天坛医院检验科,北京 100050)
目的 探索2012-2016年6类严重耐药菌在神经外科医源性感染病人的流行病学研究。方法 收集2012年1月至2016年12月首都医科大学附属北京天坛医院神经外科术后病人脑脊液培养阳性的6类耐药菌并分析其分类与耐药问题。结果5年来,脑脊液培养阳性分离株共2 250株。其中6类致病菌共523株,占23.2%,肺炎克雷伯菌、鲍曼不动杆菌与金黄色葡萄球菌的分离率高于屎肠球菌、铜绿假单胞菌与肠杆菌属。2012-2016年神经外科医源性感染金黄色葡萄球菌方面,耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)的构成比高达49%,肺炎克雷伯菌与鲍曼不动杆菌的碳青霉烯耐药率也高于40.0%。结论 2012-2016年间,6类常见院内感染致病菌在神经系统医源性感染方面耐药较为严重,尤其是MRSA、万古霉素耐药肠杆菌(vancomycin resistantEnterobacteriaceae,VRE)、碳青霉烯耐药肠杆菌(carbapenem resistantEnterobacteriaceae,CRE)等耐药菌的泛滥,使得临床上选择抗生素对神经外科医源性感染的疗效不容乐观。
耐药菌;神经外科术后感染;脑脊液
医源获得性感染是临床上一类重要的感染,由于院内微生物的耐药性的互传性与抗生素的滥用,导致此类感染在临床上较难治疗[1]。美国感染病学会(Infectious Diseases Society of America, IDSA)的抗生素效益评估小组经调查后认为屎肠球菌(Enterococcusfaecium)、金黄色葡萄球菌(Staphylococcusaureus)、肺炎克雷伯菌(Klebsiellapneumoniae)、鲍氏不动杆菌(Acinetobacterbaumannii)、铜绿假单胞菌(Pseudomonasaeruginosa)及肠杆菌属(Enterobacterspecies),这6类细菌的耐药性情况极其严峻,其各自拉丁文名称首字母而简称“ESKAPE”,在院内感染方面扮演着重要的角色[2-4]。
神经外科术后感染是医源获得性感染的重要组成部分,据美国医源获得性感染监测系统的调查[5]显示,神经外科术后病人医源获得性感染(healthcare associated infection, HAI)的发生率居所有住院感染病人的第3位,为了确定“ESKAPE”等6类细菌对神经外科术后病人的种类分布与细菌耐药性的变化规律,本研究回顾性对首都医科大学附属北京天坛医院神经外科术后病人进行了流行病学分析。
1 资料与方法
1.1 临床资料
选取2012-2016年首都医科大学附属北京天坛医院神经外科通过脑室穿刺、腰椎穿刺等方法采集脑脊液标本且脑脊液培养阳性的病人,其临床诊断包括颅内肿瘤、脑出血、脑血管畸形、椎管内肿瘤等。收集病人脑脊液培养标本,选取培养阳性的6种细菌,并去除了重复病例。
1.2 细菌鉴定方法
脑脊液标本采用常规方法进行分离、培养与鉴定,培养鉴定系统包括Phoenix 100(BD)、 Vitek-2 and VITEK MS(bioMérieux)等。将留取的脑脊液标本注入儿童需氧培养瓶在37 ℃条件下培养,并将培养结果为阳性的标本转种至血平皿上,然后通过仪器或手工进行鉴定。药敏实验主要采用纸片扩散法、微量肉汤稀释法。
1.3 统计学方法
应用细菌耐药性监测数据处理软件WHONET 5.5进行数据分析,分离构成比采用χ2检验进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 神经外科医源性感染ESKAPE的逐年分布
2012年1月至2016年12月首都医科大学附属北京天坛医院的脑脊液阳性分离株共2 250,其中ESKAPE共523株,所占比例为23.2%,其中鲍曼不动杆菌、肺炎克雷伯菌与金黄色葡萄球菌的分离株明显高于另外3种感染菌,其中逐年数目与构成比,差异无统计学意义(P=0.161),详见表1。
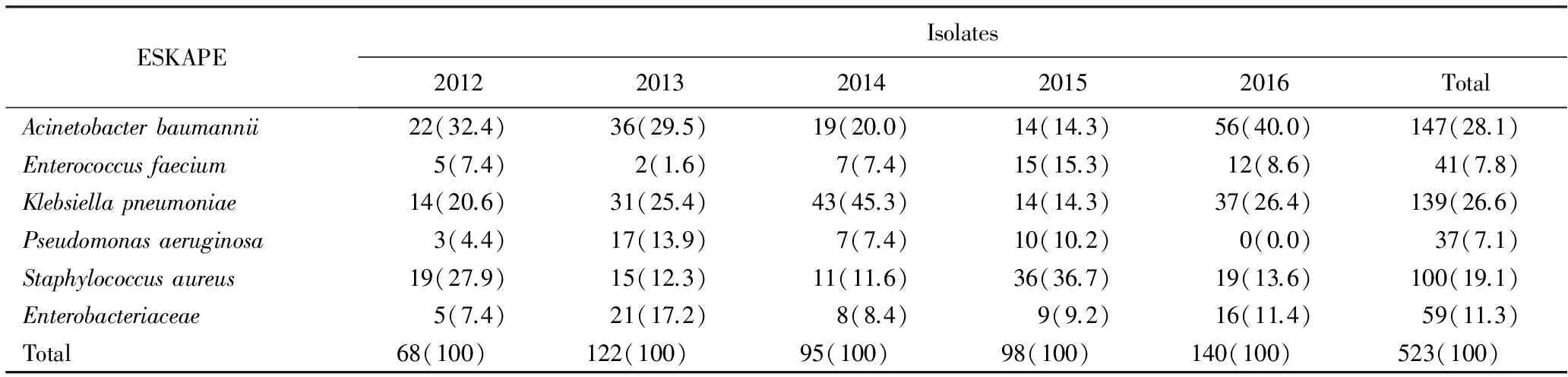
表1 2012年1月至2016年12月ESKAPE在神经外科术后感染的分布
ESKAPE:the first letter abbreviation of six types of bacteria
2.2 神经外科医源性感染ESKAPE的药敏试验结果
2012年1月至2016年12月首都医科大学附属北京天坛医院神经外科术后脑脊液培养分离得到的ESKAPE耐药性表如2与表3所示,6类细菌均能导致严重的耐药,尤其是耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA),产肺炎克雷伯菌碳青霉烯酶(Klebsiellapneumoniaecarbapenemase,KPC) 、新德里金属β-内酰胺酶(New Delhi metal beta-lactamase,NDM )的肺炎克雷伯菌以及万古霉素耐药肠球菌(vancomycin-resistantEnterococci,VRE)等,其敏感率均较低。革兰阳性菌方面,2012-2016年首都医科大学附属北京天坛医院神经外科术后感染脑脊液分离出的金黄色葡萄球菌对青霉素G的敏感率为14.3%,苯唑西林的敏感率为51.5%,对氨基糖苷类抗生素阿米卡星的敏感率较高,为86.9%,并未发现万古霉素类抗生素的耐药株,但利奈唑胺的敏感率并未达到100%。屎肠球菌的耐药率较高,VRE的所占比为22.0%,除万古霉素外,复方甲基异恶唑与甲氧苄啶的敏感率较高,均大于80.0%, 大环内酯类抗生素的敏感率较低。
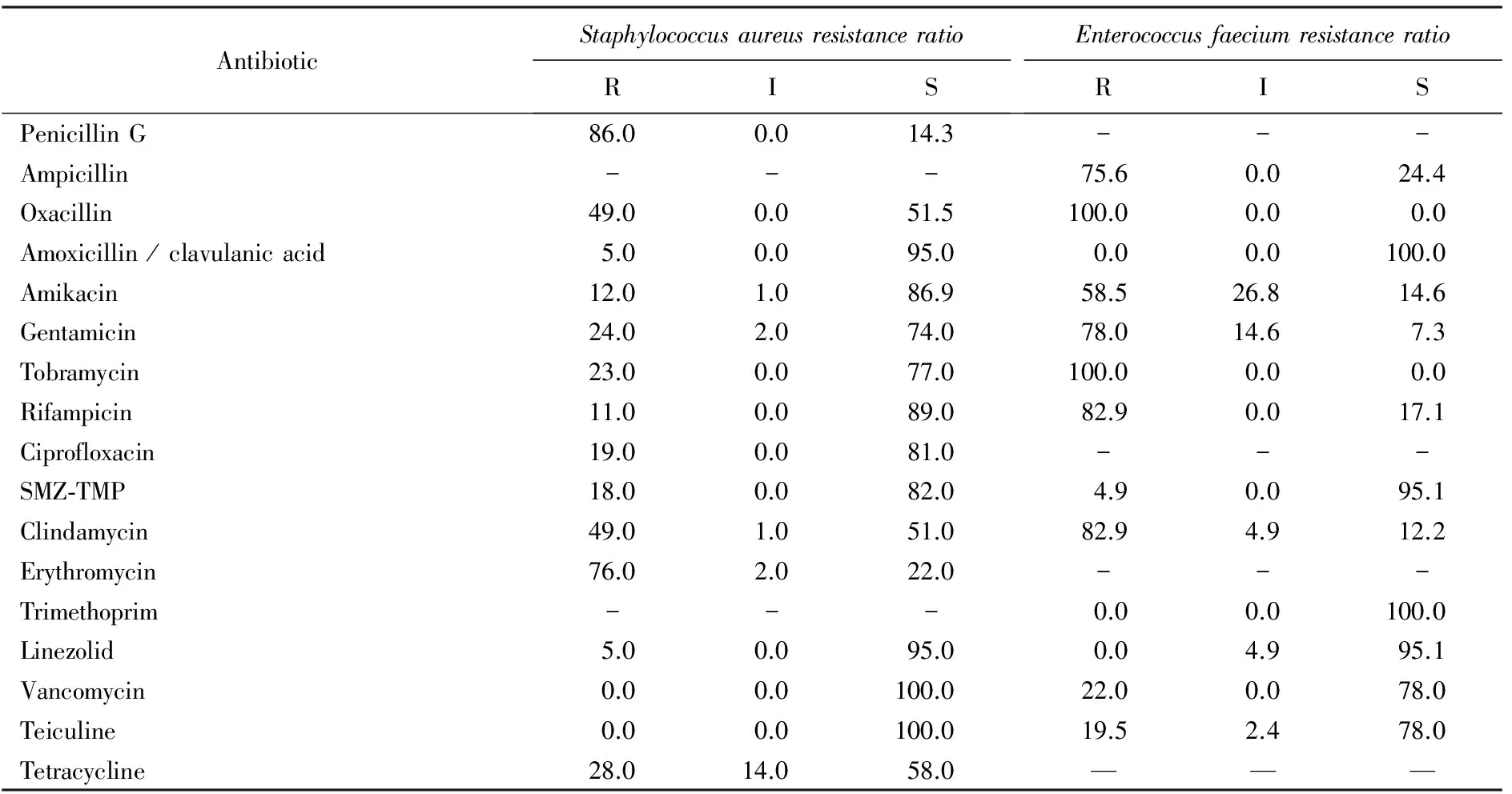
表2 2012年1月至2016年12月金黄色葡萄球菌与屎肠球菌在神经外科术后感染的药敏结果
SMZ-TMP: sulfamethoxazole-trimethoprim;R:resistant; I:intermediate sensitive; S:sensitive.
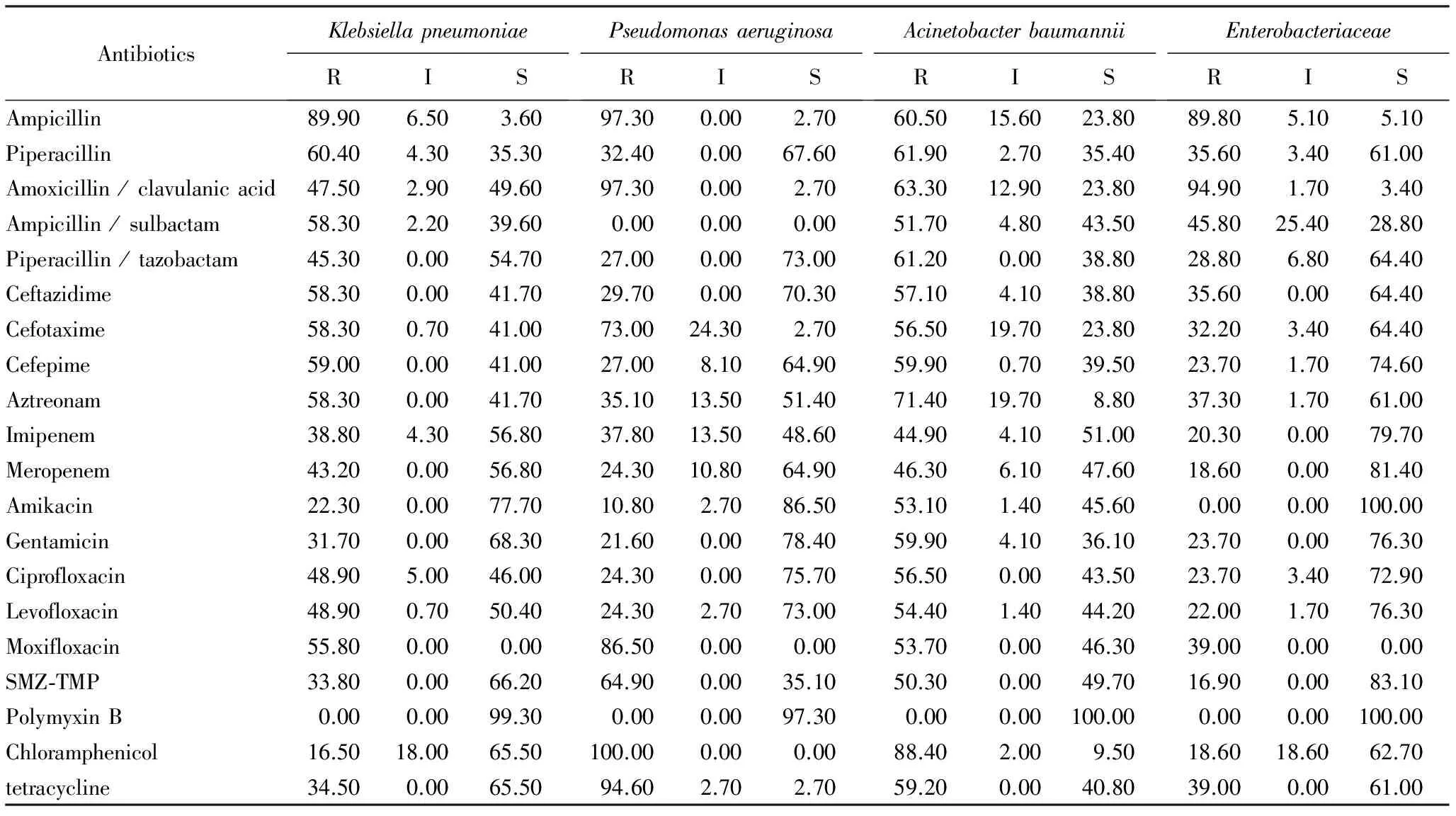
表3 2012年1月至2016年12月肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌与肠杆菌属在神经外科术后感染的药敏结果
SMZ-TMP: sulfamethoxazole-trimethoprim;R:resistant; I:intermediate sensitive; S:sensitive.
革兰阴性菌方面,肺炎克雷伯菌的耐药率较为严重,临床一线用药如三代头孢菌素,碳青霉烯类抗生素等均出现了不同程度的耐药,尤其是碳青霉烯耐药肺炎克雷伯菌(carbapenem resistantKlebsiellapneumonia, CRKP)的比例高达40%,肺炎克雷伯菌对氨基糖苷类的敏感率低于80.0%。对于合成抗菌药来说,肺炎克雷伯菌的敏感率依然不高,左氧氟沙星、环丙沙星以及复方甲基异恶唑均表现出了中等强度的敏感率,但多黏菌素B的敏感率为100.0%。神经外科术后感染铜绿假单胞菌对β-内酰胺类抗生素整体敏感率与肺炎克雷伯菌类似,但对头孢他啶的敏感率较高,对氨基糖苷类抗生素与喹诺酮类抗菌药敏感率也高于肺炎克雷伯菌,与另外3类病原菌不同,铜绿假单胞菌对碳青霉烯类抗生素出现了部分中介敏感性。
鲍曼不动杆菌为ESKAPE分离率最高的细菌,耐药性较为严重,其对美罗培南的敏感率仅为47.6%,其他β-内酰胺类抗生素的敏感率更低,仅氨苄西林/舒巴坦的敏感率为43.5%,除多黏菌素外,所有测定的抗生素敏感率均低于50.0%,仅复方磺胺甲基异噁唑敏感率稍高,达到49.7%。肠杆菌属的总体上的敏感率高于其他3种革兰阴性菌,其对美罗培南的敏感率高达81.4%,对头孢噻肟和头孢他啶的敏感率为64.4%,对氨基糖苷类抗生素的敏感率大于70.0%,对合成抗菌药的敏感率也较高。
3 讨论
目前,医源性感染是临床的一大负担,关系着手术的成功率且与病死率相关[6]。神经外科术后感染作为医源性感染的一种,在神经外科手术愈后扮演着重要的角色[7]。控制术后感染是神经外科的一项重要的工作,但由于抗生素的滥用及细菌的横向基因迁移[8]等,导致神经外科术后耐药菌的感染逐年上升。ESKAPE作为院内感染最重要的6类细菌,在神经外科病房中的感染比例也最高,故分析其分布与耐药性有着现实意义[9]。
本研究回顾性分析2012年1月至2016年12月首都医科大学附属北京天坛医院神经外科病区脑脊液分离出的6类常见院内感染菌的流行病学状况,鲍曼不动杆菌,金黄色葡萄球菌在6类致病菌的比例高达73.80%。2016年,ESKAPE 6类致病菌的临床分离株上升极为明显,说明在神经外科术后感染控制方面形势依旧严峻,且除铜绿假单胞菌外,所有革兰阴性菌的分离株数均上升,而革兰阳性菌分离数却在下降,分析原因可能为由于国家限制临床抗生素的使用率,尤其是限制术前预防应用如美罗培南等高阶抗生素,使得革兰阴性菌的分离率大幅上升,另外,革兰阴性耐药菌的大量产生,使得在阻断其传播过程中抗生素的效能越来越弱,也是使得其分离率出现了上升的原因之一[10]。革兰阳性菌方面,由于万古霉素、利奈唑胺等抗生素对金黄色葡萄球菌维持着较高的敏感率使得其传播过程中可得到良好的控制,故其分离率出现下降趋势[11]。
ESKAPE最初是由于此6类细菌的耐药性较为严重而分类的[3],本研究显示,神经外科术后感染革兰阳性菌的耐药性依旧严峻,MRSA占金黄色葡萄球菌的比例依旧较高,高达49.0%,略高于文献[12]报道,VRE所占比例为22%,此两种耐药菌抗生素的选择越来越少,应对MRSA感染,只有万古霉素类抗生素敏感率达到100%,其他抗生素包括利奈唑胺在内,都存在不同程度的耐药情况,由于脑脊液中抗生素浓度显著低于血液,故在应对MRSA在神经系统感染时,抗生素的浓度会进一步提高,使得其不良反应相应提高,在治疗MRSA感染时需要着重注意。近年来,VRE在神经系统感染的报道[13]逐年增多,本研究显示,神经系统感染的屎肠球菌的耐药性总体较为严重,但复方磺胺甲基异噁唑,甲氧苄啶与利奈唑胺等对其敏感率较高,可作为临床应用的选择之一。泛耐药革兰阴性菌是导致目前临床上抗生素危机的最主要的致病菌,2017年3月,世界卫生组织公布了威胁人类健康程度最高的12种致病菌,碳青霉烯耐药鲍曼不动杆菌,碳青霉烯耐药铜绿假单胞菌与碳青霉烯耐药肠杆菌为危险程度最高的三类菌,无一例外,此三类菌均属于ESKAPE。肺炎克雷伯菌为神经外科术后分离率最高的革兰阴性菌,其获得性耐药率较高,本研究显示,CRKP的比例较高(>40%),仅多黏菌素B对肺炎克雷伯菌的敏感率达到100%,由于目前国内未上市多黏菌素,故应对CRKP的选择极少。肺炎克雷伯菌对阿米卡星的敏感率大于70%,可作为联合用药的一种选择。有文献[14]报道,应对碳青霉烯耐药肺炎克雷伯菌在血液的感染,其病死率高达50%,而并未有针对CRKP在脑脊液感染的大规模临床研究,但由于脑脊液中抗生素的低浓度,其治愈率不容乐观。鲍曼不动杆菌是病房中的一类常见菌,近年来,泛耐药鲍曼不动杆菌是临床科室尤其是重症医学科(intensive care unit, ICU)的一大负担,本研究结果显示,与肺炎克雷伯菌类似,其超广谱β-内酰胺酶(extended spectrum beta-lactamases, ESBLs)的产生率为71.5%,碳青霉烯耐药率为46.3%,严重程度较高。有文献[15]报道,虽然鲍曼不动杆菌的致病性不如肺炎克雷伯菌,但其存在耐药基因迁移的现象,导致在ICU等病房中,耐药菌检出率递增,且难以阻断其传播,给病人带来严重的后果。治疗方面也只有多黏菌素B,替加环素等几种抗生素可供选择。铜绿假单胞菌曾经为病房的最常见的院内感染菌之一,但近年来数量出现下降,但耐药性却出现了上升,其对碳青霉烯类抗生素的敏感率显著高于肺炎克雷伯菌与鲍曼不动杆菌,但该类菌在神经系统术后感染方面容易导致非常严重的后果,除多黏菌素B外,氨基糖苷类抗生素也是应对铜绿假单胞菌在神经系统感染的一种选择[13-15]。相比于前5类致病菌,肠杆菌属的耐药率较低,碳青霉烯类抗生素为应对该类细菌感染的最主要的抗生素,近年来,肠杆菌属在神经外科感染方面的报道[16-18]开始增多,尤其是阴沟肠杆菌,能产生严重的感染并诱发全身性炎性反应,长期来看,肠杆菌属在神经系统的感染治疗不容乐观。
综上,ESKAPE等6类致病菌在神经外科术后感染方面较为严重,与病人手术成功率与病死率息息相关,应对其感染所能采用的抗生素也较为有限,尤其是泛耐药株的出现,使得临床上对相应的感染束手无策,由于耐药ESKAPE导致神经外科医源性感染的严重性与传播的广泛性,做好防止细菌耐药性的蔓延是我们今后工作的重点方向之一。
[1] Huang G, Peng Y, Yang Y, et al. Multilocus sequence typing and molecular characterization of β-lactamase genes among Acinetobacter baumannii isolates in a burn center[J].Burns,2017, Epub ahead of print.
[2] Charrier C, Salisbury A M, Savage V J, et al. Novel bacterial topoisomerase inhibitors with potent broad-spectrum activity against drug-resistant bacteria[J]. Antimicrob Agents Chemother, 2017, Epub ahead of print.
[3] Karlowsky J A, Hoban D J, Hackel M A, et al. Antimicrobial susceptibility of gram-negative ESKAPE pathogens isolated from hospitalized patients with intra-abdominal and urinary tract infections in Asia-Pacific countries: SMART 2013-2015[J]. J Med Microbiol, 2017,66(1):61-69.
[4] Adler A, Friedman N D, Marchaim D. Multidrug-resistant gram-negative bacilli: infection control implications[J]. Infect Dis Clin North Am, 2016,30(4):967-997.
[5] Crijns F R, Keinänen-Toivola M M, Dunne C P. Antimicrobial coating innovations to prevent healthcare-associated infection[J]. J Hosp Infect, 2017,95(3):243-244.
[6] Cilloniz C, Martin-Loeches I, Garcia-Vidal C, et al. Microbial etiology of pneumonia: epidemiology, diagnosis and resistance patterns[J]. Int J Mol Sci, 2016,17(12):Pii.
[7] Soavi L, Rosina M, Stefini R, et al. Post-neurosurgical meningitis: management of cerebrospinal fluid drainage catheters influences the evolution of infection[J]. Surg Neurol Int, 2016,7(Suppl 39):S927-S934.
[8] Schroeder M, Brooks B D, Brooks A E. The complex relationship between virulence and antibiotic resistance[J]. Genes (Basel), 2017,8(1):Pii.
[9] 荆楠, 唐明忠, 刘志忠, 等. 神经内外科脑脊液标本细菌流行病学分布和耐药性分析[J].首都医科大学学报,2012,33(2):143-147.
[10]Fowler L H, Lee S. Antibiotic trends amid multidrug-resistant gram-negative infections in intensive care units[J]. Crit Care Nurs Clin North Am, 2017,29(1):111-118.
[11]Safa L, Afif N, Zied H, et al. Proper use of antibiotics: situation of linezolid at the intensive care unit of the tunisian military hospital[J]. Pan Afr Med J, 2016,25:196.
[12]Wu Y, Kang J, Wang Q. Drug concentrations in the serum and cerebrospinal fluid of patients treated with norvancomycin after craniotomy[J]. Eur J Clin Microbiol Infect Dis, 2017,36(2):305-311.
[13]Le J, Bookstaver P B, Rudisill C N, et al. Treatment of meningitis caused by vancomycin-resistant Enterococcus faecium: high-dose and combination daptomycin therapy[J]. Ann Pharmacother, 2010,44(12):2001-2006.
[14]Tanner W D, Atkinson R M, Goel R K, et al. Horizontal transfer of the blaNDM-1 gene to Pseudomonas aeruginosa and Acinetobacter baumannii in biofilms[J]. FEMS Microbiol Lett, 2017, Epub ahead of print.
[15]Ye X X, Liang Y L, Yuan D, et al. Pneumocephalus caused by neonatal enterobacter cloacae infection in a case[J]. Zhonghua Er Ke Za Zhi, 2008,46(9):662-665.
[16]丁军颖,桂红,洪燕英,等.基于耐药基因分析急诊重症监护病房优势病原菌耐药特性[J].解放军医药杂志,2015,27(10):72-75.
[17]夏为, 侯云生,卞晓华.颅脑手术后并发颅内多重/泛耐药鲍曼不动杆菌感染24例治疗总结[J].临床误诊误治,2016,29(7):71-74.
[18]刘超梅, 胡晓冬,邢红英,等.某院鲍曼不动杆菌流行克隆株的分子特征[J].解放军医药杂志,2014,26(2):91-95.
编辑 慕 萌
Epidemiological study of “ESKAPE” infections in neurosurgery wards
Liu Jingzheng, Zheng Guanghui, Lyu Hong, Chen Yan, Ma Ruimin, Zhang Guojun*
(DepartmentofClinicalLaboratory,BeijingTiantanHospital,CapitalMedicalUniversity,Beijing100050,China)
Objective To explore the epidemiological features of six kinds of severe drug-resistant bacteria in patients with neurosurgery-induced infection in 2012-2016.Methods Six kinds of antibiotic resistant bacteria isolated from cerebrospinal fluid in patients with neurosurgery were collected from January 2012 to December 2016 in Beijing Tiantan Hospital Affiliated to Capital Medical University, and their epidemiological characteristics and drug resistance were analyzed. Results In the past 5 years, 2 250 isolates of pathogens in cerebrospinal fluid culture were isolated. Among them, the separation rate of six strains of pathogenic bacteria is 23.2%, accounting forKlebsiellapneumoniae,AcinetobacterbaumanniiandStaphylococcusaureuswas higher than that ofEnterococcusfaecalis,PseudomonasaeruginosaandEnterobacterspp. The resistance rate of MRSA was higher than 40.0%, and the resistance rate of carbapenem toKlebsiellapneumoniaeandAcinetobacterbaumanniiwas higher than 40.0%. Conclusion In the period of 2012-2016, six kinds of common nosocomial infection pathogens were more resistant to iatrogenic infection in the neurosurgical patients, especially the proliferation of drug-resistant bacteria such as methicillin-resistantStaphylococcusaureus(MRSA), vancomycin resistantEnterobacteriaceae(VRE) and (carbapenem resistantEnterobacteriaceae(CRE), and the clinical selection of antibiotics for neurosurgery. The ESKAPE infection in neurosurgery ward is bad.
drug-resistance bacteria; neurosurgical infection; cerebrospinal fluid
北京市卫生系统高层次卫生技术人才培养计划项目(2013-3-052),北京市优秀人才青年拔尖个人项目(2015000021223ZK34)。This study was supported by Beijing High Quality Health Technology System Personnel Training Program(2013-3-052),Beijing Outstanding Talent Young Top-notch Personal Projects(2015000021223ZK34).
时间:2017-07-16 17∶34 网络出版地址:http://kns.cnki.net/kcms/detail/11.3662.r.20170716.1734.044.html
10.3969/j.issn.1006-7795.2017.04.009]
R446.6
2017-05-09)
*Corresponding author, E-mail:tiantanzgj@163.com

