家蝇GNBP3基因克隆及感染白色念珠菌后的表达
胡 亚,罗 嫚,王 宇,3,王 涛,尚小丽,张迎春,修江帆,4*,吴建伟,4
家蝇GNBP3基因克隆及感染白色念珠菌后的表达
胡 亚1,2,罗 嫚1,王 宇1,3,王 涛1,尚小丽1,张迎春1,修江帆1,4*,吴建伟1,4
(1.贵州医科大学基础医学院,贵阳 550004;2.毕节市第一人民医院,贵州毕节551700;3.贵州省疾病预防控制中心,贵阳 550004;4.贵州博康生物工程有限公司,贵阳 550004)
对家蝇GNBP3基因进行克隆及生物信息学分析,并对该基因在感染白色念珠菌Candidaalbicans后的表达情况进行研究。从构建的家蝇Muscadomestica幼虫cDNA质粒文库中筛选到GNBP3基因,克隆并运用生物信息学方法对该基因及其编码蛋白进行预测和分析。白色念珠菌注射感染家蝇幼虫并收集标本,逆转录,通过荧光定量PCR检测感染样本中GNBP3基因的表达情况,结果进行统计学分析。研究结果表明,GNBP3基因ORF全长1473 bp,编码490个氨基酸,理论分子量为55.8 kDa,等电点为6.85;感染后不同时间点,感染组与对照组比较,在3 h、12 h、36 h、48 h GNBP3 mRNA的表达明显增高,两组比较有显著性差异(P<0.05),而24 h表达差异性最小;感染后不同组织中感染组与对照组比较,3 h和12 h时,在体壁、血淋巴、脂肪体中的表达量升高,具有显著性差异(P<0.05);24 h时,在血淋巴中的表达量较对照组高,而在唾液腺和脂肪体中的表达量呈下降趋势,均具有显著性差异(P<0.05);48 h,在血淋巴和脂肪体中表达量较对照组高,在中肠的表达量较对照组低,均具有显著性差异(P<0.01)。成功克隆GNBP3基因且在家蝇感染白色念珠菌后GNBP3的表达水平随时间的推移呈现先升高后降低再升高的趋势,在各组织中以在免疫组织(血淋巴、脂肪体)中的表达显著增高,推测其在真菌识别过程中发挥潜在作用。
GNBP3;实时荧光定量PCR;感染;mRNA水平;家蝇
昆虫的先天性免疫包括细胞和体液免疫两类,细胞和体液初始免疫反应的第一步是识别病原物,这需要模式识别受体(PRR)对病原微生物的病原相关分子模式(PAMPs)进行识别,分别依靠血细胞和脂肪体产生以及分泌抗菌因子发挥免疫效应(Kounatidis and Ligoxygakis, 2012; Kuratas, 2014)。真菌是昆虫病原微生物最大的一类,约有60%的昆虫疾病是由病原真菌所致(宋肖玲和李国霞,2002;候成香等,2012)。真菌细胞壁是昆虫识别真菌的靶位置,在昆虫中革兰氏阴性菌识别蛋白-3(GNBP3)能够识别真菌细胞壁成分,β-1,3葡聚糖是真菌细胞壁的关键成分,也是GNBP3的识别成分,GNBP3识别真菌细胞壁中的β-1,3葡聚糖,完成免疫系统对侵入真菌的识别(Elchamyetal., 2008; Hoffmannetal, 2008; Buchonetal., 2009; Mishimaetal, 2009; Lindsay and Wasserman, 2014),也是真菌在侵染宿主的每一个阶段都会受到宿主免疫抵抗的原因。如在果蝇(Matskevichetal., 2010; Fullaondoetal., 2011)、黄粉虫(Leeetal., 2009)中,GNBP3结合β-1,3葡聚糖参与抗真菌防御,提示其在对病原体识别过程中发挥重要作用。
家蝇Muscadomestica是世界性广泛分布的昆虫,隶属于昆虫纲双翅目Diptera环裂亚目Cyclorrhapha蝇科Muscidae蝇属,其体表可携带多种病原体而自身并不受害,这一特性归功于其具有强大的先天性免疫系统(修江帆等,2014;彭传林等,2015;王宇等,2015)。家蝇基因组和转录组(Jeffreyetal., 2014)研究表明GNBP3是信号通路上游模式识别受体参与昆虫先天性免疫应答反应及其对真菌的识别,从而宿主对真菌产生免疫抵抗,而有关GNBP3在家蝇感染后的表达状况国内外研究报道较少(修江帆等,2014),对GNBP3在免疫系统中发挥何作用已成为迫切解决的问题。基因表达的定量检测已经是分子生物学研究课题中的重要手段,当研究大多数基因时,不同的检测方法所得到的结果差异较大,通过实时荧光定量检测细胞中mRNA的浓度,则可以更精确地反映基因表达的状况(彭海英等,2015;易健明等,2015)。本研究采用实时荧光定量PCR(Real time Q-PCR)检测家蝇感染白色念珠菌Candidaalbicans后GNBP3的表达状况,为进一步探讨家蝇先天性免疫系统对真菌的识别机制提供新的思路。
1 材料与方法
1.1 材料
1.1.1 动物材料与菌种
家蝇由贵州医科大学病原生物学教研室常规饲养;白色念珠菌由贵州医科大学病原生物学教研室保存。宿主菌感受态细胞Trans1-T1购自北京全式金生物技术有限公司;载体pMD 18-T购自TakaRa公司。
1.1.2 主要试剂和仪器
限制性内切酶、T4连接酶、rTaq酶、MiniBEST小量质粒抽提纯化试剂盒,DNA Maker DL 2000,总RNA提取试剂TRIzol Reagent、PrimeScriptTMOne Step RT-PCR Kit试剂盒、SYBR Premix Ex TaqTM II(Perfect Real Time)试剂盒、氯仿、异丙醇、DEPC水均购自TakaRa公司;去RNA酶EP管、PCR耗材(美国sigma公司);所用引物由上海生工生物工程公司合成。PCR扩增仪(德国Eppendorf公司),冷冻高速离心机(美国德国Eppendorf公司),核酸定量分析仪(GeneQuant公司)、显微超微量注射仪(美国),ABI PRISM 7300 Fast real time PCR System(美国)。
1.2 方法
1.2.1 标本制备
以白色念珠菌作为感染源,通过显微超微量注射仪注射家蝇幼虫(2龄后期),注射浓度为1×1010CFU/mL,注射体积为210 nL,设置为感染组,并注射等体积PBS缓冲液设为对照组,感染后3 h、6 h、12 h、24 h、36 h、48 h标本及感染后3 h、12 h、24 h、48 h等时间点的家蝇幼虫不同组织(体壁、马氏管、脂肪体、中肠、唾液腺、血淋巴、气管)标本进行收集。
1.2.2 总RNA的提取及cDNA合成
对所收集标本,按照TakaRa公司TRIzol说明书提取总RNA,总RNA经电泳检测,GeneQuant公司核酸定量分析仪测定A260/280比值(1.8≤A260/A280≤2.1)及浓度,以1 μg总RNA为模板,按照cDNA合成试剂盒说明书分别合成cDNA第一链,放于-80℃冰箱保存备用。
1.2.3 引物设计
根据NCBI公布的家蝇基因组GNBP3基因预测序列和内参基因GAPDH的基因序列,运用Primer 5.0软件设计基因克隆引物(K-F、K-R)、GNBP3基因及内参GAPDH基因的实时荧光引物。引物由生工生物工程(上海)股份有限公司合成,其序列如下:
GNBP3 K-F:5′—CGCGGATCCCCACCAAGCT ATGAAGT—3′
GNBP3 K-R:5′—CCGCTCGAGTTAAACAGAA AATAC—3′
GNBP3 F: 5′—CAGACGAGAAATGATGGAGGA C—3′
GNBP3 R:5′—TATTGCGATAAGTTGTGTGC—3′
GAPDH F:5′—CAGGAGGCATTGCTGATGAT—3′
GAPDH R:5′—GAAGGCTGGGGCTCATTT—3′
1.2.4 pMD18-T/GNBP3克隆载体的构建
从家蝇幼虫cDNA质粒文库中筛选到GNBP3基因,以上述家蝇3龄幼虫cDNA为模板,应用基因克隆引物,进行PCR扩增,扩增条件:94℃,5 min预变性;94℃ 30 s ,57℃ 30 s,72℃ 1 min ,30个循环;72℃延伸10 min。取PCR产物检测:2%的琼脂糖凝胶电泳。用DNA凝胶回收试剂盒,纯化PCR产物。将PCR产物连接到pMD18-T载体上,转化Trans1-T1感受态细胞,涂布于Amp+抗性的LB固体培养基平板培养,次日挑单克隆进行PCR鉴定,扩大培养后提取质粒,送生物公司测序。
1.2.5 生物信息学分析
利用瑞士生物信息学研究所的蛋白分析专家系统(Expert Protein Analysis System, ExPASy, http://ca.expasy.org/)提供的生物信息学工具分析家蝇GNBP3基因的特点;运用NCBI Blast对基因序列进行同源比对,用ProtParam分析蛋白等电点、分子质量;ProtScale分析蛋白质的疏水性;SignaIP 4.1分析信号肽位点;免疫表位数据库分析资源IEDB Analysis Recource网站(http://tools.immuneepitope.org/tools/bcell/iedb_input)分析抗原表位。
1.2.6 荧光定量PCR
取上述家蝇幼虫(2龄后期)感染后不同时间点(3 h、6 h、12 h、24 h、36 h、48 h)及感染后3 h、12 h、24 h、48 h等时间点的家蝇幼虫不同组织(体壁、马氏管、脂肪体、中肠、唾液腺、血淋巴、气管)(PBS对照组及白色念珠菌感染组)cDNA(1∶10稀释)为模板,GAPDH为内参基因,按照Takara SYBR Premix Ex TaqTM II(Perfect Real Time)试剂盒说明,使用ABI PRISM 7300(ABI,USA)进行real-time PCR,每个样品重复3次,每组3个重复。反应体系为:2×SYBR premix EX Taq II 10 μL、上游引物(10 μmol/L)0.8 μL、下游引物(10 μmol/L)0.8 μL、ROX Reference Dye(50×)0.4 μL、cDNA 1.0 μL,加无RNA酶的水(RNase Free dH20)补足至20 μL。反应条件为:95℃预变性30 s;95℃ 5 s,60℃ 34 s,40个循环。反应结束后,确认real-time PCR的溶解曲线和扩增曲线。
1.2.7 数据处理及分析
采用GAPDH作为内参照,用GAPDH的拷贝数作为校正基数,实验获得各样本中GNBP3的Ct(cycle threshold)值,与同样本中GAPDH的Ct值相减,即获得该样本中GNBP3的△Ct值;以PBS对照组中的GNBP3与GAPDH的差值△Ct值作为校正,得出△△Ct(感染组△Ct-PBS对照组△Ct)值,按目的基因表达量= 2-△△Ct计算各感染样本中GNBP3 mRNA的相对表达含量。采用Graphpad prism 6统计软件进行统计分析并绘制柱状图,应用方差分析进行组间比较,P<0.05时差异有统计学意义。
2 结果与分析
2.1 家蝇pMD18-T/GNBP3克隆载体构建
选用克隆引物进行PCR鉴定重组质粒,结果见图1,提取重组质粒进行测序鉴定,确定插入片段链接方向正确。
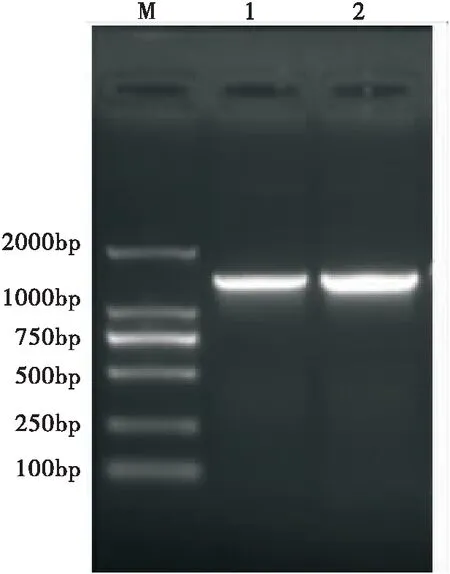
图1 pMD18-T/GNBP3重组质粒PCR鉴定Fig.1 Identification of pMD18-T/GNBP3 by PCR amplification注:M,DL2000;1-2,克隆重组质粒PCR。Note: Marker, DL2000; 1-2, PCR Product of cloning plasmid.
2.2 生物信息学分析
该cDNA序列ORF长为1473 bp,编码490个氨基酸(图2)。预测家蝇GNBP3蛋白的理论分子量为55884.6 Da,等电点为6.85。运用Signal P结果显示该编码蛋白存在信号肽序列,位于1-27位氨基酸之间,因此判定该编码蛋白为分泌型蛋白。运用Smart软件分析GNBP3的功能结构,发现了它的功能结构域位于第352位到第422位氨基酸,推测此蛋白可能具有能与β-1,3葡聚糖结合并在信号通路中发挥作用的功能。通过NCBI的Alignment在线分析工具对家蝇GNBP3基因的cDNA序列进行比对分析,结果显示GNBP3基因属于β葡聚糖GH 16超家族,具有层粘连蛋白G保守结构域,与果蝇具有高度同源性,其高达99%,具有识别β-1,3葡聚糖的功能(图3)。
2.3 荧光PCR产物分析
根据Real time PCR原理,每个反应管内的荧光信号达到设定的闽值时所经历的循环数,以Ct值表示,其与反应体系中目的基因cDNA的实际拷贝数直接相关且呈反比,因此以Ct值来反映目的基因cDNA起始含量,即Ct值越低,实际拷贝数越高,从而达到定量检测的目的。本实验显示,所有样本中GNBP3 cDNA显示指数增长,并达到平台期,其扩增曲线为一组典型的S型曲线,CT值线性范围为15-30(图4)。通过设置复孔取平均值,得到各样本中目的基因扩增的Ct值作为GNBP3的定量判定。在熔解曲线中均可见单一的峰,产物特异性好(图5)。
2.4 感染组与对照组GNBP3 mRNA水平
2.4.1 感染后不同时间点
白色念珠菌感染后,家蝇GNBP3基因在感染后36 h表达量最高,比正常组上调了17.661倍,具有显著性差异(P<0.05),其次是3 h、12 h、48 h,其表达量较正常组分别上调了8.082倍、4.986倍、3.569倍,均具有显著性差异(P<0.05),其中在。而在感染后6 h、24 h表达量差异无统计学意义(P>0.05),其中24 h表达量差异性最小,随时间变化家蝇GNBP3基因表达量呈现先升高后降低再升高的趋势(图6)。
2.4.2 感染后不同组织
根据家蝇幼虫感染白色念珠菌后不同时间点GNBP3基因的表达情况,选择3 h、12 h、24 h、48 h时间点,分析感染后GNBP3基因在各组织(马氏管、体壁、血淋巴、气管、唾液腺、脂肪体、中肠)中的表达情况。3 h时,在血淋巴中的表达量最高,比对照组上调了6.38倍,具有显著性差异(P<0.05),其次是在脂肪体和体壁中,分别比对照组上调了2.2506倍和1.697倍,均具有显著性差异(P<0.05);12 h时,在体壁中的表达量最高,比对照组上调了7.155倍,具有显著性差异(P<0.05),其次是在脂肪体和血淋巴中,其表达量较对照组分别上调了4.6295倍和2.739倍,均具有显著性差异(P<0.05);24 h时,在血淋巴中的表达量最高,比对照组上调了9.679倍,具有极显著性差异(P<0.0001),而在唾液腺和脂肪体中的表达量呈下降趋势,分别下调了3.292倍和2.366倍,均具有显著性差异(P<0.05);48 h,在血淋巴和脂肪体中表达量较对照组分别升高了2.583倍和3.207倍,均具有极显著性差异(P<0.0001),在中肠的表达量较对照组下降了2.892倍,具有显著性差异(P<0.01)。总体表达量呈先升高后降低再升高的趋势(图7)。

图2 GNBP3基因开放阅读框cDNA序列及对应编码的氨基酸序列Fig.2 cDNA sequence of GNBP3 and the amino acid sequence encoded by the ORF
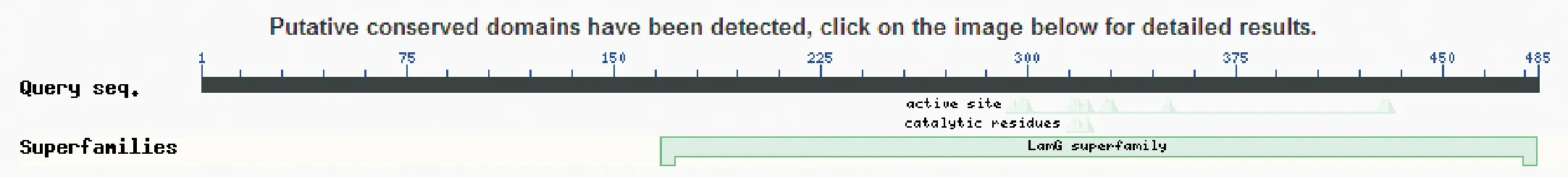
图3 Alignment检索结果Fig.3 Alignment result
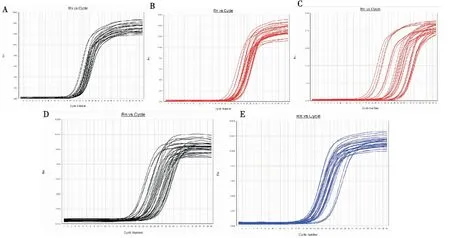
图4 GNBP3扩增曲线Fig.4 The amplification of GNBP3注:A,感染后不同时间点;B,感染后3 h不同组织;C,感染后12 h不同组织;D,感染后24 h不同组织;E,感染后48 h不同组织。Note: A, Time post infection; B, Different tissues at 3 h postinfection; C, Different tissues at 12 h postinfection; D, Different tissues at 24 h postinfection; E, Different tissues at 48 h postinfection.
图5 GNBP3溶解曲线Fig.5 The melting curve of GNBP3注:A,感染后不同时间点;B,感染后3 h不同组织;C,感染后12 h不同组织;D,感染后24 h不同组织;E,感染后48 h不同组织;Note: A, Time post infection; B, Different tissues at 3 h postinfection; C, Different tissues at 12 h postinfection; D, Different tissues at 24 h postinfection; E, Different tissues at 48 h postinfection.
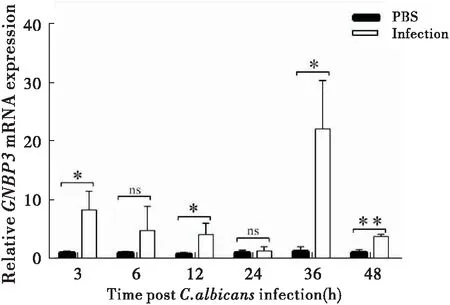
图6 GNBP3在感染后不同时间点的表达Fig.6 The expression of GNBP3in different time after Canidia albicans infection注:*,P<0.05;**,P<0.01;***,P<0.0001。
3 结论与讨论
在基因表达的相对定量评估中最常用的方法为CT比较法。此方法假设PCR的扩增效率为1,在靶基因同内对照基因扩增效率相同的情形下,直接通过公式2-△CT或2-△△CT进行计算。在CT值比较法中,2-△CT和2-△△CT方程式的选用应根据不同的研究目的。本研究主要通过检测同一样本经过不同处理方式对靶基因表达的影响则选用公式2-△△CT,即2-△△CT= 2-((CT靶基因-CT内对照基因)实验组-(CT靶基因-CT内对照基因)对照组)。本研究应用相对定量实时荧光PCR技术,选择GAPDH作为内参基因对目的基因进行校正,成功检测了GNBP3 mRNA在家蝇幼虫感染后不同时间点及不同组织中的表达,直观的反应了表达水平的不同。
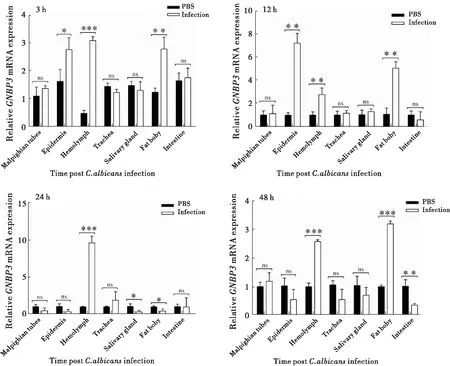
图7 GNBP3在感染后不同组织中的表达Fig.7 The expression of GNBP3 in different tissues after Candida albicans infection注:*,P<0.05;**,P<0.01;***,P<0.0001;malpighian tubes,马氏管;epidermis,体壁;haemolymph,血淋巴;trachea,气管;salivary gland,唾液腺;fat body,脂肪体;intestine,肠道。
革兰氏阴性菌识别蛋白-3(GNBP3)作为昆虫先天性免疫病原识别因子,参与昆虫先天性免疫应答,其能够识别真菌细胞壁中的β-1,3葡聚糖完成免疫系统对侵入体液中真菌的识别。家蝇孳生于杂乱菌丛的环境中传播疾病,是重要的媒介昆虫,其强大的免疫防御系统得到很多研究者的关注,而有关GNBP3在家蝇中的表达情况在国内外研究报道中知之甚少。但对于其他昆虫如黑腹果蝇(Quintinetal., 2013)、黑粉虫(Zhongetal., 2013)、蝗虫(Wangetal., 2013)、家蚕(Takahasietal., 2009)已有关于GNBP3参与免疫应答的相关报道,但主要是阐述其参加TOLL信号通路,而对GNBP3在宿主感染情况下的表达研究很少,而对于家蝇GNBP3基因及其感染后表达水平的研究,到目前仍未见相关研究报道。本研究从家蝇幼虫cDNA文库中筛选到GNBP3基因序列,并成功克隆了GNBP3基因。通过注射白色念珠菌感染家蝇幼虫,应用qPCR检测GNBP3的表达水平。结果显示,与对照组比GNBP3表达量为:36 h>3 h>6 h>12 h>48 h>24 h,其表达随时间的推移呈现先升高后降低再升高的状态,当机体受到真菌感染后,GNBP3应激性增高参与机体免疫应答,而后机体GNBP3表达量增高引起其他效应分子对它的负调控使其含量降低,随着真菌在机体内繁殖,再次引起GNBP3高表达识别真菌引起下游免疫应答反应;在感染后不同组织中GNBP3的表达各有差异,3 h时,其表达量为:血淋巴>脂肪体>体壁>肠道>马氏管>唾液腺>气管;12 h时,其表达量为:体壁>脂肪体>血淋巴>唾液腺>气管>马氏管>肠道;24 h时,其表达量为:血淋巴>气管>肠道>马氏管>脂肪体>体壁>唾液腺;48 h时,其表达量为:脂肪体>血淋巴>马氏管>唾液腺>气管>体壁>肠道。有研究表明昆虫抵御外界病原菌入侵是利用昆虫表皮、组织间体液、血细胞及免疫器官等共同协同完成,保护自身免受微生物侵害。其中脂肪体和血淋巴是昆虫的主要免疫器官,参与昆虫的免疫应答反应,在家蝇感染白色念珠菌后,在血淋巴中GNBP3的表达始终呈现高表达,其次是在脂肪体中,在真菌感染最初GNBP3在体壁中的表达也相对增高。这说明GNBP3参与了家蝇先天性免疫系统对真菌的识别,而对于家蝇先天性免疫系统对真菌的识别机制需进一步研究。此次研究将为今后家蝇先天性免疫系统对真菌的识别机制研究提供依据和参照,为进一步探讨家蝇先天性免疫系统提供新的思路。本研究成功克隆了GNBP3基因及检测了GNBP3 mRNA在家蝇幼虫感染后不同时间点及不同组织中的表达,直观的反应了其表达水平的差异。推测GNBP3在抵抗真菌感染的免疫应答过程中发挥重要作用。
References)
Buchon N, Poidevin M, Kwon HM,etal.A single modular serine protease integrates signals from pattern-recognition receptors upstream of the Drosophila Toll pathway [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2009, 106 (30): 12442-12447.
Ei CL, Leclerv V, Caldelari I,etal.Danger signal and PAMP sensing define binary signaling pathways upstream of Toll [J].NatureImmunology, 2008, 9 (10): 1165-1170.
Fullaondo A, García-Sánchez S, Sanz-Parra A,etal.Spn1 regulates the GNBP3-dependent Toll signaling pathway inDrosophilamelanogaster[J].MolecularandCellularBiology, 2011, 31 (14): 2960-72.
Hoffmann A, Funkner A, Neumann P,etal.Biophysical characterization of refolded drosophila Spatzle, a cystine knot protein, reveals distinct properties of three isoforms [J].JournalofBiologicalChemistry, 2008, 283 (47): 32598-32609.
Hou CX, Tan GX, Liu T,etal.Advances in defense machanism of insects against pathogenic fungi [J].JournalofAnhuiAgriculturalSciences, 2012, 40 (23): 11649-11652.[候成香, 覃光星, 刘挺, 等.昆虫对病原真菌的防御机制研究进展[J].安徽农业科学, 2012, 40 (23): 11649-11652]
Jeffrey GS, Wesley CW, Leo WB,etal.Genome of the house fly,MuscadomesticaL., a global vector of diseases with adaptations to a septic environment [J].GenomeBiology, 2014, 15 (10): 466.
Kounatidis I, Ligoxygakis P.Drosophila as a model system to unravel the layers of innate immunity to infection [J].OpenBiology, 2012, 2 (5): 120075.
Kurata S.Peptidoglycan recognition proteins in Drosophila immunity [J].DevelopmentalandComparativeImmunology, 2014, 42 (1): 36-41.
Lee H, Kwon HM, Park JW,etal.N-terminal GNBP homology domain of Gram-negative binding protein 3 functions as a beta-1, 3-glucan binding motif in Tenebrio molitor [J].BMBReports, 2009, 42 (8): 506-510.
Lindsay SA, Wasserman SA.Conventional and non-conventional Drosophila Toll signaling [J].DevelopmentalandComparativeImmunology, 2014, 42 (1): 16-24.
Matskevich AA, Quintin J, Ferrandon D.The Drosophila PRR GNBP3 assembles effector complexes involved in antifungal defenses independently of its Toll-pathway activation function [J].EuropeanJournalofImmunology, 2010, 40 (5): 1244-54.
Mishima Y, Quintin J, Aimanianda V,etal.The N-terminal domain of Drosophila gram-negative binding protein 3 (GNBP3) defines a novel family of fungal pattern recognition receptors [J].JournalofBiologicalChemistry, 2009, 284 (42): 28687-28697.
Peng CL, Wang Y, Wu JW,etal.Cloning expression and sequence analysis of heat shock protein 20 ofMuscadomestica[J].ChineseJournalofPublicHealth, 2015, 31 (3): 330-333.[彭传林, 王宇, 吴建伟,等.家蝇热休克蛋白HSP20 基因克隆、表达和序列分析[J].中国公共卫生, 2015, 31 (3): 330-333]
Peng HY, Ma YH, Gang W.Expression of STAT3 mRNA in esophageal squamous cell carcinoma by real time RT-PCR [J].JournalofShandongMedicalCollege, 2015, 37 (5): 367-370.[彭海英, 马育华, 高伟.实时荧光定量RT-PCR检测STAT3 mRNA在食管鳞状细胞癌中的表达 [J].山东医学高等专科学校学报, 2015, 37 (5): 367-370]
Quintin J, Asmar J, Matskevich AA,etal.The Drosophila Toll pathway controls but does not clearCandidaglabratainfections [J].TheJournalofImmunology,2013, 190 (6): 2818-27.
Song XL, Li GX.Advance of actional machanism for the toxin of entomopathogenic fungi to insects [J].ActaMicrobiologicaSinica, 2002, 42 (3):126-130.[宋肖玲, 李国霞.昆虫病原真菌毒素对昆虫的作用机制研究进展[J].微生物学报, 2002, 42 (3): 126-130]
Takahasi K, Ochiai M, Horiuchi M,etal.Solution structure of the silkworm betaGRP/GNBP3 N-terminal domain reveals the mechanism for beta-1, 3-glucan-specific recognition [J].ProceedingsoftheNationalAcademyofSciences, 2009, 106 (28): 11679-11684.
Wang Y, Wu GJ, Luo M,etal.Cloning and prokaryotic expression ofMuscadomesticaThymosin gene [J].BiotechnologyBulletin, 2015, 31 (2): 143-147.[王宇, 吴高吉, 罗曼, 等.家蝇Thymosin(THY) 基因的克隆及原核表达[J].生物技术通报, 2015, 31 (2): 143-147]
Wang Y, Yang P, Cui F, Kang L.Altered immunity in crowded locust reduced fungal (Metarhiziumanisopliae) pathogenesis [J].PLoSPathogens, 2013, 9 (1): e1003102.
Xiu JF, Wei CC, Chen MM,etal.Expression analysis of immune genes at different induction conditions of third instar larvae ofMuscadomestica[J].BiotechnologyBulletin, 2014, 6: 120-127.[修江帆, 魏川川, 陈明明, 吴建伟.不同诱导条件下家蝇 (Muscadomestica) 三龄幼虫免疫相关基因的表达研究[J].生物技术通报, 2014, 6: 120-127]
Xiu JF, Wei CC, Shang XL,etal.Cloning and prokaryotic expression ofMuscadomesticacarboxypeptidase gene [J].GunagdongAgriculturalSciences, 2014, 10: 152-154.[修江帆, 魏川川, 尚小丽, 等.家蝇 (Muscadomestica) 羧肽酶基因克隆及原核表达[J].广东农业科学, 2014, 10: 152-154]
Yi JM, Qu WB, Zhang CG.Data analysis methods of real-time fluorescent quantitative PCR [J].LettersinBiotechnology, 2015, 31 (1): 140-145.[易健明, 屈武斌, 张成岗.实时荧光定量PCR的数据分析方法[J].生物技术通讯, 2015, 31 (1): 140-145]
Zhong D, Wang MH, Pai A,etal.Transcription profiling of immune genes during parasite infection in susceptible and resistant strains of the flour beetles (Triboliumcastaneum) [J].ExperimentalParasitology, 2013, 134 (1): 61-67.
Cloning and expression pattern ofGNBP3 gene under the fungal infection inMuscadomestica
HU Ya1,2, LUO Man1, WANG Yu1,3, WANG Tao1,SHANG Xiao-Li1, ZHANG Ying-Chun1, XIU Jiang-Fan1,4*,WU Jian-Wei1,4
(1.Basic Medical College, Medical University of Guizhou, Guiyang 550004, China; 2.Bijie First Municipal People’s Hospital,Bijie 551700,Guizhou Province,China;3.Guizhou Provincial Center for Disease Control and Prevention, Guiyang 550004, China; 4.Bokang Biological Engineering Company Limited of Guizhou, Guiyang 550004, China)
To cloning and research the expression pattern ofGNBP3 Gene inMuscadomesticalarvae infected byCandidaalbicans.TheGNBP3 gene which was isolated fromM.domesticacDNA library was analyzed by the bioinformatics methods.M.domesticalarvae infectionC.albicansand collect specimens,total RNA was extracted from these samples and reverse transcription for cDNA,the expressions ofGNBP3 were detected by real-time fluorescent quantitative PCR.Laboratory data were then analysed statistically.The results indicated that the full-length ofGNBP3 gene was 1473 bp,encoding 490 amino acid.The molecular weight 55.8 kDa and pI of 6.85.Different time points after infection, infection group GNBP3 mRNA expression increased obviously in 3 h, 12 h and 36 h, 48 h compared with control group,comparing the two groups have a significant difference(P<0.05),and 24 h express different minima;Infection group different tissue compared with control group,express in the body wall, hemolymph and blood fat body volume significantly increased in 12 h, 3 h(P<0.05);Higher expression in the haemolymph, but low amount of expression in the salivary glands and the fat body than the control group of 24 h, have significant difference(P<0.05);Expressed in the hemolymph and blood fat body quantity higher,but low expression of intestinal amount than those of the control group in 48 h, all have significant difference(P<0.01).TheM.domesticaGNBP3 gene was successfully purified and analyzed by the bioinformatics methods.M.domesticalarvae infectionC.albicans,GNBP3 expression levels decrease with the passage of time after the first increase and then the trend of rise,the expression significantly increased in immunohistochemical (hemolymph and blood fat body),presumably play in the process of identifying the potential role of fungus.
GNBP3; real-time fluorescent quantitative PCR; infect; MRNA expression levels;Muscadomestica
胡亚,罗嫚,王宇,等.家蝇GNBP3基因克隆及感染白色念珠菌后的表达[J].环境昆虫学报,2017,39(3):596-604.
国家自然科学基金(81360254);贵州省科技厅省校合作项目(黔科合LH字〔2014〕7076号);贵州省卫生计生委科学技术项目(gzwjkj2014-2-100);贵州省科学技术基金(黔科合J字〔2013〕2042号)
胡亚,女,硕士研究生,研究方向为医学昆虫免疫及应用,E-mail: hooyaa@126.com
*通讯作者Author for correspondence, E-mail: xiujiangfan@163.com; wjw@gmc.edu.cn
Received: 2016-04-26;接受日期Accepted: 2016-06-30
Q963
A
1674-0858(2017)03-0596-09

