COPD患者中OxLDL与可溶性LOX-1的表达及意义
李雅男 苏鹏宇
河北省尚义县医院内一科 河北张家口 076750;①华北理工大学附属医院
COPD患者中OxLDL与可溶性LOX-1的表达及意义
李雅男 苏鹏宇①
河北省尚义县医院内一科 河北张家口 076750;①华北理工大学附属医院
①目的 探讨在慢性阻塞性肺疾病(COPD)患者中氧化低密度脂蛋白(OxLDL)与植物凝集素样氧化低密度脂蛋白受体-1(LOX-1)的表达及意义。②方法 52例患者为急性发作期COPD组,32例患者为稳定期COPD组,30例为健康对照组。应用ELISA测量血浆中可溶性LOX-1(sLOX-1)与OxLDL的浓度,比较三组间一般资料情况。③结果 急性发作期COPD组患者血浆中LOX-1为(6.15±2.56)mU/mL,明显高于稳定期COPD组(2.12±0.95)mU/mL(P<0.001)以及健康对照组(1.97±1.12)mU/mL,(P<0.001)。血浆中OxLDL水平在急性发作期COPD组(16.63±7.43)mU/mL明显高于稳定期COPD组(13.25±5.41)pg/mL,(P<0.0001)。sLOX-1与血氧分压(PaO2) (r=-0.509,P<0.001)及OxLDL(r=0.406,P<0.001)有显著的相关性。④结论 在COPD急性加重期低氧状态下LOX-1与OxLDL表达增加并且两者之间有相关性。
植物凝集素样氧化低密度脂蛋白受体-1 氧化低密度脂蛋白 慢性阻塞性肺疾病 低氧血症
慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease,COPD)是一种气道进展性的,部分不可逆的阻塞与气道炎症以及氧化/抗氧化失衡有关[1]。最近研究表明,一部分COPD患者由于炎症累及循环系统,引起系统性炎症性损伤,例如对心脏影响可导致冠心病(Coronary Heart Disease,CHD)。Yongchun Shen等人研究发现,在COPD患者中氧化低密度脂蛋白(Oxidized Low Density Lipoprotein,OxLDL)明显增高,并与血浆C反应蛋白及氧化应激有关,这提示OxLDL可能在COPD与CHD之间起着重要的桥梁作用[2]。
植物凝集素样氧化低密度脂蛋白受体-1(Lectin-like Oxidized Low Density Lipoprotein Receptor-1,LOX-1)是存在内皮细胞上的OxLDL受体,LOX-1与CHD密切相关,并认为是CHD治疗的新靶点[3]。因此,推测在COPD低氧状态下LOX-1可能介导OxLDL参与COPD的肺外效应,特别是增加了COPD患者CHD的发生率。LOX-1在靠近跨膜域的氨基酸被水解形成含有C-型凝血素样结构域的可溶性受体形式,释放到血浆中形成可溶性LOX-1(soluble LOX-1,sLOX-1)[3],故本研究通过检测不同病程COPD患者血浆中sLOX-1证实该假设,这将为进一步探讨COPD致病机制提供临床依据。
1 对象与方法
1.1 研究对象 根据中华医学会呼吸学分会2007年《慢性阻塞性肺疾病诊治指南》中COPD诊断标准。选取2013~2014年因急性加重期再次入住我院的急性发作期慢性阻塞性肺疾病(AECOPD)患者52例,从发病到入院大于24小时,并且未曾给予持续氧气吸入,入院后血气分析提示血氧分压(PaO2)<60mmHg。稳定期COPD组为经治疗后COPD稳定期门诊随访患者32例,即经过治疗后,无咳嗽、咳痰、喘息加重3个月门诊随访,血气分析PaO2>75mmHg。健康对照组,既往无呼吸系统疾病,健康查体者共30例,血氧饱和度(SaO2)>97%。排除标准:肺结核、哮喘、支气管扩张、肿瘤及癌变、心功能不全、冠心病、糖尿病、关节炎、结缔组织病、甲状腺功能异常、心肝肾功能异常等器质性病变。
1.2 方法 常规监测(WBC)、红细胞(RBC)、红细胞压积(Hct)、血小板(PLT),血气分析包括PaO2、二氧化碳分压(PaCO2)以及pH值,肺功能包括用力肺活量实测/预计(FVC%)、一秒用力呼气容积实测/预计(FEV1%)。检测末梢血氧饱和度(SaO2)。
1.3 sLOX-1、OxLDL测定 sLOX-1、OxLDL滴度用ELISA试剂盒检测。分别设空白孔、标准孔、待测样品孔。空白孔加样品稀释液100μL,余孔分别加标准品或待测样品100μL和100μL生物素螯合剂,轻轻晃动混匀,酶标板加上盖或覆膜,37℃反应60分钟。弃去孔内液体,甩干,洗板5次,每次浸泡1~2分钟,甩干。每孔加检测溶液A和B工作液100μL,37℃,15分钟。依序每孔加终止溶液50μL,终止反应。在加终止液后15分钟用酶联仪在450nm波长依序测量各孔的光密。
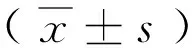
2 结果
2.1 三组间一般资料比较 性别、年龄、身高、体质量、体质量指数差异均无统计学意义(P>0.05)。血常规中RBC、Hct、PLT与WBC急性加重期明显增高。在AECOPD组与COPD组血气分析及肺功能比较中,除PH值无差异,PaO2、PaCO2、SaO2、 用力肺活量(FVC)、一秒用力呼气容积(FEV1)之间差异均有统计学意义,见表1。
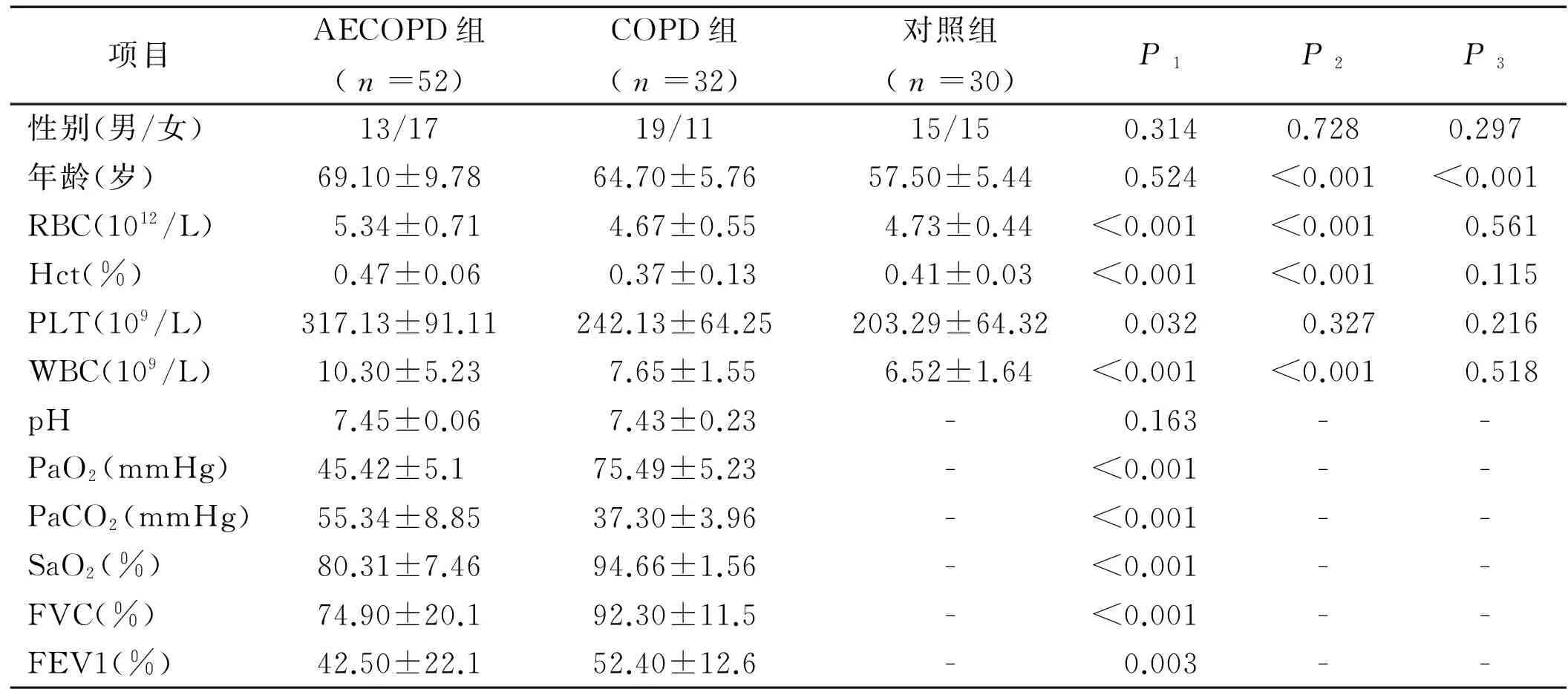
表1 三组间一般资料的比较
注:P1为AECOPD组与COPD组比较;P2为AECOPD组与对照组比较;P3为COPD组与对照组比较
2.2 方差分析三组间sLOX-1与OxLDL浓度之间的差异 AECOPD组OxLDL为(16.63±7.43)mU/mL,COPD组与对照组分别为(13.25±5.41)pg/mL与(12.96±7.36)mU/mL,AECOPD组较COPD组与对照组差异有统计学意义(P<0.001),COPD组与对照组之间没有统计学意义(P=0.089)。

表2 AECOPD组中各参数与sLOX-1之间的相关性分析
AECOPD组sLOX-1为(6.15±2.56)mU/mL,COPD组与对照组分别为 (2.12±0.95)mU/L 与 (1.97 ± 1.12)mU/L, AECOPD组较COPD组与对照组差异有统计学意义(P<0.001),COPD组与对照组之间未见明显差异(P=0.312)。
在各参数与sLOX-1之间的相关性分析发现,与OxLDL(r=0.455,P<0.001)、PaO2(r=0.509,P<0.001)、WBC(r=-0.508,P<0.001),PLT(r=0.459,P<0.001)之间密切相关,见表2。
3 讨论
OxLDL可通过相应的受体介导进入内皮细胞并诱导表达多种黏附分子,后者增强单核细胞和T淋巴细胞对内皮细胞的黏附及向内皮下移行,产生动脉粥样硬化一系列临床病理改变。LOX-1主要负责血管内皮细胞对OxLDL结合、内吞和降解,LOX-1除摄取OxLDL外,还可激活细胞内信号转导通路,介导OxLDL诱导细胞凋亡和增殖以及一些细胞因子黏附分子表达,如细胞间黏附分子-1(intercellular adhesion molecule,ICAM-1)、血管细胞黏附分子(vascular cell adhesion molecule,VCAM-1)、P-选择素和单核细胞趋化蛋白-1(monocyte chemoattractant protein,MCP-1)等,促进单核细胞黏附内皮细胞、内皮细胞功能失调损伤、泡沫细胞的形成,最终导致动脉粥样硬化的发生和发展,因此目前认为LOX-1在动脉粥样硬化形成中起着关键性始动作用[3,4]。
COPD重要的合并症是CHD,这是导致COPD患者死亡的主要原因[5],但两者之间的关系尚不明确。在先前动物实验以及临床试验中均证实在低氧状态下体内LOX-1表达增加,对呼吸睡眠综合征患者的研究发现,夜间间歇性缺氧可诱导LOX-1增高[6,7]。其机制可能是低氧状态产生大量的活性氧自由基以及过度氧化应激反应,以及体内相对抗氧化能力减低,导致脂质发生氧化增加,OxLDL生成增多[6],OxLDL进一步上调LOX-1表达增加。在本研究中COPD急性发作期患者中OxLDL以及sLOX-1表达均明显增多,并且与PaO2密切相关,这提示低氧状态下发生的氧化应激及炎症反应,不仅是COPD急性发作期一种病理反应,同时通过OxLDL以及LOX-1表达增加,进而促发了强直性脊柱炎的发生及发展。
由于本研究入选的急性加重期患者发病大于24小时,红细胞计数明显高于稳定期,这提示低氧血症可能在临床表现为急性加重期之前就已经存在,持续低氧状态可以上调缺氧诱导因子-1(Hypoxia-Inducible Factor-1,HIF-1),HIF-1 激活促红细胞生成素转录启动子,促进红细胞增多,以适应低氧状态[5]。本研究中发现白细胞计数在急性发作期较稳定期增高,这可能与感染有关,sLOX-1与WBC密切相关,提示炎症可能参与调控sLOX-1增加。另外研究未发现sLOX-1与肺功能之间有明显相关性,这可能与急性加重期全身低氧血症及炎症比肺部局部组织对LOX-1影响更为明显,不除外sLOX-1与肺功能测试时间不同有关。
sLOX-1与OxLDL在COPD急性加重期中表达增加,提示LOX-1在介导COPD患者发生CHD的过程中起关键作用,可能是干预COPD肺外效应的治疗靶点。
[1] J.Vestbo,S.S.Hurd,A.G.Agust,et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease:GOLD executive summary[J].American Journal of Respiratory and Critical CareMedicine,2013,187(4):347-365
[2] Yongchun Shen,Ting Yang,Shujin Guo,et al.Increased Serum ox-LDL Levels Correlated with Lung Function,Inflammation,and Oxidative Stress in COPD[J].Mediators of Inflammation,2013,1-5
[3] 苏鹏宇,王绿娅,吴兆苏.凝血素样氧化低密度脂蛋白受体结构与动脉粥样硬化[J].现代生物医学进展,2008,7(8):1376-1382
[4] Mehta JL,Chen J,Hermonat PL,et al.Lectin-like,oxidized low-density lipoprotein receptor-1(LOX-1):a critical player in the development of atherosclerosis and related disorders[J].Cardiovasc Res,2006,69:36-45
[5] K.Ghoorah,A.de Soyza,V.Kunadian.Increased cardiovascular risk in patients with chronic obstructive pulmonary disease and the potential mechanisms linking the two conditions:a review[J].Cardiology Review,2013,21(4):196-202
[6] 李 艳,聂秀红,张 威,等.氧化低密度脂蛋白受体-1与体内氧化应激水平相关性研究[J].首都医科大学学报,2013,4(34):609-614
[7] 徐志勇,宫姝宁,桑崇铃.阻塞性睡眠呼吸暂停综合征合并高血压30例临床特点[J].解放军医药杂志, 2012,24(5):18-19
(2016-12-11 收稿)(库雪飞 编辑)
Expression and significance of OxLDL and sLOX-1 in COPD patients
LI Yanan,SU Pengyu
(Shangyi County Hospital, Zhangjiakou 076750,China)
Objective To explore the expression and the significance of OxLDL and LOX-1 in COPD patients. Method The exacerbated COPD group were consisted of 52 patients.The stable COPD group were consisted of 32 patients, and 30 healthy control graup. The serum concentrations of sLOX-1 and OxLDL were measured by ELISA. Compared the general information among the three groups. Results Patients with exacerbated COPD had significantly higher serum sLOX-1 levels (6.15±2.56)mU/mL compared to those with stable COPD (2.12±0.95)mU/mL (P<0.0001) and healthy control group (1.97±1.12)mU/mL (P< 0.0001). Serum OxLDL levels were significantly higher in the exacerbated COPD group (16.63±7.43)mU/mL compared to stable COPD group (13.25±5.41)pg/mL,(P=0.0001). sLOX-1 was significantly associated with PaO2(r=-0.509,P<0.001) and OxLDL(r=0.406,P<0.001).Conclusion The expression of sLOX-1 and OxLDL increased in the hypoxic state of acute exacerbated COPD and there is a correlation between them.
Lectin-like oxidized low density lipoprotein receptor-1.Oxidized low density lipoprotein.Chronic obstructive pulmonary disease.Hypoxia
2008年卫生部人类疾病比较医学重点实验室开放课题基金项目(编号:ZDS200801)。
李雅男(1972-),男,学士,副主任医师。研究方向:慢性心力衰竭治疗。
R 563
A
2095-2694(2017)04-281-04

