低氧、低氧训练对小鼠骨骼肌Nrf2/Keap1结合量和p-Nrf2表达的影响
姬卫秀,何诗依,严 露,张 缨
JI Wei-xiu,HE Shi-yi,YAN Lu,ZHANG Ying
低氧、低氧训练对小鼠骨骼肌Nrf2/Keap1结合量和p-Nrf2表达的影响
姬卫秀,何诗依,严 露,张 缨
JI Wei-xiu,HE Shi-yi,YAN Lu,ZHANG Ying
目的:转录因子NF-E2相关因子(Nrf2)-Kelch样环氧氯丙烷相关蛋白-1(Keapl)信号通路是细胞氧化应激反应中的关键通路。普遍认为,长期低氧训练会影响抗氧化能力,研究试图通过对小鼠施加低氧暴露、低氧训练两种方式,探讨其对小鼠骨骼肌Nrf2/Keap1结合量和Nrf2、Keap1、p-Nrf2蛋白表达以及活性氧(ROS)水平的影响。方法:C57BL/6J小鼠30只,分为3组,分别是对照组(C)、低氧组(H)和低氧训练组(HT)。其中,小鼠跑台训练的跑速为12 m/min,1 h/d,6 d/周,持续4周;低氧浓度为10%,8 h/d,持续4周。干预结束后脱颈处死取后腿两侧骨骼肌。Western Blot法测定骨骼肌Nrf2、Keapl和p-Nrf2的蛋白表达。免疫共沉淀法测Nrf2/Keap1结合量。高质荧光测定法检测小鼠骨骼肌ROS水平。结果:与C组相比,H、HT组小鼠骨骼肌中Nrf2/Keap1结合量显著升高,游离Nrf2显著降低,p-Nrf2蛋白表达显著降低,游离Keap1基本无变化。WHT组ROS水平显著高于WC组。结论:氧浓度为10%的4周低氧暴露和低氧训练均抑制了小鼠骨骼肌Nrf2和Keap1的解绑作用;低氧训练组小鼠骨骼肌p-Nrf2蛋白水平非常显著性降低,可能是造成ROS水平显著升高的原因之一。
低氧;低氧训练;Nrf2/Keap1;p-Nrf2
近年来,低氧训练已成为运动员提高运动成绩的重要辅助手段。研究已表明,低氧训练可影响骨骼肌的抗氧化能力[1,3,4,11],但其作用机制目前并不十分清楚。
NF-E2相关因子(NF-E2-related factor 2,Nrf2)是细胞氧化应激反应中的关键转录因子,可调节靶基因Ⅱ相解毒酶和抗氧化酶基因的表达[11,26]。Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein-1,Keapl),是Nrf2的调节者,对Nrf2功能起负调控作用[19]。在正常情况下,Keapl与Nrf2耦联,并与肌动蛋白结合被锚定于胞浆中,通过泛素化介导Nrf2蛋白降解,从而维持细胞浆内Nrf2处于较低水平[15]。而当机体受到氧化应激刺激后,Keap1蛋白上半胱氨酸的巯基易受到破坏,使其构象发生改变,可促进Nrf2与Keapl偶联作用的解除。同时,氧化应激刺激使Nrf2/Keap1复合物中的Nrf2发生磷酸化(p-Nrf2),加剧其和Keap1的解离作用,也可使游离Nrf2发生磷酸化[10,14],从而使Nrf2和P-Nrf2在细胞浆中聚集,并转位进入细胞核与Maf蛋白形成杂化二聚体[25],而后与下游靶基因DNA上的抗氧化元件(ARE)结合,启动其靶基因的转录,成为许多抗氧化基因的开关[17,20]。
运动可以激活Nrf2-ARE通路,增强心肌的抗氧化防御能力,但Nrf2敲除鼠这种作用减弱[22]。也有研究发现,急性运动可使小鼠骨骼肌细胞核Nrf2的蛋白表达升高[5]。在低氧环境中,机体细胞缺氧,会产生一系列的反应。低氧预处理可以激活Nrf2及其靶基因的表达,从而提高大鼠胚胎心肌细胞的生物学功能及抗缺氧能力[16]。沉默Nrf2基因后,低氧导致的内皮细胞凋亡增加,细胞的体外增殖活动减少[28]。但也有研究表明,慢性间歇性低氧暴露4周和8周小鼠心肌组织中Nrf2表达水平下降[8]。在氧浓度为零的极度缺氧环境下培养24 h的人类晶状体上皮细胞,其Nrf2蛋白和mRNA表达降低,导致严重的细胞蛋白破坏[29]。
由上可知,低氧与Nrf2关系密切。然而,低氧暴露和低氧训练如何影响骨骼肌的Nrf2信号及其抗氧化作用,目前并不十分清楚。因此,本研究试图通过动物实验,以Nrf2/Keap1复合物为切入点,探讨4周低氧暴露和低氧训练,对小鼠骨骼肌Nrf2/Keap1结合量和Nrf2、Keap1、p-Nrf2蛋白表达以及活性氧(ROS)水平的影响,为低氧训练影响骨骼肌抗氧化作用的分子机制提供理论依据。
1 材料与方法
1.1 研究对象
健康8周龄C57BL/6J雄性小鼠(购于维通利华公司实验动物技术有限公司,动物合格证书:SCX-K(京)2009-0004)30只,按体重随机分为3组,分别是对照组(C组),低氧暴露组(H组),低氧训练组(HT组),每组10只。小鼠体重(18.37±2.26)g,每笼3~4只饲养于北京体育大学动物房,动物房温度保持在20~25℃,相对湿度保持在50%~70%,每天光照12 h(7:00~19:00),3组动物均自由进食和饮水。
1.2 干预方案
低氧暴露组小鼠每天暴露在常压低氧环境中8 h(8:00~16:00),氧气浓度为10%,持续4周;通过制氮机(北京创文气体有限公司)、冻干机(杭州超滤)和空气压缩机(美国英格索兰)共同作用将空气中的氮气通入动物饲养室内达到相应氧浓度;低氧训练组的低氧环境与低氧组相同,并在低氧环境下进行跑台运动,经过两天的适应性训练后,进行正式训练,其中,跑速12m/min,坡度为0,每天1 h,每周6天,持续4周。
1.3 取材
最后一次训练结束后,休息48 h脱颈处死,迅速取两侧腿部骨骼肌,用锡纸包裹标记,投于液氮,后转移至-80℃冰箱备后续之用。
1.4 指标测定
1.4.1 提取总蛋白
取100 mg组织,加入800μl含蛋白酶抑制剂的RIPA蛋白裂解液,超声匀浆,冰上静置30 min,随后12 000 rpm,4℃离心30 min,取上清溶液即为总蛋白。
1.4.2 Western blot
对提取的组织蛋白进行BCA蛋白浓度测定(BCA Protein Assay Reagent,美国Thermo Scientific公司),根据浓度计算配样,上样量为20μg。采用Bolt 4%~12% Bis-Tris Plus凝胶(美国life technologies公司)和NuPAGE MOPS SDS电泳缓冲液(美国life technologies公司)进行电泳。之后采用美国Invitrogen公司的iBlot 2将蛋白从电泳凝胶转移至NC膜上。目的条带标记后用5%的脱脂牛奶或BSA封闭1 h后,进行一抗孵育:p-Nrf2(bs-2013R,1:200)、Nrf2(sc-722,1:200)、Keap1(sc-33569,1:500)、内参β-actin(sc-47778,1:1 000),于4℃摇床孵育过夜。次日洗脱一抗后进行二抗孵育1 h:p-Nrf2(羊抗兔,中杉金桥,ZB-2301,1:5 000)、Nrf2(羊抗兔,中杉金桥,ZB-2301,1:2 000)、Keap1(羊抗兔,中杉金桥,ZB-2301,1:5 000)、β-actin(羊抗鼠,中科晨宇,164017,1:5 000)、。最后,洗脱二抗后加发光液用BIORAD凝胶显影仪器进行显影,用其配套软件进行条带检测与分析。读取灰度值,计算结果,公式如下:

1.4.3 免疫共沉淀
采用免疫共沉淀法测组织胞浆中Nrf2/Keap1的结合量。根据蛋白的浓度,用PBS稀释到1μg/μl;将1 ml已稀释的蛋白溶液中加入到含20μl Protein A/G Mix Magnetic Beads(美国Millipore公司,LSKMAGAG02)的离心管中,4℃摇床2 h,将离心管放到磁力架(美国Millipore公司),转移上清;向上清中加入5μl Nrf2抗体(sc-30915,santa cruz)(Input中加入Nomal goat IgG),4℃摇床过夜;次日加入30 μl Protein A/G Mix Magnetic Beads,室温摇床2 h,弃上清,PBS清洗3次,加35 μl上样缓冲液洗脱,70℃水浴10 min,转移上清液,重复洗脱第二遍,共吸出上清液70μl。用Bolt 4%~12% Bis-Tris Plus凝胶(美国life technologies公司)上样30μl进行电泳。之后,采用美国Invitrogen公司的iBlot 2将蛋白从电泳凝胶转移至NC膜上。目的条带标记后用5%的脱脂牛奶封闭1 h后,加入一抗稀释液Keap1(sc-33569,1:500),于4℃摇床孵育过夜。次日洗脱一抗后加入二抗稀释液(羊抗兔,中杉金桥,ZB-2301,1:5 000),室温摇床孵育1 h。最后,洗脱二抗后加发光液用BIO-RAD凝胶显影仪器进行显影。
1.4.4 ROS测定
采用GENMED试剂盒(中国上海杰美基因医药科技有限公司,GMS10016.3)对小鼠骨骼肌ROS进行测定,实验操作严格按照试剂盒的说明书进行。
1.5 统计学分析
采用SPSS 17.0软件对实验数据进行统计处理,数据分析方法为单因素方差分析,用P<0.05和P<0.01分别表示具有显著性和非常显著性差异。
2 实验结果
2.1 低氧、低氧训练对小鼠骨骼肌 Nrf2/Keap1结合量的影响
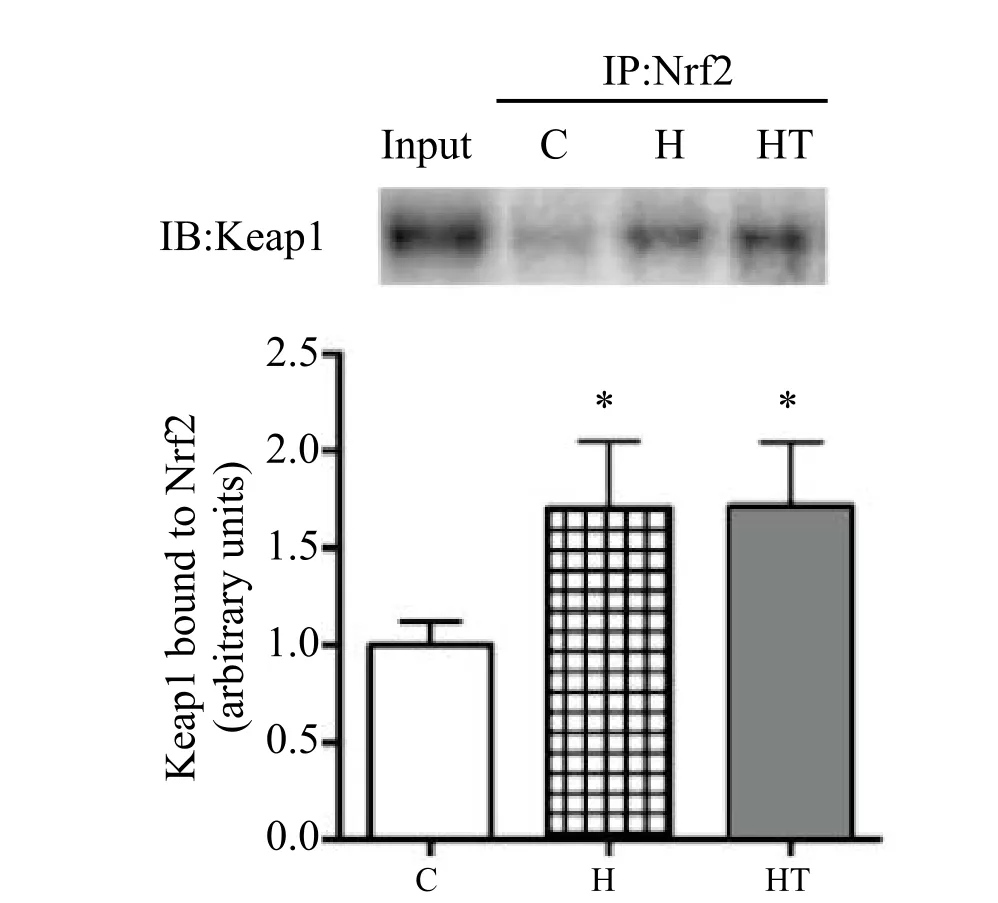
图1 各组小鼠骨骼肌Nrf2/Keap1结合量Figure 1 The Nrf2/Keap1 Binding Capacity in Skeletal Muscle of Mice
由图1可知,H、HT组分别与C组相比,小鼠骨骼肌Nrf2/Keap1复合物结合量显著性增加。
2.2 低氧、低氧训练对小鼠骨骼肌Nrf2蛋白表达的影响
由图2可知,H、HT组分别与C组相比,小鼠骨骼肌Nrf2蛋白表达量均显著性降低。
2.3 低氧、低氧训练对小鼠骨骼肌Keap1蛋白表达的影响
由图3可知,H、HT组分别与C组相比,小鼠骨骼肌Keap1蛋白表达均无显著性变化。
2.4 低氧、低氧训练对小鼠骨骼肌p-Nrf2蛋白表达的影响
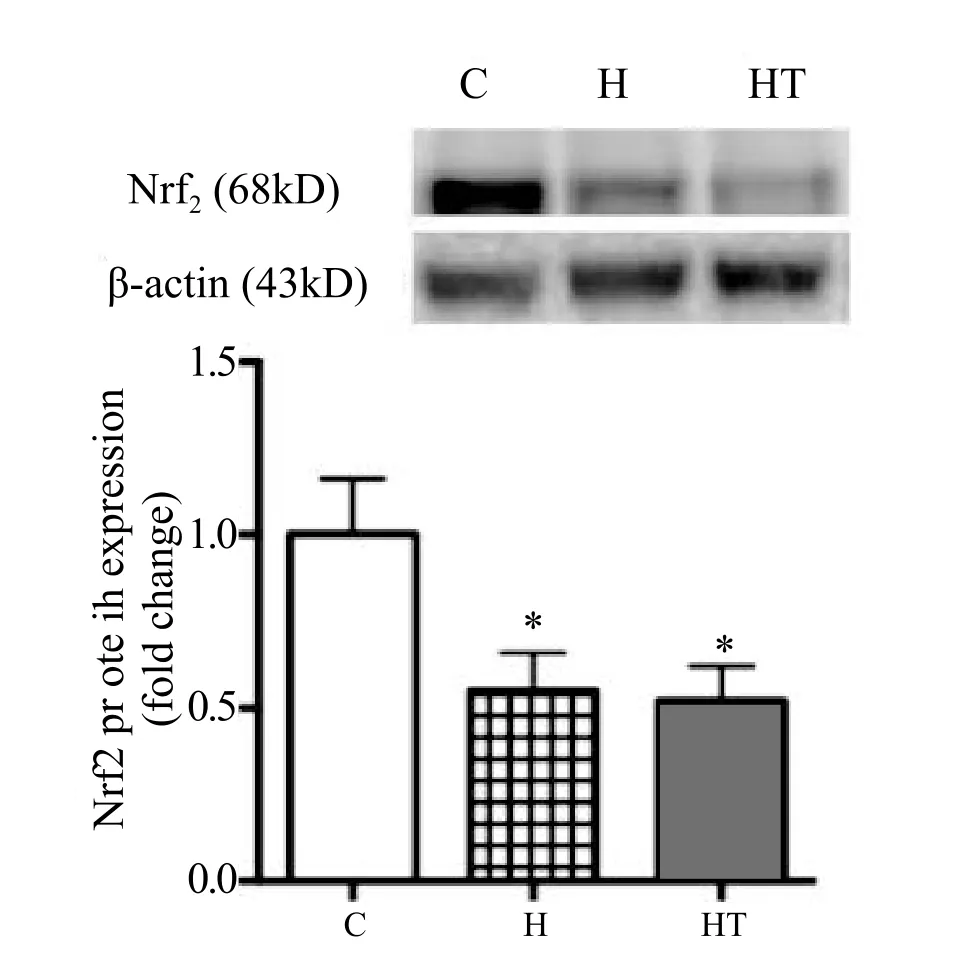
图2 各组小鼠骨骼肌Nrf2蛋白表达量Figure 2 The Expression of Nrf2 in Skeletal Muscle of Mice
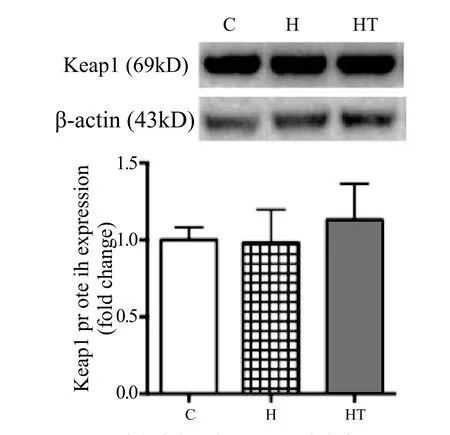
图3 各组小鼠骨骼肌Keap1蛋白表达量Figure 3 The Expression of Keap1 in Skeletal Muscle of Mice
由图4可知,间歇低氧暴露后,H组骨骼肌p-Nrf2蛋白表达水平与C组相比显著性下降;低氧训练后,HT组小鼠骨骼肌p-Nrf2蛋白表达量与C组相比,非常显著性降低。
2.5 低氧、低氧训练对小鼠骨骼肌活性氧(ROS)的影响
由图5可知,H组与C组相比,小鼠骨骼肌中ROS水平无显著性变化;HT组与C组相比,小鼠骨骼肌ROS水平显著性升高。
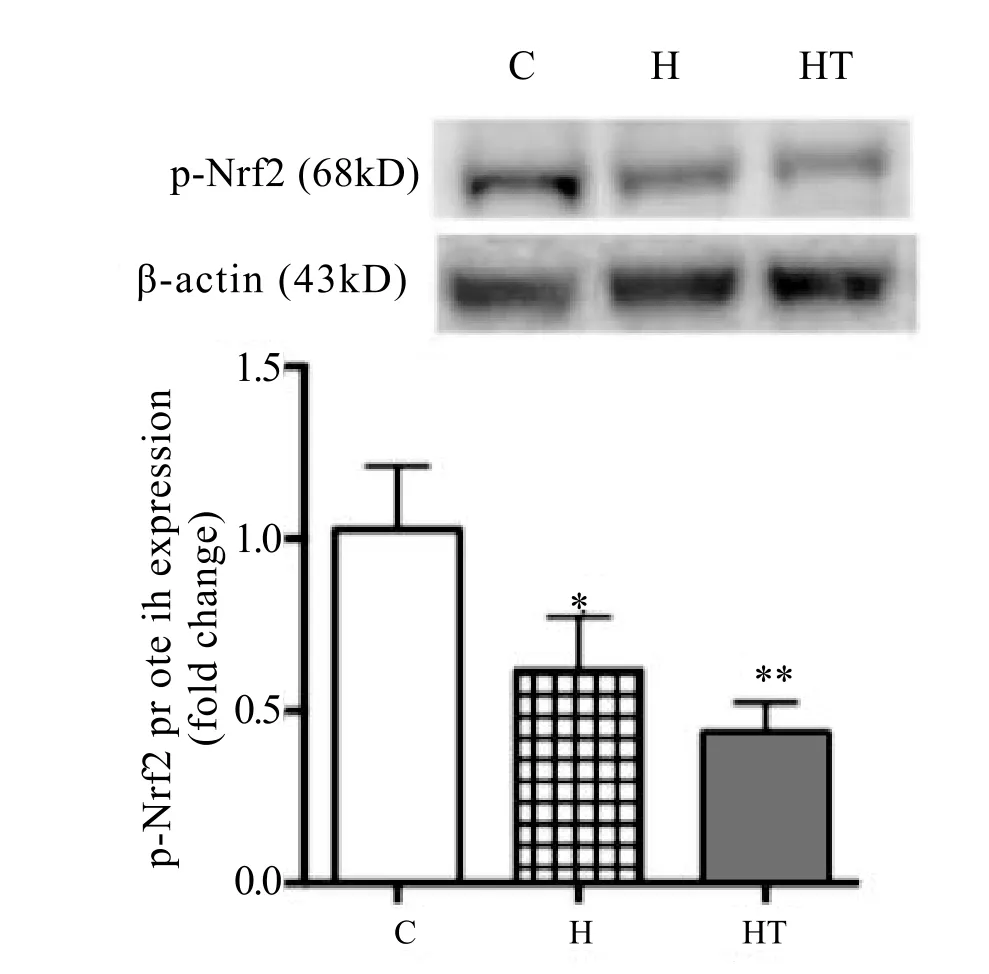
图4 各组小鼠骨骼肌p-Nrf2蛋白表达量Figure 4 The Expression of p-Nrf2 in Skeletal Muscle of Mice
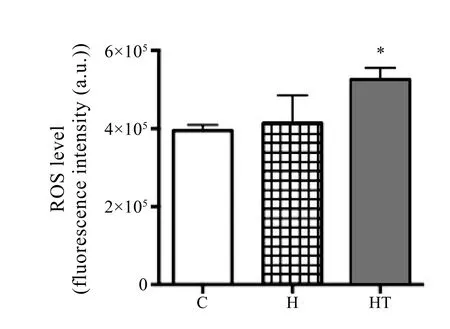
图5 各组小鼠骨骼肌ROSFigure 5 The Level of ROS in Skeletal Muscle of Mice
3 分析讨论
3.1 低氧、低氧训练对小鼠骨骼肌Nrf2、Keap1蛋白表达量和Nrf2/Keap1结合量的影响
缺氧模拟化合物氯化钴(CoCl2)处理小鼠视网膜神经节细胞和骨骼肌卫星细胞,可促进Nrf2从细胞质转位入细胞核,使核内Nrf2蛋白含量增加,进而上调Nrf2介导的抗氧化酶基因的转录[6,7]。Nrf2作为氧化应激反应的关键调节者,急性运动后小鼠心脏和骨骼肌细胞Nrf2核蛋白表达显著增加[18,22]。6周中等强度运动训练可提高年轻和年老小鼠心脏细胞Nrf2核蛋白的水平,从而使抗氧化酶的表达增强[13]。也有研究发现,4周和8周的慢性间歇低氧暴露,小鼠心肌组织中Nrf2表达水平下降[8]。在本研究中,低氧暴露、低氧训练这两种干预作用下,小鼠骨骼肌Nrf2蛋白表达量均显著性降低,且两种干预方式间无显著性差异。这种Nrf2蛋白表达量的降低可能与实验动物所处低氧环境的氧浓度有关。
有研究提出,Keap1与Nrf2的相互作用遵循着“开放”和“闭合”不同构象的循环方式。“开放”构象即1个Nrf2分子结合1个Keap1分子;“闭合”构象即1个Nrf2分子结合两个Keap1分子。当机体受到氧化应激刺激时,处于安静“开放”状态的分子可被诱导呈现为“闭合”态,从而释放出1个游离Nrf2分子,而Keap1结合数量仍保持不变,游离Keap1未被释放[9]。因此,在本研究中,低氧暴露、低氧训练两种干预作用下小鼠骨骼肌游离Keap1蛋白表达无显著性变化,可能与此相关。
Nrf2/Keap1复合物是Nrf2和Keap1结合物。在本研究中,低氧暴露、低氧训练两种干预作用下,小鼠骨骼肌Nrf2/ Keap1结合量均显著增加。说明两种干预方式使得Nrf2/ Keap1复合物的解离作用减弱,是造成游离Nrf2蛋白水平降低的重要原因。
3.2 低氧、低氧训练对小鼠骨骼肌p-Nrf2蛋白表达和ROS水平的影响
机体受到氧化应激后,Nrf2蛋白磷酸化(p-Nrf2)与Nrf2一样,在与Keap1解绑、核易位及其靶基因转录过程中也可能发挥着重要调控作用[10,23]。有研究发现,大鼠6周游泳运动后,海马体的p-Nrf2蛋白表达增加[12]。而在本研究中,低氧暴露、低氧训练这两种干预作用下小鼠骨骼肌p-Nrf2蛋白表达均降低,且降低程度依次增强,但两种干预方式之间并无显著变化。Nrf2蛋白磷酸化减少可能也会造成p-Nrf2与靶基因的ARE结合活性降低,从而影响靶基因的转录。
生物活性小分子ROS是细胞代谢的产物,正常情况下细胞内ROS的产生和清除能力之间呈现动态平衡。运动、低氧都会影响机体ROS的产生[2,24,27]。在本研究中,低氧暴露、低氧训练这两种干预作用下,低氧训练组小鼠骨骼肌ROS水平显著性增加,说明p-Nrf2蛋白表达的非常显著性降低可能影响了下游抗氧化酶的表达,进而使骨骼肌的ROS水平提高。
4 结论
氧浓度为10%的4周低氧暴露和低氧训练均抑制了小鼠骨骼肌Nrf2和Keap1的解绑作用;且低氧训练组小鼠骨骼肌p-Nrf2蛋白水平非常显著性降低,可能是造成ROS水平显著升高的原因之一。
[1] 薄海,李玲,段富强,等. 低氧复合运动抑制低氧诱导的骨骼肌线粒体DNA氧化损伤 [J]. 生理学报,2014,(5):597-604.
[2] 薄海,王义和,李海英,等. 耐力训练抑制急性低氧时骨骼肌线粒体生物能学变化:ROS和UCP3的作用 [J]. 生理学报,2008,(6):767-76.
[3] 黄丽英,翁锡全,林文弢,等. 间歇低氧训练对抗氧化酶系统及其适应能力的影响 [J]. 广州体育学院学报,2007,(2):111-115.
[4] 黄丽英,翁锡全,林文弢. 间歇低氧训练活性氧介导基因调控作用的研究 [J]. 北京体育大学学报,2008,(5):615-617.
[5] 李铁瑛,何诗依,刘思雪,等. 急性运动对小鼠骨骼肌核蛋白Nrf2-ARE结合活性的影响 [J]. 中国运动医学杂志,2015,(07):649-652,687.
[6] 刘永,李俊平,罗冬梅. CoCl2预处理对C2C12细胞氧化损伤后增殖和Nrf2表达的影响 [J]. 中国运动医学杂志,2014,(03):238-241.
[7] 裴涌,郝旭红,孙晓楠. 低氧对视网膜神经节细胞中Nrf2及其调控的抗氧化酶表达的影响 [J]. 解剖科学进展,2016,(01):26-28.
[8] 周珊珊. Nrf2与MT的协同作用在保护慢性间歇性低氧所致心脏损伤中的作用 [D].长春:吉林大学,2015.
[9] BAIRD L,LLERES D,SWIFT S,et al. Regulatory flexibility in the Nrf2-mediated stress response is conferred by conformational cycling of the Keap1-Nrf2 protein complex [J]. Proc Nat Acad Sci U S A,2013,110(38):15259-15264.
[10] BLOOM D A,JAISWAI A K. Phosphorylation of Nrf2 at Ser40 by protein kinase C in response to antioxidants leads to the release of Nrf2 from INrf2,but is not required for Nrf2 stabilization/accumulation in the nucleus and transcriptional activation of antioxidant response element-mediated NAD(P)H:quinone oxidoreductase-1 gene expression [J]. J Bio Chem,2003,278(45):44675-44682.
[11] CHEN T I,TU W C. Exercise attenuates intermittent hypoxia-induced cardiac fibrosis associated with sodium-hydrogen exchanger-1 in rats [J]. Frontiers Physiol,2016,7:462.
[12] DA SILVA FIORIN F,DE OLIVERRA A P,RIBEIRO L R,et al. The impact of previous physical training on redox signaling after traumatic brain injury in rats:A behavioral and neurochemical approach [J]. J Neurotrauma,2016,33(14):1317-1330.
[13] GOUNDER S S,KANNAN S,DEVADOSS D,et al. Impaired transcriptional activity of Nrf2 in age-related myocardial oxidative stress is reversible by moderate exercise training [J]. PloS one,2012,7(9):e45697.
[14] HAYES J D,MCMAHON M. NRF2 and KEAP1 mutations:permanent activation of an adaptive response in cancer [J]. Trends Biochemical Sci,2009,34(4):176-188.
[15] ITOH K,MIMURA J,YAMAMOTO M. Discovery of the negative regulator of Nrf2,Keap1:a historical overview [J]. Antioxid Redox Signal,2010,13(11):1665-1678.
[16] KOLAMUNNE R T,DIAS I H,VERNALLIS A B,et al. Nrf2 activation supports cell survival during hypoxia and hypoxia/reoxygenation in cardiomyoblasts;the roles of reactive oxygen and nitrogen species [J]. Redox Bio,2013,1:418-426.
[17] KWAK M K,WAKABAYASHI N,KENSLER T W. Chemoprevention through the Keap1-Nrf2 signaling pathway by phase 2 enzyme inducers [J]. Mutat Res,2004,555(1-2):133-148.
[18] LI T,HE S,LIU S,et al. Effects of different exercise durations on Keap1-Nrf2-ARE pathway activation in mouse skeletal muscle [J]. Free Radic Res,2015,49(10):1269-1274.
[19] MENEGON S,COLUMBANO A,GIORDANO S. The dual roles of Nrf2 in cancer [J]. Trends Mol Med,2016,22(7):578-593.
[20] MIN K J,KIM J H,JOU I,et al. Adenosine induces hemeoxygenase-1 expression in microglia through the activation of phosphatidylinositol 3-kinase and nuclear factor E2-related factor 2 [J]. Glia,2008,56(9):1028-1037.
[21] MOI P,CHAN K,ASUNIS I,et al. Isolation of NF-E2-related factor 2 (Nrf2),a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1 repeat of the beta-globin locus control region [J]. Proc Nat Acad Sci U S A,1994,91(21):9926-9930.
[22] MUTHUSAMY V R,KANNAN S,SADHAASIVAM K,et al. Acute exercise stress activates Nrf2/ARE signaling and promotes antioxidant mechanisms in the myocardium [J]. Free Radic Bio Med,2012,52(2):366-376.
[23] NGUYEN T,YANG C S,PICKETT C B. The pathways and molecular mechanisms regulating Nrf2 activation in response to chemical stress [J]. Free Radic Bio Med,2004,37(4):433-441.
[24] SACHDEV S,DAVIES K J. Production,detection,and adaptive responses to free radicals in exercise [J]. Free Radic Bio Med,2008,44(2):215-223.
[25] SEKHAR K R,RACHAKONDA G,FREEMAN K L. Cysteine-based regulation of the CUL3 adaptor protein Keap1 [J]. Toxi Appl Pharmacol,2010,244(1):21-26.
[26] SUZUKI T,YAMAMOTO M. Molecular basis of the Keap1-Nrf2 system [J]. Free Radic Bio Med,2015,88(Pt B):93-100.
[27] YAN Z. Exercise,PGC-1alpha,and metabolic adaptation in skeletal muscle [J]. Appl Physiol,Nut,Metab,2009,34(3):424-427.
[28] ZHAO R,FENG J,HE G. Hypoxia increases Nrf2-induced HO-1 expression via the PI3K/Akt pathway [J]. Front Biosci (Landmark ed),2016,21:385-396.
[29] ZHENG X Y,XU J,CHEN X I,et al. Attenuation of oxygen fluctuation-induced endoplasmic reticulum stress in human lens epithelial cells [J]. Exp Therapeutic Med,2015,10(5):1883-1887.
Effects of Hypoxia and Hypoxic Training on Nrf2/Keap1 Binding Capacity and p-Nrf2 Expression in Skeletal Muscle of Mice
Objective:NF-E2-related factor 2(Nrf2)-Kelch-like ECH-associated protein-1 (Keapl) signaling pathway is a key pathway of cell oxidative stress reaction. It is generally believed that the long-term hypoxic training could impact oxidation resistance. This research attempts to apply hypoxic training on mice to study the binding capacity of Nrf2/Keap1 and the contents of Nrf2、Keap1、p-Nrf2proteins in skeletal muscle. Methods:The 30 C57BL/6J mice were divided into three groups:control group (C),hypoxia group (H),hypoxic training group (HT). The mice ran on treadmill in speed of 12 m/min,1h/d,6d/week,for 4 weeks. Oxygen concentration in hypoxia chamber was 10%. Mice were treated for 4 weeks,8h/d. After both the interventions,the mice were sacrificed and collected skeletal muscle of legs. The expression of Nrf2,Keap1 and p-Nrf2were analyzed by western blot. High quality fluorescence assay was done to detect ROS level in skeletal muscle of mice. Result:Compared with C group,Nrf2/Keap1 binding capacity in skeletal muscle of H、HT groups mice was significantly increased while free Nrf2 and p-Nrf2were significantly reduced respectively;Free Keap1 did not change in skeletal muscle of mice;The ROS level in skeletal muscle of HT group mice significantly increased compared with C group mice. Conclusion:Hypoxia and hypoxic training which oxygen concentration was 10% could reduce the Nrf2/Keap1 unbinding capacity in skeletal muscle of mice. The exerpression of p-Nrf2in skeletal muscle of mice in hypoxic training group was significantly reduced,which may result in marked increase in ROS level.
hypoxia;hypoxic training;Nrf2/Keap1;p-Nrf2
1002-9826(2017)04-0114-05
10. 16470/j. csst. 201704016
G804.2
A
2016-11-28;
2017-05-24
国家自然基金项目(31471134);中央高校基本科研业务费资助;北京体育大学自主课题(2016BS004)。
姬卫秀,女,博士研究生,主要研究方向为运动与骨骼肌代谢,E-mail:jwx8918@163.com。
张缨,女,北京人,博士,博士研究生导师,研究方向为运动与骨骼肌代谢,E-mail:zhyi9256@126.com,Tel:(010)62989584
北京体育大学 运动人体科学学院,北京 100084
Beijing Sports University,Beijing 100084,China.

