改良Hyper-CVAD方案诱导治疗中老年pH阴性急性淋巴细胞白血病继发高血糖的临床研究
叶惠成,刘玉华
东莞市人民医院1内分泌科;2综合一科,广东 东莞 523059
改良Hyper-CVAD方案诱导治疗中老年pH阴性急性淋巴细胞白血病继发高血糖的临床研究
叶惠成1,刘玉华2
东莞市人民医院1内分泌科;2综合一科,广东 东莞 523059
目的探讨改良Hyper-CVAD方案对中老年pH阴性急性淋巴细胞白血病血糖的影响,并探索血糖与预后的关系。方法随机选择72例中老年pH阴性急性淋巴细胞性白血病患者并分为A、B组,各36人。A组给予改良Hyper-CVAD方案诱导化疗,B组给予常规Hyper-CVAD方案治疗,比较化疗前后两组患者的临床特征、继发高血糖的情况及化疗后生存状况,并对患者进行为期3年的随访。结果对照组第3周末的随机血糖高于观察组(8.03±2.73 mmol/Lvs7.85±2.54 mmol/L),且高于对照组自身第1周末的随机血糖(8.03±2.73 mmol/Lvs7.37±2.19 mmol/L,P<0.05);第4周末两组患者的空腹及随机血糖均高于自身第1周末,且对照组随机血糖显著高于观察组(8.57±3.32 mmol/Lvs8.03±2.59 mmol/L,P<0.05),但两组空腹血糖差异无统计学意义(P>0.05)。对照组继发高血糖比例为22.22%,显著高于观察组的5.56%(P<0.05),但两组复发率、生存率差异无统计学意义。两组第4周末空腹及随机血糖均与感染、缓解率、复发率及总生存率呈相关性。两组分别有11、14例出现复发,但其复发率差异无统计学意义(30.56%vs38.89%,P=0.458);两组分别有9、12例患者死亡,生存率差异无统计学意义(75.00%vs67.67%,P=0.437)。结论改良Hyper-CVAD方案可有效降低中老年Ph阴性急性淋巴细胞白血病并发继发性高血糖的几率。
改良Hyper-CVAD;中老年;pH阴性;急性淋巴细胞白血病;高血糖
化疗继发高血糖在儿童急性淋巴细胞白血病(ALL)的研究较为深入详尽[1-2],而在成人ALL方面相关研究却相对少见,尤其是中老年患者[3]。Hyper-CVAD方案是近年来国际上治疗ALL的新方案,已被证实具有较好的疗效,但同时也存在一定的不良反应,后者以继发性高血糖较常见,且血糖的异常可能影响肿瘤细胞的代谢而影响肿瘤决局,因此改良后的Hyper-CVAD方案对内分泌代谢的影响较少,然而目前关于Hyper-CVAD引起中老年ALL血糖异常的报道仍较少[4-5]。为探索改良Hyper-CVAD方案对中老年pH阴性急性淋巴细胞白血病血糖的影响,并探索血糖与预后的关系,本研究将对72例中老年pH阴性ALL患者进行研究,并发现该方案可有效降低中老年pH阴性急性淋巴细胞白血病并发继发性高血糖的几率,过程如下:
1 资料与方法
1.1 一般资料
选取2010年1月~2016月12月我院内分泌科收治的经改良Hyper-CVAD方案诱导治疗的初诊中老年pH阴性ALL患者,有72例纳入研究。纳入标准:(1)所有患者均符合WHO2008年淋巴组织造血肿瘤诊断标准[6];(2)年龄≥55岁;(3)主要脏器功能满足:总胆红素≤2倍正常参考值上限;丙氨酰转移酶及门冬氨酸转移酶≤2.5倍正常参考值上限;肌酐清除率≥50 mL/min;(4)美国东部肿瘤协作组体能状态评分(ECOG评分)≤3分。剔除标准:(1)既往糖耐量异常或患有糖尿病病史者;(2)化疗1个月前有应用糖皮质激素者;(3)pH阳性急性淋巴细胞白血病者;(4)依从性差及不接受化疗者。研究对象随机平均分为观察组、对照组,给予不同的治疗方案:观察组给予改良Hyper-CVAD方案诱导化疗,对照组给予常规Hyper-CVAD方案治疗。观察组男性21例、女性15例,平均年龄51~71岁;对照组男性23例、女性13例,平均年龄50~70岁。两组患者的性别构成、年龄、病程、白细胞计数、骨髓免疫分型、染色体畸形及BCR基因融合率等比较,差异均无统计学意义(P>0.05,表1);两组患者的空腹血糖、随机血糖、糖化血红蛋白差异均无统计学意义 (P>0.05,表2)。
表1 两组患者一般资料比较(n=36,)
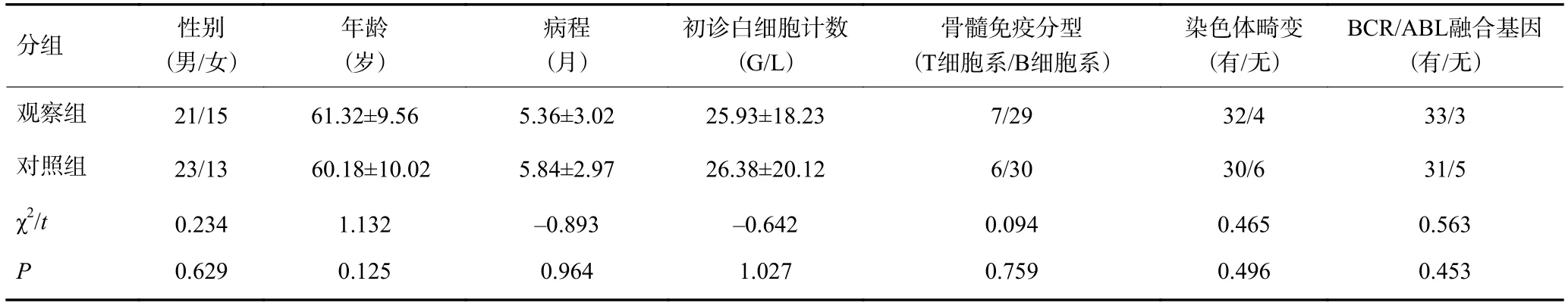
表1 两组患者一般资料比较(n=36,)
分组性别(男/女)BCR/ABL融合基因(有/无)观察组21/1561.32±9.565.36±3.0225.93±18.237/2932/433/3对照组23/1360.18±10.025.84±2.9726.38±20.126/3030/631/5 χ2/t0.2341.132-0.893-0.6420.0940.4650.563P0.6290.1250.9641.0270.7590.4960.453年龄(岁)病程(月)初诊白细胞计数(G/L)骨髓免疫分型(T细胞系/B细胞系)染色体畸变(有/无)
表2 两组患者血糖代谢基线水平比较(n=36,)
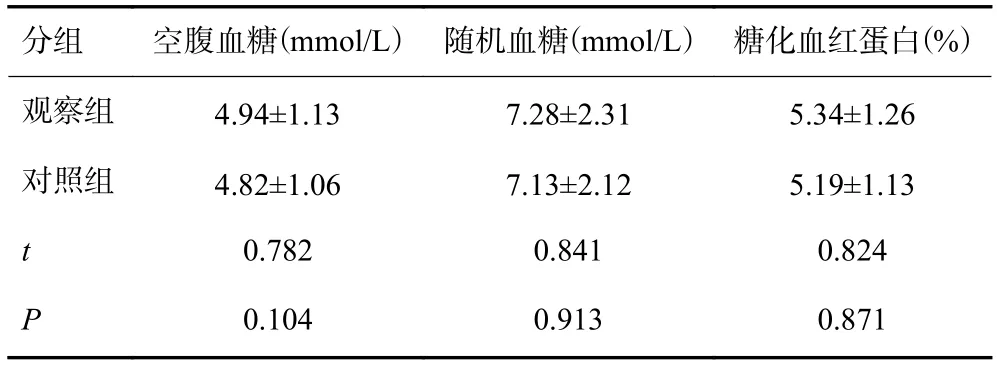
表2 两组患者血糖代谢基线水平比较(n=36,)
分组空腹血糖(mmol/L)随机血糖(mmol/L)糖化血红蛋白(%)观察组4.94±1.137.28±2.315.34±1.26对照组4.82±1.067.13±2.125.19±1.13t0.7820.8410.824P0.1040.9130.871
1.2 治疗方法
A组采用改良Hyper-CVAD方案诱导化疗,第1、3、5、7疗程采用A方案,第2、4、6、8疗程采用B方案。A方案:第1~3天,环磷酰胺(CTX)300 mg/m2,每12 h 1次;第1~4、11~14天,地塞米松(DEX)40mg/d;第4、11天,长春地辛2~4 mg;第4天,吡柔比星(THP)50 mg/m2。B方案:第1天,甲氨蝶呤(MTX)1 g/m2;第2~3天,阿糖胞苷(Ara-C)1~2 g/m2,对于>60岁的患者减量为0.5 g/m2,每12 h1次,。
B组采用常规Hyper-CVAD方案[7]诱导治疗,A方案 :静脉滴注环磷酰胺300 mg/m2,2次/d ;第1~3天,美司钠600 mg/(m2·d),于CTX静脉滴注开始时、开始后4 h、8 h,分3次静脉推注;第4、11天,静脉滴注长春新碱(VCR)2 mg;第4天,静脉滴注吡柔比星50 mg/m2;第1~4、11~14天,口服或静脉滴注地塞米松40 mg/d。造血恢复后给予B方案:第1天,甲氨蝶呤2 g/m2,静脉滴注2 h,后将其剂量增加至0.8 g/m2,静脉滴注22 h;第2~3天,阿糖胞苷1.0~1.5 g/m2,每日2次。于MTX治疗结束后12 h行静脉推注亚叶酸钙50 mg/m2,每6 h 1次,共8次,以减低MTX毒性。
两组治疗方案均由A方案和B方案交替进行,每28 d为1个疗程,1个A方案或1个B方案计为1个疗程。两组患者化疗期间及化疗后都应给予必要的对症抗感染和支持治疗。其中,每个疗程内进行1次甲氨蝶呤和(或)阿糖胞苷联合地塞米松鞘内注射以预防中枢神经系统白血病[8]。患者经过8个疗程治疗后转入维持化疗:每月泼尼松1 mg·kg-1·d-1,第1~7天;第1天,长春地辛2~4 mg;甲氨蝶呤20 mg/m2,每周1次,口服;第1~21天,6-巯基嘌呤60 mg·m-2·d-1,口服,直至缓解后2年。
1.3 记录及观察指标
1.3.1 一般资料 患者年龄、性别、体质量指数、确诊时间、初诊时血细胞计数、骨髓免疫分型、染色体核型、BCR/ABL融合基因[9]、诱导化疗期感染情况、早期死亡情况、复发例数及总生存时间等。
1.3.2 血糖指标 初诊时空腹及随机血糖指标、糖化血红蛋白水平,诱导化疗期连续1个月内动态血糖指标。其中化疗相关性高血糖的定义:即诱导化疗期连续1个月内,出现连续2次或2次以上空腹血糖≥126 mg/dL(7.0 mmoL/L)和(或)连续2次或2次以上随机血糖≥200 mg/dL(11.1 mmoL/L)。
1.4 统计学方法
应用SPSS 17.0统计软件进行分析,计数资料以百分率表示,计数资料的比较采用χ2检验;计量资料用均数±标准差表示,计量资料的比较采用t检验;P<0.05为差异有统计学意义。
2 结果
2.1 血糖水平比较
两组患者第1、2周末的空腹及随机血糖差异均无统计学意义。对照组第3周末的随机血糖高于观察组(P<0.05),且高于本组第1周末的随机血糖(P<0.05),两组空腹血糖无明显差异。第4周末两组患者的空腹及随机血糖均高于该组第1周末(P<0.05),对照组的随机血糖显著高于观察组(P<0.05),但两组的空腹血糖差异无统计学意义(表3)。
表3 两组不同时间点的血糖水平比较(mmol/L,,n=36)

表3 两组不同时间点的血糖水平比较(mmol/L,,n=36)
*P<0.05vs观察组;#P<0.05vs第1周末.
分组测量时机第1周末第2周末第3周末第4周末观察组空腹4.85±1.215.02±1.325.14±1.455.37±1.65#随机7.31±2.127.63±2.327.85±2.548.03±2.59#空腹4.93±1.175.11±1.455.33±1.565.84±1.93随机7.37±2.197.74±2.498.03±2.73*#8.57±3.32*#对照组
2.2 两组患者高血糖及复发例数与预后
对照组有8例(22.22%)出现继发性高血糖,而观察组仅为2例(5.56%),两组的继发性高血糖差异具有统计学意义(P<0.05)。两组分别有11、14例出现复发,但两组复发率差异无统计学意义。两组分别有9、12例患者死亡,但两组的生存率差异同样无统计学意义(P>0.05,表4)。
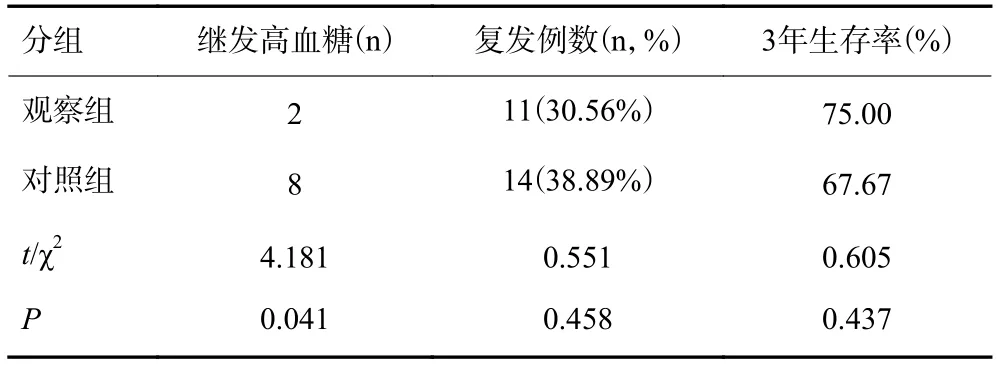
表4 两组患者高血糖及复发例数与生存情况(n=36)
2.3 相关性分析
两组的第4周末空腹及随机血糖均与感染、缓解率、复发率及总生存率呈相关性(P<0.05),其中相关性最强为随机血糖与总生存率(r=0.845,P=0.003),其次为与缓解率(r=0.822,P=0.011,表5)。
3 讨论
不同年龄阶段的ALL异质性很强,近年来随着异基因造血干细胞移植的进展、酪氨酸激酶抑制剂靶向治疗的出现,儿童ALL的治疗得到了较大的改善,但针对中老年人ALL的治疗却进展缓慢,中老年人ALL治疗仍是目前医学上的一个难题[10-14]。此外,由于成人费城染色体阴性(pH-)ALL不具备应用伊马替尼等分子靶向治疗的指征[15-16],因此中老年人pHALL的治疗更加困难。中老年ALL患者整体较低的缓解率、较差的生存状态与患者的治疗模式显著相关。由于中老年患者年龄大,基础病变多,各脏器功能逐渐下降,难以耐受强烈的化疗,而小剂量的联合化疗不能有效抑制白血病细胞克隆。同时,化疗过程中多伴随严重的不良反应,如高血糖(发生率为4%~20%),可进一步导致多种代谢异常(如脂代谢),极大降低临床疗效[17-18]。目前已明确,在成人ALL中,高血糖的发生与早期复发及高死亡率之间存在一定关系,而中老年人若继发高血糖则预后更为不佳。以往研究显示,联合用药的方式、剂量不同,ALL继发糖尿病的发病率也不等[19]。自1992年起,美国MD.Anderson肿瘤中心便将Hyper-CVAD方案用于ALL的治疗上。其设计原理为:CTX半衰期6 h,大剂量分次给药,使药物有效治疗浓度持续72 h,尽可能覆盖肿瘤细胞增殖周期,同时避免耐药发生[20]。

表5 第4周末血糖水平与预后的相关性分析
Hyper-CVAD方案治疗ALL疗效虽好,但容易产生严重并发症,对于机体储备功能较差的中老年患者影响则更大,因此,本研究在Hyper-CVAD方案上进行改良以提高Hyper-CVAD方案在中老年ALL治疗上应用的可能性。本研究对接受不同化疗方案的ALL患者血糖变化检测结果显示,观察组与对照组的患者均有发生高血糖的例数,可见化疗可以诱发ALL患者发生高血糖,这与Dare等[21]的研究结果一致。以往对成人ALL患者的治疗并发症的研究更多地采取了儿童治疗方案[22],而忽视的不同年龄个体的差异性,因此实验结果往往代表性不足以充分说明年龄在ALL治疗继发高血糖的具体作用。
本研究选择了对成人ALL患者针对性更强的Hyper-CVAD方案,在探究年龄对治疗预后的影响的同时还能对比不同治疗措施的优劣,结果也更有说服力。进一步的研究结果发现,应用未改良Hyper-CVAD方案化疗的患者(对照组)相比较于应用改良Hyper-CVAD方案(观察组)的患者更容易继发高血糖,分别为22.22%、5.56%,且对照组患者出现感染的几率更高,提示应用改良Hyper-CVAD方案则在一定程度上可有效减少高血糖的发生,从而降低ALL治疗后发生感染的风险。已有的采用未改良Hyper-CVAD方案进行治疗的研究中,患者均易出现骨髓抑制、严重细菌感染等并发症[23],而本研究根据国人的体质特点和以往的用药经验,对原本的Hyper-CVAD的用药种类及剂量进行了调整,发现在研究过程中,患者的不良反应多数为胃肠道反应以及轻度肝损害等非血液学方面的反应,体现了本改良方案的耐受性与安全性,这更有利于对患者治疗后继发糖尿病的研究。国内潘慈等[24]以ALL患儿为研究对象,探讨化疗期间药物性高血糖发生的概率及高危因素,结果发现,较大年龄的儿童继发高血糖的概率更高,年龄是引起药物性高血糖的重要因素。不同于其研究的是,本研究针对中老年患者进行了研究,结果显示,中老年ALL患者进行治疗后易继发高血糖,且中老年ALL患者血糖浓度高与感染、缓解率、复发率及总生存率等均呈正相关关系,提示血糖浓度升高对ALL生存期有重要影响。本研究中,对照组和观察组的完全缓解率虽然均低于MD Anderson癌症中心的91%完全缓解率,但从长期随访来看,患者仍能取得较高的无病生存率,临床疗效较好。然而,本研究虽应用了不同的ALL治疗方案,且高血糖的发生率也有所差异,但对照组与观察组的ALL复发率、生存率并无统计学上的差别,与刘蒙等[25]得出的改良Hyper-CVAD方案可有效延长ALL患者生存期并减少复发的结果有所出入,可能与本次研究的样本量较少、后续患者跟踪时间较短有关,需要后续进一步的深入研究以便更充分地评估本改良Hyper-CVAD方案的应用价值。
综上所述,改良Hyper-CVAD方案诱导治疗中老年pH阴性ALL继发高血糖的风险有所降低,具有较好的治疗效果,值得临床推广。至于改良Hyper-CVAD方案在延长ALL患者的无病生存期上是否更具优势,进一步的循证研究证实。
[1]李 萍, 梁爱斌. 成人急性淋巴细胞白血病的诊疗进展[J]. 中国癌症杂志, 2014, 27(10): 738-44.
[2]Devos P, Preiser JC. Tight blood glucose control: a recommendation applicable to any critically ill patient[J]. Crit Care, 2004, 8(6): 427-9.
[3]王良妥, 张湘兰, 司徒健瑜, 等. 化疗相关性高血糖对急性淋巴细胞白血病患者生存状况的影响[J]. 海南医学, 2016, 12(7): 1080-2.
[4]孔 圆, 江 滨, 刘开彦, 等. Ph染色体阳性和阴性青少年急性淋巴细胞白血病MICM分型与临床预后分析比较[J]. 中国综合临床,2004, 8(S1): 1-2.
[5]高泓浩, 靖 彧, 于 力. Ph阴性青少年与年轻成人急性淋巴细胞白血病预后及治疗综述[J]. 解放军医学院学报, 2017, 11(4): 389-92.
[6]Swedlow SH, Campo E, Harris NL, et al. WHO classification of tumours of haematopoietic and lymphoid tissues[M]. 4th ed.Lyon:IARC Press, 2008: 14-367.
[7]刘 梦, 张丽君. Hyper-CVAD方案治疗成人复发难治急性淋巴细胞白血病疗效评价[J]. 中国实用内科杂志, 2017, 33(2): 148-9.
[8]陈 泽, 刘惠杰, 王 莹, 等. 急性淋巴细胞白血病诱导治疗缓解后用 HyperCVAD 方案治疗的疗效观察[J]. 临床血液学杂志,2010, 23(2): 112-3.
[9]张之南, 沈 悌. 血液病诊断及疗效标准[M]. 3版. 北京: 科学出版社, 2007: 116-21.
[10]Narayanan S, Shami PJ. Treatment of acute lymphoblastic leukemia in adults[J]. Crit Rev Oncol Hematol, 2012, 81(1): 94-102.
[11]Dores GM, Devesa SS, Curtis RE, et al. Acute leukemia incidence and patient survival among children and adults in the United States,2001-2007[J]. Blood, 2012, 119(1): 34-43.
[12]Rowe JM, Buck G, Burnett AK, et al. Induction therapy for adults with acute lymphoblastic leukemia: results of more than 1500 patients from the international ALL trial: MRC UKALL XII/ECOG E2993[J]. Blood, 2005, 106(12): 3760-7.
[13]Robak T. Acute lymphoblastic leukaemia in elderly patients:biological characteristics and therapeutic approaches[J]. Drugs Aging, 2004, 21(12): 779-91.
[14]Delannoy A, Ferrant A, Bosly A, et al. Acute lymphoblastic leukemia in the elderly[J]. Eur J Haematol, 1990, 45(2): 90-3.
[15]李业楠, 邹德慧, 顾 敏, 等. 成人Ph染色体和(或)bcr-abl阳性急性淋巴细胞白血病患者细胞遗传学及预后分析[J]. 中华血液学杂志, 2009, 30(5): 298-302.
[16]刘 霆. Ph阳性急性淋巴细胞白血病的治疗进展与思考[J]. 中华血液学杂志, 2012, 33(2): 73-5.
[17]Canbolat AA, Timur C, Kalaycik O. A retrospective analysis of complications observed in children with acute lymphoblastic leukemia during chemotherapy[J]. Minerva Pediatr, 2017, 69(2): 95-105.
[18]Zhang BH, Wang J, Xue HM, et al. Impact of chemotherapy-related hyperglycemia on prognosis of child acute lymphocytic leukemia[J]. Asian Pac J Cancer Prev, 2014, 15(20): 8855-9.
[19]Feltbower RG, Mckinney PA, Greaves MF, et al. International paralles inleukemia and diabetes epidemiology[J]. Arch Dis Child,2004, 89(1): 54-6.
[20]沈志祥, 周 励. 复发难治性淋巴瘤的治疗进展[J]. 临床内科杂志, 2005, 22(9): 580-2.
[21]Dare JM, Moppett JP, Shield JP, et al. The impact of hyperglycemia on risk of infection and early death during induction therapy for acute lymphoblastic leukemia (ALL)[J]. Pediatr Blood Cancer,2013, 60(12): E157-9.
[22]Khabori M, Minden MD, Yee KW, et al. Improved survival using an intensive, pediatric-based chemotherapy regimen in adults with T-cell acute lymphoblastic leukemia[J]. Leuk Lymphoma, 2010,51(1): 61-5.
[23]秦晓铧, 陈 立, 陈国枢, 等. Hyper-CVAD方案治疗成人急性淋巴细胞白血病疗效分析[J]. 中国医药科学, 2011, 22(6): 65-7.
[24]潘 慈, 汤静燕, 薛惠良, 等. 急性淋巴细胞白血病患儿左旋门冬酰胺酶联合化疗期间血糖监测的临床研究[J]. 临床儿科杂志,2012, 30(5): 415-6.
[25]刘 蒙, 杨明珍, 夏瑞祥, 等. 改良Hyper-CVAD/MA方案治疗25例淋巴系统恶性肿瘤的临床分析[J]. 中国肿瘤临床, 2012, 31(3):166-9.
Effect of modified Hyper-CVAD therapy on elderly patients with pH negative acute lymphoblastic leukemia secondary hyperglycemia
YE Huicheng1, LIU Yuhua21Department of Hematology;2Department of the first integrative medicine, Dongguan People's Hospital, Dongguan 523059, China
ObjectiveTo investigate the effect of modified Hyper-CVAD therapy on elderly patients with pH negative acute lymphoblastic leukemia (ALL) secondary hyperglycemia and explore the relation between prognosis and hyperglycemia.MethodsSeventy-two elderly patients (≥55) with pH -negative ALL were enrolled in the study. The patients were randomly divided into 2 groups with 36 patients in each group. Patients in group A were performed with improved Hyper-CVAD therapy. Group B were performed with routine Hyper-CVAD therapy. The clinical features, secondary hyperglycemia and the survival status after chemotherapy were compared between the two groups before and after chemotherapy. The patients were followed up for 3 years.ResultsThe random blood sugar of control group on the third weekend was higher than that of the observation group, and higher than that of the first weekend in control group (P<0.05). Fasting blood glucose and blood glucose were higher on the fourth weekend in the two groups than that in the first weekend (P<0.05). The random blood sugar in control group was significantly higher than that in observation group (P<0.05). There was no significant difference of fasting blood glucose between the two groups (P<0.05). The proportion of secondary hyperglycemia in control group was 22.22%,which is significantly higher than that of observation group(5.56%). There was no significant difference of recurrence rate and survival rate between the two groups. Fasting and random blood glucose on the fourth week of the two groups were correlated with infection, remission rate, relapse rate and overall survival rate.There were 11 and 14 cases recurred respectively in the two groups, with no significant difference (30.56%vs38.89%,P=0.458). Nine cases and 12 patients died respectively in the two groups, with no significant difference(75.00%vs67.67%,P=0.437).ConclusionThe improved Hyper-CVAD therapy can effectively reduce the risk of secondary hyperglycemia induced by chemotherapy on elderly patients with Ph-negative acute lymphoblastic leukemia.
improved Hyper-CVAD; aged patients; pH negative; acute lymphocytic leukemia hyperglycaemia;
2017-05-14
东莞市社会科技计划一般项目(201750715001294)
叶惠成,主治医师,E-mail: foshanmyf@126.com
刘玉华,主任医师,E-mail: foshanmyf@126.com

