脂多糖在创伤性颅脑损伤炎症反应中的应用
樊友道,尹海斌,张旺明,黄 鸣,周金菊佛山市南海区第三人民医院脑科,广东 佛山 5844;南方医科大学珠江医院神经外科,广东 广州 5080
脂多糖在创伤性颅脑损伤炎症反应中的应用
樊友道1,尹海斌1,张旺明2,黄 鸣1,周金菊1
1佛山市南海区第三人民医院脑科,广东 佛山 528244;2南方医科大学珠江医院神经外科,广东 广州 510280
目的评价分析脂多糖在创伤性颅脑损伤(TBI)炎症反应中的应用价值。方法选择2014年6月~2016年12月期间佛山市南海区第三人民医院脑科和南方医科大学珠江医院神经外科收治的TBI患者86例,并按照格拉斯哥昏迷评分分为3组:轻度组33例、中度组24例、重度组29例;并且选取同期来本院进行体检的健康者28例作为对照组。通过ELISA方法检测研究对象血清中TNF-α、IL-6、IL-1β,GREISS法检测一氧化氮含量。结果轻度组、中度组及重度组患者入院时的血清TNF-α浓度均有升高,其中第3天为最高,第5、7天已逐渐降低,但仍高于对照组。轻度组、中度组及重度组患者入院时的血清IL-6浓度均升高,其中第5天为最高,第7天已开始降低,仍高于对照组;TBI严重分级与血清IL-6浓度(r=0.925,P<0.05)。轻度组、中度组及重度组患者入院时的血清IL-1β浓度均升高,第1、3、5天缓慢增加,第7天增加更加显著,重度组升高幅度明显高于对照组、轻度组和中度组(P<0.05)。TBI严重分级与血清IL-1β浓度(r=1.267,P<0.05)。轻度组、中度组及重度组患者入院时的血清一氧化氮浓度有升高,其中第3天为升高较明显,第5、7天已逐渐降低,仍高于对照组;TBI严重分级与血清一氧化氮浓度(r=0.847,P<0.05)。结论脂多糖在TBI患者体内存在不同程度的炎症反应;血清中TNF-α、IL-6、IL-1β、一氧化氮浓度变化与TBI程度密切相关;如果浓度持续保持较高水平,这就说明脑组织损伤严重,预后效果不佳。
创伤性颅脑损伤;脂多糖;血清TNF-α: IL-6;IL-1β;一氧化氮
创伤性颅脑损伤(TBI)严重影响人类的生活质量和寿命,其发病率、致残率和死亡率显著增高,给家庭生活带来极大的影响[1-3]。选用何种方法早期保护颅脑损伤患者的继发性脑损伤,促进脑功能尽早恢复十分重要。炎症细胞因子是TBI病理生理过程中的一个重要组成环节,虽可增强机体的抵抗力,有效促进组织修复,但会因过度激活所导致的强烈全身性炎症反应,反而加重继发性脑损伤[4]。杨玺等[5]研究结果显示,运用星状神经节阻滞可以减轻TBI患者的炎症反应,抑制淋巴细胞NF-κB和AP-1的激活。运用糖皮质激素、内毒素抗体、TNF抗体、IL-1受体拮抗剂、IL-6受体拮抗剂、缓激肽拮抗剂、七叶皂苷、褪黑素、血液透析等抑制或清除炎症介质[6-7],取得了一定疗效,但尚未达到满意的效果。脂多糖(LPS)是由核心多糖、O抗原链和类脂A 3部分构成,也被称为内毒素,是革兰氏阴性菌外膜的主要组成成分,细胞内ROS水平少量升高,都可刺激FOXOs转录因子蛋白家族,使其转录活性增加,因此,LPS也是导致炎症和人体天然免疫反应的主要诱因[8-10]。是否可以通过阻断LPS对小胶质细胞的激活过程,从而抑制炎性细胞因子的分泌,减少炎症反应对脑组织的损伤需进一步研究,同时LPS也许可以成为预测TBI预后的一个新指标。综合国内相关文献并与查新对比分析,国内较多报道TBI后TNF-α、IL-6、IL-1β等的变化及临床意义,但未见涉及一氧化氮(NO)在不同程度TBI中的变化规律及与预后相关研究和探讨。本研究通过评价分析LPS在TBI炎症反应血清中TNF-α、IL-6、IL-1β、NO水平中的应用价值,为提高TBI临床治疗,改善患者预后提供客观科学合理的指导。
1 资料与方法
1.1 一般资料
选择2014年6月~2016年12月期间佛山市南海区第三人民医院脑科和南方医科大学珠江医院神经外科收治的TBI患者86例,患者均经头颅CT或MRI扫描确诊。其中男性66例,女性20例,年龄18~78岁,平均45.79±12.83岁;并按照格拉斯哥昏迷(GCS)评分分为3组:轻度组33例(GCS评分13~15分),占38.37%(33/86),男26例,女7例,年龄18~62岁,平均43.54±10.27岁;中度组24例(GCS评分9~12分),占27.91%(24/86),男19例,女5例,年龄20~71岁,平均年龄45.81±11.45岁;重度组29例(GCS评分3~8分),占27.91%(24/86),男性21例,女性8例,年龄23~78岁,平均46.78±13.09岁。均为伤后24 h内入院。
排除标准:(1)严重的心、脑血管等器质性病变或肝肾功能不全等慢性病史;(2)失血性休克;(3)妊娠期及哺乳期妇女;(4)伤前血液病、感染等疾病;(5)精神病患者。本组TBI患者86例中,脑挫裂伤51例(59.30%),外伤性蛛网膜下腔出血15例(17.44%),硬膜下血肿10例(11.63%),脑挫裂伤合并硬膜外血肿6例(6.98%),脑内血肿4例(4.65%)。重度组29例入院后接受了开颅血肿清除术或去骨瓣减压术。
选取2014年6月~2016年12月期间到医院进行体检的健康者28例作为对照组。遵循赫尔辛基宣言和中国临床试验的相关法规,经本院伦理委员会研究决定,所有参加本实验研究的患者或家属均全部自愿签署知情同意书。4组患者的年龄、性别构成比等基线资料均无统计学差异(P>0.05),具有可比性。
1.2 方法
所有病例均在入院第1、3、5、7天晨起分别采空腹肘部静脉血5 mL,对照组体检的健康者只采空腹肘部静脉血5 mL血1次,置于干燥管中,37 ℃恒温培养箱(苏州江东精密仪器)保存待测。室温下3000 r/min台式离心机(德国Thermo)离心15 min去上清液,将血清置于低温-20 ℃冰箱(海尔)中待测。LPS(Escherchia coli,serotype 026:B6,Sigma),用无菌的0.9%氯化钠稀释为1 mg/mL,储存于冰箱备用。采用双抗体夹心酶联免疫吸附法炎症相关指标测定血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)含量的变化。GREISS法检测NO含量,试剂盒购买自美国Raybiotech,其余试剂均为分析纯。
1.3 统计学分析
采用社会科学统计软件包SPSS18.0计算分析,计量资料以均数±标准差表示,两组比较采用t检验,各数据之间相关性采用Pearson相关、多元逐步回归法分析,以P<0.05为差异有统计学意义。
2 结果
2.1 LPS在TBI患者血清中TNF-α浓度变化的比较
轻度组、中度组及重度组患者入院时的血清TNF-α浓度均有升高,其中第3天最高,第5、7天逐渐降低,但仍高于对照组(表1);相关性分析显示,TBI严重分级与血清TNF-α浓度相关(r=1.873,P<0.05)。
表1 LPS在TBI患者血清中TNF-α浓度变化的比较(,pg/mL)

表1 LPS在TBI患者血清中TNF-α浓度变化的比较(,pg/mL)
#P<0.05vs其它3组.
组别n第1天第3天第5天第7天对照组28137.95±9.36137.95±9.36137.95±9.36137.95±9.36轻度组29210.85±7.23191.68±7.64176.88±9.21158.19±8.05中度组24225.67±6.49233.89±7.52222.92±8.63193.86±8.55重度组33247.98±7.72#268.37±9.76#244.75±8.41#218.35±9.32#
2.2 LPS在TBI患者血清中IL-6浓度变化的比较
轻度组、中度组及重度组患者入院时的血清IL-6浓度均升高,其中第5天为最高,第7天已开始降低,但仍高于对照组(表2);相关性分析表明,TBI严重分级与血清IL-6浓度相关(r=0.925,P<0.05)。
2.3 LPS在TBI患者血清中IL-1β浓度变化的比较
轻度组、中度组及重度组患者入院时的血清IL-1β浓度均升高,第1、3、5天缓慢增加,第7天增加更加显著,重度组升高幅度明显高于对照组、轻度组和中度组(P<0.05,表3)。相关性分析表明,TBI严重分级与血清IL-1β浓度(r=1.267,P<0.05)。
2.4 LPS在TBI患者血清中NO浓度变化的比较
轻度组、中度组及重度组患者入院时的血清血清NO浓度有升高,其中第3天为升高较明显,第5、7天已逐渐降低,并且仍高于对照组(表4);相关性分析表明,TBI严重分级与血清NO浓度相关(r=0.847,P<0.05)。
表2 LPS在TBI患者血清中IL-6浓度变化的比较(,pg/mL)

表2 LPS在TBI患者血清中IL-6浓度变化的比较(,pg/mL)
#P<0.05vs其它3组.
组别n第1天第3天第5天第7天对照组28 6.98±0.71 6.98±0.71 6.98±0.71 6.98±0.71轻度组2912.17±1.7519.05±3.0236.10±2.8729.13±2.82中度组2444.39±2.2253.57±4.8978.19±6.0768.15±6.39重度组33 103.15±12.06#143.41±20.04#233.15±11.16#168.41±33.01#
表3 LPS在TBI患者血清中IL-1β浓度变化的比较(,pg/mL)
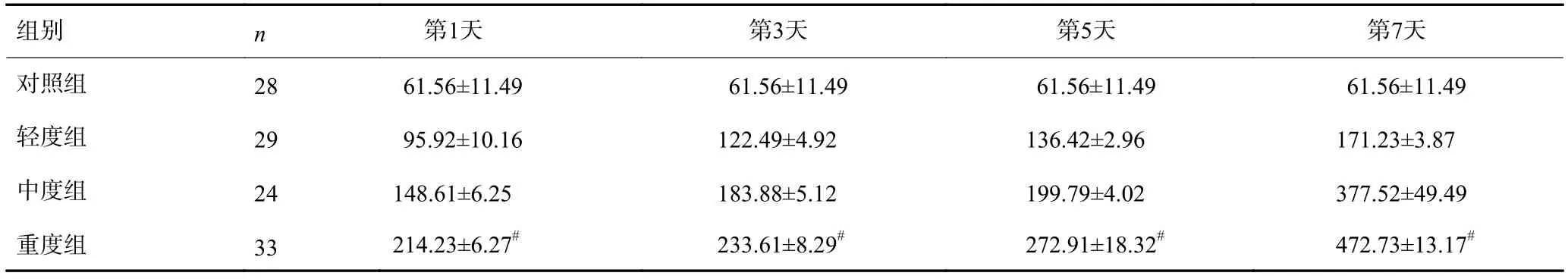
表3 LPS在TBI患者血清中IL-1β浓度变化的比较(,pg/mL)
#P<0.05vs其它3组.
组别n第1天第3天第5天第7天对照组2861.56±11.4961.56±11.4961.56±11.4961.56±11.49轻度组2995.92±10.16122.49±4.92136.42±2.96171.23±3.87中度组24148.61±6.25183.88±5.12199.79±4.02377.52±49.49重度组33214.23±6.27#233.61±8.29#272.91±18.32#472.73±13.17#
表4 LPS在TBI患者血清中NO浓度变化的比较(,pg/mL)

表4 LPS在TBI患者血清中NO浓度变化的比较(,pg/mL)
#P<0.05vs其它3组.
组别n第1天第3天第5天第7天对照组2829.38±5.5729.38±5.5729.38±5.5729.38±5.57轻度组2938.59±5.7739.98±7.3134.65±6.5131.66±5.71中度组2444.68±6.4946.19±8.3842.98±8.3338.78±6.76重度组3348.87±6.65#51.28±8.87#46.47±7.29#41.26±6.98#
3 讨论
TBI后的继发性脑损害是导致脑损伤高病死率、高致残率的重要原因,TBI能够导致机体释放大量的炎性细胞因子,目前认为炎症细胞因子是合并脑水肿、脑缺血、颅内压增高等病理生理过程中的一个重要组成环节[11-12]。LPS是内毒素的主要成份,能引起广泛的炎症反应[13]。IL-1β和TNF-α的短暂上调,表明急性炎症反应时,细胞因子的产生受到严格控制,进而引发营养因子的产生,有利于损伤神经元的恢复[14]。细胞因子的表达变化,由初始的神经保护作用转变为加重神经元的损伤,体现出持续激活小胶质细胞的不利方面[15-16]。TBI造成的局部组织损伤引起的炎症反应对于损伤细胞碎片的清除是必不可少的。TNF-a对人皮层神经元和类神经元具有毒性作用,小胶质细胞在LPS的作用下可以被激活而释放TNF-α,TNF-a的表达能够容易转基因小鼠脑病及神经退行性病理改变[17]。本研究结果表明,轻度组、中度组及重度组患者入院时的血清TNF-α浓度均降低,TBI严重分级与血清TNF-α浓度相关。
尤其是在TBI早期,神经细胞和局部血管等组织遭到严重的破坏,诱发各种炎症反应,白介素是由白细胞分泌的一类调节细胞生长与分化的细胞因子,血中则就会产生大量的促炎因子(IL-6、IL-1β和TNF-α),通过这些介质几乎影响所有的免疫细胞、内皮细胞参与炎症反应和组织损伤。小胶质细胞在多种神经系统疾病中发挥重要作用,它还参与大脑的损伤和修复过程,可以起到神经保护作用,能够进行迅速响应大脑中的病理刺激,并参与一系列免疫反应,其相关研究越来越多。星形胶质细胞通过基因表达、形态发生和细胞增殖等改变对不同形式的TBI做出反应[18-19]。
LPS是一种强力炎性反应诱导剂,能够迅速地激活小胶质细胞,释放许多致炎性细胞因子和一系列活性产物,对神经元细胞产生毒性作用,是导致炎症和人体天然免疫反应的主要诱因[20]。LPS能够显著升高BV-2细胞中TNF-α的表达及其上清液中TNF-α的浓度,同时还有效的改变BV-2细胞的形态,使其胞体变大、突起变短[21-22]。IL-6除能够破坏微循环,损伤神经细胞,加重脑水肿,并且能够通过活化血小板和粒细胞加重脑组织损害。本研究结果表明,轻度组、中度组及重度组患者入院时的血清IL-6浓度均升高,TBI严重分级与血清IL-6浓度相关。IL-1β主要在吞噬性的小胶质细胞和巨噬细胞上表达,对脑缺血晚期炎性反应有一定的调节作用。本研究结果表明,轻度组、中度组及重度组患者入院时的血清IL-1β浓度均升高,重度组升高幅度明显高于对照组、轻度组和中度组,TBI严重分级与血清IL-1β浓度相关。NO的化学性质非常活泼,能够彻底的改变细胞的脂多糖和蛋白结构,导致信号转导机制的失衡并引起细胞毒性。本研究结果显示轻度组、中度组及重度组患者入院时的血清NO浓度有升高,TBI严重分级与血清NO浓度相关。
综上所述,LPS在TBI患者体内存在不同程度的炎症反应,不同程度TBI及TBI不同时间点,血清中TNF-α、IL-6、IL-1β、NO水平变化及规律提示LPS参与了TBI的病理生理过程,并表现出与TBI程度呈正相关。本文采用动态检测血清中TNF-α、IL-6、IL-1β、NO浓度;与单项检测相比反应颅脑损伤更全面;由此通过检测血清中TNF-α、IL-6、IL-1β、NO浓度的变化,能够有效的为临床提供脑组织损伤严重程度的客观依据,尽早评估患者预后,对临床病情的判断、治疗显得尤为重要。但LPS在TBI体内不同程度的炎症反应之间的机制是什么,血清中TNF-α、IL-6、IL-1β、NO是否充分代表、反映脑损伤本质,能否通过药物或方法降低、甚至阻断LPS对炎症细胞的激活过程,减少炎症反应对脑组织的继发损伤,仍需要进一步探讨和研究。
[1]武晓灵, 喻 莉, 龙 鼎. su PAR及D-二聚体对创伤性颅脑损伤患者病情严重程度及预后的判断价值[J]. 实用医学杂志, 2017, 33(2): 234-7.
[2]赵雅度. 神经系统外伤[M]. 北京: 人民军医医出版社, 2001: 3-5.
[3]李 明, 杨继红, 耿维凤, 等. 鼠神经生长因子联合亚低温对重度创伤性颅脑损伤的神经保护作用及其机制[J]. 中国生化药物杂志,2017, 37(1): 129-32.
[4]朱占胜, 吴明灿, 张家均, 等. 创伤性颅脑损伤后白介素-6、18、27变化及临床意义[J]. 广东医学, 2011, 32(6): 762-3.
[5]杨 玺, 杨孟昌, 温开兰. 星状神经节阻滞对创伤性颅脑损伤患者炎症反应的影响[J]. 四川医学, 2016, 37(11): 1241-4.
[6]Segev AN, Trudler D, Frenkel D. Preconditioning to mild oxidative stress mediates astroglial neuroprotection in an IL-10-dependent manner[J]. Brain Behav Immun, 2013, 30(7): 176-85.
[7]Patterson ZR, Holahan MR. Understanding the neuroinflammatory response following concussion to develop treatment strategies[J].Front Cell Neurosci, 2012, 6(11): 58-61.
[8]Li H, Liao T, Debowski AW, et al. Lipopolysaccharide structure and biosynthesis in helicobacter pylori[J]. Helicobacter, 2016,21(6): 445-61.
[9]Bryant CE, Spring DR, Gangloff M, et al. The molecular basis of the host response to lipopolysaccharide[J]. Nat Rev Microbiol,2010, 8(1): 8-14.
[10]Meseguer V, Alpizar YA, Luis E, et al. TRPA1 channels mediate acute neurogenic inflammation and pain produced by bacterial endotoxins[J]. Nat Commun, 2014, 5(1): 3125-9.
[11]林 祺, 高 亮, 秦 松. 星形胶质细胞激活与创伤性颅脑损伤研究进展[J]. 中国临床神经科学, 2017, 25(1): 81-7.
[12]刘兴华, 陈春有, 郑 璘, 等. 神经生长因子对急性颅脑损伤患者血清S100β与IL-6的影响[J]. 中国生化药物杂志, 2016, 36(4):167-9.
[13]乔智慧. 唐兰芬抵抗素与炎症相关性疾病研究进展[J]. 医学综述, 2010, 16(11): 1632-4.
[14]Juengst SB, Kumar RG, Failla MD, et al. Acute inflammatory biomarker profiles predict depression risk following moderate to severe traumatic brain injury[J]. J Head Trauma Rehabil, 2015,30(3): 207-18.
[15]Tompkins P, Tesiram Y, Lerner M, et al. Brain injury: neuroinflammation, cognitive deficit, and magnetic resonance imaging in a model of blast induced traumatic brain injury[J]. J Neurotrauma,2013, 30(22): 1888-97.
[16]Hu YC, Sun Q, Li W, et al. Biphasic activation of nuclear factor kappa B and expression of p65 and c-Rel after traumatic brain injury in rats[J]. Inflamm Res, 2014, 63(2): 109-15.
[17]Putker F, Bos MP, Tommassen J. Transport of lipopolysaccharide to the Gram-negative bacterial cell surface[J]. FEMS Microbiol Rev,2015, 39(6): 985-1002.
[18]Burda JE, Bernstein AM, Sofroniew MV. Astrocyte roles in traumatic brain injury[J]. Exp Neurol, 2016, 275(3, SI): 305-15.
[19]李 莹, 杜旭飞, 杜久林. 小胶质细胞的生理特性和功能[J]. 生理学报, 2013, 65(5): 471-82.
[20]黄红伟, 沈 伟. 脂多糖对BV-2细胞的形态及肿瘤坏死因子-α表达的影响[J]. 临床神经病学杂志, 2011, 24(5): 365-7.
[21]He Y, Appel S, Le W. Minocycline inhibits microglial activation and protects nigral cells after 6-hydroxydopamine injection into mouse striatum[J]. Brain Res, 2001, 909(1/2): 187-93.
[22]吴晓平, 张大明, 陈伟良. 口服普萘洛尔治疗婴幼儿头颈部血管瘤的临床效果观察[J]. 口腔疾病防治, 2016, 24(3): 158-61.
Application of lipopolysaccharide on inflammatory reaction of traumatic brain injury
FAN Youdao1, YIN Haibin1, ZHANG Wangming2, HUANG Ming1, ZHOU Jinju11Department of Brain, Third People's Hospital of Nanhai Foshan, Foshan 528244, China;2Department of Neurosurgery, Zhujiang Hospital Affiliated to Southern Medical University, Guangzhou 510280, China
ObjectiveTo evaluate the value of lipopolysaccharide (LPS) in invasive brain injury (TBI) inflammatory response(Inflammation).MethodsEighty-six patients with TBI in Third People's Hospital of Nanhai Foshan were enrolled.They were divided into 3 groups according to the Glasgow coma scale (GCS) score, with mild group of 33 cases, moderate group of 24 cases and severe group of 29 cases. Twenty-eight cases with health examination in the same period were selected as a control group.The levels of nitric oxide (NO) in serum were detected by GREISS. The levels of TNF-α, IL-6, IL-1β and were measured by ELISA.ResultsThe levels of serum TNF-α were increased in the mild, moderate and severe groups, and the third day was the highest. The levels of serum TNF-α on the 5th and 7th day were gradually decreased and still higher than the control group. The levels of serum IL-6 in the mild, moderate and severe groups were higher than those in the control group (P<0.05).The level of IL-6 in the mild and moderate group was significantly higher than that in the control group (r=0.925,P<0.05). The levels of serum IL-1β in the mild group, moderate group and severe group were higher than those in the control group, and the increasement was significant on the third , fifth day (P<0.05). The severity of TBI was correlated with serum IL-1β concentration (r=1.267,P<0.05). The levels of serum NO in the mild, moderate and severe groups were significantly higher than those in the control group (P<0.05), and serum NO levels on the third day was higher than that in the control group. NO concentration was correlated with the severity of TBI (r=0.847,P<0.05).ConclusionThe changes of TNF-α, IL-6, IL-1β and NO in serum are closely related to the degree of TBI. High NO concentration means a serious brain tissue injury and poor prognosis.
traumatic brain injury; lipopolysaccharide; serum TNF-α: IL-6; IL-1β; nitric oxide
2017-05-03
广东省佛山市医学类科技攻关项目(2015AB000352)
樊友道,E-mail: 1651807280@qq.com

