嗜酸乳杆菌产细菌素的提取及其生物特性研究
冉军舰,焦凌霞,梁新红,何鸿举,朱明明,卢艳清,赵瑞香
(河南科技学院食品学院,河南新乡 453003)
嗜酸乳杆菌产细菌素的提取及其生物特性研究
冉军舰,焦凌霞,梁新红,何鸿举,朱明明,卢艳清,赵瑞香*
(河南科技学院食品学院,河南新乡 453003)
以嗜酸乳杆菌为研究对象,通过响应面实验和生物学方法,对该菌细菌素产生条件、细菌素定位和稳定性进行研究。结果表明:该菌产生细菌素的最适培养条件为:培养温度38 ℃、初始pH7.0、培养时间18 h;在嗜酸乳杆菌发酵液中提取的细菌素具有抑制大肠杆菌生长的作用,主要存在于细胞外;该菌产生的细菌素在40~70 ℃保持较高的活性;在蛋白酶K、胃蛋白酶和胰蛋白酶处理后,抑菌活性显著下降;在pH3.0~10.0之间具有抑菌活性;在紫外照射时间0.25~1 h之间,活性较稳定。此研究结果对该菌产细菌素的分离鉴定及应用提供了重要参考。
嗜酸乳杆菌,细菌素,定位,抑菌活性,稳定性
在生活水平越来越高的今天,人们对各种食品安全的要求也越来越高,而各种化学防腐剂有逐渐被生物活性物质取代的趋势[1-4]。乳酸菌是公认的安全的微生物,常用于发酵食品的生产中[5-8]。嗜酸乳杆菌属于乳杆菌属,在生长代谢过程中产生许多抗菌物质[9-10],其中由核糖体合成的细菌素具有高效、无毒、无残留等优点而成为食品生物防腐剂的热点[11]。细菌素根据其化学结构、来源、稳定性和分子量,目前可以分为五类[12-13]:第一类是含有19~50个以上的氨基酸残基的小分子修饰肽的羊毛硫抗生素,分子量小于5 ku[14];第二类是具有膜活性和疏水性的热稳定肽(SHSP),分子量小于10 ku[15];第三类是热敏感大分子蛋白(LHLP),分子量大于30 ku;第四类是复合型大分子复合物;第五类是大多数大肠杆菌等肠内菌所分泌的细菌素,称为微菌素或大肠杆菌素[16]。目前研究较深入的大多数是第一、二类细菌素,广泛应用到食品防腐保鲜中的是尼生素(Nisin)[17-20]和片球菌素(Pediocin)[21-24],嗜酸乳杆菌产细菌素接近于第二类细菌素[25]。
Lactobacillusacidophilus是由本课题组自行分离保存的一株细菌,对大肠杆菌、金黄色葡萄球菌等有较强抑制作用[26],但是对于该菌产生细菌素的性质,本课题组还没有系统研究。为了进一步研究该菌产生细菌素的条件和细菌素的特性,本研究对Lactobacillusacidophilus细菌素进行了细菌素产生条件优化、定位测定和稳定性的测定。这对深入研究Lactobacillusacidophilus的抗菌性,细菌素进行分离、纯化和鉴定具有重要的意义。
1 材料与方法
1.1 材料与仪器
Lactobacillusacidophilus由本实验室自行分离保存;大肠埃希菌(Escherichiacoli)JM109 实验室保藏菌株;MRS液体培养基 蛋白胨10 g、葡萄糖20 g、乙酸钠5 g、柠檬酸氢二铵2 g、Mg2SO4·7H2O 0.58 g、K2HPO42 g、硫酸锰0.25 g、牛肉膏10 g、酵母膏5 g、吐温80 1 mL、蒸馏水1000 mL,微调pH6.5,用于Lactobacillusacidophilus的培养;LB培养基 液体培养基:蛋白胨10 g/L,酵母浸膏5 g/L,NaCl 10 g/L,pH7.0;固体培养基:固体培养基加琼脂15 g/L)用于EscherichiacoliJM109的培养及乳酸菌活性测定。
Kendro D-37520高速冷冻离心机 德国sorvall-Heraeus公司;SW-CJ-1D单人单面垂直净化工作台 苏州智华净化精密仪器有限公司;Alpha1-2LD plus冷冻干燥机 德国Chirst公司;SHP-250型生化培养箱 上海三发科学仪器有限公司;VCX500超声波细胞破碎仪 美国Sonics & Materials公司;Lambda 25紫外可见光分光光度计 美国Perkin Elmer公司。
1.2 实验方法
1.2.1 发酵上清液的制备 在50 mL MRS液体培养基中接种Lactobacillusacidophilus,于37 ℃恒温生化培养箱中进行第一次活化,约24 h;将第一次活化的Lactobacillusacidophilus取3%接种到200 mL MRS液体培养基中,于37 ℃恒温生化培养箱中进行二次活化,约16~18 h。将活化后的Lactobacillusacidophilus按3%的接种量加入到pH6.2的MRS培养基中,37 ℃培养18 h,经4 ℃低温下,10000 r/min,15 min离心去沉淀,经0.22 μm孔径无菌滤膜过滤后,放入4 ℃冰箱保存备用[26]。
1.2.2 细菌素的提取 本实验采用硫酸铵盐析法粗提Lactobacillusacidophilus细菌素。取100 mL发酵培养液,10000 r/min离心20 min,上清在冰浴中缓慢加入硫酸铵至70%饱和度,置于4 ℃冰箱中过夜,10000 r/min离心20 min,弃去上清,用磷酸缓冲液(pH6.8)将沉淀悬浮,悬浮液装入透析袋中(截留量8000~14000 Da)4 ℃充分去盐后冷冻干燥,溶于1 mL无菌水测定抑菌效果[27]。
1.2.3 细菌素抑菌效果测定采用牛津杯法测定:将大肠杆菌液100 μL均匀涂布于LB固体培养基上,用牛津杯打孔(孔径6 mm),细菌素加样量50 μL/孔,静置30 min,放入37 ℃培养箱过夜培养后,测定抑菌圈大小。
抑菌圈直径(mm)=总直径(mm)-牛津杯直径(mm)
每个实验重复4次[27]。
1.2.4 单因素实验 在排除有机酸、过氧化氢等因素影响的基础上[28],确定了MRS为产细菌素培养基,基本发酵条件为培养温度37 ℃,初始pH7.0,培养时间18 h,以抑菌圈为指标,改变1个因素的水平,其他因素水平不变,考察培养温度,初始pH和培养时间对抑菌效果的影响。其中培养温度为31、34、37、40、43 ℃,初始pH为5.0、6.0、7.0、8.0、9.0,培养时间为14、16、18、20、22 h。每个实验重复3次。
1.2.5 响应面实验设计 在单因素实验的基础上,综合考虑发酵过程中各个因素对Lactobacillusacidophilus产细菌素活性的影响,采用统计分析软件Design-Expert8.0建立3因素3水平的Box-Behnken模型,通过实验确定优化发酵条件。以抑菌圈直径(Y)为响应值,培养温度(X1),初始pH(X2),培养时间(X3)为自变量,因素编码水平见表1。
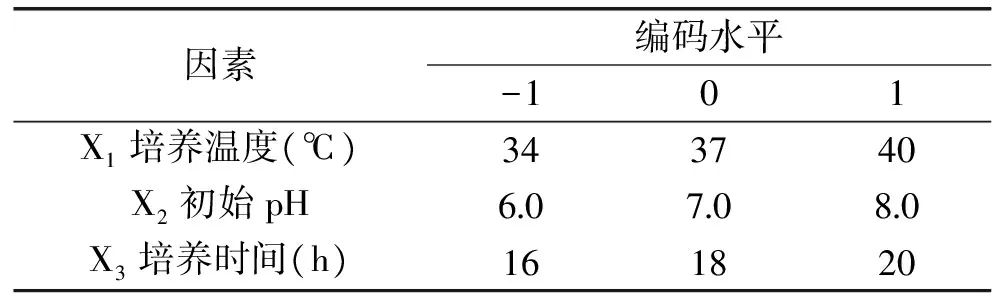
表1 响应面实验因素水平编码值Table 1 Coded table of factors and levels for response surface experiment
1.2.6Lactobacillusacidophilus产细菌素的定位 根据优化的条件培养Lactobacillusacidophilus得到发酵液,采用渗透冲击法进行提取[29]:先取发酵液室温离心(8000 r/min,5 min)上清液(S1)冻存;沉淀(P1)10 mL(pH6.8)50 mmol·L-1PBS重悬,离心(4 ℃,8000 r/min,10 min),洗涤2次,上清液(S2)冻存;沉淀(P2)以10 mL,25%蔗糖溶液重悬,于25 ℃振荡10 min,离心(4 ℃,12000 r/min,15 min),上清液(S3)冻存;沉淀(P3)加冷的双蒸水重悬,在冰水浴中振荡10 min,离心(4 ℃,12000 r/min,15 min),上清液(S4)冻存;沉淀(P4)重悬于10 mL(pH6.8)50 mmol/L PBS中,在冰浴中超声波破碎1 min,重复5次,间隔1 min,再离心(4 ℃,15000 r/min,20 min),上清液(S5)冻存,沉淀(P5)弃去,将S1、S2和S3合并,即为胞外提取液,S4为膜周质提取液,S5为膜内提取液。取3种提取液,按照1.2.3测不同处理样品的抑菌活性,从而得知细菌素在细胞中的分布情况。
1.2.7 细菌素稳定性的测定 热稳定性:将经过硫酸铵沉淀的粗提液分别在40、50、60、70、80、90、100 ℃不同温度条件下水浴处理30 min,在120 ℃的灭菌锅中静置30 min,以未经高温处理的粗提液作为对照,测定经过不同温度处理的粗提液的抑菌活性,每个处理重复三次[30]。
蛋白酶的稳定性:取三份经过硫酸铵沉淀的2 mL粗提液,分别加入1 mg/mL的胰蛋白酶、胃蛋白酶、蛋白酶K溶液20 μL,37 ℃水浴处理60 min,采用牛津杯法测定处理后的粗提液的抑菌活性,以加入20 μL PBS缓冲液(pH6.8)处理的粗提溶液作为对照,每个处理重复三次[31]。
pH的稳定性:将经过硫酸铵沉淀的粗提溶液分别调pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,处理12 h后调节pH至中性,以未经处理的粗提溶液为对照,采用牛津杯法,测定不同的pH处理后的粗提液的抑菌活性,每个处理重复3次[32]。
紫外线的稳定性:将经过硫酸铵沉淀的粗提液置于30 W紫外光下,距离30 cm,照射0.25、0.5、1、1.5、2 h,以不用紫外光照射的粗提液为对照,采用牛津杯法,取20 μL检测其抑菌活性[32]。
1.3 数据分析
抑菌圈直径采用十字交叉法测量,每个实验三次重复,采用平均值±标准误差,用SPSS(18.0)软件对数据进行分析处理,方差分析显著水平为p=0.05。
2 结果与分析
2.1Lactobacillusacidophilus的抑菌效果
Lactobacillusacidophilus发酵培养液抑菌活性测定结果如图1所示,和对照相比,样品作用于大肠杆菌均有明显的抑菌圈,说明Lactobacillusacidophilus可以产生抑菌物质,对大肠杆菌具有较好的抑菌作用。
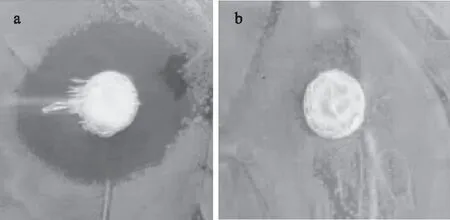
图1 菌液对大肠杆菌的抑菌效果Fig.1 Inhibitory effect of fermentation broth on Escherichia coli注:a. 抑菌物质;b. CK。
2.2 单因素实验结果
2.2.1 培养温度对抑菌效果的影响 从图2可以看出,在温度31~43 ℃范围内,抑菌圈直径随着温度的升高增大后减小,在低于37 ℃时,抑菌圈直径的增加有显著性差异,而在高于37 ℃时,抑菌圈直径没有显著增加,在43 ℃时有下降的趋势,可能是抑菌物质在温度较高时会部分失活[33],因此,培养温度选择34~40 ℃之间为宜。
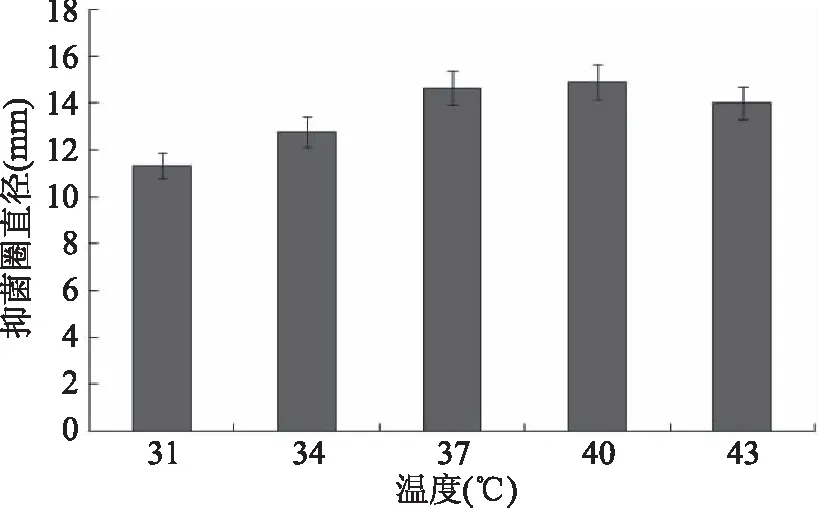
图2 温度对抑菌效果的影响Fig.2 Effect of temperature on antagonistic effect
2.2.2 初始pH对抑菌效果的影响 由图3可知,在初始pH5.0~9.0范围内,抑菌圈直径随着初始pH的升高先增大后减小,在初始pH高于7.0后,抑菌圈直径随着初始pH的升高而降低,不同于大多数乳酸菌在弱酸性环境中生长,说明细菌素的产生是菌株对不良环境的应激反应[33]。因此,选择初始pH6.0~8.0之间较好。
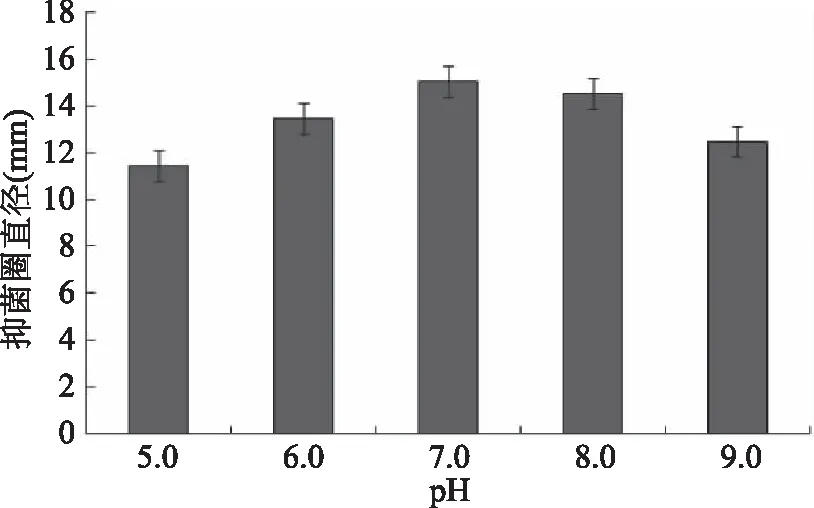
图3 初始pH对抑菌效果的影响Fig.3 Effect of initial pH on antagonistic effect
2.2.3 培养时间对抑菌效果的影响 由图4可知,随着培养时间的延长,抑菌圈直径逐渐增大并趋于稳定,其中在18 h内,抑菌圈直径的增大有显著性差异,而在18 h后,抑菌圈直径基本保持不变,已经趋于稳定,说明该菌发酵产生的抑菌物质已达到最高值,而且培养时间过长会使部分抑菌物质失活或者被菌体吸附[32],所以综合考虑,选择培养时间16~20 h。
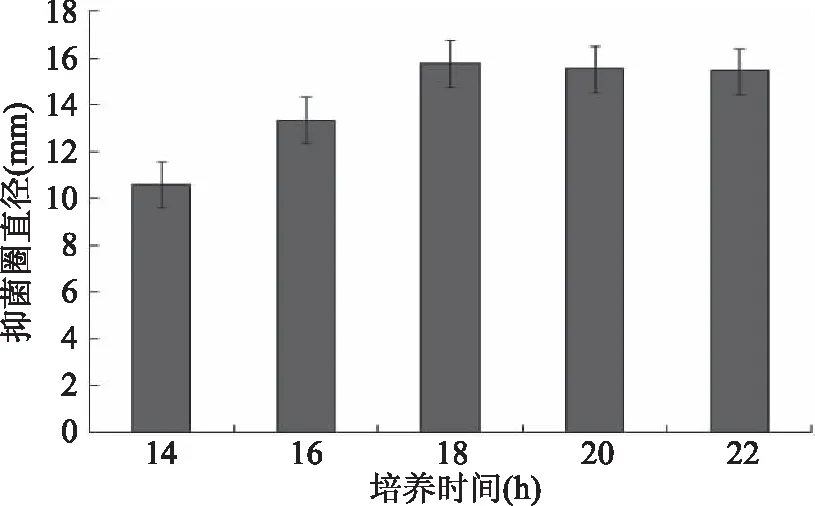
图4 培养时间对抑菌效果的影响Fig.4 Effect of time on antagonistic effect
2.3 响应面优化实验结果
2.3.1 回归模型的建立及方差分析 按照表1设计的因素水平,采用Box-Behnken实验设计,对Lactobacillusacidophilus发酵条件进行优化研究,结果见表2~表4。
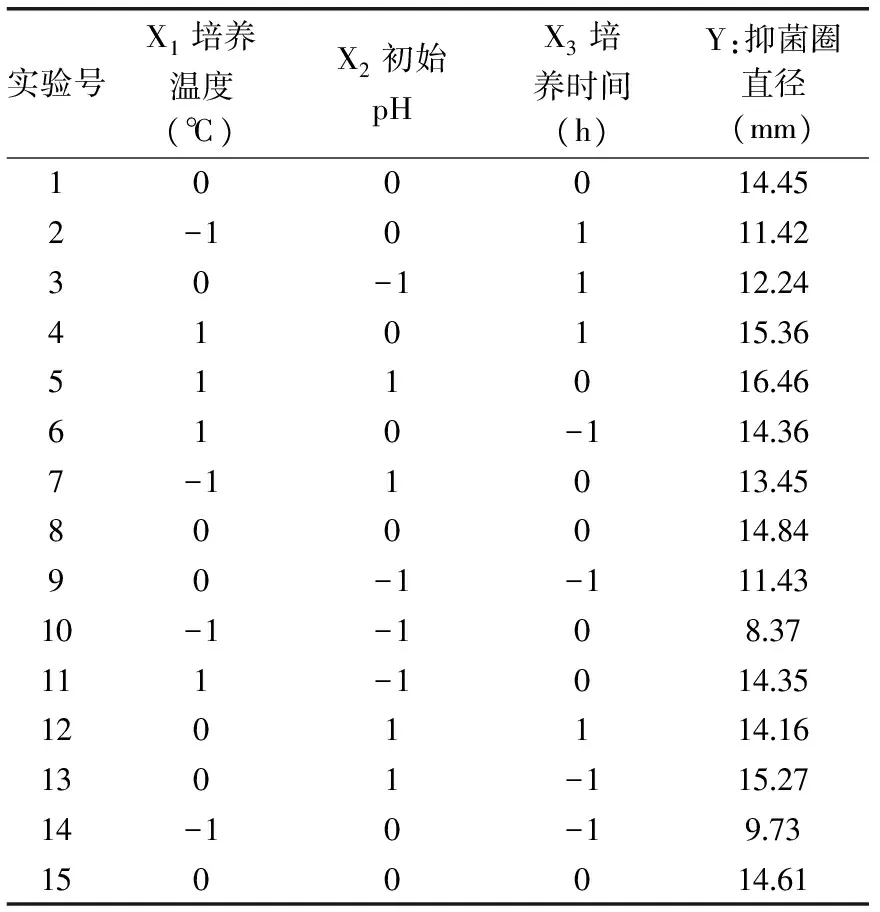
表2 响应面设计与结果Table 2 Response surface design and corresponding response values
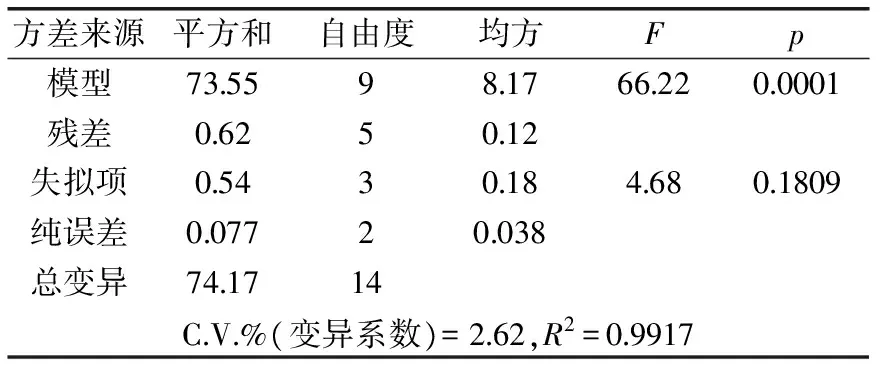
表3 回归方程系数显著性检验表Table 3 Significant test of regression equation coefficient
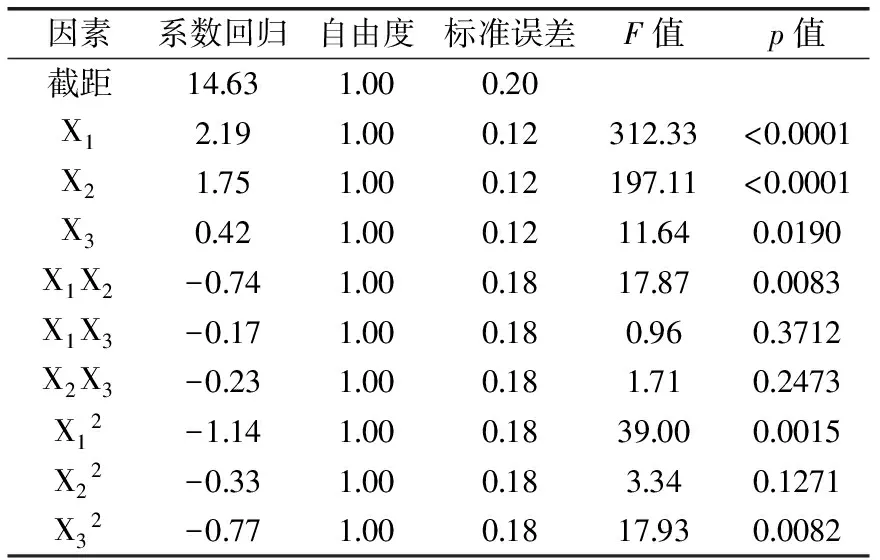
表4 响应面模型的方差分析结果Table 4 ANOVA for response surface model
表3的数据结果显示,R2(决定系数)为0.9917表示该模型能够解释99%的响应值变化,失拟项不显著说明该模型拟合程度良好,实验误差小。模型p=0.0001表明该响应面设计模型为显著模型。
从表4回归方程系数显著性检验可知,在p=0.05显著水平,模型一次项X1、X2和X3都显著;交互项X1X2显著,X1X3和X2X3不显著;二次项X12和X32显著,X22不显著。各因素对抑菌活性的影响不是简单的线性关系,利用软件对表4中的数据进行二元回归分析,得到各因子对抑菌圈直径(Y)影响的二次多项回归模型:
Y=-378.94+12.37X1+17.65X2+9.05X3-0.25X1X2-0.03X1X3-0.12X2X3-0.13X12-0.33X22-0.19X32
2.3.2 响应面双因素交互分析 二阶回归模型的响应面和等高线图分别见图5~图7,通过图中因素对响应值的直观分析,可以对两因素间的交互作用进行评价,并根据回归方程求出优化工艺条件。
在培养时间为18 h的条件下,培养温度和初始pH的交互作用结果显示最优值分别是培养温度37 ℃,初始pH为7,抑菌圈直径达到最大值14.45 mm(图5),在培养温度一定的条件下,抑菌圈直径随着pH的增加而增大,当pH接近8时,抑菌圈直径增加缓慢;在pH一定的条件下,抑菌圈的直径随着温度的升高而增大,当温度超过38 ℃后,继续升高温度,抑菌圈直径呈下降趋势,且后者的下降变化速率比前者上升的变化速率更快。从等高线图可以看出,响应值对培养温度的变化比对初始pH的变化更为敏感,两者的交互作用极为显著。
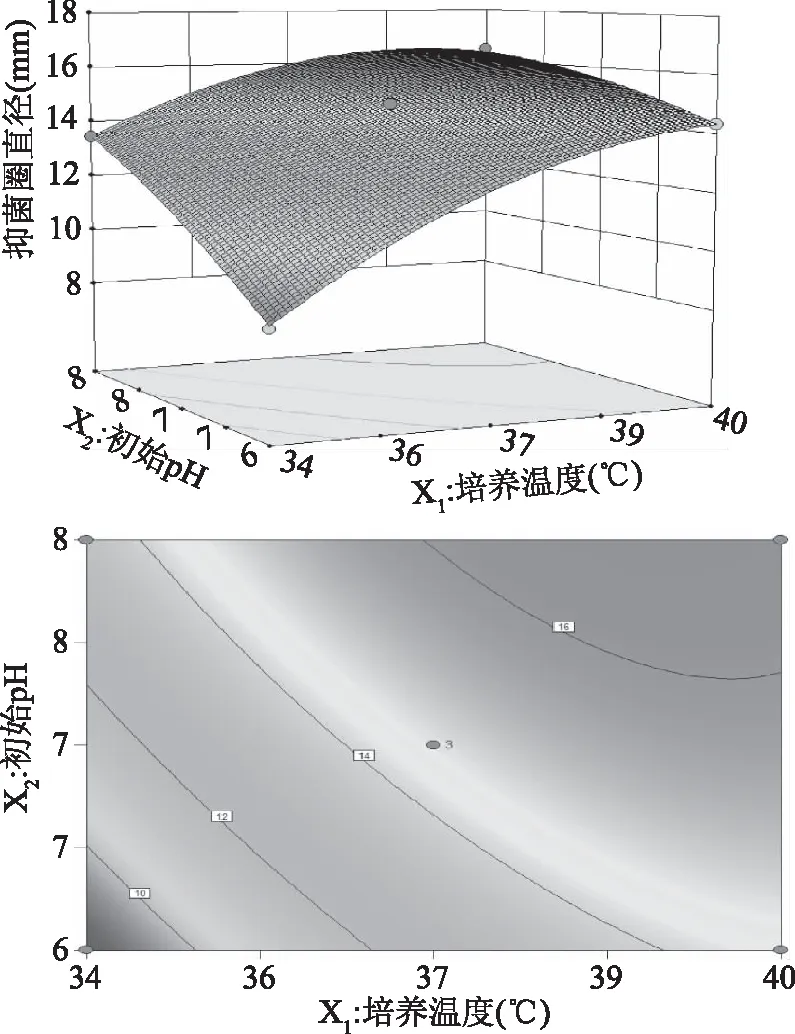
图5 培养温度和初始pH对抑菌圈直径的 交互作用响应面模型Fig.5 Response surface model plot showing the effects of temperature and initial pH on antagonistic diameter
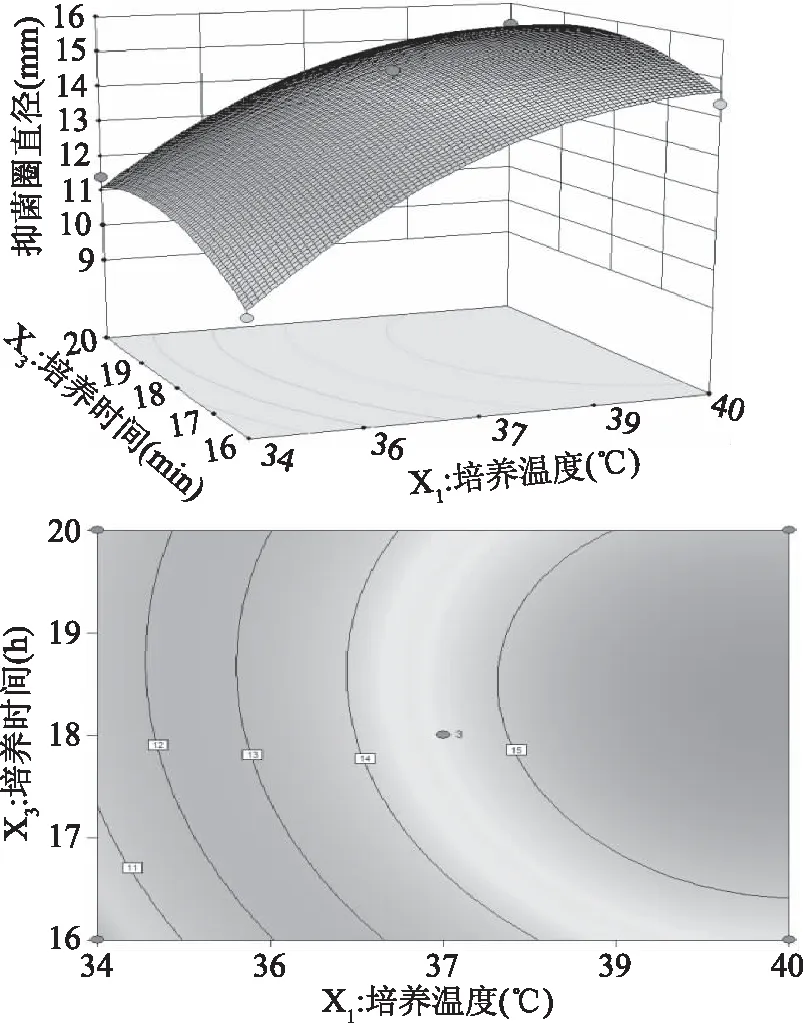
图6 培养温度和培养时间对抑菌圈直径的 交互作用响应面模型Fig.6 Response surface model plot showing the effects of temperature and time on antagonistic diameter
在pH为7的条件下,培养温度和培养时间的交互作用结果显示最优值分别是培养温度37 ℃,培养时间18 h,抑菌圈直径达到最大值14.61 mm(图6),在培养温度一定的条件下,抑菌圈直径随着培养时间的增加而增大,当培养时间超过18 h后,再延长培养时间抑菌圈直径反而下降,但是后者下降的变化速率比前者上升的变化速率明显要慢;在培养时间一定的条件下,抑菌圈的直径随着培养温度的升高而增大,当温度超过38 ℃后,继续升高温度,抑菌圈直径呈下降趋势,后者的下降变化速率和前者上升的变化速率相当。从等高线图可以看出,响应值对培养时间的变化比对培养温度的变化更为敏感,但两者的交互作用不显著。
在培养温度为37 ℃的条件下,初始pH和培养时间的交互作用结果显示最优值分别是初始pH为7,培养时间18 h,抑菌圈直径达到最大值14.61 mm(图7),在初始pH一定的条件下,抑菌圈直径随着培养时间的增加而增大,当培养时间超过18 h后,再延长培养时间,抑菌圈直径反而下降,但是后者下降的变化速率比前者上升的变化速率明显要慢;在培养时间一定的条件下,抑菌圈的直径随着初始pH的升高而增大,当pH超过7后,继续增加pH,抑菌圈直径呈下降趋势,后者下降的变化速率比前者上升的变化速率更快。从等高线图可以看出,响应值对培养时间的变化比对初始pH的变化更为敏感,两者的交互作用不显著。
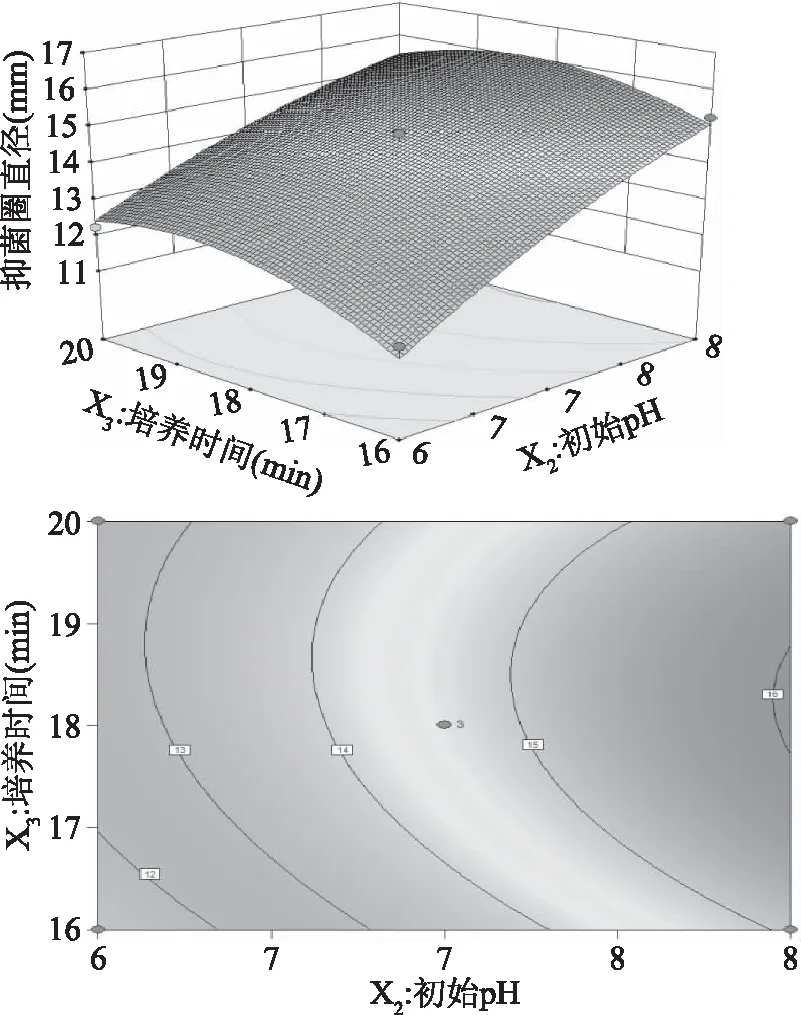
图7 初始pH和培养时间对抑菌圈直径的 交互作用响应面模型Fig.7 Response surface model plot showing the effects of initial pH and time on antagonistic diameter
2.3.3 培养条件优化及验证实验 通过design expert 8.0优化的培养条件为:培养温度38.13 ℃,初始pH为7.00,培养时间17.87 h,抑菌圈直径最大值为16.47 mm。结合实际情况,可将培养温度38 ℃,初始pH为7,培养时间18 h作为实际操作的工艺参数。在优化的培养条件重复进行五次实验,结果如表5所示,标准偏差较小,实验结果稳定,可以进行下一步应用。
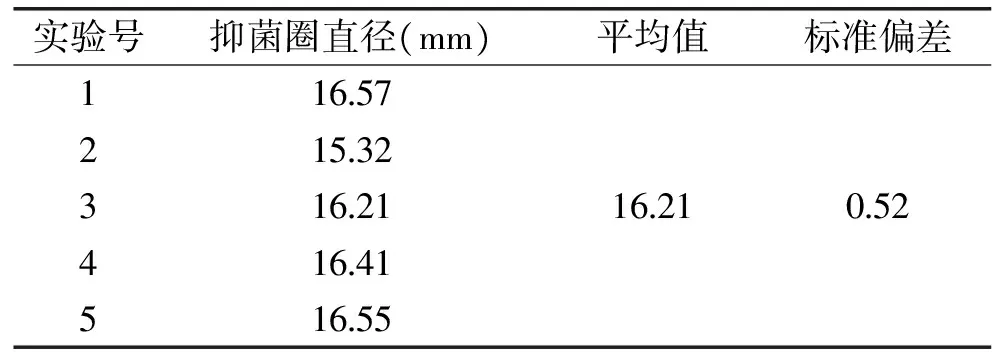
表5 验证实验Table 5 Verification test
2.4Lactobacillusacidophilus产细菌素的定位
Lactobacillusacidophilus菌体不同部位抑菌活性测定结果如图8所示,胞外提取液的抑菌活性最高,其次是周质空间,而胞内提取液几乎没有抑菌活性,说明Lactobacillusacidophilus菌体在胞内产生的细菌素为可溶性物质,大部分分泌到了胞外培养液中,由此确定Lactobacillusacidophilus产的细菌素为胞外酶。
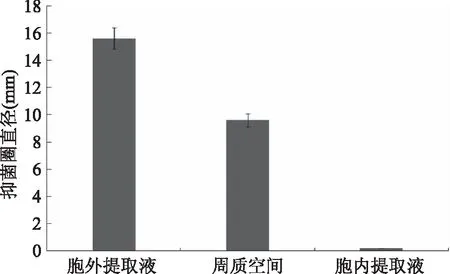
图8 Lactobacillus acidophilus产细菌素定位Fig.8 Bacteriocin localization of Lactobacillus acidophilus
2.5Lactobacillusacidophilus产细菌素的稳定性
2.5.1 对热的稳定性 将经过硫酸铵沉淀的粗提液分别在不同的温度条件下进行处理,以未经温度处理的粗提液作为对照,不同温度处理的粗提液的抑菌活性如图9所示。
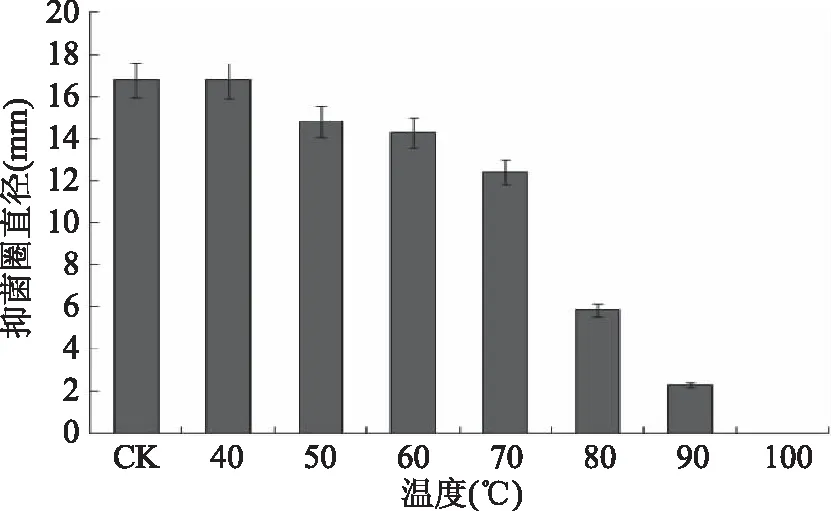
图9 温度对细菌素抑菌活性的影响Fig.9 Inhibitory activity of the bacteriocin treated by different temperature
从图9可以看出,Lactobacillusacidophilus产生的细菌素受温度的影响较大,当温度低于70 ℃时,虽然随着温度升高该细菌素质抑菌活性有所下降,但没有显著性差异,总体上比较稳定;在温度达到80 ℃时,细菌素质的抑菌活性大幅下降,与之前的抑菌活性相比有显著性差异;当温度达到100 ℃时细菌素失去活性,说明该细菌素质有很好的热稳定性。
2.5.2 对蛋白酶的稳定性 取三份经过硫酸铵沉淀的粗提液分别加入胰蛋白酶、胃蛋白酶、蛋白酶K溶液进行处理,后测定其抑菌活性,以加入20 μL PBS缓冲液(pH6.8)处理的粗提液作为对照,测定结果如图10所示。
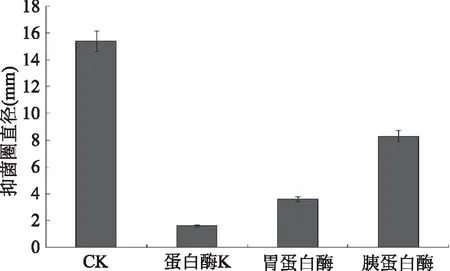
图10 蛋白酶对细菌素抑菌活性的影响Fig.10 Inhibitory activity of the bacteriocin treated by different proteinase
从图10可以看出,经蛋白酶处理后的粗提液与未经蛋白酶处理的粗提液相比,抑菌活性明显下降,有显著性差异,特别是蛋白酶K的影响最大,说明该细菌素对蛋白酶敏感。
2.5.3 对pH的稳定性 将经过硫酸铵沉淀的粗提液分别用不同pH处理,以未经处理的粗提液为对照,测定不同的pH处理后的粗提液的抑菌活性,结果如图11所示。
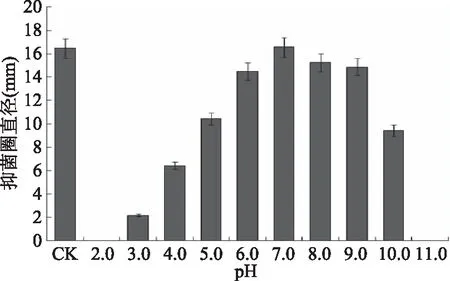
图11 pH对细菌素抑菌活性的影响Fig.11 Inhibitory activity of the bacteriocin treated by different pH
从图11可以看出,细菌素的抑菌活性受pH的影响很大,该细菌素在中性条件下比较稳定,在强酸性和强碱性条件下抑菌活性显著下降,与中性条件下的抑菌活性相比有显著性差异,在pH达到10.0以上或者3.0以下失去抑菌活性,说明该细菌素的活性pH范围很广。
2.5.4 对紫外线的稳定性 将经过硫酸铵沉淀的粗提液置于紫外光下,距离30 cm,照射不同时间进行处理,以不用紫外光照射的粗提液为对照,测定其抑菌活性,结果如图12所示。结果表示,随着紫外线照射时间的延长,粗提液的稳定性受到影响,经过差异性分析发现紫外照射超过1 h其抑菌活性有显著性降低。
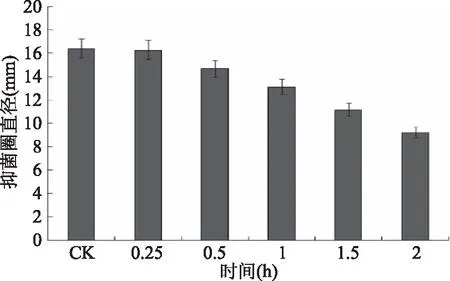
图12 紫外线对细菌素抑菌活性的影响Fig.12 Inhibitory activity of the bacteriocin treated by ultraviolet irradiation
3 结论
乳酸菌细菌素是乳酸菌在代谢过程中产生的多肽类的抑菌物质,具有无毒、高效、耐酸、耐高温等特点,可用来代替化学防腐剂应用于食品保鲜。本课题组保存的一株Lactobacillusacidophilus所产生的细菌素对大肠杆菌有很好的抑制作用,在MRS培养基中,Lactobacillusacidophilus产生细菌素的最适条件为培养温度38 ℃,初始pH7.0,培养时间18 h,抑菌圈直径为16.47 mm,在此条件下验证实验结果为16.21 mm,相对偏差小,说明该工艺条件稳定。通过硫酸铵盐析对发酵液中的细菌素进行提取,发现沉淀有抑菌作用,初步可以断定为蛋白类物质,且通过定位实验发现细菌素大部分存在于细胞外。细菌素在40~90 ℃有活性,具有良好的热稳定性;在蛋白酶K、胃蛋白酶和胰蛋白酶处理后,抑菌活性大大降低;在pH3.0~10.0之间具有抑菌活性;紫外照射时间超过1 h,其抑菌活性有显著性的减低。本研究对于Lactobacillusacidophilus产生的细菌素的分离、纯化和鉴定等后续工作奠定了理论基础。
[1]曾玉英. 食品物流存在的食品安全问题与对策[J]. 食品与机械,2015(3):278-280.
[2]Liu H,Dengpan B U,Zhongwang L,et al. Effect of Lactic Acid Bacteria or a Chemical Preservative on the Quality and Aerobic Stability of Alfalfa Silage Produced in Farm-scale Silos[J]. Acta Veterinaria Et Zootechnica Sinica,2015,46(5):784-791.
[3]Jafarpour M,Golparvar A R,Askari-Khorasgani O,et al. Improving postharvest vase-life and quality of cut gerbera flowers using natural and chemical preservatives[J]. Journal of Central European Agriculture,2015,16(2):199-211.
[4]Giménez B,Graiver N,Califano A,et al. Physicochemical characteristics and quality parameters of a beef product subjected to chemical preservatives and high hydrostatic pressure.[J]. Meat Science,2015,100:179-188.
[5]王亚利,包秋华,王俊国,等. 乳酸菌活的非可培养态的研究进展[J]. 中国乳品工业,2016,44(3):41-45.
[6]王悦齐,吴燕燕,李来好,等. 乳酸菌的抗氧化活性及其在水产品加工中的应用[J]. 食品工业科技,2015,36(8):356-360.
[7]宋宇琴,孙志宏,张和平. 乳酸菌微进化的研究进展[J]. 微生物学报,2015,55(11):1371-1377.
[8]崔月倩,王菁蕊,王艳萍. 乳酸菌基因表达载体及其应用研究进展[J]. 食品科学,2015,36(9):224-229.
[9]任璐雅,杨艳艳,章检明,等. 乳酸菌抗菌肽(细菌素)抗菌机理的研究进展[J]. 中国食品添加剂,2015(1):143-149.
[10]Mohedano M L,García-Cayuela T,Pérez-Ramos A,et al. Construction and validation of a mCherry protein vector for promoter analysis in Lactobacillus acidophilus[J]. Journal of Industrial Microbiology & Biotechnology,2015,42(2):247-253.
[11]张鑫,黄乐平,陈卫平. 微生物防腐剂细菌素在食品上的应用[J]. 食品研究与开发,2010,31(12):266-269.
[12]Cotter P D,Hill C,Ross R P. Bacteriocins:developing innate immunity for food[J]. Nature Reviews Microbiology,2005,3(10):777-788.
[13]Appleyard A N,Choi S,Read D M,et al. Dissecting structural and functional diversity of the lantibiotic mersacidin[J]. Chemistry & Biology,2009,16(5):490-498.
[14]Terebiznik M R,Jagus R J,Cerrutti P,et al. Combined effect of nisin and pulsed electric fields on the inactivation of Escherichia coli[J]. Journal of Food Protection,2000,63(6):741-746.
[15]Traub W H,Eiden A,Leonhard B,et al. Typing of nosocomial strains of Serratia marcescens:comparison of restriction enzyme cleaved genomic DNA fragment(PFGE)analysis with bacteriocin typing,biochemical profiles and serotyping[J]. Zentralblatt für Bakteriologie,1996,284(1):93-106.
[16]朱双,张爱忠,姜宁,等. 细菌素及其在动物生产中的应用[J]. 动物营养学报,2014,26(2):327-333.
[17]Field D,Cotter P D,Ross R P,et al. Bioengineering of the model lantibiotic nisin.[J]. Bioengineered,2015,6(4):187-192.
[18]Abdollahzadeh E,Rezaei M,Hosseini H. Antibacterial activity of plant essential oils and extracts:The role of thyme essential oil,nisin,and their combination to control Listeria monocytogenes,inoculated in minced fish meat[J]. Food Control,2014,35(35):177-183.
[19]Felicio B A,Pinto M S,Oliveira F S,et al. Effects of nisin on Staphylococcus aureus,count and physicochemical properties of Minas Frescal cheese[J]. Journal of Dairy Science,2015,98(7):589-596.
[20]Perin L M,Nero L A. Antagonistic lactic acid bacteria isolated from goat milk and identification of a novel nisin variantLactococcuslactis[J]. BMC Microbiology,2014,14(1):36-47.
[21]Fernandez B,Savard P,Fliss I. Survival and metabolic activity of pediocin producerPediococcusacidilacticiUL5:Its impact on intestinal microbiota andListeriamonocytogenesin a model of the human terminal ileum[J]. Microbial Ecology,2015,72(4):1-12.
[22]Kumariya R,Sood S K,Rajput Y S,et al. Gradual pediocin PA-1 resistance inEnterococcusfaecalis,confers cross-protection to diverse pore-forming cationic antimicrobial peptides displaying changes in cell wall and mannose PTS expression[J]. Annals of Microbiology,2015(2):1-12.
[23]Mandala B,Chowdhury R,Bhtattacharjee C. Pediocin production byPediococcusacidilacticiNCIM 2292 in fed batch and repeated fed batch fermentation using goat meat processing wastes[J]. Asian Journal of Microbiology Biotechnology & Environmental Sciences,2015,17(1):87-94.
[24]Liu S,Takala T M,Reunanen J,et al. Attachment ofEscherichiacoli,toListeriamonocytogenes,for Pediocin-Mediated Killing[J]. Current Microbiology,2015,70(2):195-198.
[25]杨天佑,段改丽,赵瑞香,等. 嗜酸乳杆菌细菌素 Lactobacillin XH1 的生物学特性[J]. 食品科学,2013,34(17):197-200.
[26]段改丽. 嗜酸乳杆菌细菌素Lactobacillin XH1分离纯化及特性研究[D]. 新乡:河南科技学院,2014.
[27]冉军舰,徐剑宏,胡晓丹,等. 1株产脂肽类抗生素芽孢杆菌的鉴定及脂肽类抗生素相关基因克隆[J]. 食品科学,2016,37(17):127-132.
[28]王莹,赵瑞香,马艳艳,等. 嗜酸乳杆菌细菌素Lactobacillin XH1发酵条件优化[J]. 食品工业,2016,37(10):30-34.
[29]徐剑宏,潘艳梅,胡晓丹,等. 降解菌DDS-1产3-AC-DON氧化酶的酶学特性[J]. 中国农业科学,2013,46(11):2240-2248.
[30]Leelasuphakul W,Sivanunsakul P,Phongpaichit S. Purification,characterization and synergistic activity ofβ-1,3-glucanase and antibiotic extract from an antagonistic Bacillus subtilis,NSRS 89-24 against rice blast and sheath blight[J]. Enzyme & Microbial Technology,2006,38(7):990-997.
[31]彭好文,黎起秦,蒙娇荣,等. 芽孢杆菌B11拮杭蛋白性质及其对西瓜枯萎病菌的作用机理[J]. 植物保护,2003(5):22-25.
[32]冉军舰,徐剑宏,赫丹,等. 小麦赤霉病原菌拮抗菌Bacillus amyloliquefaciens 7M1产抗菌素的研究[J]. 微生物学通报,2016,43(11):2437-2447.
[33]王娜娜,李婉,杜金城,等. 乳酸乳球菌KLDS4.0325产细菌素最佳培养条件的研究[J]. 食品工业科技,2016(14):187-190.
Extraction of bacteriocin produced byLactobacillusacidophilusand biology characteristic analysis
RAN Jun-jian,JIAO Ling-xia,LIANG Xin-hong,HE Hong-ju,ZHU Ming-ming,LU Yan-qing,ZHAO Rui-xiang*
(Henan Institute of Science and Technology,School of Food Science,Xinxiang 453003,China)
Response surface methodology was used to optimize the conditions for producing bacteriocin,biological methods was applied for localization of bacteriocin and the stabilization of bacteriocin ofLactobacillusacidophilus. Results showed that the optimal bacteriocin production forLactobacillusacidophiluswere:38 ℃,pH7.0 and 18 hours in MRS medium.Lactobacillusacidophilusfermentation broth could inhibit the growth ofEscherichiacoliwhich was mainly in the extracellular extracts. The bacteriocin had good heat stability under 40~70 ℃. The inhibitory activity was decreased by the treatment with proteinase K,pepsin and trysin. The active pH of the bacteriocin to the pathogen was from 3.0 to 10.0. The inhibitory activity was stable with the time of ultraviolet irradiation 0.25~1 h. These results may provide an important reference for separation and application of bacteriocin produced byLactobacillusacidophilus.
Lactobacillusacidophilus;bacteriocin;localization;antimicrobial activity;stability
2016-12-27
冉军舰(1981-),男,博士,副教授,主要从事食品生物技术的研究,E-mail:ranjunjian@126.com。
*通讯作者:赵瑞香(1966-),女,博士,教授,主要从事食品营养因子的研究,E-mail:zhaoruixiang103@126.com。
国家自然科学基金青年基金(31401673);河南科技学院高层次人才科研项目(2015016);河南科技学院科技创新基金(2015006)。
TS201.3
A
1002-0306(2017)13-0112-07
10.13386/j.issn1002-0306.2017.13.021

