芥子酸模拟体系化学氧化褐变反应
董 霞,王 芳,庞美霞,徐令怡,崔宇倩,綦菁华
(北京农学院食品科学与工程学院/北京农学院农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206)
芥子酸模拟体系化学氧化褐变反应
董 霞,王 芳,庞美霞,徐令怡,崔宇倩,綦菁华*
(北京农学院食品科学与工程学院/北京农学院农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206)
为了明确芥子酸化学氧化的影响因素,为今后更好地控制果蔬及其制品的褐变提供理论依据,本实验以芥子酸建立模拟体系,采用紫外可见分光光度计法在315、420 nm处分别测定芥子酸浓度及氧化产物褐变度。结果表明,对芥子酸化学氧化进行反应动力学拟合,确定符合一级反应动力学模型,其中在pH10.0条件下反应速率最大(5.38 h-1)。正交实验结果表明,温度在0.05水平对芥子酸化学氧化褐变度影响显著,pH在0.1水平对芥子酸化学氧化褐变度影响显著,浓度在0.1水平对芥子酸化学氧化褐变度影响不显著。芥子酸在90 ℃比40、25 ℃更容易发生化学氧化,在pH10.0比pH3.7、7.0条件更容易发生化学氧化。芥子酸在高温碱性环境下更易氧化褐变,针对这一特点,在果蔬的加工过程中为尽可能避免褐变的发生,应尽量避免高温高碱等加工操作。
芥子酸,化学氧化,褐变,一级反应动力学
酚类广泛存在于果蔬及其制品中,直接影响其风味、色泽和稳定性。酚类氧化包括酶促氧化和非酶促氧化[1-2]。
当果蔬产生损伤时,果蔬中的多酚会发生酶促氧化,引起果蔬褐变[3]。果蔬加工中的高温杀菌等工艺,已使酚酶钝化,因此对于加工后的果蔬,酚类主要发生的是化学氧化。
果蔬褐变影响产品的感官特性及营养价值[4-5]。目前,已有研究表明蔬菜及其制品的褐变与酚类化学氧化有关。胡燕[6]认为酚类氧化聚合是藕片产生褐变的原因;易俊洁[7]研究发现酸菜的褐变可能是由酚类化学氧化引起的。目前,控制褐变主要采用添加螯合剂、亚硫酸盐等化学方法,由于食品安全方面的问题,亟待寻求更安全有效的抑制褐变的方法[8]。
芥子酸普遍存在于芸薹属蔬菜中[9-11]。柑橘果皮和蜜柚中也含有大量的芥子酸[12-13]。国内外目前对芥子酸的关注点主要在于其生物活性方面[14]。对其氧化机理及氧化产物的报道较少。杨汝婷曾用单电子氧化剂(氧化银)氧化芥子酸,得到了氧化偶联产物双内酯二聚物,并推测其氧化机理:首先形成稳定的酚氧自由基,经历自由基的偶联聚合,通过分子内的亲核进攻生成相应的双内酯二聚物[15]。但并未涉及到氧化产物与褐变的研究。果蔬加工过程中,芥子酸接触到的加工操作不同,其氧化机理及氧化产物也会存在差异,这些需要进一步的探索。
本实验以芥子酸建立模拟体系,系统研究酚类氧化对褐变度的影响,目的在于明确芥子酸化学氧化的影响因素,合理地控制其氧化,为今后更好地控制果蔬产品的褐变提供理论支持。
1 材料与方法
1.1 材料与仪器
芥子酸(Aladdin®)纯度98%;磷酸、硼酸、醋酸、氢氧化钠均为分析纯 北京化工厂;TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司;HH-S数显恒温水浴锅 常州翔天实验仪器厂;高纯氧气 北京市氧利来科技发展有限公司。
1.2 实验方法
1.2.1 缓冲溶液配制 据要求分别配制不同 pH(3.7、7、10)的 Britton-Robison缓冲溶液,提供反应体系的溶液环境。
1.2.2 酚类化学氧化 参考綦菁华等方法[16],将芥子酸溶解在不同 pH缓冲溶液中,取30 mL置于两口圆底烧瓶中,不停地鼓入高纯氧气,提供给反应体系充足的氧气。将圆底烧瓶置于不同温度的水浴锅中加热保温。
酚类化学氧化的影响因素有反应物的组成及浓度、反应体系的温度、反应环境pH、反应时间等[17]。结合果蔬加工过程中涉及到的工艺条件选择pH、温度、浓度作为研究因素。
一般果蔬制品的pH在中性范围;而有的发酵产品如酸菜pH在3~4之间;此外有的果蔬在加工过程中会进行碱液去皮,碱液去皮常用NaOH,pH在10~14不等[18]。因此pH选择3.7、7.0、10.0作为研究条件。
对于温度的选择,25 ℃和40 ℃分别模拟了果蔬在加工及贮存流通过程常见的室温水平。果蔬在加工过程中为抑制其酶促氧化,通常会进行加热和漂烫处理,使酶钝化;一般加热和漂烫温度在75~95 ℃之间[19]。为使实验结果更加明显及结合工艺条件,选择90 ℃模拟果蔬加工过程中的漂烫钝酶过程。
不同芸薹属蔬菜中芥子酸含量差异较大。叶用芥菜的芥子酸含量在102.48~257.67 μg/g Dw之间,小白菜芥子酸含量变化范围在88.97~249.51 μg/g Dw之间,不同基因型菜心与紫菜蔓的芥子酸含量在45.91~126.93 μg/g Dw之间[20]。胡玉霞分别用干腌、湿腌及接种三种方法腌渍雪里蕻,5周后芥子酸含量在83.9~106.7 μg/g Dw之间[21]。根据参考文献报道蔬菜中芥子酸含量以及实验结果的可见性,选择芥子酸浓度50、150、250 mg/L。
选择芸薹属蔬菜中普遍存在的羟基肉桂酸芥子酸作为研究的酚类,按正交实验设计 L9(34)具体的酚类氧化体系,进行化学氧化反应,见表1。反应时间为8 h。
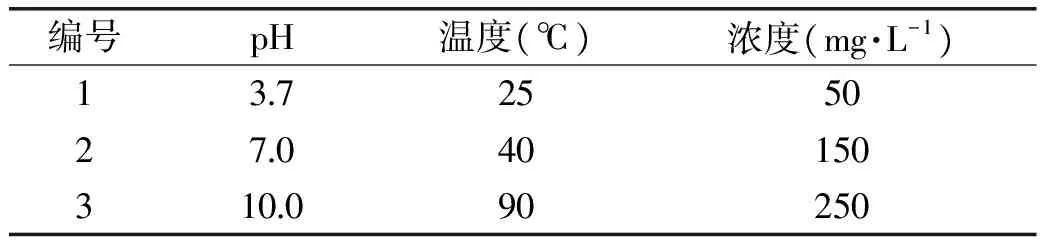
表1 芥子酸化学氧化的 L9(34) 正交设计表Table 1 L9(34)orthogonal design of chemical oxidation about sinapic acid
1.2.3 褐变度的测定 利用紫外可见分光光度计,选择波长420 nm,每1 h测定一次溶液吸光度值,平行测定三次。
1.2.4 芥子酸浓度测定 采用紫外可见分光光度计法测定芥子酸浓度[17]。用缓冲溶液在波长200~500 nm做基线校准。配制浓度为30 mg/L的芥子酸标准溶液,在波长200~500 nm进行光谱扫描,得到芥子酸的吸收曲线,选择最大吸收峰处的波长作为芥子酸最大吸收波长。配制浓度分别为0、1.6、4.5、6、7.5、8.3 mg/L芥子酸标准溶液,在最大吸收波长处测定标准品溶液的吸光度,做吸光度-浓度标准曲线。
芥子酸分别溶解于pH3.7、7.0、10.0的缓冲溶液中,浓度为200 mg/L,置于90 ℃的水浴锅中加热保温,持续通氧反应8 h。每1 h用紫外可见分光光度计在最大吸收峰波长处测定溶液的吸光度值,根据芥子酸标准曲线计算芥子酸浓度。
1.2.5 数据处理 每个实验指标重复测定3次,数据取平均值。数据通过origin 8.0软件处理。
2 结果与分析
2.1 芥子酸化学氧化的反应动力学研究
2.1.1 芥子酸标准溶液线性关系考察 对芥子酸进行光谱扫描,在315 nm处有最大吸收峰,所以选择315 nm作为芥子酸最大吸收波长。对芥子酸梯度标准液在315 nm处的吸光度值与浓度进行线性拟合,得出标准曲线方程Y=76.2X+0.007,R2=0.995,线性关系良好。
2.1.2 pH对芥子酸浓度的影响 pH对芥子酸浓度的影响实验结果如图1所示。

图1 不同pH条件下芥子酸化学氧化浓度变化(90 ℃)Fig.1 Change of concentration of chemical oxidation by sinapic acid in various values of pH(90 ℃)
从图1可以看出,随着反应时间的增加,芥子酸浓度均有不同程度的下降。其中pH10.0条件下,芥子酸含量下降最为显著,0~8 h内,芥子酸含量下降了87.4%;芥子酸在pH7.0 条件下,0~8 h 芥子酸含量下降了59.45%;而pH3.7缓冲溶液环境中,芥子酸浓度变化仅为24.41%。这与芥子酸在不同pH条件下的褐变趋势相符(图4)。芥子酸浓度的变化表明芥子酸发生了化学氧化。
由图1可以看出,在芥子酸化学氧化后期,浓度逐渐趋于平稳,不再被消耗,而图4中芥子酸在不同pH条件下,芥子酸化学氧化产物的褐变度却一直处于逐渐增加的趋势。说明,芥子酸在化学氧化后期,主要是前期生成的中间物质发生聚合反应,导致体系褐变度增加。
2.1.3 芥子酸氧化反应动力学 根据芥子酸含量的变化计算反应速率,进行反应速率与浓度的线性拟合,如图2所示。

图2 芥子酸化学氧化浓度与速率的关系Fig.2 Relationship between sinapic acid concentration and chemical oxidation reaction rate
由图2可以看出,芥子酸化学氧化过程反应过程反应速率与浓度成直线关系。凡是反应速率与反应物浓度的一次方成正比的反应称为一级反应[23]。芥子酸化学氧化符合一级反应动力学特征,可以认为芥子酸的化学氧化是一级反应。
2.1.4 芥子酸化学反应速率常数与pH关系 由图3可以看出,芥子酸的反应速率在pH10.0 的条件下是非常快的(一级反应速率常数5.38 h-1),但是在pH3.7的缓冲溶液中,芥子酸的反应速率很慢(一级反应速率常数为0.172 h-1)。这表明碱性环境更有利于芥子酸的化学氧化。咖啡酸与芥子酸都属于羟基肉桂酸,属于C6-C3结构。Cilliers和Singleton在研究咖啡酸的化学氧化时发现,在通入100%氧气的条件下,咖啡酸在pH8.0时的一级反应速率常数远远大于pH4.0 的氧化反应速率常数[24]。这与此次实验的实验现象相符。
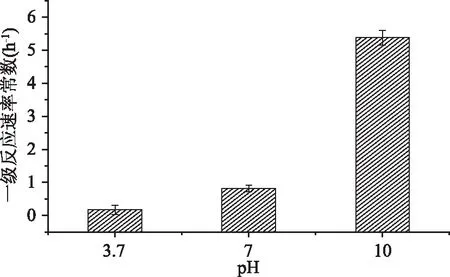
图3 芥子酸化学氧化不同pH条件下一级反应速率常数Fig.3 First order reaction rate constant of chemical oxidative products by sinapic acid in various pH
芥子酸在酸性条件下较稳定,随着pH的增加,苯环上的羧基-COOH开始解离,继续增加pH,羟基-OH开始解离[25]。随着羧基羟基的电离,体系分子的带电状态发生了变化,影响分子间的聚合,导致褐变产物的生成。
2.2 芥子酸化学氧化产物的褐变度研究
2.2.1 芥子酸化学氧化影响因素 根据表1的正交实验设计,进行芥子酸的氧化实验,反应8 h后测定吸光度值。并对正交实验结果进行极差和方差分析,分析结果如表2、表3所示。
由表2极差分析可知,芥子酸化学氧化对褐变影响的主次因素为温度>pH>浓度。由表2可知,温度为90 ℃,芥子酸化学氧化褐变度最大。进一步对正交实验结果进行方差分析,分析结果如表3所示。温度的选择对褐变度(F=54.13885>19.00)的影响在0.05的水平显著,pH的选择对褐变(F=17.70707>9.00)的影响在0.1的水平显著,浓度对褐变影响在0.1水平不显著(F=6.181445<9.00)。
本实验利用A420 nm测定产物褐变度,A420 nm值越大,说明产物褐变越严重。从上述数据可以看出,芥子酸发生化学氧化后,褐变度均有增加,说明芥子酸化学氧化均产生了褐变产物。浓度大小对芥子酸化学氧化产物的生成影响不显著,因此即使果蔬中芥子酸含量很低,随着时间的延长,在加工贮藏过程中,酚类通过化学氧化聚合,引起果蔬的褐变。

表3 正交实验方差分析Table 3 Analysis of variance of L9(34)orthogonal design of chemical oxidation about sinapic acid
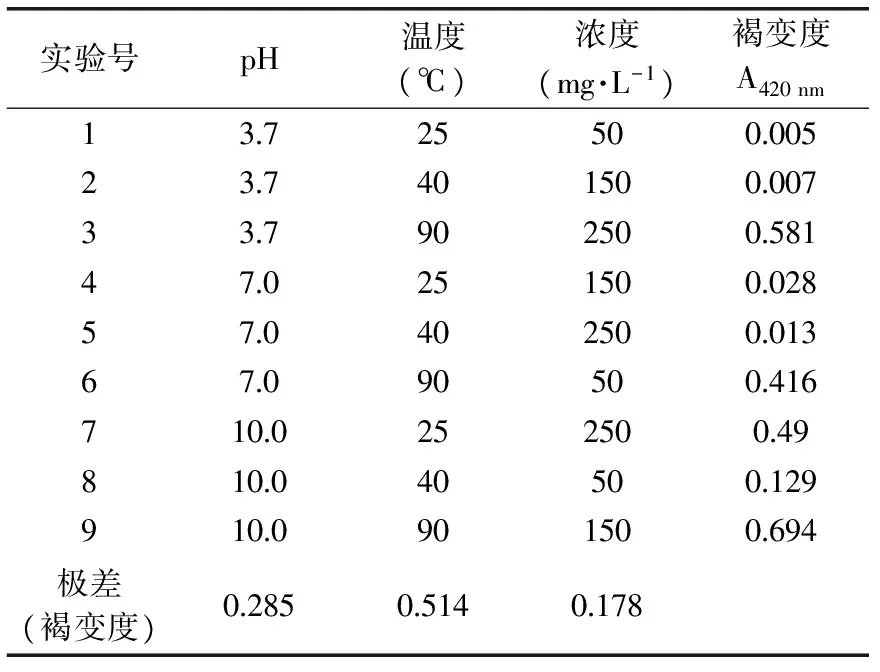
表2 正交实验结果与分析Table 2 Results and analysis of L9(34)orthogonal design of chemical oxidation about sinapic acid
根据芥子酸的结构图[26],我们可以知道芥子酸结构中含有羧基、羟基、甲氧基。在碱性条件下,羧基、羟基陆续发生电离,体系的带电状态发生改变,分子之间发生聚合反应。苯环上的甲氧基为发色基团,随着聚合度的增加,氧化产物逐渐红移,最终导致产物变成褐色。
2.2.2 pH对芥子酸化学氧化褐变度的影响 pH对芥子酸化学氧化褐变度的影响结果如图4所示。

图4 不同pH条件下芥子酸(200 mg·L-1) 化学氧化产物褐变度(40 ℃)Fig.4 Browning degree of chemical oxidative products by sinapic acid(200 mg·L-1)in various values of pH(40 ℃)
由图4可以看出,芥子酸化学氧化产物褐变度pH10.0>pH7.0>pH3.7,说明芥子酸在碱性条件下更容易发生氧化褐变。
果蔬在加工过程中,碱液去皮是应用最广泛的方法,碱液去皮常用NaOH,pH在10~14之间[27]。碱液容易造成果蔬褐变,因此在果蔬加工中可采用冷冻去皮、真空去皮等方法代替碱液去皮,可以有效减少加工过程中果蔬褐变的发生[28]. 一些高酸性类水果如梅子、梨等果汁的pH在1.3~3.5之间,因此酚类化学氧化对果汁的影响较小。
2.2.3 温度对芥子酸化学氧化褐变度的影响 温度对芥子酸化学氧化褐变度的影响结果如图5所示。
由图5可以看出,随着反应温度的升高,芥子酸化学氧化产物褐变度逐渐增大。芥子酸在90 ℃比40、25 ℃更容易发生化学氧化。果蔬在加工过程中通常会进行热烫处理,目的是钝化酶,避免因酶促褐变引起果蔬汁色泽和品质的变化[29]。然而高温热烫存在酚类氧化褐变的现象,因此可以通过缩短热烫时间等措施避免褐变的发生。近年来,微波热烫因其时间短、较好保留营养成分等特点在果蔬的应用上受到广泛关注[30]。
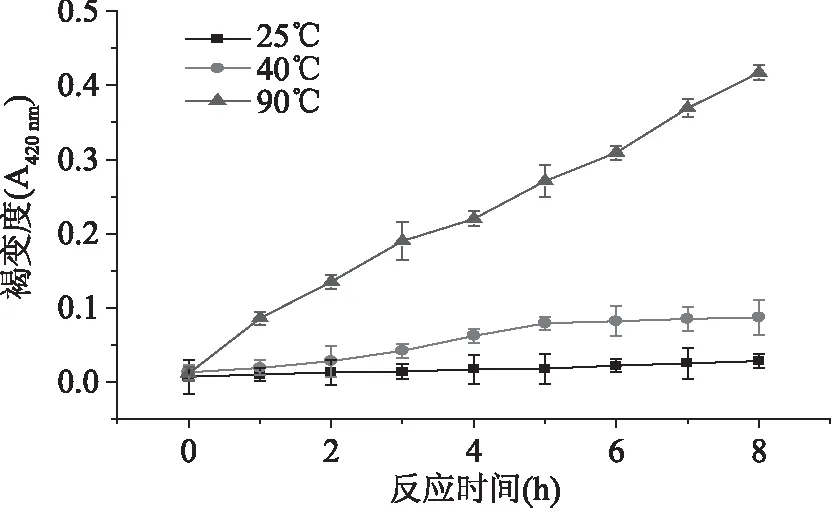
图5 不同温度下芥子酸(200 mg·L-1) 化学氧化产物褐变度(pH7.0)Fig.5 Browning degree of chemical oxidative products by sinapic acid(200 mg·L-1)in various temperature(pH7.0)
2.3 芥子酸化学氧化与产物褐变的关系
2.1节对芥子酸的化学氧化进行动力学拟合,可以发现,芥子酸化学氧化符合一级反应动力学模拟。根据动力学模型,得到在不同pH条件下的反应速率,芥子酸在pH10.0 条件下反应速率大于pH7.0、pH3.7,说明碱性环境更利于芥子酸的化学氧化。
2.2节探讨了芥子酸化学氧化产物褐变度的影响因素,可以发现,芥子酸化学氧化产物褐变度pH10.0>pH7.0>pH3.7,说明芥子酸在碱性条件下更容易发生氧化褐变。
反应动力学探讨的是底物浓度的变化,褐变度研究的是产物。芥子酸化学氧化过程中底物不断转化为产物,导致产物褐变度增加。底物转化速率快慢与产物褐变度的增加有直接关系。2.1节可以看出,pH10.0芥子酸反应速率最大,2.2节可以发现,pH10.0条件下产物褐变度最大,2.1节与2.2节可以共同说明碱性环境利于芥子酸的氧化。
3 结论
实验针对芸薹属蔬菜中普遍存在的芥子酸建立模拟体系,进行体外化学氧化。研究发现芥子酸化学氧化符合一级反应动力学模型,其中在碱性环境下的反应速率更快。芥子酸发生化学氧化后,反应体系褐变度均有不同程度的增加,其中温度对芥子酸氧化褐变的影响最大,其次是pH,浓度对芥子酸氧化褐变影响不显著。芥子酸在高温、碱性环境下更容易发生氧化褐变。
针对本实验中芥子酸在高温碱性环境下易褐变的特点,在果蔬的加工过程中为避免酚类化学氧化褐变对果蔬制品感官的影响,应尽量避免高温高碱等加工操作,如高温漂烫钝酶可尽量缩短加热时间,碱液去皮可考虑真空去皮等操作手段代替,达到防止果蔬制品褐变的目的。
[1]Chang T S. An updated review of tyrosinase inhibitors[J]. International Journal of Molecular Sciences,2009,10(6):2440-2475.
[2]Queiroz C,Lopes M M,Fialho E,et al. Polyphenol oxidase:characteristics and mechanisms of browning control[J]. Food Reviews International,2008,24(4):361-375.
[3]He Q,Luo Y G. Enzymatic browning and its control in fresh-cut produce[J]. Stewart Postharvest Review,2007,3(6):1-7.
[4]Bustos M C,Mazzobre M F,Buera M P. Stabilization of refrigerated avocado pulp:effect of allium and brassica extracts on enzymatic browning[J]. Food Science and Technology,2015,61(1):89-97
[5]Constabel C P,Barbehenn R. Defensive roles of polyphenol oxidase in plants. in:Schaller a. Induced plant resistance to herbivory[M]. Berlin:Springer Science Business Media BV,2008:253-269.
[6]胡燕. 水煮藕片褐变机理的研究[D].武汉:华中农业大学,2008
[7]易俊洁,李琳,冯仑等. 超高压处理酸菜褐变机理初探[J]. 食品工业科技,2010,31(12):97-99+103
[8]高海生. 果蔬加工过程中褐变及其控制措施的研究进展[J]. 河北科技师范学院学报,2013(4):1-7+13.
[9]Francisco M.,Moreno D A,Cartea M E,et al. Simultaneous identification of glucosinolates and phenolic compounds in a representative collection of vegetable brassica rapa[J]. Journal of Chromatography,2009,1216(38):6611-6619.
[10]Harbaum B,Hubbermann E M,Zhu Z,et al. Impact of fermentation on phenolic compounds in leaves of Pak Choi(brassica campestris L. ssp. Chinensis var.communis)and Chinese leaf mustard(brassica juncea coss)[J]. Journal of Agricultural and Food Chemistry,2008,56(1):148-157.
[11]Jiang N,Chung S O,Lee J,et al. Increase of phenolic compounds in new Chinese cabbage cultivar with red phenotype[J]. Horticulture,Environment and Biotechnology,2013,54(1):82-88.
[12]江萍,徐贵华,刘东红,陈健初,叶兴乾. 15种柑橘果皮中酚酸的含量测定[J]. 食品与发酵工业,2008,34(6):124-128.
[13]熊兰兰. 平和蜜柚果实贮藏期间黄酮类化合物含量及品质变化的研究[D].福州:福建农林大学,2012.
[15]杨汝婷,郭志成. 羟基肉桂酸类化合物的氧化偶联机理研究[J]. 甘肃科学学报,2013(03):55-58.
[16]綦菁华. 苹果浓缩汁二次混浊形成机理及控制技术研究[D].北京:中国农业大学,2003.
[17]张建勇. 酯型茶黄素化学氧化形成的影响因素及其机理研究[D].北京:中国农业科学院,2007.
[18]董全,高晗. 果蔬加工学[M]. 郑州:郑州大学出版社,2011:12-13.
[19]沈金玉,黄家音,李晓莉. 果蔬酶促褐变机理及其抑制方法研究进展[J]. 食品研究与开发,2005,26(6):150-156.
[20]王萍. 中国主要芸薹属蔬菜抗氧化能力基因型差异和环境效应的研究[D].杭州:浙江大学,2005.
[21]胡玉霞. 雪里蕻腌渍过程中理化成分及其抗氧化性变化研究[D].杭州:浙江大学,2007.
[22]Naczk M,Wanasundara P K J P D,Shahidi F. Facile spectrophotometric quantification method of sinapic acid in hexane-extracted and methanol-ammonia-water-treated mustard and rapeseed meals[J]. Journal of Agricultural and Food Chemistry,1992,40(3):444-448.
[23]李元高. 物理化学[M]. 上海:复旦大学出版社,2013:252-253.
[24]Cilliers J L,Singelton V L. Nonenzymic autooxidative phenolic browning reactions in a caffeic acid model system[J]. Journal of Agricultural and Food Chemistry,1989,37(4):890-896.
[25]张宁. 中药成分丁香酸、芥子酸和儿茶素的荧光性质及其分析方法研究[D].石家庄:河北师范大学,2013.
[26]杨汝婷. 无机单电子氧化剂对羟基肉桂酸类化合物的氧化偶联研究[D].甘肃:兰州大学,2010.
[27]孟宪军,乔旭光. 果蔬加工工艺学[M].北京:中国轻工业出版社,2012:12-13.
[28]严佩峰. 果蔬加工与保鲜技术[M]. 北京:中国科学技术出版社,2013:83-83.
[29]陈学红,秦卫东,马利华,戴晓娟. 加工工艺条件对果蔬汁的品质影响研究[J]. 食品工业科技,2014,35(1):355-362.
[30]Patricia C M,Bibiana D Y,Jose P M. Evaluation of microwave technology in blanching of broccoli(BrassicaoleraceaL. var Botrytis)as a substitute for conventional blanching[J]. Procedia Food Science,2011(1):426-432.
Chemical oxidative phenolic browning reactionsin a sinapic acid model system
DONG Xia,WANG Fang,PANG Mei-xia,XU Ling-yi,CUI Yu-qian,QI Jing-hua*
(College of Food Science and Engineering,Beijing University of Agriculture/Beijing Key Laboratory of Detectionand Control of Spoilage Organisms and Pesticide Residues in Agricultural Products,Beijing University of Agriculture,Beijing 102206,China)
In order to determine the influence factor of sinapic acid chemical oxidation,so as to provide the basis for better control of fruits and vegetables browning,sinapic acid chemical oxidation simulation system was established. The sinapic acid concentration and browning degree were investigated at 315 nm and 420 nm by ultraviolet visible spectrophotometer. Chemical oxidation of sinapic acid accords with First order reaction kinetics model by kinetic fitting. The rate of chemical oxidation of sinapic acid was maximum at pH10.0(5.38 h-1). The results of orthogonal test showed that the effect of temperature at 0.05 level on the chemical oxidative browning of sinapinic acid was significant and the effect of pH at 0.1 level on the chemical oxidative browning of sinapic acid was significant. The effect of concentration of sinapic acid at 0.1 level on the chemical oxidative browning of sinapic acid was not significant. Sinapic acid was more prone to chemical oxidation at pH10.0 than pH3.7 and pH7.0 and at 90 ℃ than 40 ℃ and 25 ℃. Sinapic acid is more susceptible to oxidative browning in high temperature and alkaline environment. For this feature,in order to as far as possible to avoid the occurrence of browning of fruits and vegetables,high temperature and alkali processing operations should be avoided.
sinapic acid;chemical oxidation;browning;first order reaction kinetics model
2016-11-17
董霞(1990-),女,硕士研究生,研究方向:农产品加工与贮藏工程,E-mail:525619374@qq.com。
*通讯作者:綦菁华(1966-),女,博士,教授,研究方向:农产品深加工与副产物综合利用,E-mail:abc960718@sina.com。
本研究由“现代农业产业技术体系北京市创新团队”提供资金与技术支持。
TS201.1
A
1002-0306(2017)13-0069-05
10.13386/j.issn1002-0306.2017.13.013

