响应面优化盐析法姬松茸多糖脱蛋白研究
吴 春,孙 宁,刘 宁,黎晨晨,李 健
(哈尔滨商业大学食品工程学院 黑龙江省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
响应面优化盐析法姬松茸多糖脱蛋白研究
吴 春,孙 宁,刘 宁,黎晨晨,李 健*
(哈尔滨商业大学食品工程学院 黑龙江省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
目的:探讨盐析法对姬松茸多糖脱蛋白的最佳工艺。方法:采用盐析法对姬松茸多糖脱蛋白,探讨在磁力搅拌器的影响下,其盐析温度、盐析转数、盐析时间及硫酸铵粉末饱和度对蛋白脱除率和多糖回收率的影响,以单因素实验为基础,通过响应曲面分析确定最佳工艺。结果:各因素对姬松茸多糖蛋白脱除率和多糖回收率的影响由大到小依次为:盐析温度>盐析转数>盐析时间。最佳工艺为:盐析温度为51 ℃,盐析转数为660 r/min,盐析时间为31 min,硫酸铵粉末饱和度为20%时,蛋白脱除率和多糖回收率分别为80.29%和79.59%。结论:盐析法可安全便捷、快速有效地脱除姬松茸多糖中的蛋白,同时能够得到较高的蛋白脱除率和多糖回收率。
盐析法,姬松茸多糖,脱蛋白条件,响应面分析
姬松茸又叫巴西蘑菇,是一种珍贵的药食兼用真菌[1],其子实体中含有多种具有高抗肿瘤活性和刺激T细胞作用的多糖[2-5]。目前姬松茸多糖提取方法有:溶剂法、酶法、超声波法、微波法、超滤技术等。如梁婷等[6],唐小俊等[7],张艳荣等[8]采用微波法提取姬松茸多糖。付志英[9]等采用超声波技术提取姬松茸多糖。聂志勇[10]采用酶解法提取姬松茸多糖。李峰[11]利用复合酶法提取姬松茸多糖。王艳[12]等应用超声波协同复合酶法提取姬松茸多糖。彭勇胜[13]等采用热水提取法提取姬松茸多糖。沈爱英[14]等采用水提醇沉法提取姬松茸多糖。丁重阳[15]等采用碱提法提取姬松茸多糖。韩永萍等[16]应用超滤技术提取姬松茸多糖。但提取的粗多糖中往往混杂着蛋白质,粗多糖进行脱蛋白提纯以后,其生物活性更高[17]。常用的脱除蛋白质方法有TCA法[18],Sevage法,盐酸法,三氯乙酸法,三氟三氯乙烷法,酶解法等[19-21]。Sevage法是实验室经典的脱蛋白方法,条件较温和,但烦琐、费时,有机试剂用量大,并且破坏多糖结构,多糖损失较大。另外在生产过程中,分液后,多糖溶液中还残留有有机溶剂,有机溶剂毒性较大,需蒸发除去[22]。盐酸法脱蛋白的效果虽然较好,但若实验条件不能严格控制,不但多糖的损失率会高,而且存在多糖水解缺点[23]。三氯乙酸法除蛋白质随着三氯乙酸浓度增大,除蛋白质效果越好,但对多糖结构的影响也越大,可能是酸性溶液中,多糖链可能被三氯乙酸降解[24]。三氟三氯乙烷法除蛋白质的效果较好,但溶剂沸点较低、易挥发,因此很难大量应用到实验中[25]。酶解法可以将糖链上蛋白质水解,提高蛋白质脱除率,但如果加酶量控制不当,反而会引入外源蛋白,而且实验成本较高[26]。
本研究选择盐析法,为姬松茸多糖脱蛋白提供一种新的参考方法。盐析法根据不同蛋白质在一定浓度盐溶液中沉淀程度不同而到达彼此分离。盐析一般是指溶液中加入无机盐类来改变溶解物的溶解度,而使溶解的物质析出的过程。如:加硫酸铵粉末使蛋白质凝聚的过程。蛋白质随着盐浓度的变大,溶解度会随之升高,这个过程是盐溶。但当盐浓度达到一定数值时,其溶解度又会逐渐下降,直至蛋白质沉淀析出,这个过程是盐析。盐析的发生在于盐浓度增高到一定数值时,导致水活度降低,进而使蛋白质分子表面电荷逐渐被中和,蛋白质表面水化膜逐渐被破坏,使蛋白质相互结合聚集形成沉淀析出[27]。
1 材料与方法
1.1 材料与仪器
姬松茸粗多糖提取液 实验室制备;牛血清白蛋白、考马斯亮蓝G250 分析纯,上海国药集团化学试剂厂;磷酸 分析纯,天津市耀华化学试剂有限责任公司;乙醇 分析纯,天津市永大化学试剂有限公司;硫酸铵 分析纯;天津市科密欧化学试剂有限公司;蒸馏水。
电子天平FA2004 上海越平科学仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;紫外可见分光光度计5100B 上海元析仪器有限公司;循环水式多用真空泵SHB-Ⅲ 郑州长城科工贸有限公司;台式离心机TDL-4A 上海菲恰尔分析仪器有限公司;电热鼓风干燥箱DHG-9123A 上海一恒科技有限公司。
1.2 实验方法
1.2.1 姬松茸多糖纯化的工艺流程 姬松茸粗多糖提取液→磁力搅拌器搅拌→加入硫酸铵粉末至设定饱和度→冷却至室温后离心去沉淀(4000 r/min,20 min)→抽滤→收集滤液→含量测定。
1.2.2 含量测定
1.2.2.1 蛋白质含量测定——考马斯亮蓝法 参考文献[28]的方法,测得595 nm下的吸光度值(Y)对牛血清白蛋白含量(X,单位:μg)作线性回归,得测定蛋白质含量标准曲线的回归方程:Y=0.0072X+0.0157,R2=0.9984,由此可知横纵坐标在一定范围内线性相关且相关性显著。姬松茸多糖蛋白脱除率如式(1)所示[30]。
蛋白脱除率(%)=(溶液初始蛋白含量(μg)-脱蛋白后蛋白含量(μg))/溶液初始蛋白含量(μg)×100
式(1)
1.2.2.2 多糖含量测定——苯酚硫酸法 参考文献[29]的方法,测得吸光度值(Y)对葡萄糖标准溶液的浓度(X,单位:mg/mL)作线性回归,得测定总糖含量的标准曲线回归方程:
Y=12.38X+0.0296,R2=0.9990,由此可知横纵坐标在一定范围内线性相关且相关性显著。姬松茸多糖回收率如式(2)所示[30]。
多糖含量(mg)=单位体积多糖的量(mg)×提取多糖体积(mL)×稀释倍数

式(2)
1.2.3 单因素实验
1.2.3.1 硫酸铵粉末饱和度对脱除姬松茸多糖中蛋白的影响 量取姬松茸多糖提取液20 mL置于烧杯中,放在磁力搅拌器上边搅拌边慢慢加入硫酸铵粉末至设定饱和度分别为10%、20%、30%、40%、50%、60%、70%,转数650 r/min,温度50 ℃,搅拌30 min。冷却至室温后离心去沉淀(4000 r/min,20 min),收集滤液最后用1.2.2的方法测姬松茸多糖脱蛋白率。
1.2.3.2 盐析转数对脱除姬松茸多糖中蛋白的影响 量取姬松茸多糖提取液20 mL置于烧杯中,放在磁力搅拌器上边搅拌边慢慢加入硫酸铵粉末至设定饱和度20%,转数分别为430、540、650、760、870、980、1080 r/min,温度50 ℃,搅拌30 min。冷却至室温后离心去沉淀(4000 r/min,20 min),收集滤液最后用1.2.2的方法测姬松茸多糖脱蛋白率。
1.2.3.3 盐析温度对脱除姬松茸多糖中蛋白的影响 量取姬松茸多糖提取液20 mL置于烧杯中,放在磁力搅拌器上边搅拌边慢慢加入硫酸铵粉末至设定饱和度20%,转数650 r/min,温度分别为20、30、40、50、60、70、80 ℃,搅拌30 min。冷却至室温后离心去沉淀(4000 r/min,20 min),收集滤液最后用1.2.2的方法测姬松茸多糖脱蛋白率。
1.2.3.4 盐析时间对脱除姬松茸多糖中蛋白的影响 量取姬松茸多糖提取液20 mL置于烧杯中,放在磁力搅拌器上边搅拌边慢慢加入硫酸铵粉末至设定饱和度20%,转数650 r/min,温度50 ℃,搅拌时间分别为10、20、30、40、50、60、70 min。冷却至室温后离心去沉淀(4000 r/min,20 min),收集滤液最后用1.2.2的方法测姬松茸多糖脱蛋白率。
1.2.4 盐析法纯化姬松茸多糖的工艺优化实验 进行响应面优化实验时,选取盐析温度(因素A)、盐析转数(因素B)、盐析时间(因素C)3个为蛋白脱除率和多糖回收率的因素。采用Design Expert 8.0.6软件进行3因素3水平的设计。
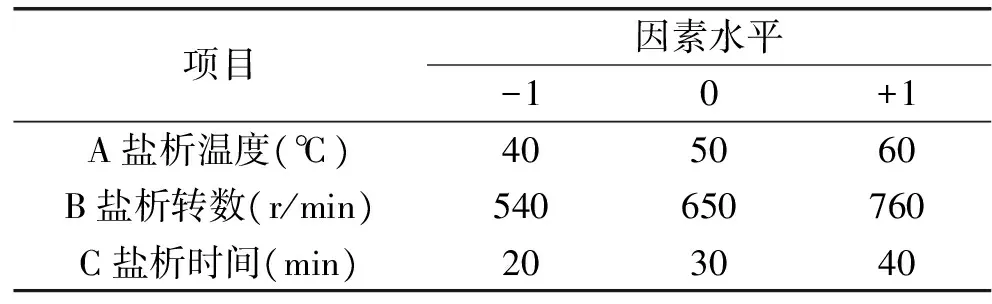
表1 盐析法纯化姬松茸多糖因素水平Table 1 Neuter salt method of purification ofAgaricus blazei murill polysaccharides reference factors and levels
1.3 数据统计分析
本实验采用Excel软件做图分析单因素影响,并在数据图上显示误差线Y推断显著性标准。采用设计专家软件(Design-Expert 8.0.6,简称DE 8.0.6)对所得数据进行分析,确定最佳脱蛋白工艺。
2 结果与分析
2.1 单因素实验
2.1.1 硫酸铵粉末饱和度对脱除姬松茸多糖中蛋白的影响 如图1所示,多糖的回收率持续下降,硫酸铵粉末饱和度为20%时多糖蛋白脱除率有显著影响。硫酸铵粉末用量少时,由于盐的浓度低,蛋白质无法沉淀完全,因而,在一定程度上,多糖蛋白脱除率随着硫酸铵用量的增加而升高。当硫酸铵粉末饱和度大于20%时,盐的浓度过高,所得沉淀多为蛋白酸铵,反而不利于蛋白质的沉淀。同时硫酸铵用量过大时,也会增加后续脱盐难度,造成硫酸铵和脱盐液的浪费,增加实验成本,同时多糖损失显著。综上选择20%为后续实验硫酸铵粉末饱和度,但在响应面实验中不对其进行优化分析[31]。
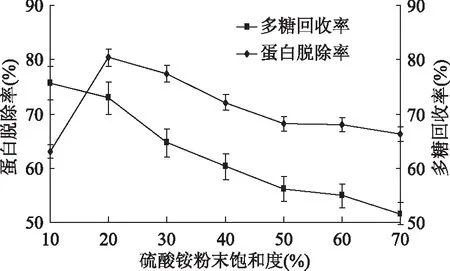
图1 硫酸铵粉末饱和度对蛋白脱除率和多糖回收率的影响Fig.1 Effect of saturation of ammonium sulfate powder on protein removal rate and polysaccharide recovery rate
2.1.2 盐析转数对脱除姬松茸多糖中蛋白的影响 如图2所示,多糖的回收率持续下降,盐析转数为650 r/min时对多糖蛋白脱除率最高。这可能是因为随着转数的增加,易使蛋白质析出,但过高的盐析转数会导致环境不稳定性增强,析出的部分蛋白质沉淀溶解,从而影响多糖蛋白脱除率,同时多糖损失。因而,盐析转数为650 r/min时多糖蛋白脱除率最高。
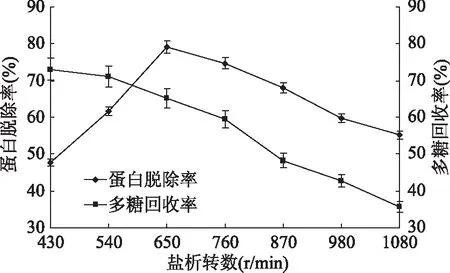
图2 盐析转数对蛋白脱除率和多糖回收率的影响Fig.2 Effects of revolution of salting-out on protein removal rate and polysaccharide recovery rate
2.1.3 盐析温度对脱除姬松茸多糖中蛋白的影响 如图3所示,脱蛋白温度对多糖含量的影响较小,盐析温度为50 ℃时对多糖蛋白脱除率有显著影响。这可能是因为盐析时,温度过低,蛋白质沉淀速率慢,并且沉淀不完全,故多糖蛋白脱除率低。温度过高时,高温会导致部分蛋白质沉淀溶解,甚至破坏蛋白质结构,降低多糖蛋白脱除率。因而,盐析温度为50 ℃时多糖蛋白脱除率最高[32]。

图3 盐析温度对蛋白脱除率和多糖回收率的影响Fig.3 Effects of temperature of salting-out on protein removal rate and polysaccharide recovery rate
2.1.4 盐析时间对脱除姬松茸多糖中蛋白的影响 如图4所示,多糖的回收率持续下降,特别是搅拌时间超过40 min后,多糖回收率急剧下降,盐析时间为30 min时对多糖蛋白脱除率有显著影响。这可能是因为盐析时,盐析时间过长,蛋白质沉淀可能会发生部分溶解,从而降低多糖脱蛋白率。而搅拌时间过短时,由于一部分蛋白质来不及沉淀,导致盐析作用不完全,使多糖蛋白脱除率低。因而,盐析时间为30 min时多糖蛋白脱除率最高[33]。
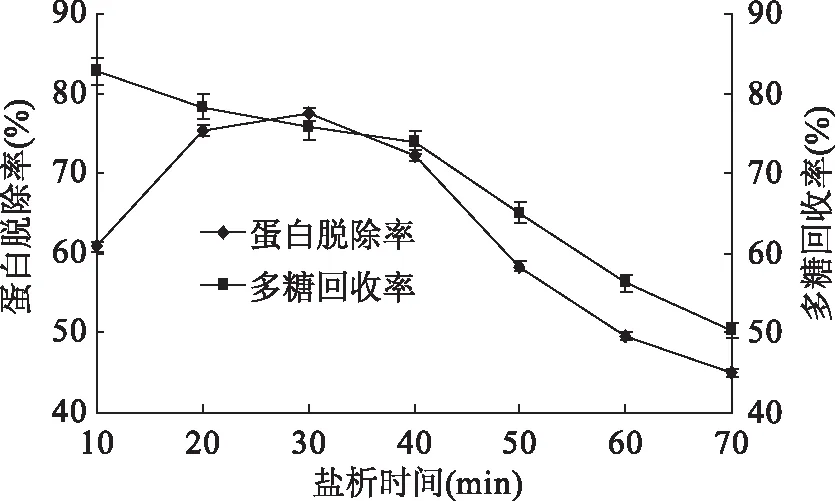
图4 盐析时间对蛋白脱除率和多糖回收率的影响Fig.4 Effects of time of salting-out on protein removal rate and polysaccharide recovery rate
2.2 响应曲面优化实验
2.2.1 回归模型的建立及统计检验 回归模型的建立及统计检验见表2,采用设计专家软件(Design-Expert 8.0.6,简称DE 8.0.6)对所得数据进行分析,结果见表3。
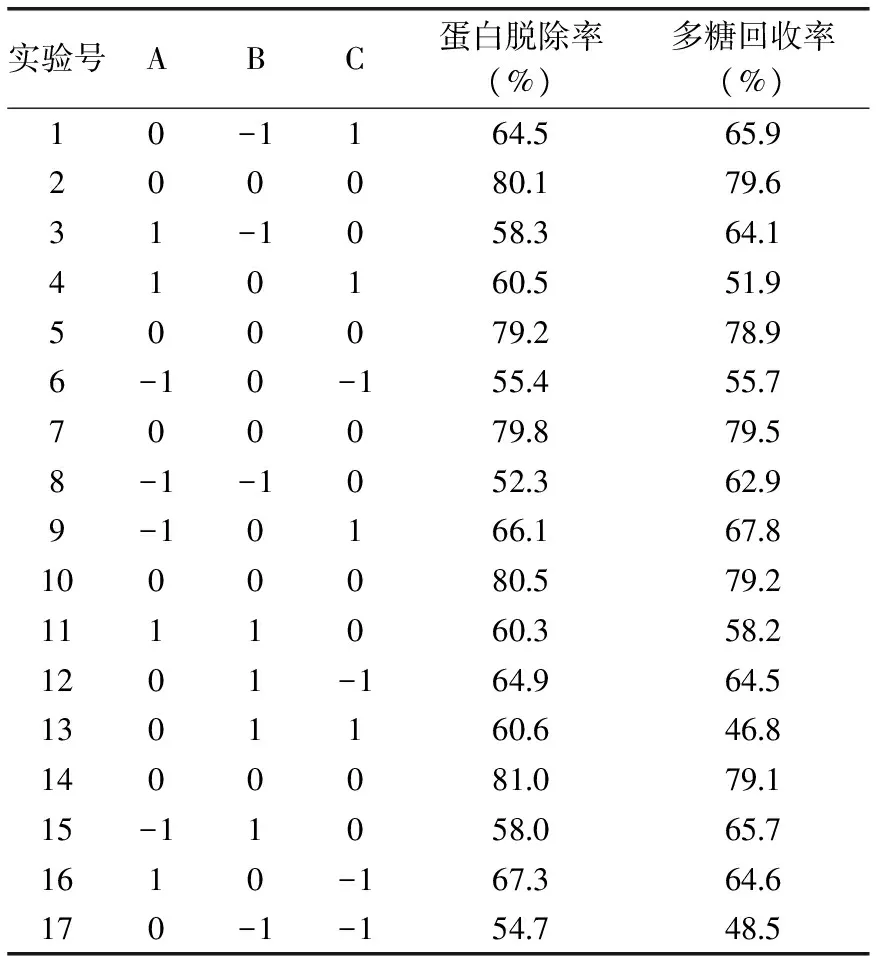
表2 盐析法纯化姬松茸多糖响应面分析实验结果Table 2 Neuter salt method of purification ofAgaricus blazei murill polysaccharides reference response and the analysis of experimental
以蛋白脱除率为响应值,各因素经回归拟合后,得回归方程:Y1(蛋白脱除率,%)=80.12+1.83A+1.75B+1.17C-0.93AB-4.38AC-3.52BC-10.87A2-12.02B2-6.92C2。
表3为蛋白脱除率回归模型方差分析结果,从中可以看出该模型回归显著(p<0.0001),R2=0.9982,失拟项不显著,说明该模型与实际实验拟合程度较好,可用上述回归方程描述各因子与响应值的关系,以多糖回收率为响应值,各因素经回归拟合后,得回归方程:Y2(多糖回收率,%)=79.26+1.66A+0.77B+0.11C-2.18AB-6.20AC-8.78BC-6.48A2-10.05B2-12.78C2。

表3 蛋白脱除率回归模型方差分析结果Table 3 Protein removal rate of the regression model of variance analysis results
注:**代表p<0.01,极显著;*代表p<0.05,显著。对盐析法脱蛋白工艺进行预测。各项的p值(A:<0.0001、B:0.0001、C:0.0013)可以说明盐析温度、盐析转数、盐析时间对蛋白脱除率影响显著。从各项的F值(A:63.59、B:58.47、C:26.36)可以看出,在所选的各因素水平范围内,对姬松茸多糖蛋白脱除率影响大小的顺序为:盐析温度>盐析转数>盐析时间。
表4为多糖回收率回归模型方差分析结果,从中可以看出该模型回归显著(p<0.0001),R2=0.9998,失拟项不显著,说明该模型与实际实验拟合程度较好,可用上述回归方程描述各因子与响应值的关系,对盐析法脱蛋白工艺进行预测。各项的p值(A:<0.0001、B:<0.0001、C:0.2272)可以说明盐析温度、盐析转数对多糖回收率影响显著。从各项的F值(A:382.64、B:83.15、C:1.75)可以看出,在所选的各因素水平范围内,对姬松茸多糖回收率影响大小的顺序为:盐析温度>盐析转数>盐析时间。
2.2.2 盐析法纯化姬松茸多糖各因素间的交互作用 从图5A可看出,从图形的弧面看出盐析温度对蛋白脱除率的影响比盐析转数的影响明显,且两因素间存在较强的相互作用。从图5B可看出,盐析温度对蛋白脱除率的影响大于盐析时间,且两因素之间存在较强的相互作用。从图5C可看出盐析转数对蛋白脱除率的影响高于盐析时间,且两因素间存在较强的相互作用。从图5D可看出,从图形的弧面看出盐析温度对多糖回收率的影响比盐析转数明显,且两因素间存在一定的相互作用。从图5E可看出,盐析温度对蛋白脱除率的影响大于盐析时间,且两因素之间存在较强的相互作用。从图5F可看出盐析转数对蛋白脱除率的影响高于盐析时间,且两因素间存在较强的相互作用。
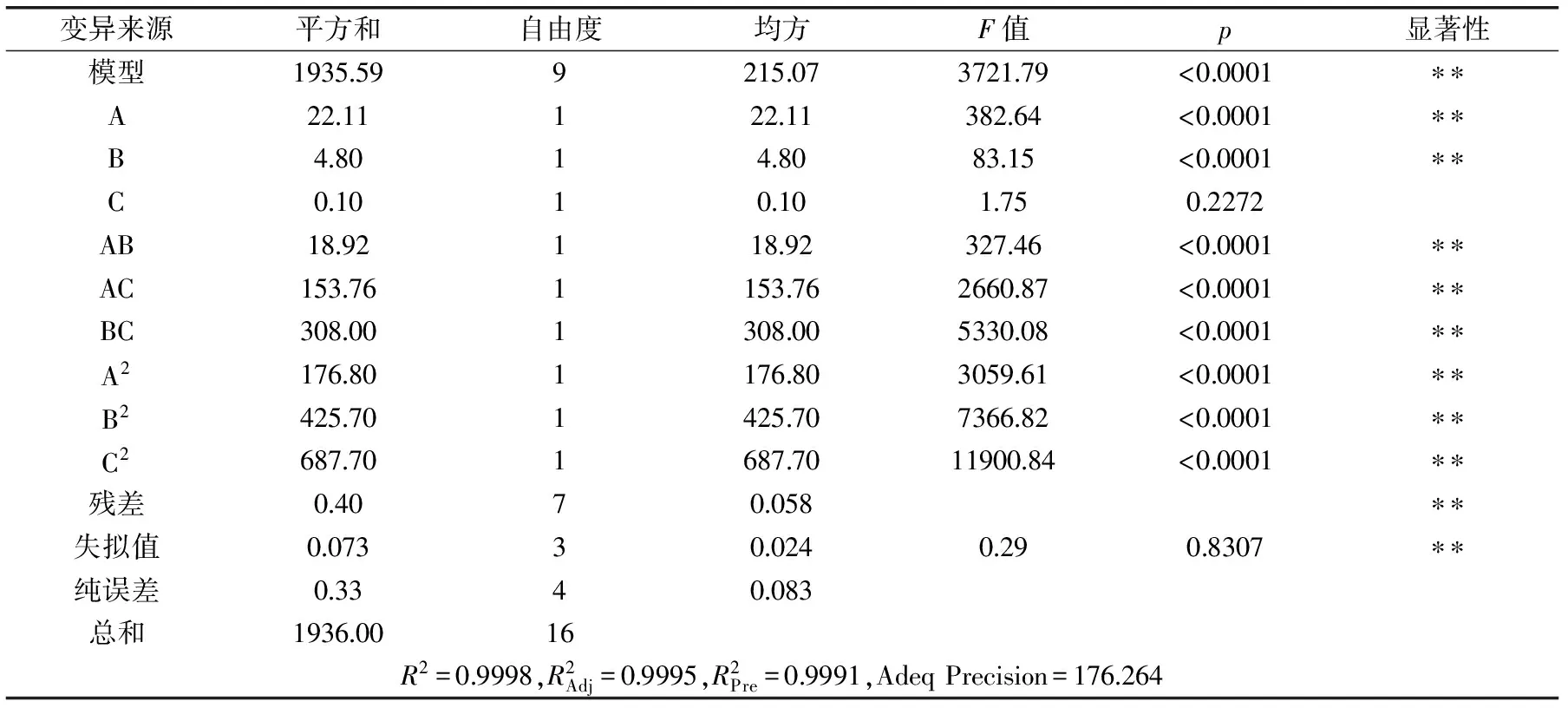
表4 多糖回收率回归模型方差分析结果Table 4 Polysaccharide recovery regression model of variance analysis
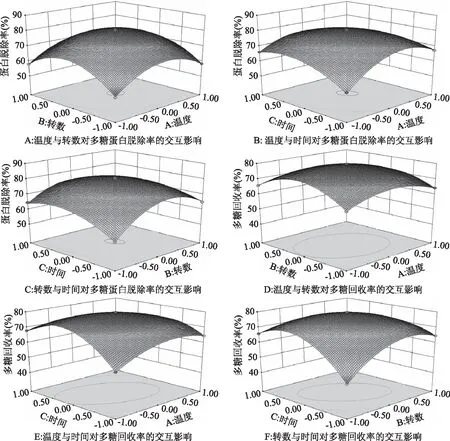
图5 各因素交互作用的响应面图Fig.5 Response surface plots for the effects of three process conditions
注:**代表p<0.01,极显著;*代表p<0.05,显著。本研究采用硫酸按盐析法对姬松茸多糖粗品脱蛋白,对其进行工艺优化,并详细探讨了盐析过程中的盐析温度、盐析转数、盐析时间对其脱蛋白效果均有影响。随着盐析温度的上升,蛋白脱除率呈现出先升高后降低的趋势。蛋白质在一定温度条件下虽然性质稳定,但是温度较低不利于盐析反应的进行。同时适宜温度,糖类物质易与蛋白质结合,所以纯化溶液具有糖蛋白的部分性质,温度过高会引起蛋白的变性,从而影响蛋白的浓度。随着盐析转数的增加,蛋白脱除率呈现出先迅速升高后降低的过程。硫酸铵盐析的原理是硫酸铵溶液中高浓度的盐离子与水分子的亲和力大于蛋白质,并且适当的盐析转数赋予纯化环境能量,从而破坏蛋白质表面的水化膜,溶解度下降,因此从溶液中沉淀析出。随着盐析温度的增加,蛋白脱除率随着盐析时间的增加先增加后减少。这说明蛋白在盐溶液中的反应需要一定的时间,在盐析时,蛋白质可以与盐离子充分反应,达到最大程度的沉淀,最后充分沉淀析出[34]。
为保证脱蛋白过程中,姬松茸多糖结构尽可能不被破坏,达到蛋白脱除效果,结合回归模型分析结果可知,盐析法脱蛋白的最佳工艺条件为硫酸铵粉末饱和度为20%,盐析温度为50.73 ℃,盐析转数为656.93 r/min,盐析时间为30.46 min,此时姬松茸多糖的蛋白脱除率为80.2681%,多糖回收率为79.5627%。为验证此方法的结果,并考虑实际可操作性,将最佳工艺参数修正为:硫酸铵粉末饱和度为20%,盐析温度为51 ℃,盐析转数为660 r/min,盐析时间为31 min。进行蛋白脱除率和多糖回收率的验证实验,经3次平行实验,实际蛋白脱除率和多糖回收率的平均值分别为80.29%和79.59%,实验结果与模型符合良好,说明该模型能较好预测姬松茸多糖脱蛋白工艺。
3 结论
本文选用盐析法脱蛋白,在多糖纯化技术方面进行应用具有一定的创新性。但从实验结果可以看出,多糖结构发生变化,有损失,而此时蛋白并没有完全去除。为保证脱蛋白过程中,姬松茸多糖结构尽可能不被破坏,在蛋白脱除率高时,多糖回收率也高的前提下,实现分离纯化。由盐析法纯化姬松茸多糖及利用DE 8.0.6软件分析数据结果结合考虑实际可操作性,将最佳工艺参数修正为:硫酸铵粉末饱和度为20%,盐析温度为51 ℃,盐析转数为660 r/min,盐析时间为31 min。进行蛋白脱除率和多糖回收率的验证实验,经3次平行实验,实际蛋白脱除率和多糖回收率的平均值分别为80.29%和79.59%,数值相差范围在0~0.05%可忽略不计。此方法简单快捷,安全可行,极大降低了实验成本与实验时间,提供了大量实验数据,为姬松茸多糖脱蛋白的方法提供了新的参考依据。
[1]陈智毅,李清兵,吴娱明.巴西蘑菇的食疗价值[J].中国食用菌,2001,20(4):4-6.
[2]Chen L,Shao H J,Su Y B. Coimmunization ofAgaricusblazeiMurillextract with hepatitis Bvirus core protein through DNA vaccine enhances cellular and humoral immune respons-es[J]. International Immunopharmacology,2004,4:403-409.
[3]Takaku Takeshi,Kimura Yoshiyuki,Okuda Hiromichi. Isolation of an antitumor compound fromAgaricusblazeiMurilland its mechanism of action[J]. Journal of Nutrition,2001,131(5):1409-1413.
[4]Kimura Yoshiyuki,Kido Tadashi,Takaku Takeshi,et al. Isolation of an anti-angiogenic substance fromAgaricusblazeiMurill:Its antitumor and antimetastatic actions[J]. Cancer Science,2004,95(9):758-764.
[5]Mizuno M,Morimoto M,Minatio K,et al. Polysaccharides formAgaricusblazeistimulate lymphocyte T cell sub sets in mice[J]. Biosci. Biotechnol. Biochem.,2014,62(3):434.
[6]梁婷,赵亚男,刘爱丽,等. 微波法提取姬松茸多糖的工艺研究[J].食品工业科技,2012,34(4):236-238.
[7]唐小俊,张名位,池建伟,等. 姬松茸多糖的微波辅助提取与含量测定[J]. 中国食品学报,2006,6(1):267-272.
[8]张艳荣,单玉玲,刘婷婷,等. 微波萃取技术在姬松茸多糖提取中的应用[J]. 食品科学,2006,27(12):267-269.
[9]付志英,林花,丁玲. 应用超声波技术提取姬松茸多糖工艺的优化研究[J].江西农业学报,2015,27(10):92-95.
[10]聂志勇. 酶法提取姬松茸多糖的研究[D]. 长沙:中南大学,2009:48-59.
[11]李峰. 姬松茸多糖不同提取与干燥方法的比较研究[D]. 天津:天津大学,2014:12-37.
[12]王艳,聂志勇,贺瑛,等. 超声波协同复合酶法提取姬松茸多糖[J]. 天然产物研究与开发,2009,21:866-870.
[13]彭勇胜,王江之,黄程,等. 响应面法优化姬松茸多糖的提取工艺[J]. 现代食品科技,2015,27(9):1119-1122.
[14]沈爱英,谷文英. 姬松茸子实体水溶性多糖提取工艺的研究[J]. 中国食用菌,2002,21(1):15-17.
[15]丁重阳,张笑然,张梁,等. 姬松茸胞内多糖碱提取工艺[J]. 生物加工过程,2008,6(5):21-26.
[16]韩永萍,何江川,缪刚. 超滤提纯姬松茸多糖的研究[J]. 中国食用菌,2005,24(2):44-46.
[17]刑小黑,吴明忠,朱述钧,等. 灵芝多糖化学研究[J]. 中国食用菌,1996,15(3):1-16.
[18]Xie Li yuan,Peng Wei hong,Gan Bing cheng. Optimization of Protein Removal. Method and Condition of Polysaccharide from Phellinus Linteus[J]. Agricultural Science & Technology,2011,12(9):1249-1251.
[19]伍善广,赖泰君,孙建华,等. 蚕蛹多糖脱蛋白方法研究[J]. 食品科学,2011,32(14):21-24.
[20]刘成海,万茵,涂宗财,等. 百合多糖脱蛋白方法的研究[J]. 食品科学,2002,23(1):89-90.
[21]张坤,吴皓,王令充,等. 四角蛤蜊多糖脱蛋白方法比较[J]. 食品科学,2011,32(8):50-53.
[22]候卓. 蒙古口蘑多糖的提取、分离及纯化技术的研究[D].长春:吉林农业大学,2008:28-29.
[23]郑晓翠,苏瑛,唐咏,等. 淫羊藿多糖的提取及其蛋白的脱除[J]. 华西药学杂志,2009,24(2):155-157.
[24]李翠丽,王炜,张英,等. 中药多糖提取、分离纯化方法的研究进展[J].中国药房,2016,27(19):2701.
[25]姚新生,吴立军,吴继洲,等.天然药物化学(第4版)[M]. 北京:人民卫生出版社,2006:102.
[26]王金玺. 平菇多糖分离纯化、结构表征与修饰及抗氧化性的研究[D]. 扬州:扬州大学,2013:2.
[27]张帆. 苦杏仁蛋白提取及其对人结肠腺癌细胞生长影响[D]. 北京:北京林业大学,2011:7.
[28]南亚,李宏高. 考马斯亮蓝G250法快速测定牛乳中的蛋白质[J]. 饮料工业,2007,10(12):41-42.
[29]张惟杰. 糖复合物生化研究技术(第2版)[M]. 杭州:浙江大学出版社,1998. 11-12.
[30]王金玺. 平菇多糖分离纯化、结构表征与修饰及抗氧化性的研究[D]. 扬州:扬州大学,2013:34.
[31]刘义武,王碧. 柠檬皮中果胶提取工艺研究[J]. 内江师范学院学报,2011,26(10):14-17.
[32]邓红,宋纪蓉. 盐析法从苹果渣中提取果胶的工艺条件研究[J]. 食品研究与开发,2002,23(3):57-60.
[33]黎想. 盐析法和黄孢原毛平革菌处理柑橘罐头废水的研究[D]. 长沙:湖南大学,2014:23.
[34]胡静. 视黄醇结合蛋白的纯化、抗血清的制备和检测方法的建立[D].南京:南京理工大学,2013:14-15.
Optimization of deproteinization process fromAgaricusblazeimurillpolysaccharides by salting-out method
WU Chun,SUN Ning,LIU Ning,LI Chen-chen,LI Jian*
(Key Laboratory for Food Science and Engineering of Heilongjiang Province,College ofFood Engineering,Harbin University of Commerce,Harbin 150076,China)
Objective:To explore deproteinization process fromAgaricusblazeimurillpolysaccharides by salting-out method. Methods:Salting-out method was used to the deproteinization of polysaccharides fromAaricusblazeimurill,the effect of salting-out temperature,salting-out speed,salting-outtime and saturation of ammonium sulfate powder on the protein removal rate and polysaccharide recovery rate were investigated under the influence of the magnetic stirrer,and the conditions were optimized on the basis of single factor experiment through the response surface analysis. Results:Effects of protein removal rate and polysaccharide recovery rate by various factors as order:salting-out temperature>salting-out speed>salting-out time. The best parameters were salting-out temperature of 51 ℃,salting-out speed of 660 r/min,salting-out time of 31 min,saturation of ammonium sulfate powder of 20%,protein removal rate and polysaccharide recovery rate were 80.29% and 79.59%. Conclusions:The experimental results show that deproteinization process fromAgaricusblazeimurillpolysaccharides by salting-outt method is safe and convenient,fast and efficient,and can get higher protein removal rate and polysaccharide recovery rate at the same time.
salting-out method;Agaricusblazeimurillpolysaccharides;deproteinization condition;response surface analysis
2016-12-06
吴春(1962-),女,硕士,教授,研究方向:食品化学,E-mail:wuchun1962@126.com。
*通讯作者:李健(1956-),男,本科,教授,研究方向:食品科学,E-mail:lijian4852147@163.com。
黑龙江省教育厅项目(12541199)。
TS201.1
B
1002-0306(2017)13-0191-07
10.13386/j.issn1002-0306.2017.13.036

