培美曲塞/顺铂联合博来霉素+热疗治疗晚期肺腺癌合并恶性胸腔积液的临床疗效分析
薛志红,曾贵林,熊伟杰,李志茹,王云涛,曾守群
(四川省成都市第五人民医院肿瘤科,成都 611130)
培美曲塞/顺铂联合博来霉素+热疗治疗晚期肺腺癌合并恶性胸腔积液的临床疗效分析
薛志红,曾贵林,熊伟杰,李志茹,王云涛,曾守群
(四川省成都市第五人民医院肿瘤科,成都 611130)
目的:观察培美曲塞/顺铂联合博来霉素胸腔热灌注治疗晚期肺腺癌合并恶性胸腔积液的临床疗效。方法:将70例晚期肺腺癌合并恶性胸腔积液患者随机分成两组,每组35例,分别设为观察组和对照组。对照组患者予以培美曲塞加顺铂静脉化疗;观察组在培美曲塞/顺铂静脉化疗的基础上联合博来霉素胸腔热灌注治疗。2个疗程后,对患者进行胸腔积液肿瘤标志物(CEA、CYFRA21-1)检测;末次化疗后再次检测CEA与CYFRA21-1水平并评价疗效及毒副反应;采用KPS评分评价患者治疗后生活质量。结果:①治疗前,两组CEA、CYFRA21-1水平比较无明显差异。2个疗程后,两组CEA、CYFRA21-1水平均较治疗前明显降低,观察组CEA、CYFRA21-1水平显著低于对照组。末次化疗后,两组CEA、CYFRA21-1水平均较2个疗程结束时明显更低,组间比较无明显差异。②胸水疗效:观察组RR(91.4%)明显高于对照组。胸膜病灶疗效:观察组RR(85.7%)明显高于对照组。③治疗后,观察组患者的KPS评分[(82.15±9.26)分]、总改善率(82.9%)明显高于对照组。④观察组主要毒副反应:消化道反应、发热和骨髓抑制;对照组主要毒副反应:消化道反应、骨髓抑制。结论:培美曲塞/顺铂联合博来霉素胸腔热灌注治疗晚期肺腺癌合并恶性胸腔积液临床疗效好,毒副反应少而轻,能有效改善患者生活质量。
肺腺癌;恶性胸腔积液;培美曲赛;博来霉素;顺铂;胸腔热灌注
恶性胸腔积液是常见于胸膜恶性肿瘤的并发症,部分肺腺癌患者首诊及病情进展过程中均可发现恶性胸腔积液,但大多数肺腺癌患者出现恶性胸腔积液提示病情发展已到晚期,患者预后不良,生存期短[1-2]。因此,有效地治疗胸腔积液是恶性肿瘤治疗的重要环节。研究表明,培美曲塞联合铂类全身化疗方案对肺腺癌具有明显的疗效,而热疗结合胸腔灌注药物(胸腔热灌注)能有效缓解胸腔积液的压迫症状[3-4]。本研究采用培美曲赛/顺铂联合博来霉素胸腔热灌注治疗晚期肺腺癌合并恶性胸腔积液患者,对比单纯培美曲赛联合顺铂化疗方案疗效更优。报道如下。
1 资料与方法
1.1 一般资料选择2013年1月~2015年12月我院肿瘤科收治的首次确诊为晚期肺腺癌合并恶性胸腔积液患者70例。所有患者均经肺癌病理学及(或)细胞学诊断确诊,胸腔彩超检查判断胸腔积液为中等量以上,且胸腔积液中发现肿瘤细胞。化疗前,所有患者肝肾功能均正常,卡氏功能状态(KPS)评分≥60分,白细胞计数(WBC)≥4.2×109/L,中性粒细胞(NE)≥2.0× 109/L,血小板计数(PLT)≥100×109/L,预计生存期≥3个月[5]。排除合并严重肝肾、心肺功能障碍、发热并体温 > 38 ℃、出血倾向患者以及化疗禁忌者。将70例晚期肺腺癌合并恶性胸腔积液患者随机分为两组,每组各35例。观察组中男21例,女14例,年龄52~75岁,平均年龄(60.5±8.0)岁;对照组中男23例,女12例;年龄50~74岁,平均年龄(62.6±6.6)岁。两组性别、年龄无明显差异,具有可比性(P>0.05)。
1.2 治疗方法治疗前1 w,所有患者口服复合维生素片,至末次化疗后3 w。对照组患者采用培美曲赛(500 mg/m2)联合顺铂(75 mg/m2)静滴15 min,每3 w给药1次(1个疗程),共4个疗程;化疗前、化疗当天及化疗第2 d给予地塞米松处理,肌内注射补充维生素B12,每3个疗程(9 w)给药1次,至末次化疗后3 w;每次化疗前静滴给予托烷司琼止吐。观察组患者行胸腔闭式引流,引流前B超定位,胸腔穿刺置入中心静脉导管,将胸腔积液引流干净后给予博来霉素(45 mg)热灌注液进行胸腔灌注治疗。给药后嘱患者多次翻转体位以利于药物与胸腔充分接触。灌注治疗当天配合培美曲赛(500 mg/m2)+顺铂(75 mg/m2)全身化疗,化疗方案与对照组平行。于化疗前、化疗2个疗程后、末次化疗后分别测定两组患者的胸腔积液肿瘤标志物水平(CEA、CYFRA21-1),末次化疗后评价两组疗效、观察治疗后患者毒副反应,采用KPS评分评价两组患者健康状况。
1.3 评价标准胸膜病灶疗效评定根据RECIST标准[6]:完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD),总有效率(RR)= CR+PR,疾病控制率(DCR)= CR+PR+SD。
胸腔积液疗效评定[7]:CR:胸腔积液完全消失,持续4周以上;PR:胸腔积液减少≥50%,持续4周以上;SD:胸腔积液增多不足25%,减少不足50%;PD:胸腔积液无变化或增多≥25%;RR = CR+PR。生活质量评价标准[8]:KPS提高20分及以上为显著改善,提高10分为改善,提高或降低不足10分为稳定,降低10分及以上为生活质量下降,总改善率=显著改善率+改善率。不良反应分级按WHO毒性反应评定标准分为I~Ⅳ级。
1.4 统计学分析采用SPSS 17.0 统计学软件对所得数据进行分析。肿瘤标志物水平及KPS评分均以均数±标准差(±s)表示,两组间比较采用t检验;率采用n(%)表示,比较采用χ2检验;P<0.05表示差异具有统计学意义。
2 结果
2.1 治疗前后两组CEA、CYFRA21-1水平比较治疗前,两组CEA、CYFRA21-1水平组间比较无明显差异(P>0.05)。治疗2个疗程后,两组CEA、CYFRA21-1水平均较治疗前明显降低(P<0.05),并且观察组CEA、CYFRA21-1水平显著低于对照组(P<0.05)。末次化疗后,两组CEA、CYFRA21-1水平均较2个疗程结束时明显更低(P<0.05),组间比较无明显差异(P>0.05),见表1。
表1 治疗前后两组CEA、CYFRA21-1水平比较(±s,μg/L)
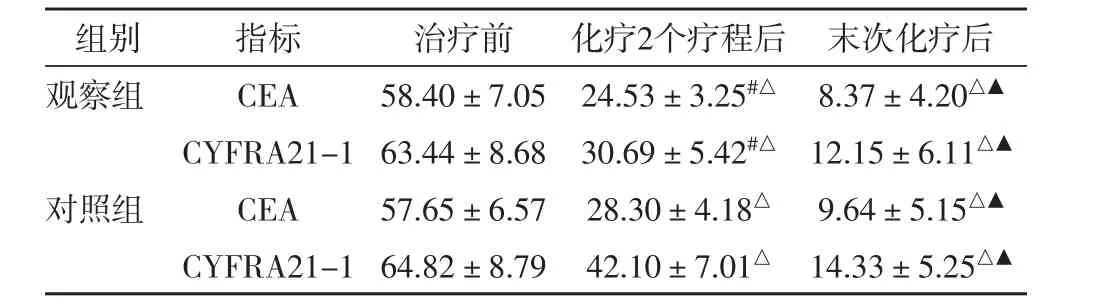
表1 治疗前后两组CEA、CYFRA21-1水平比较(±s,μg/L)
与对照组比,#P<0.05;与治疗前比,△P<0.05;与化疗2个疗程后比,▲P<0.05。
组别 指标 治疗前 化疗2个疗程后 末次化疗后观察组 C E A 5 8 . 4 0 ± 7 . 0 5 2 4 . 5 3 ± 3 . 2 5#△8 . 3 7 ± 4 . 2 0△▲C Y F R A 2 1 -1 6 3 . 4 4 ± 8 . 6 8 3 0 . 6 9 ± 5 . 4 2#△1 2 . 1 5 ± 6 . 1 1△▲对照组 C E A 5 7 . 6 5 ± 6 . 5 7 2 8 . 3 0 ± 4 . 1 8△9 . 6 4 ± 5 . 1 5△▲C Y F R A 2 1 -1 6 4 . 8 2 ± 8 . 7 9 4 2 . 1 0 ± 7 . 0 1△1 4 . 3 3 ± 5 . 2 5△▲
2.2 两组临床疗效比较胸水疗效:观察组中,CR 17例(48.6%),PR 15例(42.9%),SD 3例(8.6%),无PD病例;对照组中,CR 10例(28.6%),PR 13例(37.1%),SD 8例(22.9%),PD 4例(11.4%);观察组RR(91.4%)明显高于对照组(65.7%)(χ2=6.873,P<0.05),DCR无明显差异(χ2= 4.242,P>0.05)。胸膜病灶疗效:观察组中,CR 13例(37.1%),PR 17例(48.6%),SD 3例(8.6%),PD 2例(5.7%);对照组中,CR 7例(20.0%),PR 14例(40.0%),SD 10例(28.6%),PD 4例(11.4%);观察组RR(85.7%)明显高于对照组(60.0%)(χ2= 5.851,P<0.05),DCR无明显差异(χ2= 0.729,P>0.05),见表2。

表2 两组临床疗效比较[n(%)]
2.3 治疗前后两组生活质量比较治疗后,观察组患者的KPS评分为(82.15±9.26)分,明显高于治疗前和对照组,差异有统计学意义(P<0.05)。观察组中,生活质量显著改善12例(34.3%),改善17例(48.6%),稳定4例(11.4%),下降2例(5.7%);对照组中,生活质量显著改善7例(20.0%),改善13例(37.1%),稳定12例(34.3%),下降3例(8.6%);观察组总改善率(82.9%)明显高于对照组(57.1%)(χ2= 5.510,P<0.05),见表3、表4。

表3 治疗前后两组KPS评分比较

表4 治疗后两组生活质量改善情况比较[n(%)]
2.4 化疗后毒副反应观察组主要毒副反应:消化道反应20例、发热2例和骨髓抑制16例,骨髓抑制主要表现为白细胞减少,其中Ⅰ~Ⅱ级14例,Ⅲ~Ⅳ级2例,发热经对症处理后体温恢复正常;对照组主要毒副反应:消化道反应17例、骨髓抑制14例,骨髓抑制中白细胞减少均为Ⅰ~Ⅱ级;观察组毒副反应较对照组明显,经对症处理后很快恢复正常,且两组均无治疗相关死亡病例。
3 讨论
肺癌是恶性胸腔积液的首要病因,约15%的肺癌患者以胸腔积液为首发临床表现,其中70%发生胸腔积液的患者为肺腺癌患者,且大部分肺腺癌患者并发恶性胸腔积液时已处于晚期,失去有效的手术治疗机会[9-10]。目前以铂类药物为基础的联合化疗方案是治疗晚期肺腺癌的有效手段之一。
恶性胸腔积液的形成主要是由于肿瘤细胞分泌物增加了血管通透性导致渗出增加,同时由于肿瘤的压迫使血管、淋巴管回流受阻,以及肿瘤直接侵犯胸膜等[11]。恶性胸腔积液的形成容易引起患者呼吸困难加重、胸痛和干咳等症状,加上反复引流积液导致大量蛋白质丢失,加重了肺腺癌患者的消耗性损伤,严重影响患者生活质量[12]。治疗恶性胸腔积液的最有效方法是积液引流后化疗药物胸腔内灌注,可增加局部药物浓度,促进药物吸收并减轻毒性反应,具有“双路治疗”的作用[13]。近年研究发现,热疗可显著提高灌注的疗效,胸腔热灌注治疗应运而生,其临床应用已得到认可和推广[14]。研究表明,采用胸腔热灌注联合静脉化疗治疗肺癌恶性胸腔积液疗效确切,毒副反应轻,且能提高患者生存质量[15-17]。
培美曲赛是一种新型的肿瘤抗代谢类药物,具有多靶点抗叶酸细胞毒作用,能够有效抑制胸苷酸合成酶、二氢叶酸还原酶及甘氨酰胺核苷甲酰基转移酶的活性,从而抑制肿瘤DNA合成,最终抑制肿瘤细胞增殖;另外,培美曲赛还能通过胸膜粘连抑制作用抑制胸腔积液发生[18-19]。美国FDA于2004年已将培美曲赛联合顺铂作为治疗非小细胞肺癌和恶性胸膜间皮瘤的一线化疗药物。博来霉素是治疗恶性胸腔积液的有效药物之一,具有药效强、抗癌谱广、无骨髓免疫抑制的特点,在实现铂类药物疗效的同时又能减少对血液的毒性作用[5]。
本研究采用培美曲赛/顺铂联合博来霉素胸腔热灌注治疗肺腺癌晚期合并恶性胸腔积液患者,结果表明,该治疗方案能够明显降低患者胸腔积液中肿瘤标志物CEA和CYFRA21-1水平。CEA和CYFRA21-1均为肺腺癌的标志物,具有较高的敏感性,且其在胸腔积液中的检测敏感性高于血清[20]。治疗2个疗程后,观察组CEA和CYFRA21-1水平明显低于对照组,说明培美曲赛/顺铂联合博来霉素胸腔热灌注治疗比单纯培美曲赛联合顺铂经静脉化疗疗效更明显。治疗后,观察组的胸膜病灶、胸腔积液均得到明显的改善,患者生活质量提高,说明培美曲赛/顺铂静脉化疗和博来霉素胸腔热灌注化疗两者疗效可能相互叠加,显示出比单一化疗方案更优的抗肿瘤作用。本研究两组患者治疗后出现的主要毒副反应包括骨髓抑制、消化道反应,观察组毒副反应较对照组明显,但均呈一过性,且更多的集中在Ⅰ~Ⅱ级,毒性较低,经对症治疗后患者毒副反应均得到缓解。
综上所述,培美曲塞/顺铂联合博来霉素胸腔热灌注,双途径联合治疗晚期肺腺癌合并恶性胸腔积液具有较好的疗效和安全性,对患者生活质量具有明显的改善作用,值得在临床上推广应用。
[1] Park DS, Kim D, Hwang KE, et al. Diagnostic value and prognostic significance of pleural C - reactive protein in lung cancer patients with malignant pleural effusions [J]. Yonsei Med J, 2013, 54(2): 396-402.
[2] Tian P, Shen Y, Wan C, et al. Diagnostic value of survivin for malignant pleural effusion: a clinical study and meta-analysis[J]. Int J Clin Exp Pathol, 2014, 7(9): 5880-5887.
[3] 林晓明, 段林建, 胡伶清, 等. 培美曲塞联合顺铂治疗肺腺癌临床疗效的Meta分析[J]. 实用心脑肺血管病杂志, 2014, 22(10): 13-15.
[4] 曲洪澜, 孙宝才, 关琦, 等. 培美曲塞二钠联合顺铂治疗晚期肺腺癌的临床研究[J]. 海南医学院学报, 2013, 19(11): 1549-1551.
[5] 刘大治, 王宪东. 博来霉素胸腔灌注联合培美曲塞+顺铂全身化学治疗肺腺癌晚期合并恶性胸腔积液的效果分析[J]. 中国综合临床, 2014, 30(3): 302-303.
[6] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009, 45(2): 228-247.
[7] 马少林, 李润浦, 王艳丽, 等. 博莱霉素联合白介素-2 及凝血酶治疗恶性胸腔积液的临床观察[J]. 现代肿瘤医学, 2013, 21(3): 557-559.
[8] 胡文兵, 陈智龙. 顺铂胸腔灌注联合化疗治疗肺癌恶性胸水的疗效观察[J]. 现代肿瘤医学, 2015, 23(21): 3115-3117.
[9] Stinchcombe TE, Socinski MA. Current treatments for advanced stage non-small cell lung cancer [J]. Proc Am ThoracSoc, 2009, 6(2): 233-241.
[10] 戈伟, 伍钢. 实用肺部肿瘤学[M]. 人民军医出版杜, 2003, 447-448.
[11] 孙燕, 石远凯. 临床肿瘤内科手册[M]. 北京: 人民卫生出版社, 2009: 416.
[12] 陈绍锋, 黄杰, 肖纬字. 甘露聚糖肽联合顺铂胸腔内灌注治疗恶性胸腔积液的临床观察[J]. 现代肿瘤医学, 2014, 17(8): 1841-1843.
[13] 叶盛, 施一峰, 汪诚. 恶性胸腔积液的腔内灌注治疗进展[J]. 医学综述, 2012, 18(4): 547-550.
[14] 李思文, 赵健, 崔书中. 胸腔热灌注治疗恶性胸腔积液的研究进展[J]. 肿瘤基础与临床, 2014, 27(2): 174-177.
[15] 张万儒. 胸腔热灌注联合静脉化疗治疗肺癌胸腔积液疗效分析[J].中国医药科学, 2012, 2(2): 53-53.
[16] 马艳丽, 宋钰卿, 张桂香. 胸腔热灌注联合静脉化疗治疗肺癌胸腔积液26例分析[J]. 中国误诊学杂志, 2008, 8(20): 5025-5026.
[17] 赵晗程. 胸腔热灌注联合化疗治疗晚期非小细胞肺癌的临床研究[D]. 南方医科大学, 2015.
[18] Calvert H. An overview of folate metabolism: Features relevant to the action and toxicities of antifolate anticancer agents[J]. Semin Oncol, 1999, 26(2 Suppl 6): 3.
[19] Racanelli AC, Rothbart SB, Heyer CL, et al. Therapeutics by cytotoxic metabolite accumulation: pemetrexed causes ZMP accumulation, AMPK activation, and mammalian target of rapamycin inhibition [J]. Res, 2009, 69(13): 5467-5474.
[20] 温青久, 高桂华, 随冬侠. 血清和胸水肿瘤标志物检测对肺癌所致胸腔积液的诊断价值[J]. 中国医刊, 2012, 47(6): 64-66.
Clinical efficacy of pemetrexed combined w ith cisp latin and the bleom ycin chest hot perfusion for lung adenocarcinoma patients w ith malignant p leural effusion
Xue Zhi-hong, Zeng Gui-lin, Xiong Wei-jie, Li Zhi-ru, Wang Yun-tao, Zeng Shou-qun
(Department of oncology, The Fifth People’s Hospital of Chengdu, Sichuan, Chengdu 611130, China)
Objective To observe the clinical efficacy of pemetrexed combined with cisplatin and the bleomycin chest hot perfusion for the treatment of lung adenocarcinoma patients with malignant pleural effusion. M ethods 70 lung adenocarcinoma patients with malignant pleural effusion were randomly divided into two groups just as the observation group (35 cases) and the control group (35 cases). Patients in the observation group were taken intravenous chemotherapy with pemetrexed combined with cisplatin, and patients in the control group were taken pemetrexed combined with cisplatin and the bleomycin chest hot perfusion. After 2 period of the treatment, the levels of serum tumor markers (CEA, CYFRA21-1) were detected on the patients with effective. After the last courses of chemotherapy, the serum levels of CEA and CYFRA21-1 were detected again and the clinical efficacy were evaluated. The toxic and side effect after chemotherapy were observed on each patient. KPS score was performed to evaluate the quality of life of patients after treatment. Results Before the treatment, no significant difference of the levels of CEA and CYFRA21-1 was found between the observation group and control group. The levels of CEA and CYFRA21-1 in the observation group after the 2 period of treatment were obviously lower than that in the control group and that before treatment. When all courses of chemotherapy finished, the levels of CEA and CYFRA21-1 decreased more significantly. The RR of pleural effusion treatment (91.4%) and pleural lesions (85.7%), KPS score (82.15±9.26) and total improvement rate (82.9%) in the observation group were all greatly higher than that in the control group. The major toxic and side effects such as digestive tract reaction, fever and bone marrow suppression were found in the observation group, and thedigestive tract reaction, bone marrow suppression were additional found in the control group. Conclusion Therapy of pemetrexed combined with cisplatin and the bleomycin chest hot perfusion showed the well clinical efficacy in the treatment of lung adenocarcinoma patients with malignant pleural effusion.
lung adenocarcinoma; malignant pleural effusion; pemetrexed; bleomycin; cisplatin; chest hot perfusion
R734.2
A
1673-016X(2017)04-0120-04
2017-01-03
薛志红,E-mail:xuezhihong200@163.com

