癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的相关因素研究
黄思思
(四川省内江市第一人民医院,内江 641000)
癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的相关因素研究
黄思思
(四川省内江市第一人民医院,内江 641000)
目的:探讨癌症化疗患者应用重组人粒细胞集落刺激因子(rhG-CSF)持续时长的相关因素。方法:回顾性分析在本院接受化疗的癌症患者且应用rhG-CSF治疗的患者118例,根据应用重组人粒细胞集落刺激因子持续平均时长,将患者分为长持续时间组和短持续时间组,比较两组患者的性别比例、年龄分布、BMI指数,肿瘤类型,肿瘤分级,中性粒细胞含量,血红蛋白,血小板计数,血肌酐,卡氏评分,化疗方案确定癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的相关影响因素,再通过多因素分析确定癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的独立影响因素。结果:通过单因素分析确定年龄分布、BMI指数,肿瘤分级,中性粒细胞含量为癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的相关影响因素;通过多因素分析确定年龄分布、BMI指数,肿瘤分级,中性粒细胞含量为癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的独立影响因素。结论:对于癌症化疗患者应用rhG-CSF药物需要足够的持续时长才能起作用,对于年龄较大,BMI指数较低,肿瘤分级较晚以及中性粒细胞含量较低的患者需要应用rhG-CSF药物更长的时间,要引起临床足够的重视。
癌症;化疗;重组人粒细胞集落刺激因子;持续时长;相关因素
重组人粒细胞集落刺激因子(recombinant human anulocyte-colony stimulating factor,rhG-CSF)属于促进中性粒细胞生长的细胞因子的一种,其主要作用是支持粒系造血干细胞的生存,并促进其成熟,维持粒细胞的数量并进一步提升中性粒细胞吞噬抗原的能力[1-2]。癌症患者化疗过程可能诱发中性粒细胞的减少,可能会降低粒细胞的吞噬能力[3-4]。但是由于机体个性化的差异,rhG-CSF的应用时长不同,并需要实时对患者的血像指标进行频繁的监测,为临床治疗带来不便[5]。本研究探讨影响患者应用重组人粒细胞集落刺激因子持续时长的相关因素,为癌症患者化疗制定更加个性化的用药方案提供科学依据。
1 资料与方法
1.1 一般资料回顾性分析2011年7月~2015年2月期间在本院接受化疗的癌症患者且应用rhG-CSF治疗的患者118例,其中男54例,女64例,平均年龄为(64.9±8.1)岁,BMI指数(23.6±2.8)kg/m2,肿瘤类型分布:肺癌39例,恶性淋巴瘤35例,胃癌25例,乳腺癌19例,应用重组人粒细胞集落刺激因子持续平均时长为(8.9±3.7)天,本研究通过本院的伦理委员会审查同意。
1.2 纳入标准所有患者均由影像学和病理学确诊为癌症;癌症患者均为首次接受治疗;首次接受化疗的患者;骨髓功能正常;血常规检测正常;不伴随其他重大器官的损伤;临床资料齐全的患者。
1.3 排除标准排除全身存在严重感染的患者;排除接受过化疗的患者;排除肿瘤发生骨髓转移的患者;排除脑转移的患者;排除造血干细胞移植的患者;排除对rhG-CSF药物过敏的患者;排除临床资料不全的患者。
1.4 方法
1.4.1 分组方法根据应用重组人粒细胞集落刺激因子持续平均时长,将患者分为长持续时间组(持续时长 > 9天的患者)和短持续时间组(持续时长≤9天的患者),比较两组患者的性别比例、年龄分布、BMI指数,肿瘤类型,肿瘤分级,中性粒细胞含量,血红蛋白,血小板计数,血肌酐,卡氏评分,化疗方案确定癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的相关影响因素,再通过多因素分析确定癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的独立影响因素。
1.4.2 重组人粒细胞集落刺激因子的使用方法本研究采用重组人粒细胞集落刺激因子注射液(哈药集团,里亚金,国药准字S20000061),通过皮下注射给药,给药剂量根据患者的体重确定,在化疗后48h后给药,2.5μg/kg,每条一次。
1.4.3 化疗方法本研究的化疗方案供分为4种,其中紫杉醇+卡柏为PC方案,多柔比星+环磷酰胺为AC方案,多柔比星+环磷酰胺+长春新碱+强的松为CHOP方案,紫杉醇+多柔比星为PA方案。
1.5 统计学方法采用SPSS 19.0统计软件对数据进行处理,定量数据均采用平均值±标准差(¯±s)进行表示;计量资料采用t检验;计数资料均采用χ2检验,组间生存率的差异通过kaplan-meier检验获得,多因素分析是COX检验获得,所得结果P<0.05为差异具有统计学意义。
2 结果
2.1 影响癌症化疗患者应用重组人粒细胞集落刺激因子持续时长单因素分析通过单因素分析确定年龄分布、BMI指数,肿瘤分级,中性粒细胞含量为癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的相关影响因素,见表1。
2.2 影响癌症化疗患者应用重组人粒细胞集落刺激因子持续时长多因素分析通过多因素分析确定年龄分布、BMI指数,肿瘤分级,中性粒细胞含量为癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的独立影响因素,见表2。
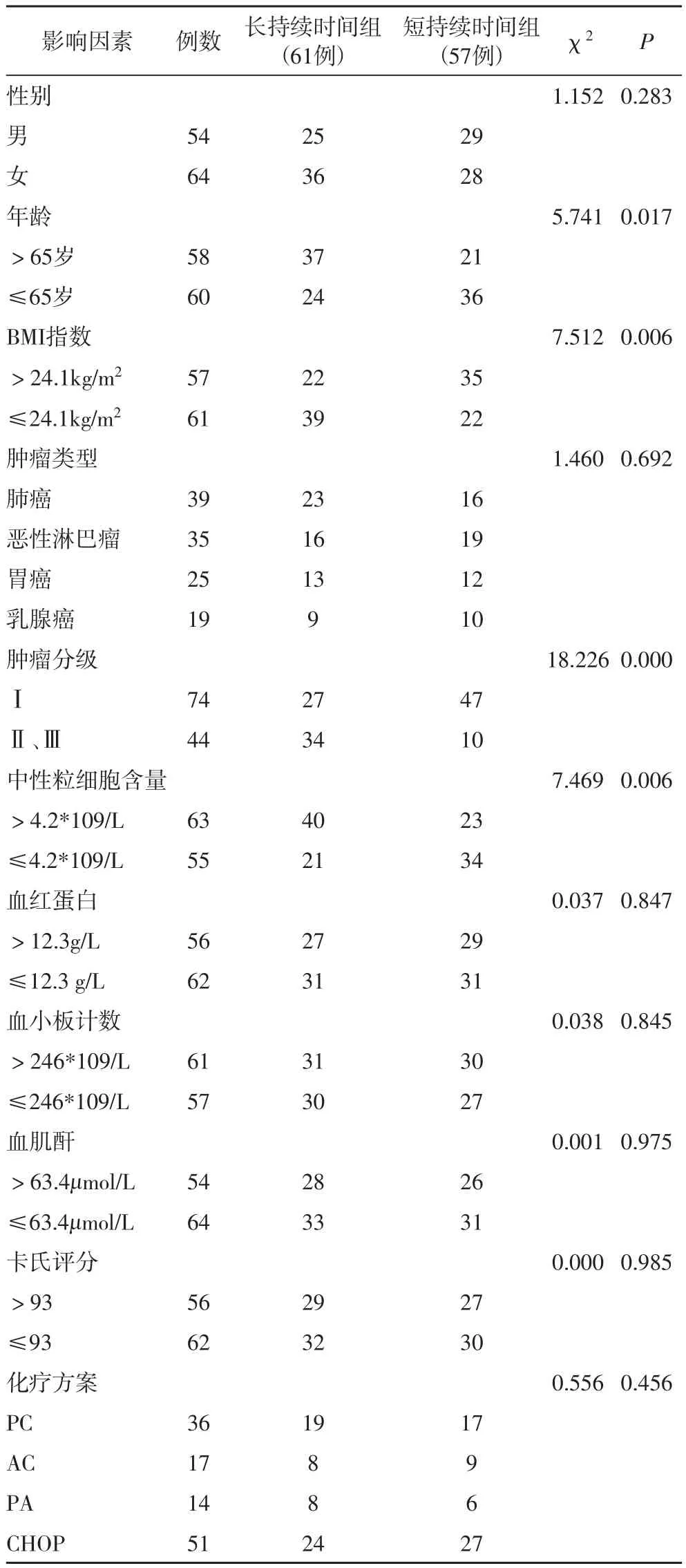
表1 影响癌症化疗患者应用重组人粒细胞集落刺激因子持续时长单因素分析

表2 影响癌症化疗患者应用重组人粒细胞集落刺激因子持续时长多因素分析
3 讨论
对于部分癌症患者,在化疗过程中预防性使用rhG-CSF药物对于患者恢复机体中性粒细胞水平是必要的。有研究指出,对癌症患者应用rhG-CSF药物可以在保证患者的安全性的基础上有效的提升患者的化疗剂量,提升患者的疗效[6]。但是由于应用rhG-CSF药物的相关费用较高,且尚未纳入医疗报销的范畴中,因此,国内的应用量较少。再加上临床医师在实践中很难密切的关注和检测患者的血像指标给予患者及时的停药[7-8]。所以,在临床上确定癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的独立影响因素尤为重要,为临床癌症患者应用rhG-CSF药物的时长提供科学依据。
通过多因素分析确定年龄分布、BMI指数,肿瘤分级,中性粒细胞含量为癌症化疗患者应用重组人粒细胞集落刺激因子持续时长的独立影响因素。其中年龄> 65岁的癌症患者化疗应用rhG-CSF药物持续时间要长于年龄≤65岁的癌症化疗患者,且差异具有统计学意义,可能的原因是年龄 > 65岁的癌症患者的免疫水平低下,多合并一些基础类疾病,对于化疗的抵抗能力较弱,更容易产生发热性的中性粒细胞降低,中性粒细胞的减少会导致患者的应用rhG-CSF药物的时间会相应的提升[9-10],而且也会增加患者住院的时间。所以,年龄 > 65岁的癌症患者化疗应用rhG-CSF药物持续时间要长于。
BMI指数≤24.1kg/m2的癌症患者化疗应用rhGCSF药物持续时间要长于BMI指数大于24.1kg/m2的癌症化疗患者,差异具有统计学意义。而且也研究指出[11-12],BMI指数较低的癌症患者化疗后,发热性的中性粒细胞降低的概率更高,与本研究结果一致。可能的原因是BMI指数可以有效的反应患者的营养体力状况,BMI指数较低的患者的营养体力较弱,对于化疗药物的适应以及创伤恢复能力均显著低于BMI指数较高的患者,因此,BMI指数≤24.1kg/m2的癌症患者化疗应用rhG-CSF药物持续时间要长。
肿瘤分级较晚的患者的化疗应用rhG-CSF药物持续时间要长于肿瘤分级较早的癌症化疗患者,差异具有统计学意义。可能的原因是肿瘤分级较晚的患者的可能会严重影响到骨髓产生中性粒细胞,虽然本研究已经将肿瘤转移至骨髓的患者已经排除,但是随着肿瘤分级的不断恶化,虽然未转移至骨髓,但是也会对骨髓生成功能有所损伤,也就会影响到中性粒细胞生成。而且,肿瘤分级较晚的患者的身体基础较差,对于化疗的抵抗能力较弱,中性粒细胞的恢复能力较弱[13-14]。所以,肿瘤分级较晚的患者的化疗应用rhG-CSF药物持续时间要长。
中性粒细胞含量≤4.2*109/L的患者的化疗应用rhG-CSF药物持续时间要长于中性粒细胞含量 >4.2*109/L的癌症化疗患者,差异具有统计学意义。可能的原因是rhG-CSF药物的主要作用就是恢复癌症患者机体内的中性粒细胞的水平,本身中性粒细胞含量较低的患者可能是由于机体产生中性粒细胞的能力下降,在短时间内恢复能力不理想[15-16]。所以,中性粒细胞含量≤4.2*109/L的患者的化疗应用rhG-CSF药物持续时间要长。
综上所述,对于癌症化疗患者应用rhG-CSF药物需要足够的持续时长才能起作用,对于年龄较大,BMI指数较低,肿瘤分级较晚以及中性粒细胞含量较低的患者需要应用rhG-CSF药物更长的时间,要引起临床足够的重视。
[1] 刘建军, 崔林, 张志胜, 等. 重组人粒细胞集落刺激因子对化疗后粒细胞下降的疗效观察[J]. 肿瘤研究与临床, 2006, 18(12): 848-849.
[2] 李娇, 张晟, 张瑾, 等. 重组人粒细胞集落刺激因子预防乳腺癌化疗后骨髓抑制的疗效分析[J]. 中国癌症杂志, 2014, 24(12): 925-930.
[3] 石远凯, 刘鹏, 杨晟, 等. 注射用聚乙二醇化重组人粒细胞集落刺激因子Ⅰ期临床耐受性试验[J]. 癌症, 2006, 25(4): 495-500.
[4] 汪晓洁, 寿涛, 胡静, 等. 不同剂量rhG-CSF预防晚期非小细胞肺癌化疗后白细胞减少的临床研究[J]. 中国癌症杂志, 2015, 25(10): 823-827.
[5] 杨晟, 何小慧, 刘鹏, 等. 化疗后预防性使用重组人粒细胞集落刺激因子的持续时间及其影响因素[J]. 中华肿瘤杂志, 2016, 38(1): 69-72.
[6] 杨晟, 何小慧, 刘鹏, 等. 聚乙二醇化重组人粒细胞集落刺激因子预防化疗后中性粒细胞减少的有效性分析[J]. 中国肿瘤临床, 2015, 42(12): 626-631.
[7] 刘元强, 崔杰. 重组人粒细胞集落刺激因子治疗10例恶性肿瘤化疗所致的Ⅳ度白细胞减少症[J]. 中国癌症杂志, 2001, 11(4): 331-332.
[8] 钟济华, 黄洪晖, 陈芳源, 等. 恶性淋巴瘤患者化疗后应用rhG-CSF对中性粒细胞的影响[J]. 中国癌症杂志, 2006, 16(7): 540-543.
[9] 袁丽娟, 张宏伟. 重组人粒细胞集落刺激因子惠血能应用于白细胞减少的临床研究[J]. 交通医学, 2002, 16(5): 523-524.
[10] 蔡永明, 陈拯民, 李铭, 等. 酶联免疫法研究注射用聚乙二醇化重组人粒细胞集落刺激因子的临床药动学[J]. 中草药, 2009, 40(8): 1267-1270.
[11] Chan A, Chen C, Chiang J, et al. Incidence of febrile neutropenia among early-stage breast cancer patients receiving anthracycline-based chemotherapy[J]. Supportive Care in Cancer, 2012, 20(7): 1525-1532.
[12] 周世勇, 王华庆, 张会来, 等. 聚乙二醇化重组人粒细胞集落刺激因子预防化疗后中性粒细胞减少症临床疗效观察[J]. 中国肿瘤临床, 2011, 38(18): 1154-1158.
[13] 孙皓. 不同剂量 rhG-CSF 预防晚期非小细胞肺癌化疗后白细胞减少的临床分析[J]. 中外医疗, 2016, 35(18): 119-120.
[14] 中国医师协会肿瘤医师分会, 中国抗癌协会肿瘤临床化疗专业委员会, 《中华医学杂志》编辑委员会, 等. 中国重组人粒细胞集落刺激因子在肿瘤化疗中的临床应用专家共识 (2015年版) [J]. 中华医学杂志, 2015, 95(37): 3001-3003.
[15] 石燕霞, 冯鑫. 肿瘤化疗中重组人粒细胞集落刺激因子对粒细胞减少症的疗效观察[J]. 中华临床医师杂志 (电子版), 2013, 7(21): 9768-9769.
[16] 吴鹏飞, 邱宏春, 孔荣, 等. 重组人粒细胞集落刺激因子在老年人恶性血液病治疗中的临床应用[J]. 中华老年医学杂志, 2011, 30(12): 1036-1037.
Study on the related factors of the duration time of the recombinant human granulocyte colony stimulating factor in cancer patients w ith chemotherapy
Huang Si-si
(The First People’s Hospital of Neijiang City, Neijiang 641000, China)
Objective To investigate the related factors of the duration time of the recombinant human granulocyte colony stimulating factor (rhG-CSF) in cancer patients with chemotherapy. M ethods A retrospective analysis of 118 cancer patients undergoing chemotherapy and treated with rhG-CSF in our hospital for, , The patients were divided into of long duration group and short duration group according to the average length of time of application of recombinant human granulocyte colony stimulating factor, patients with age and gender distribution, BMI index, tumor type, tumor stage, neutrophil content, hemoglobin, platelet count, serum creatinine, Karnofsky score, chemotherapy scheme of two groups were compared to determine the relatedfactors of the duration time of the recombinant human granulocyte colony stimulating factor in cancer patients with chemotherapy, and then multi factor analysis to determine the independent factor he duration time of the recombinant human granulocyte colony stimulating factor in cancer patients with chemotherapy. Results The age distribution, BMI index, tumor stage, the neutrophil content werethe related factors of the duration time of the recombinant human granulocyte colony stimulating factor in cancer patients with chemotherapy by the single factor analysis; through multi factor analysis the age distribution, BMI index, tumor stage, the neutrophil content were the independent factors of the duration time of the recombinant human granulocyte colony stimulating factor in cancer patients with chemotherapy. Conclusion The application of rhG-CSF chemotherapy drugs for cancer patients need to continue to work long enough, for the patients with older, lower BMI index, tumor stage and neutrophil content lower rhG-CSF needs longer time for drug application to cause clinical attention.
cancer; chemotherapy; recombinant human granulocyte colony stimulating factor; duration; related factors
R730.5
A
1673-016X(2017)04-0103-04
2017-01-03
黄思思,E-mail:81846496@qq.com

