利用重组自交系群体定位不同温度条件下玉米种子发芽性状的QTL
韩赞平,陈彦惠,刘海英,赵瑞芳,郭书磊
(1.河南科技大学农学院,河南洛阳471003;2.河南农业大学农学院,河南郑州450002;3.河南省农业科学院,河南郑州450002)
利用重组自交系群体定位不同温度条件下玉米种子发芽性状的QTL
韩赞平1,2,陈彦惠2,刘海英2,赵瑞芳2,郭书磊3
(1.河南科技大学农学院,河南洛阳471003;2.河南农业大学农学院,河南郑州450002;3.河南省农业科学院,河南郑州450002)
以基于豫82×沈137和豫537A×沈137构建的2个重组自交系群体的420个家系为材料,借助SNP分子标记遗传连锁图谱,利用复合区间作图法定位了发芽率(GP)、发芽势(GE)、发芽指数(GI)、活力指数(VI)、苗长(SL)、幼苗干质量(SDW)、根干质量(RDW)7个种子发芽相关性状的QTL。结果表明,基于豫82×沈137的重组自交系群体检测到24个QTLs,分布在1、2、3、5、6、7、10染色体上,单个QTL解释性状遗传变异的5.61%~11.01%;基于豫537A×沈137的重组自交系群体检测到40个QTLs,分布在除第2染色体外的其余9条染色体上,单个QTL解释性状遗传变异的5.39%~11.92%。通过元分析方法将64个原初QTLs中的25个(39.1%)整合进6个mQTLs,分别分布于第3、5、7、10染色体上,每个mQTL平均包含4.17个QTLs,分别参与2~4个性状的调控,其中,mQTL3-2包含了7个QTLs,参与对VI、SDW、RDW、GE等4个性状的调控。确定了位于6个mQTLs对应标记区间的35个候选基因,主要参与种子萌发、氧化还原代谢途径、信号传导、逆境抵御等生物学过程。
玉米;重组自交系;温度;发芽性状;QTL定位
低温冷害是影响玉米种子发芽和产量的关键因素。在我国的玉米生产实践中,障碍型冷害,尤其是萌芽期低温冷害的发生往往造成早播玉米大幅度减产,严重威胁玉米的安全生产。研究玉米耐冷特性,培育高活力玉米品种以抵御低温冷害造成的不利影响是保证玉米安全生产经济有效的途径,同时也对通过控制温度调控种子发芽、降低种子贮藏成本、延长贮存年限具有重要的借鉴意义。
玉米耐冷性是受多基因控制的数量性状,容易受到环境条件的影响[1-2]。随着玉米高密度分子遗传连锁图谱的构建,国内外科研工作者借助分子标记技术对作物耐冷性相关性状的QTL定位开展了比较广泛的研究[3-11]。在有关玉米耐冷性相关性状的基因定位方面,不同的研究者分别利用不同的定位群体,以叶绿素含量、光合参数、发芽指数、侧根长度等玉米幼苗耐冷性相关指标和性状进行QTL检测,分别检测到分布于不同染色体上的主效QTLs,得出了不尽相同的研究结果。Fracheboud等[12]基于BAc7643×Ac7729/TZ和ETH-DH7×ETHDL3分别构建一套重组自交系群体和F2:3群体,以玉米幼苗在低温胁迫下光合作用系统的耐冷性和叶绿素荧光参数为鉴定指标进行了QTL检测,前者在检测到的多个QTLs中,位于第3染色体上的主效QTL可解释28%的表型遗传变异,它在多个与光合作用相关的指标中均能被检测到,仅在低温胁迫下特异表达;后者检测到玉米幼苗耐冷性主效QTL分布在第6染色体上,能解释低温胁迫下慢性光抑制遗传变异的37.4%,且与地上部分干物质质量、暗反应速率等呈显著相关。Hund等[13]利用基于Lo964×Lo1016构建的一套F2:3群体,对低温胁迫下玉米幼苗根部和芽发育的QTL进行定位,共检测到20个QTLs,位于第5染色体的主效QTL能解释12%的萌芽指数变异以及14%的初生侧根长度变异。Jompuk等[14]和Leipner等[2]均基于ETHDH7×ETH-DL3构建的一套F2:3群体对玉米苗期耐冷性QTL进行检测,结果发现,主效QTLs分别分布在第6染色体和第3染色体上。Guerra-Peraza等[15]基于B73×Mo17构建群体IBM302,以叶片叶绿素含量及光合量子效率为度量指标,检测到耐低温的主效QTL分布在第5染色体上。
针对低温下玉米萌芽期种子发芽相关性状的QTL分析研究开展较少的现状,本研究利用基于豫82×沈137、豫537A×沈137获得的2个分别包含208个、212个家系的玉米重组自交系群体为材料,分别在正常环境条件[(28±1)℃]和低温环境条件[(18±1)℃]下,研究玉米萌芽期种子发芽相关性状的表型变化,并进行相关性状的QTL定位,旨在揭示玉米耐冷性相关性状的基因位点,以期为进一步实现对玉米在多个环境下稳定表达的耐冷性育种主效QTL的精细定位提供参考,也为玉米耐冷性育种的分子标记辅助选择提供种质材料。
1 材料和方法
1.1 试验材料
试验所用材料为分别基于豫82×沈137、豫537A×沈137获得的2个重组自交系群体(分别以Pop.1、Pop.2表示),分别包含208、212个家系。2010年冬,在海南加代繁殖亲本和各家系,单行区种植,行长4 m、行距0.6 m、株距25 cm,全生育期及时防治病虫害,田间管理同一般大田生产。花期选择长势整齐一致的单株自交授粉,成熟时单株分收分藏,用于室内种子发芽试验。豫82和豫537A是由河南农业大学选育的种子活力差异明显的2个普通玉米自交系。其中,豫82选自于豫综5号C3改良群体,从中选择优良单株通过连续多代自交选育而成,株型紧凑,萌芽力好;豫537A是利用豫综5号C2改良群体,采用轮回选择的方法,连续自交6代选育而成,萌芽力差。沈137是沈阳农业科学院利用国外杂交种6JK-111选育而成,配合力高,萌芽力好,具有较强的种子活力。
1.2 种子发芽试验及性状测定方法
选择大小均匀、无破损的玉米种子,按照《农作物种子检验规程》(GB/T 3543.4—1995)的方法在人工气候培养箱中采用沙培法,分别在正常温度[(28±1)℃]、低温处理[(18±1)℃](相对湿度均为65%,光周期为光照14 h/黑暗10 h)条件下进行种子发芽试验。首先将种子种植于规格为4 cm× 4 cm的发芽穴盘中,每穴2粒,穴深5 cm。每天定时定量补水。
温度为(28±1)℃的处理,从第2天起,逐日统计每份材料的发芽数,至第8天调查结束,3次重复;温度为(18±1)℃的处理,从第4天起,逐日统计每份材料的发芽数,至第10天调查结束,3次重复。发芽率(germination percentage,GP)、发芽势(germination energy,GE)、发芽指数(germination index,GI)、活力指数(vigor index,VI)、苗长(seedling length,SL)、苗干质量(seedling dry weight,SDW)、根干质量(root dry weight,RDW)的测定参照宋松泉等[16]的方法进行。
1.3 表型数据统计分析与QTL定位及命名
首先对百分数数据资料(发芽率)先进行求平方根反正弦arc-1sin的数据转换,然后利用SPSS 17.0软件对2个重组自交系群体所考察性状的表型数据进行平均数、标准差、偏度、峰度等描述性统计以及相关性和方差分析。
利用Illumina Maize SNP 500G Bead Chip(Illumina,San Diego,California,USA)对亲本进行多态性检测,通过卡平方(χ2)测验进行多态性标记的偏分离分析,之后用软件Joinmap 4.0进行SNP分子标记的遗传连锁分析,然后采用Mapdraw 2.1绘制分子标记遗传连锁图谱[17],利用WinQTLCart 2.5软件,采用复合区间作图法对所考察性状的QTL进行检测,QTL定位过程中,窗口大小默认为10 cM,背景标记5个,采用正向-反向逐步回归法控制背景,每个性状均单独在α=0.05显著水平下进行1 000次排列检验,以LOD=2.5作为阈值在每一连锁群上间隔1 cM对QTL存在的可能性进行扫描,当某一区间里的LOD值大于2.5时,该区间里的最大LOD值所对应的位点即为QTL在该连锁群上可能的位置,同时计算出每个QTL对各性状的遗传贡献率和加性效应。
QTL的命名参照McCouch等[18]的方法,为q+温度环境英文首个字母的小写+性状的英文缩写+群体编号+QTL所在的染色体号,若同一性状在某染色体上有多个QTLs时,分别用-1、-2、-3、…加以区分,QTL名称均用斜体表示,如qlGP1-3-1表示低温环境条件下豫82×沈137群体所检测到的控制发芽率这一性状分布在第3染色体上的第1个QTL。
1.4 一致性QTL确定和候选基因预测
利用BioMercator 3.1软件,采用元分析技术进行一致性QTL区间的鉴定,根据一致性QTL区间两端标记在玉米物理图谱B73 RefGen v1上的位置,将一致性QTL区间进行物理图谱定位,利用Plant GDB(http://www.plantgdb.org/)在线区段批量下载工具(download region data)下载一致性区间的预测基因序列并进行生物信息学分析,发掘与玉米种子发芽相关的基因组区域及其候选基因。
2 结果与分析
2.1 不同温度条件下种子发芽相关性状的表型分析
由表1可以看出,低温条件下3个亲本的GP、GE、SDW、RDW、GI、VI、SL明显低于正常条件下的相应性状平均值。3个亲本中,GP、GE、GI均以豫82最高,沈137的GP、GE高于豫537A。重组自交系家系所有性状的变异系数介于8.72%~23.50%,表现出超亲分离的特点,偏度和峰度分别介于-1.25~0.61和-0.24~1.18,服从正态分布。
由表2可以看出,在不同群体、不同温度条件下彼此之间均呈显著正相关关系的有GP与GE、GI、VI,GE与GI、VI,GI与VI、SL,VI与SL、SDW、RDW,SDW与RDW。这种相关性在相同群体、不同温度条件或者不同群体、相同温度条件下的表现不一,其他性状之间的相关程度不确定,但相关性质都是一致的。
2.2 不同温度条件下种子发芽相关性状的QTL分析
2种温度条件下共检测到所测定7个种子发芽相关性状的QTLs 64个(表3)。其中,在Pop.1中检测到24个,分布在第1、2、3、4、5、6、7、10染色体上,单个QTL解释性状遗传变异的5.61%~11.01%;在Pop.2中检测到40个,分布在除第2染色体之外的其余9条染色体上,单个QTL解释性状遗传变异的5.39%~11.92%。

表1 不同温度条件下亲本及2个重组自交系群体的表型统计

表2 不同温度条件下7个种子发芽相关性状之间的表型相关系数

表3 不同温度条件下7个种子发芽相关性状的QTL检测
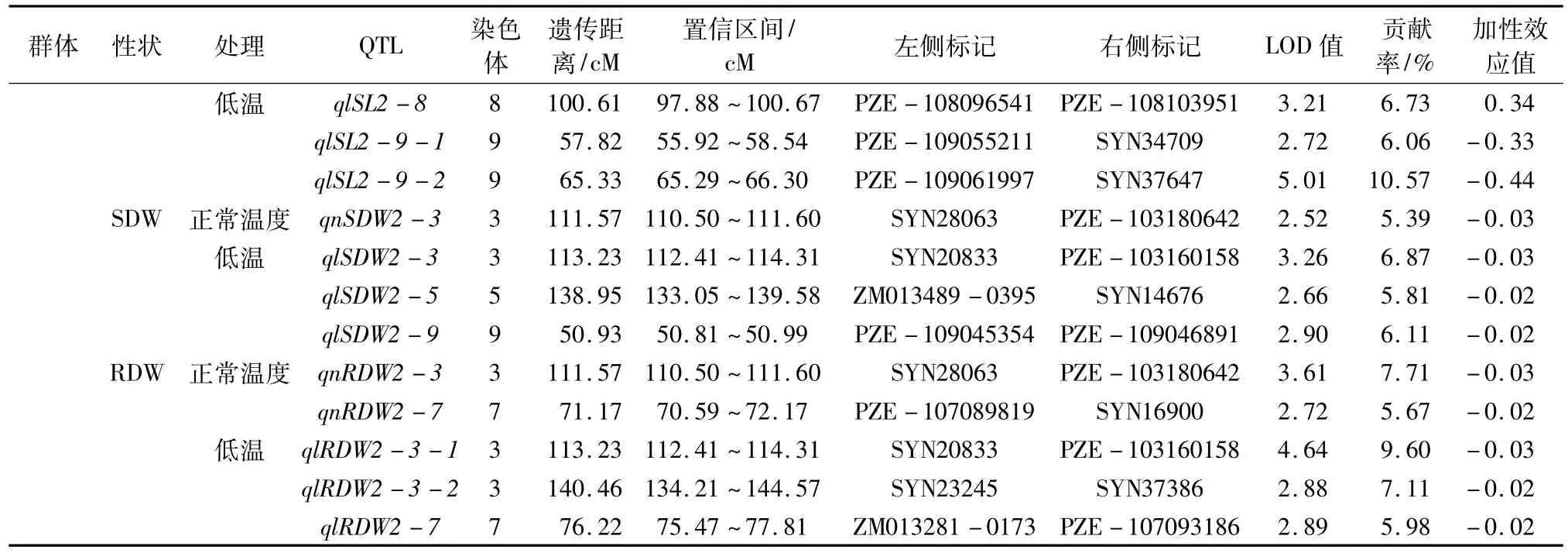
续表3不同温度条件下7个种子发芽相关性状的QTL检测
2.2.1 GP由表3可知,共检测到8个GP加性QTLs,其中Pop.1中有4个(正常温度下3个、低温条件下1个),Pop.2中有4个(正常温度下1个、低温条件下3个)。它们分别位于第1、2、3、5、6、7、10染色体上,单个QTL可解释GP遗传变异的5.97%~9.06%。qlGP2-7的遗传贡献率最大,为9.06%,位于PZE-107032490与PZE-107045266之间;其次是位于SYN14676与SYN33425之间的qnGP1-5,可解释7.98%的表型变异。
2.2.2 GE由表3可知,共检测到11个GE加性QTLs,其中Pop.1中有4个(正常温度下1个、低温条件下3个),Pop.2中有7个(正常温度下3个、低温条件下4个)。它们分别位于第2、3、4、5、6、9、10染色体上,单个QTL可解释GE遗传变异的5.58%~10.77%。qlGE2-10-1的遗传贡献率最大,为10.77%,位于PZE-110040961与PZE-110042144之间,可能是控制GE的一个主效QTL。
2.2.3 GI由表3可知,共检测到9个GI加性QTLs,其中Pop.1中有4个(正常温度下2个、低温条件下2个),Pop.2中有5个(正常温度下3个、低温条件下2个)。它们分别分布第1、3、7、8染色体上,单个QTL可解释GI遗传变异的5.49%~11.01%。qlGI1-7-2的遗传贡献率最大,为11.01%,位于SYN34644与PZE-107137037之间,另外,分别位于PZE-108067511与PZE-108069726、PZE-108073195与PZB00865.2之间的qnGI2-8-1、qnGI2-8-2的遗传贡献率分别为10.25%、10.82%,它们可能是控制GI的主效QTLs。
2.2.4 VI由表3可知,共检测到9个VI加性QTLs,其中Pop.1中有3个(正常温度下2个、低温条件下1个),Pop.2中有6个(正常温度下5个、低温条件下1个)。它们分别位于第1、3、4、5、8、9染色体上,单个QTL可解释VI遗传变异的5.39%~7.78%。qnVI2-3-1的遗传贡献率最大,为7.78%,位于PZE-103180642与SYN28063之间;其次是位于SYN1576与PZE-103151399之间的qnVI2-3-2,可解释7.59%的表型变异。
2.2.5 SL由表3可知,共检测到12个SL加性QTLs,其中Pop.1中有3个(正常温度下2个、低温条件下1个),Pop.2中有9个(正常温度下6个、低温条件下3个)。它们分别位于第3、4、7、8、9、10染色体上,单个QTL可解释SL遗传变异的5.41%~11.92%。qnSL2-9-1的遗传贡献率最大,为11.92%,位于PZE-109061997与SYN37647之间;其次是位于PZE-109061997与SYN37647之间的qlSL2-9-2,可解释10.57%的表型变异。qnSL2-9-1和qlSL2-9-2可能是控制SL的主效QTLs。
2.2.6 SDW由表3可知,共检测到7个SDW加性QTLs,其中Pop.1中有3个(正常温度下1个、低温条件下2个),Pop.2中有4个(正常温度下1个、低温条件下3个)。它们分别位于第3、4、5、6、9染色体上,单个QTL可解释SDW遗传变异的5.39%~7.11%,其中qlSDW1-6的遗传贡献率最大,为7.11%,位于PZE-106108187与SYN26189之间。
2.2.7 RDW由表3可知,共检测到8个RDW加性QTLs,其中Pop.1中有3个(正常温度下2个、低温条件下1个),Pop.2中有5个(正常温度下2个、低温条件下3个)。它们分别位于第1、3、7、10染色体上,单个QTL可解释RDW遗传变异的5.67%~9.60%,qlRDW2-3-1的遗传贡献率最大,为9.60%,位于SYN20833与PZE-103160158之间。
2.3 一致性QTL分析和候选基因
元分析确定的6个mQTLs分别位于第3、5、7、10染色体上,所有mQTLs所包含的QTLs均在2个群体同时被检测到且可能参与调控2个或者更多性状,25个QTLs被整合其中,被包含进mQTL的比例为39.1%,每个mQTL平均包含4.17个QTLs,参与调控2~4个性状,其中mQTL3-2包含了7个QTLs,参与对VI、SDW、RDW、GE等4个性状的调控(表4)。
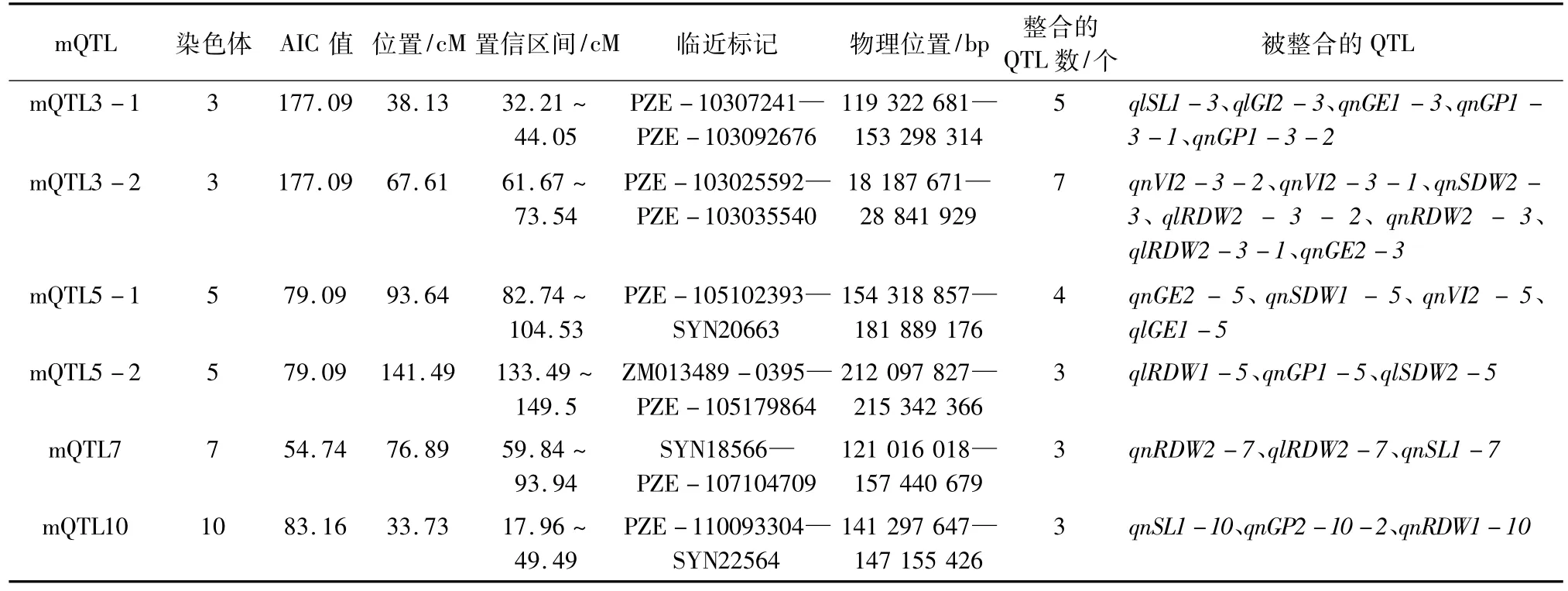
表4 不同温度条件下7个种子发芽相关性状的一致性QTL
根据各个mQTL所对应的SNP标记分布区间,参照B73的基因组信息,查找与之对应的物理位置,以http://www.maizegdb.org/中鉴定的基因信息为对照,确定各个mQTL对应SNP标记分布区间内的候选基因(表5)。35个候选基因分别位于6个mQTLs对应SNP标记分布区间内,它们的主要编码产物按功能可划分为4类:第1类参与蛋白质和DNA合成代谢途径,主要有生长素结合蛋白(GRMZM2G116204)、根冠蛋白(GRMZM2G097316)、核糖体蛋白(GRMZM2G314646)、纤维素合成酶催化亚基(GRMZM2G142898)、谷胱甘肽转移酶(GRMZM2G028556、GRMZM5G895383、GRMZM2-G032856、GRMZM2G416632)、异淀粉酶型淀粉脱支酶(GRMZM2G150796、GRMZM2G063517)、乙酰乳酸合成酶(GRMZM2G143008)、谷氨酰氨合成酶(GRMZM2G09-8290)、半胱氨酸蛋白酶(GRMZM2G098298)、增殖细胞核抗原(GRMZM2G030523、GRMZM2G410710)、苯丙氨酸转运蛋白(GRMZM2G472869)、S-腺苷甲硫氨酸脱羧酶酶原(GRMZM2G461159)、二氢黄酮醇还原酶(GRMZM2G109560、GRMZM2G004683);第2类参与生长发育,主要有翻译起始因子eIF-2Bα亚单位蛋白(GRMZM2G084647)、胚胎细胞发生感应器类似蛋白激酶(GRMZM2G115420)、胚乳发育蛋白(GRMZM2G160687)、细胞壁转化酶(GRMZM2G174249)、高直链淀粉酶(GRMZM2G032628)、衣被蛋白(GRMZM2G028929)、NADP-结合蛋白(GRMZM2G050076);第3类抵御逆境胁迫,主要有抵御干旱、低温和高温胁迫的翻译起始因子eIF-2Bα亚单位蛋白(GRMZM2G084647)、抵御缺铁胁迫的核糖体蛋白(GRMZM2G019325);第4类是一些功能未知的假定蛋白,主要有GRMZM2G155096、GRMZM2G084762、GRMZM5G821639、GRMZM2G174221、GRMZM2G163749、GRMZM2G161302、GRMZM2G307588、GRMZM2G114642。
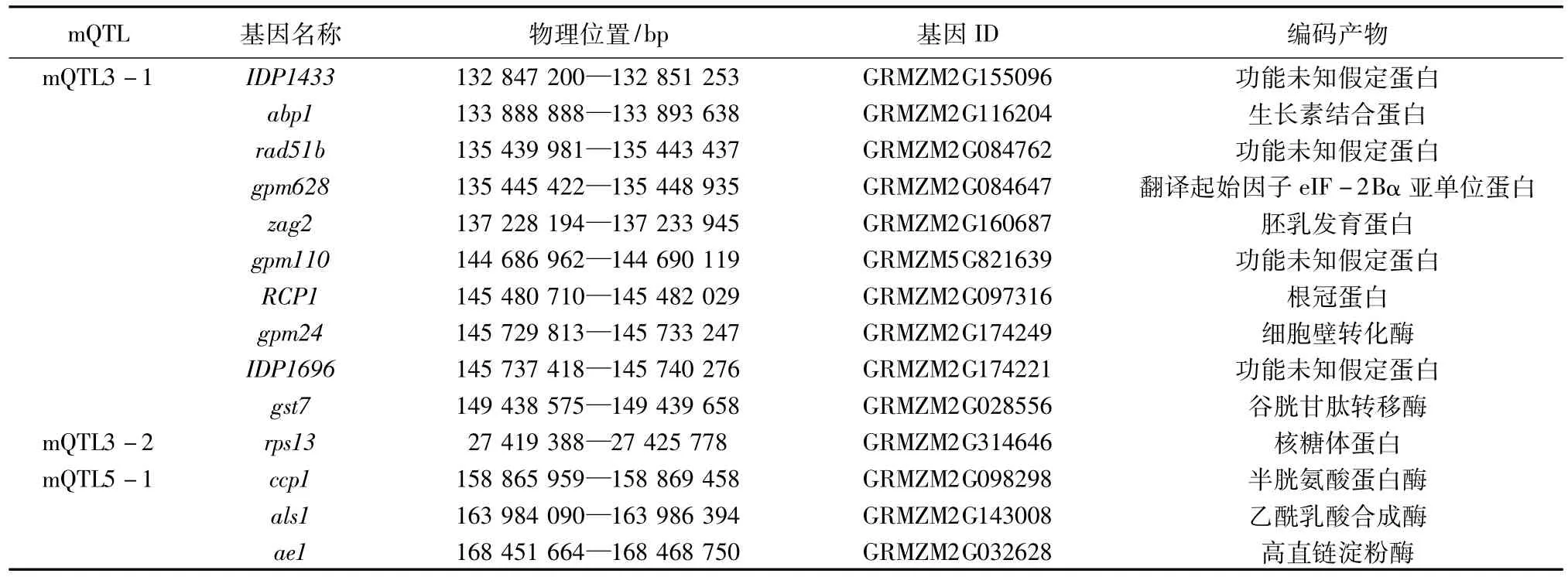
表5 不同温度条件下种子发芽相关性状与一致性QTL共定位的候选基因

续表5不同温度条件下种子发芽相关性状与一致性QTL共定位的候选基因
3 结论与讨论
玉米是利用杂种优势最为充分的异花授粉作物,全生育期对温度反应敏感。萌芽和幼苗期低温直接影响其正常生长发育,降低其对其他逆境胁迫的抵抗力,最终影响产量。
3.1 基因型对不同温度条件的响应差异
2个重组自交系群体对不同温度条件的响应不同。Pop.1中检测到7个种子发芽相关性状的24个QTLs,分布在第1、2、3、4、5、6、7、10染色体上,单个QTL解释性状遗传变异的5.61%~11.01%。Pop.2中检测到7个种子发芽相关性状的40个QTLs,分布在除第2染色体之外的其余9条染色体上,单个QTL解释性状遗传变异的5.39%~11.92%。Pop.1中所检测到的24个QTLs中有10个加性效应值为负,14个加性效应值为正;Pop.2中所检测到的40个QTLs中有27个QTLs加性效应值为负,13个为正,说明来自于不同亲本间QTL的加性效应互为补充,在进行分子标记辅助育种时高值亲本的选择很重要,但也不能忽视低值亲本。
2个重组自交系群体的QTL检测结果存在差异。位于第3染色体上调控SDW的QTLs在基于豫537A×沈137的重组自交系群体正常温度和低温条件下均被检测到,单个QTL对表型变异的贡献率分别为5.39%和6.87%,但在基于豫82×沈137的重组自交系群体中第3染色体上则没有检测到相应的QTL。位于第9染色体上调控SL的QTLs在基于豫537A×沈137的重组自交系群体正常温度和低温条件下都位于PZE-109061997—SYN37647标记区间,单个QTL对性状表型变异的贡献率分别为11.92%和10.57%,可能是调控SL的主效QTL,同样,在基于豫82×沈137的重组自交系群体中第9染色体上也没有检测到相应的QTL。
研究中未发现可在不同群体、不同温度条件下重复检出的QTL,而参与调控VI、RDW、SVI、SL的QTLs可在不同温度条件下重复检出,充分说明环境因素对玉米萌芽期和幼苗性状的影响较大以及数量性状遗传的复杂性。
3.2 不同温度条件下种子发芽mQTL在染色体上的热点分布区域
本研究对被整合入6个mQTLs中的QTLs可能参与调控的性状之间的相关性进行了分析,每个mQTL平均包含4.17个QTLs,参与调控2~4个性状。其中,mQTL3-1、mQTL3-2、mQTL5-1、mQTL5-2、mQTL7、mQTL10等6个mQTLs中均包含了多个与种子发芽相关且稳定表达的QTLs,如被整合入位于第3染色体上的mQTL3-2的7个原初QTLs,分别参与了对VI、SDW、RDW、GE等4个性状的调控,且集中分布在PZE-103025592—PZE-103035540标记区间,同样被整合入位于第3染色体上的mQTL3-1的5个原初QTLs,分别参与了对GP、GI、SL、GE等4个性状的调控,且集中分布在PZE-103072415—PZE-103092676标记区间,结合表2所揭示的在不同群体、不同温度条件下它们彼此之间均呈现显著的相关关系可知,基因多效性和/或紧密连锁以及相关密切的性状在染色体上往往相距较近,也体现了QTL有集中分布于少数染色体上的倾向[19-20],初步推定PZE-103072415—PZE-103092676标记区间是参与调控响应温度相关种子发芽性状的QTLs在染色体上分布的热点区域。如同Ye等[21]所指出的,仅仅依靠常规的QTL分析方法很难全面揭示复杂性状与其构成因素或相关性状在单个QTL水平之间的相互关系。
3.3 不同温度条件下种子发芽相关性状的QTL与候选基因的对应关系
低温冷害影响种子的萌发和幼苗生长发育,持续的低温会大幅降低蛋白质合成过程中发生的一系列新陈代谢活动、抑制细胞周期信号转导通路和植物生长调节物质的分泌,同时,核酸、脂质、蛋白质破坏的程度相伴增加[20-21]。在长期的进化过程中,植物受低温胁迫后,细胞能迅速感知外界信号,通过一系列复杂的信号转导并激活特定转录调控因子,提高植物耐受及抵抗低温的能力。本研究探讨了mQTLs与标记分布区间之间的对应关系,35个候选基因分别位于6个mQTLs对应的SNP标记分布区间内。其中,分布基因数目最多的mQTL7中有调控纤维素合成代谢的GRMZM2G142898、调控多胺合成代谢的GRMZM2G461159[22]、调控蛋白质代谢的GRMZM5G895383、调控淀粉合成代谢的GRMZM2G063517、编码产物为功能未知假定蛋白的GRMZM2G161302和GRMZM2G307588[23]、调控不育系育性的GRMZM2G050076[24]、调控细胞壁生物合成的GRMZM2G004683、调控花青素合成的GRMZM2G109560、调控蛋白质生物合成精确性的GRMZM2G472869[25]、调控纤维素生物合成的GRMZM5G895383[26]。mQTL3-1中有调节生长素生物合成的GRMZM2G116204[27],调控染色质重塑和修复的GRMZM2G084762[26],运输RNA由细胞核到细胞质转移的GRMZM2G084647,调控玉米胚乳发育的GRMZM2G160687[27],编码产物为根冠蛋白的GRMZM2G097316,调控蔗糖代谢、促进籽粒灌浆、抵御非生物胁迫的GRMZM2G174249,具有解毒作用的GRMZM2G028556,编码产物为功能未知假定蛋白的GRMZM2G155096、GRMZM5G821639和GRMZM2G174221[25]。另外,还有调控淀粉酶合成的GRMZM2G032628、调节育性的GRMZM2G115420[24]、抵御病害胁迫的GRMZM2G410710[25]、在ATP的存在下使氨与谷氨酸结合生成谷氨酰胺的GRMZM2G098290[28],它们分别在DNA和蛋白质合成代谢、生长发育、逆境响应等生物学过程中发挥重要作用。
[1]Hodges D M,Andrews C J,Johnson D A,et al.Sensitivity of maize hybrids to chilling and their combining abilities at two developmental stages[J].Crop Science,1997,37 (3):850-856.
[2]Leipner J,Stamp P.Handbook of maize:Its biology[M].New York:Springer-Verlag,2009:291-310.
[3]Teng S,Zeng D L,Qian Q,et al.QTL analysis of rice low temperature germinability[J].Chinese Science Bulletin,2001,46(21):1800-1803.
[4]Miura K,Lin S Y,Yano M,et al.Mapping quantitative trait loci controlling low temperature germinability in rice (Oryza sativa L.)[J].Breeding Science,2001,51(4): 293-299.
[5]Fujino K,Sekiguchi H,Sato T,et al.Mapping of quantitative trait loci controlling low-temperature germinability in rice(Oryza sativa L.)[J].Theoretical and Applied Genetics,2004,108(5):794-799.
[6]Zhang Z H,Yu S B,Yu T,et al.Mapping quantitative trait loci(QTLs)for seedling-vicror using recombinant inbred lines of rice(Oryza sativa L.)[J].Field Crops Research,2005,91(2/3):161-170.
[7]Chen J,Hu J,Vick B A,et al.Molecular mapping of a nuclear male-sterility gene in sunflower(Helianthus annuus L.)using TRAP and SSR markers[J].Theoretical and Applied Genetics,2006,113(1):122-127.
[8]Fujino K,Sekiguchi H,Matsuda Y,et al.Molecular identification of a major quantitative trait locus,qLTG3-1,controlling low-temperature germinability in rice[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(34):12623-12628.
[9]Fujino K,Matsuda Y.Genome-wide analysis of genes targeted by qLTG3-1 controlling low-temperature germinability in rice[J].Plant Molecular Biology,2010,72(1/2): 137-152.
[10]Dias P M B,Brunel-Muguet S,Duerr C,et al.QTL analysis of seed germination and pre-emergence growth at extreme temperatures in Medicago truncatula[J].Theoretical and Applied Genetics,2011,122(2):429-444.
[11]Li L,Liu X,Xie K,et al.qLTG-9,a stable quantitative trait locus for low-temperature germination in rice(Oryza sativa L.)[J].Theoretical and Applied Genetics,2013,126(9):2313-2322.
[12]Fracheboud Y,Jompuk C,Ribaut J M,et al.Genetic analysis of cold-tolerance of photosynthesis in maize[J].Plant Molecular Biology,2004,56(2):241-253.
[13]Hund A,Fracheboud Y,Soldati A,et al.QTL controlling root and shoot traits of maize seedlings under cold stress[J].Theoretical and Applied Genetics,2004,109(3): 618-629.
[14]Jompuk C,Fracheboud Y,Stamp P,et al.Mapping of quantitative trait loci associated with chilling tolerance in maize(Zea mays L.)seedlings grown under field conditions[J].Journal of Experimental Botany,2005,56 (414):1153-1163.
[15]Guerra-Peraza O,Leipner J,Reimer R,et al.Temperature at night affects the genetic control of acclimation to cold in maize seedlings[J].Maydica,2011,56(4): 367-377.
[16]宋松泉,程红焱,龙春林,等.种子生物学研究指南[M].北京:科学出版社,2005:30-150.
[17]韩赞平.玉米种子活力相关性状QTL定位及基因克隆[D].郑州:河南农业大学,2014.
[18]McCouch S R,Cho Y G,Yano M P E,et al.Report on QTL nomenclature[J].Rice Genetics Newsletters,1997,14:11-13.
[19]Bettey M,Finch-savage W E,King G J,et al.Quantitative genetic analysis of seed vigour and pre-emergence seedling growth traits in Brassica oleracea[J].New Phytologist,2000,148(2):277-286.
[20]孙群,王建华,孙宝启.种子活力的生理和遗传机理研究进展[J].中国农业科学,2007,40(1):48-53.
[21]Ye Z H,Wang J M,Liu Q,et al.Genetic relationships among panicle characteristics of rice(Oryza sativa L.) using unconditional and conditional QTL analyses[J].Journal of Plant Biology,2009,52(3):259-267.
[22]Levine R L,Stadtman E R.Oxidative modification of proteins during aging[J].Experimental Gerontology,2001,36(9):1495-1502.
[23]Schnable P S,Ware D,Fulton R S,et al.The B73 maize genome:Complexity,diversity,and dynamics[J].Science,2009,326:1112-1115.
[24]Liu H,Qin C,Chen Z,et al.Identification of miRNAs and their target genes in developing maize ears by combined small RNA and degradome sequencing[J].BMC Genomics,2014,15(1):25.
[25]Liao C,Peng Y,Ma W,et al.Proteomic analysis revealed nitrogen-mediated metabolic,developmental,and hormonal regulation of maize(Zea mays L.)ear growth[J].JournalofExperimentalBotany,2012,63(14): 5275-5288.
[26]Nan G L,Ronceret A,Wang R C,et al.Global transcriptome analysis of two ameiotic1 alleles in maize anthers: Defining steps in meiotic entry and progression through prophaseⅠ[J].BMC Plant Biology,2011,11(1):120.
[27]Zhang M,Zhao H,Xie S,et al.Extensive,clustered parental imprinting of protein-coding and noncoding RNAs in developing maize endosperm[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(50):20042-20047.
[28]Ruan Y L,Jin Y,Yang Y J,et al.Sugar input,metabolism,and signaling mediated by invertase:Roles in development,yield potential,and response to drought and heat[J].Molecular Plant,2010,3(6):942-955.
QTL Mapping of Seed Germination Traits under Different Temperature Conditions Using Recombinant Inbred Lines of Maize
HAN Zanping1,2,CHEN Yanhui2,LIU Haiying2,ZHAO Ruifang2,GUO Shulei3
(1.Agricultural College,Henan University of Science and Technology,Luoyang 471003,China; 2.Agricultural College,Henan Agricultural University,Zhengzhou 450002,China; 3.Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
Two recombinant inbred lines(RILs)populations which were obtained from Yu 537A×Shen 137 and Yu 82×Shen 137 and contained 420 family lines were used as materials,two high-density molecular linkage maps were constructed using single nucleotide polymorphism(SNP)molecular marker technology.Through composite interval mapping method,the QTLs of seed vigor-related morphological and physiological traits were detected,including percentage of germination(GP),germination energy(GE),germination index(GI),vigor index(VI),seedling length(SL),seedling dry weight(SDW),root dry weight(RDW).Sixty-four QTLs for seed vigor-related traits were detected in the two connected RILs population in normal and low temperature conditions.The results showed that twenty-four QTLs were found inthe population based on Yu 82×Shen 137,and were located on chromosomes 1,2,3,4,5,6,7 and 10,with the explanation of phenotypic variation of a single QTL from 5.61%to 11.01%.Others fourty QTLs were found in the population based on Yu 537A×Shen 137,and located on all chromosomes except 2,with the explanation of phenotypic variation of a single QTL from 5.39%to 11.92%.Six mQTLs were identified on chromosomes 3,5,7 and 10 by meta-analysis,and twenty-five initial QTLs were integrated,the consolidation ratio was 39.1%.Each mQTL contained 4.17 QTLs on average,involved in the regulation of two to four traits,including VI,SDW,RDW,GE,mQTL3-2 contained 7 QTLs.Thirty-five candidate genes were located in 6 mQTLs corresponding SNP marker distribution ranges,which involved in the regulation of seed germination,plant development,growth metabolic pathways,signal transduction,withstanding adversity and so forth.
maize;recombinant inbred lines;temperature;germination trait;QTL mapping
S513
A
1004-3268(2017)07-0009-10
2017-01-26
国家自然科学基金项目(U1504315);河南科技大学青年基金项目(2015QN031);河南科技大学科研启动基金项目(13480067)
韩赞平(1975-),男,河南孟津人,副教授,博士,主要从事玉米遗传改良研究。E-mail:hnlyhzp@163.com

