铁皮石斛灰霉病病原学初步研究
王连平,方 丽,谢昀华,王汉荣
(浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
铁皮石斛灰霉病病原学初步研究
王连平,方 丽,谢昀华,王汉荣*
(浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
2013—2014年,从浙江乐清、新昌、建德、富阳、龙游等石斛产区采集感染灰霉病的铁皮石斛病叶,从中分离纯化出真菌分离物,对分离物的培养性状和繁殖体特征进行观测。取10株分离物进行离体和盆栽致病性试验,从盆栽致病植株上采集病叶,分离并观测分离物。结果显示,从产区采集的铁皮石斛病叶上分离到的真菌分离物是灰葡萄孢霉(BotrytiscinereaPers.ex Fr.),10株分离物均对离体和盆栽石斛叶片致病,从盆栽致病植株上采集的病叶能分离出与原接种分离物相同的真菌。根据科赫氏法则,石斛灰霉病的病原是灰葡萄孢霉,是一种石斛新病害。
铁皮石斛; 灰霉病; 病原
铁皮石斛(DeudrobiumofficinaleKimura et Migo)是一种名贵的兰科中药材。现在铁皮石斛野生资源极少,主要以人工栽培为主,特别是工厂化设施栽培,主要来源地有浙江、云南、安徽、贵州、江西等。据报道,石斛主要病害有炭疽病、黑斑病、软腐病、自绢病、茎基腐病等[1-5]。近年来,灰霉病在浙江省主要石斛产区频繁发生,一般叶发病率25%,有时可高达90%,是一种危害人工栽培石斛的重要病害。为明确该病的发病规律,进而提出该病的防治方法,本文对该病害进行了较系统的病原学研究,现将初步研究结果报道如下。
1 材料与方法
1.1 病害标样采集
石斛灰霉病病样采集于浙江乐清、新昌、建德、富阳、龙游等地;采样后将标样稍作阴干,置于信封中带回实验室分离。
1.2 病原菌的分离纯化
用PDA培养基进行常规组织分离,于25 ℃培养纯化获得菌株。人工接种后,采集病样,经相同方法分离获得菌株[6]。
1.3 病原菌的培养性状
选取分离物FD13-12,观测其主要培养性状。将分离物接种于PDA培养基,25 ℃培养20 d,记录菌落形态、颜色和子实体产生情况;测量100个分生孢子的大小,重复3次,计算平均值[6]。
1.4 致病性测定
选取FD13-12等10株分离物进行致病性测定。各供试分离物在PDA培养基上培养产生分生孢子,用毛笔刷取孢子并与0.1% CMC-Na水溶液混合均匀制成菌悬液,用0.1% CMC-Na水溶液稀释菌悬液至其含菌量为106·mL-1,该菌悬液是本试验用的接种体。
离体接种试验。摘取外观健康的石斛中位叶(除去心叶及其下一位叶和末位叶)进行试验。在直径90 mm培养皿底垫3层用无菌水浸湿的滤纸,随机取叶片排放在滤纸上,在每片叶的两端盖上湿的脱脂棉,每皿5叶。伤口接种试验处理在叶片中央用针头穿刺1个小孔。在每张叶片中央滴加20 μL接种体菌悬液,每个分离物无伤口和有伤口接种试验均涂6个培养皿共30片叶;对照用清水涂布叶片。将接种处理培养皿置28 ℃、5 000 lx光照生化培养箱内,观察并记录发病情况。
盆栽接种试验。取健康中位叶用印泥标记作接种叶,用毛笔将接种体菌悬液均匀涂布在接种叶上,每个分离物无伤口和有伤口接种试验均涂100个叶片;对照用清水涂布叶片。接种处理的植株在湿布围成的保湿棚中保湿48 h后移去保湿棚,7 d后观察记录发病情况。每个病原分离物接种处理均采3片病叶,采用1.2节方法分离病原物,采用1.3节方法对新分离物与原分离物进行性状对比。
2 结果与分析
2.1 症状
灰霉病主要侵染铁皮石斛的叶片及嫩茎。叶片染病后病斑初呈淡褐色至黑褐色的小点,后小点渐渐扩大,有时呈轮纹状,病斑与绿色叶片的病健交界处常有褐色至深褐色的晕圈;病斑圆形或椭圆形,淡褐色至黑褐色,中间凹陷,最大病斑可达铁皮石斛叶片的边缘。深秋、冬季和早春石斛发病后叶片常发黄,或枯死,或脱落。发黄的石斛病叶常常带有橘红色,而其上病斑则呈淡褐色至黑褐色,病斑与发黄叶部交界处常常有或深或浅的绿色晕圈;病斑上,尤其是病斑中心常长有灰褐色的霉层,即病原菌的分生孢子。这些发黄的石斛病叶轻轻碰触,即可脱落。在深秋、冬季和早春田间湿度高时,叶片、嫩梢以及枯黄的叶片有时会出现大量水渍状的湿腐,并在病斑上产生大量的灰褐色的霉层,即病原菌的分生孢子(图1)。

左上图为褐色至深褐色的晕圈;右上图为或深或浅的绿色晕圈;左下图为水渍状的湿腐;右下图为分生孢子图1 铁皮石斛灰霉病为害症状
2.2 病原菌的形态及培养性状
培养基上菌落圆形、白色,营养菌丝半透明、稀疏,气生菌丝较少。培养4 d后菌落直径达到45 mm,培养11 d左右中间部位呈现灰色,后期出现黑色不规则菌核。
该菌较易产生分生孢子,其产孢量较大。分生孢子单胞,圆形或椭圆形,无色至淡灰褐色,大小7.5~10.8 μm ×4.8~9.6 μm,成簇聚生于分生孢子梗末端的膨大部。分生孢子梗丛生,直立或稍弯曲,大小192.5~387.6 μm×9.7~13.4 μm,淡褐色有隔膜。经鉴定,该真菌属半知菌亚门丛梗孢目丛梗孢科葡萄孢属灰葡萄孢霉(BotrytiscinereaPers.ex Fr.)。
2.3 致病性
从2013—2014年采自温州乐清、绍兴新昌、杭州建德、杭州富阳、衢州龙游等病样分离物中,选取10株分离物进行离体试验和盆栽试验测定其致病性。离体接种试验结果显示,10株供试分离物均对石斛叶片致病,无伤口接种的叶发病率86.7%~96.7%,有伤口接种的叶发病率90.0%~100%。采集自不同地区的分离物致病性有一定差异(表1)。
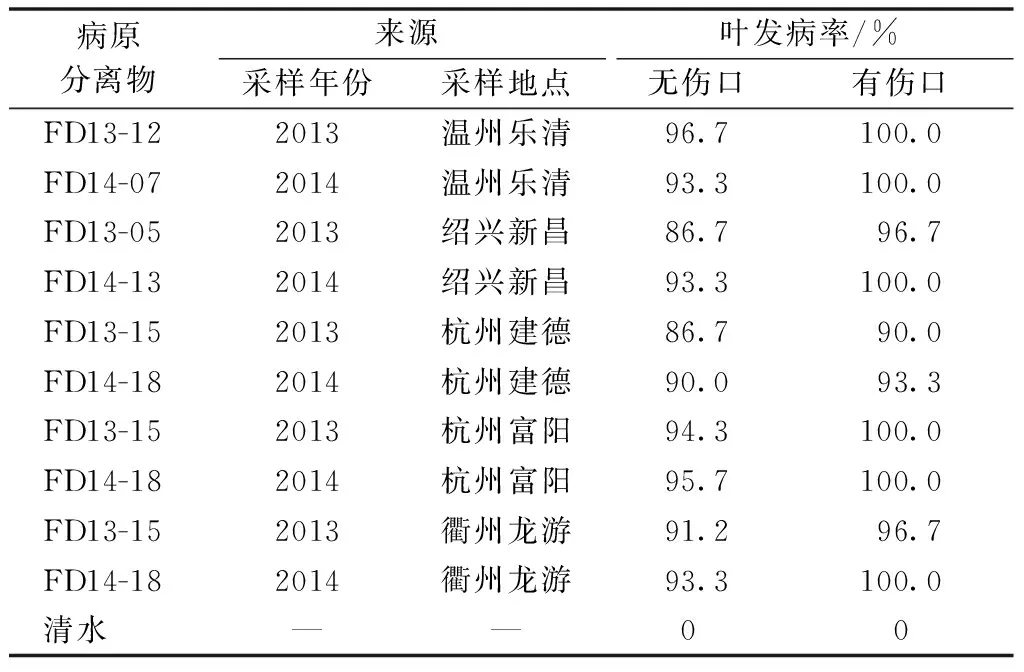
表1 浙江各石斛产区灰葡萄孢霉分离物 致病力测定(离体试验)
盆栽接种试验结果显示,10株供试分离物均对石斛叶片致病,无伤口接种的叶发病率80%~91%,有伤口接种的叶发病率84%~100%,有伤口接种的叶发病率高于无伤口接种,采集自不同地区的分离物致病性有一定差异(表2)。每个分离物接种处理均采3片病叶,从中均能分离到灰葡萄孢霉。该灰葡萄孢霉分离物与原用于接种的灰葡萄孢霉分离物在PDA培养基上的培养性状和繁殖体形态特征相同,说明2种分离物是同一分离物。
3 小结与讨论
3.1 石斛灰霉病的分离物鉴定
根据对石斛灰霉病分离物的培养性状和形态特征观测,参照魏景超等[7-9]的描述,石斛灰霉病的分离物被鉴定为灰葡萄孢霉,属半知菌亚门、丛梗孢目、丛梗孢科、葡萄孢属。

表2 浙江各石斛产区灰葡萄孢霉分离物 致病力测定(盆栽试验)
3.2 石斛灰霉病的病原确定
从石斛灰霉病病样中分离到灰葡萄孢霉,用该分离物成功诱发出灰霉病,从诱发出灰霉病的病样中分离到与原分离物形态特征一致的灰葡萄孢霉。根据柯赫氏法则,石斛灰霉病的病原为灰葡萄孢霉。据报道,该病原的寄主范围极为广泛,几乎可以寄生所有的双子叶植物[8-9],但在铁皮石斛上尚未见明确的报道。
3.3 石斛灰霉病发生原因探讨
石斛需要温暖潮湿、散射光等生长条件,而这些条件也是多数病害发生的适宜条件,在自然状态下,由于植株密度小,灰霉病发生相对较少、较轻;但在人工栽培条件下,灰霉病则多发、重发。人工栽培石斛灰霉病多发、重发的原因可能有以下3个方面:1)人工栽培石斛密度远高于自然状态;2)人工栽培相对密闭的环境及增湿等栽培措施有利于形成灰霉病发生所需的高湿和结露的条件;3)人工栽培所采用的增肥等促进石斛快速生长的栽培措施很可能降低植株对灰霉病的抗病性。
[1] 张敬泽, 郑小军. 铁皮石斛黑斑病病原菌的鉴定和侵染过程的细胞学研究[J]. 植物病理学报, 2004, 34(1): 92-94.
[2] 李静, 张敬泽, 吴晓鹏, 等. 铁皮石斛疫病及其病原菌[J]. 菌物学报, 2008, 27(2): 171-176.
[3] 邱道寿, 刘晓津, 郑锦荣, 等. 棚栽铁皮石斛的主要病害及其防治[J]. 广东农业科学, 2011 (增刊1): 126-128.
[4] 李向东, 王云强, 王卉, 等. 金钗石斛和铁皮石斛软腐病原菌的分离和鉴定[J]. 中国药学杂志, 2011 (4): 249-252.
[5] 李戈, 李荣英, 高微微. 药用石斛规模化种植中的病害问题及防治策略[J]. 中国中药杂志, 2013, 38(4): 485-488.
[6] 张翊, 桑维钧, 梁郡驿. 金钗石斛炭疽病病原鉴定及杀菌剂毒力测定[J]. 湖北农业科学, 2014, 53(14): 3307-3309.
[6] 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998.
[7] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
[8] 张中义. 中国真菌志: 第二十六卷 葡萄孢属柱隔孢属[M]. 北京: 科学出版社, 2006.
[9] 何永宏. 我国灰葡萄孢的新寄主植物[J]. 云南农业大学学报:自然科学, 2002.
(责任编辑:侯春晓)
2017-04-24
乐清院士工作站和院地合作项目(wz20130006);浙江省特色农产品全产业链安全风险管控项目(201303088)
王连平(1965—),男,副研究员,从事植保技术研究工作,E-mail:wlp8843@163.com。
王汉荣,E-mail: wanghrg@126.com。
10.16178/j.issn.0528-9017.20170626
S567.23+9
A
0528-9017(2017)06-0990-03
文献著录格式:王连平,方丽,谢昀华,等. 铁皮石斛灰霉病病原学初步研究[J].浙江农业科学,2017,58(6):990-992.

