头颈部鳞癌术后辅助放化疗的研究现状
陆雪官,胡超苏
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海200032
头颈部鳞癌术后辅助放化疗的研究现状
陆雪官,胡超苏
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海200032

陆雪官,复旦大学附属肿瘤医院放疗科头颈组主任医师,博士研究生导师。目前任中华放射肿瘤学会青年委员,中国医师协会脑胶质瘤放射治疗专业委员会委员和《国际肿瘤学杂志》编委。先后主持和参与国家和省部级科研项目6项,以第一或通信作者发表相关学术论文50余篇,其中SCI论文18篇。
临床研究显示,术后放化疗能够提高头颈部鳞癌术后高危患者的治疗疗效。放疗实施时需根据原发肿瘤部位、临床分期、术后病理和术后影像学评估情况来确定照射靶区和剂量。目前临床上推荐放疗同步应用单药顺铂方案已经达成共识,而放疗同步联合其他化疗药物和(或)表皮生长因子受体(epidermal growth factor receptor,EGFR)单抗的疗效则仍不确定。人乳头状瘤病毒(human papillomavirus,HPV)阳性口咽癌具有独特的生物学特性,其术后放化疗适应证和辅助放化疗的治疗模式至今仍不明确,值得深入研究。
头颈部肿瘤;鳞癌;放疗;化疗;分子靶向治疗
根据2017年美国癌症学会统计,美国年新发头颈部恶性肿瘤患者49 670例,占所有新诊断肿瘤患者的2.94%,其中男性新诊断患者占所有男性患者的4%[1]。我国国家肿瘤登记中心统计了2009—2011年全国部分地区的肿瘤发病率,结果显示,唇、口腔和咽部(不包括鼻咽)肿瘤的发病率为48.1/100 000,喉部肿瘤的发病率为26.4/100 000[2]。通常头颈部鳞癌是指除鼻咽癌和皮肤鳞癌之外的来源于头颈部各个部位的鳞癌,包括口腔、口咽、喉和下咽部位的鳞癌。治疗具有挑战性,因为一方面,头颈部集中了诸多控制吞咽和发音功能的重要器官,治疗时需要尽量保护这些器官的功能,以最大限度地提高患者治疗后的生活质量;另一方面,超过50%的头颈部鳞癌确诊时为临床Ⅲ/Ⅳ期,需要从事不同专业的头颈部肿瘤医师进行多学科协作,根据病情制定个体化的诊疗方案。目前,手术仍是治疗头颈部鳞癌最重要的手段之一,对于存在高危因素的患者应予以术后辅助放化疗[3]。本文拟对局部晚期头颈部鳞癌术后辅助放化疗的研究现状进行综述。
1 术后辅助放化疗的指征
目前美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)推荐的术后放疗指征为:手术切缘阳性、淋巴结包膜外侵犯、原发肿瘤pT3或pT4、淋巴结N2或N3、原发口腔癌或口咽癌患者存在Ⅳ区或Ⅴ区淋巴结转移、神经受侵或脉管癌栓[4]。有研究发现,对于不存在上述高危因素的患者,单纯手术后的5年局部复发率仅为10%,而对于有淋巴结包膜外侵犯或存在2个及以上危险因素的患者,尽管接受了手术和术后放疗,其5年局部复发率和生存率分别为32%和42%[3]。
为进一步提高这部分存在术后高危因素患者的治疗疗效,临床医师们开始尝试在术后辅助放疗的基础上联合同步化疗。目前,在这方面已发表的最重要的两个临床研究分别是RTOG 95-01和EORTC 22931试验。RTOG 95-01试验共入组459例头颈部鳞癌术后患者,入组标准:有2个及以上的淋巴结转移、淋巴结包膜外侵犯和切缘阳性。所有患者被随机分为单纯放疗组和同步放化疗组(化疗方案为单药顺铂100 mg/m2,第1、22和43天给药)。中位随访时间45.9个月,结果显示,同步放化疗组的局部区域控制率和无病生存率显著优于单纯放疗组,HR分别为0.61(95%CI:0.41~0.91)和0.78(95%CI:0.61~0.99);两组的总生存率差异无统计学意义,HR为0.84(95%CI:0.65~1.09)[5]。EORTC 22931试验共入组334例头颈部鳞癌术后放疗患者,入组标准:淋巴结包膜外侵犯、切缘阳性、临床分期为Ⅲ或Ⅳ期、原发口腔癌或口咽癌患者存在Ⅳ区或V区淋巴结转移、神经受侵或脉管癌栓。研究分组和治疗方案同RTOG 95-01试验一致。随访结果显示,同步放化疗组的5年局部区域复发率显著低于单纯放疗组(18% vs 31%,P=0.007);同步放化疗组的5年肿瘤无进展生存率和总生存率显著优于单纯放疗组(47% vs 36%,P=0.04;53% vs 40%,P=0.02)[6]。随后Bernier等[7]对上述2个临床试验进行了比较性分析,发现仅有切缘阳性和有淋巴结包膜外侵犯的患者能从术后同步放化疗中获益。因此,目前NCCN推荐的术后同步放化疗的指征为:术后切缘阳性和有淋巴结包膜外侵犯。2012年Cooper等[8]报告了RTOG 95-01临床试验的长期随访结果,亚组分析显示,对于有淋巴结包膜外侵犯和切缘阳性的患者,同步放化疗组的10年局部区域失败率显著低于单纯放疗组(21.0% vs 33.1%,P=0.02);同步放化疗组的10年无病生存率和总生存率均优于单纯放疗组(18.4% vs 12.3%,P=0.05;27.1% vs 19.6%,P=0.07),为对切缘阳性和有淋巴结包膜外侵犯患者采用术后同步放化疗治疗进一步提供了循证医学证据。
但是有学者对NCCN推荐的口咽癌术后同步放化疗的指征提出了质疑,因为上述研究入组的口咽癌患者并没有考虑其人乳头状瘤病毒(human papillomavirus,HPV)感染的状态[9]。对于存在术后切缘阳性和有淋巴结包膜外侵犯的HPV阳性口咽癌患者接受术后同步放化疗的作用并不能肯定,因此需要开展临床研究予以证实。
2 术后辅助放疗的实施
头颈部鳞癌术后辅助放疗实施时需要考虑的问题包括手术至放疗开始的合适时间、术后肿瘤情况影像学评估手段、放疗靶区定义和勾画、分割剂量和照射总剂量的确定以及一些特殊的注意点,如术后皮瓣和假体植入对放疗实施的影响等。
2.1 手术至放疗开始的合适时间
目前,NCCN推荐放疗的开始时间应在手术后6周内[4]。Huang等[10]通过对已发表的文献进行系统性分析后发现,术后超过6周接受放疗的头颈部鳞癌患者的5年局部复发率要显著高于术后6周内接受放疗的患者(OR=2.89,95%CI:1.60~5.21)。同样,Chen等[11]也对已发表的文献进行系统性分析后发现,术后放疗开始时间每延长1个月,局部复发风险就增加1.28倍(95%CI:1.08~1.52)。Ang等[12]的研究发现,总治疗时间小于11周、11~13周和大于13周患者的5年局部控制率分别为76%、62%和38%(P=0.002),5年总生存率分别为48%、27%和25%(P=0.03)。上述研究结果提示,总治疗时间(从手术开始到放疗结束的总时间)也是影响头颈部鳞癌治疗疗效的重要预后因素,存在高危复发因素的头颈部鳞癌患者手术后应尽快开始接受术后放化疗,且放疗疗程不应无故中断或延长。
2.2 手术后放化疗前肿瘤情况影像学评估
影像学评估手段包括CT、MRI和PET/CT。相较于CT,MRI有更好的软组织分辨率,故临床上推荐首选MRI来评估。但是,部分患者在术后4~6周内获取的MRI图像要分辨术后改变和肿瘤残留或复发比较困难。因此,可以考虑在行MRI常规扫描序列的同时补做功能性MRI加以鉴别,如弥散成像和MRI波谱分析等[13]。另外,目前PET/CT也被推荐应用于手术和(或)放化疗后的疗效评价。一般认为合适的检查时间应在手术后2~3个月之后,因为如果距手术的时间太短进行检查,PET/CT图像的假阳性率则较高[14]。但是,也有研究提示,在术后放化疗前(手术后4周左右)行PET/CT检查有助于治疗方案的优化。Shintani等[15]对已行头颈部肿瘤全切手术且拟行术后放化疗的91例患者行PET/ CT检查后发现,24例(26.4%)有大于等于1个的异常高代谢病灶,其中11例穿刺证实有肿瘤细胞存在,对14例的初始治疗方案进行了调整,包括放弃放疗、放疗靶区和剂量进行调整、再次手术和改为姑息化疗等。Liao等[16]和Dutta等[17]的研究也发现了类似的结果。
2.3 放疗靶区的确定
头颈部鳞癌术后放疗靶区的确定要求放疗科医师了解手术方式、详细的手术记录、手术边界和皮瓣使用情况等,同头颈外科医师充分沟通[18]。参考已有文献[19]并且结合复旦大学附属肿瘤医院的临床实践,本院推荐的靶区定义如下:① GTVp或GTVln:指术后残留的原发病灶或淋巴结包膜外侵犯区域;② CTV1(原发病灶高危亚临床区域):包括原发肿瘤手术瘤床、毗邻肿瘤但未被直接累及的区域;③CTV2(颈部淋巴结高危亚临床区域):有颈部淋巴结转移的区域和相邻的淋巴结引流区,对有颈部淋巴结包膜外侵犯者(特别是经病理学证实者),CTV2边缘需更靠近皮肤表面,病理学不能提供具体淋巴结包膜外侵犯阳性的颈淋巴结区域时,建议参考术前CT和(或)MRI,勾画时更贴近皮肤表面,当病理阳性淋巴结侵犯肌肉时,建议将该肌肉包括在CTV2内;④ CTV3(颈部淋巴结低危亚临床区域):包括影像学和病理未受累的颈部淋巴结区域,可认为是选择性颈部淋巴结区域或颈部淋巴结预防区域。颈部淋巴结预防性照射的范围需根据肿瘤原发病灶的部位、侵犯范围(包括是否超越中线)和分期及淋巴结转移的部位和分期而定,目前推荐的具体照射范围见表1。但其中有关部分原发病灶位于一侧的口腔癌和口咽癌的患者,主要是T分期比较晚或同侧颈部存在淋巴结转移的患者,有研究建议可仅行单侧颈部淋巴引流区照射。Vergeer等[19]回顾性分析了123例原发病灶位于一侧的口腔鳞癌和口咽鳞癌患者的手术联合术后辅助放化疗的疗效,其中原发病灶属T3-4期者有53例,淋巴结转移属N1-2b期者有50例。所有患者仅接受了原发病灶瘤床和单纯同侧颈部淋巴引流区照射,结果发现,对侧颈部出现淋巴结转移者有7例(6%),N0、N1-2a和N2b患者的5年对侧颈部淋巴结控制率分别为99%、88%和73%,71%对侧颈部淋巴结转移的患者得到了成功的挽救性治疗。同样,Rackley等[20]分析了81例接受手术和术后放疗的T1-2N0-2b期的扁桃体鳞癌患者的疗效,颈部仅行单纯淋巴引流区照射,随访结果显示,5年总生存率、疾病无进展生存率和局部控制率分别为91.0%、93.0%和95.4%。因此,这部分患者的颈部淋巴引流区照射范围值得进一步研究加以优化。
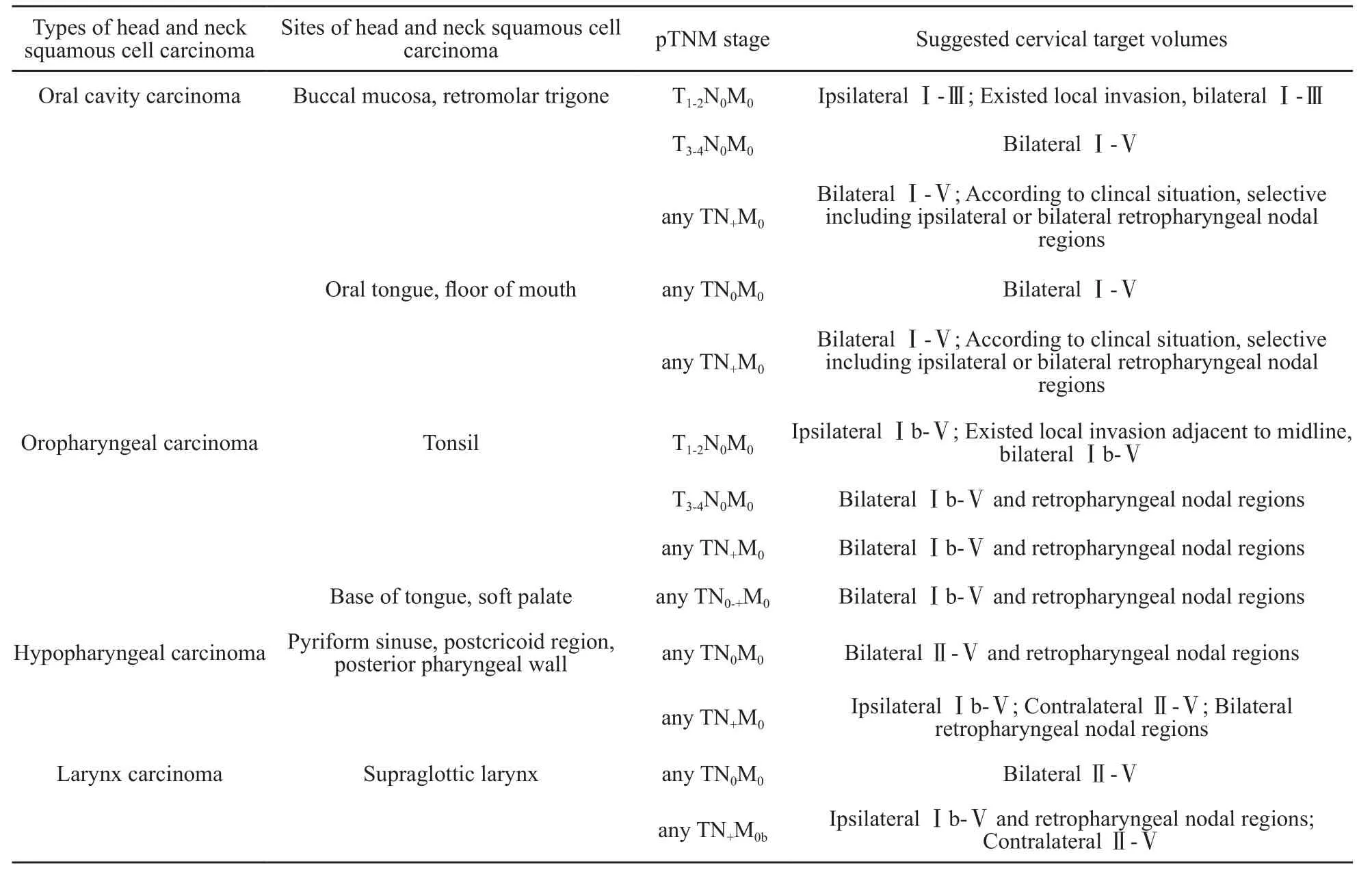
表1 目前头颈部鳞癌术后推荐的颈部淋巴结预防性照射范围Tab. 1 Suggested cervical target volumes of postoperative radiotherapy for head and neck squamous cell carcinoma
2.4 照射剂量
在常规分割(每次1.8~2.0 Gy)的条件下,推荐GTVp和GTVln给予66.0~70.0 Gy,CTV1和CTV2给予60.0 Gy,CTV3给予50.0~55.0 Gy的照射。
目前,头颈部鳞癌采用非常规分割放疗较常规分割放疗并没有显示出显著的优势。RTOG 0129 Ⅲ期随机临床试验比较了临床Ⅲ~Ⅳ期头颈部鳞癌分别采用术后加速放疗(72.0 Gy/42次,共6周,其中常规分割32.4 Gy/18次,之后每天照射2次,分别为1.8和1.5 Gy)联合同步化疗(n=360)和术后常规分割放疗(70.0 Gy/35次,共7周)联合同步化疗(n=361)的疗效。随访结果显示,两组的8年的生存率、疾病无进展生存率和局部区域失败率差异均无统计学意义(48% vs 48%,P=0.37;41% vs 42%,P=0.52;39% vs 37%,P=0.78);并且两组3~5级的急性反应和晚期毒性差异无统计学意义[21]。
2.5 皮瓣移植和假体植入对放疗实施的影响
由于头颈部肿瘤,特别是口腔颌面部恶性肿瘤接受根治性手术后会引起明显的骨和软组织缺损,导致功能缺失和面部外形改变,因此,部分患者需要接受皮瓣移植和假体植入手术。有研究显示,术后放疗对植入皮瓣的存活没有显著影响,但也有研究提示,放疗会导致游离皮瓣移植的手术床的并发症发生率上升和严重程度增加。因此,在放疗时应尽量减少移植皮瓣的照射。Bittermann等[22]通过对口腔癌患者在手术中放置钛夹标记出手术切缘边界,随后根据标记出的手术边界确定瘤床的放疗靶区,同时勾画出游离皮瓣以便在做放疗计划时减少其照射剂量。但目前仍缺乏临床研究数据证实这种靶区勾画方法的疗效及是否对局部控制率有影响。
一部分头颈部鳞癌患者在接受根治性手术的同时施行了假体的植入。有研究显示,高剂量放疗可能会影响假体与骨组织的融合和增加假体临近骨组织放射性坏死的可能性[23]。此外,从入射线角度来看,金属假体分别会增加和降低位于其前缘和后缘照射靶区的剂量,而照射剂量的不足可能导致肿瘤的复发[24]。但现在应用的调强放疗技术所采用的从多个角度进行的多野照射弥补了这方面对剂量分布产生的不利效应[25]。
3 术后放疗联合化疗和分子靶向药物的应用
现有临床证据显示,术后单纯辅助化疗并不能使头颈部鳞癌患者获益[3],且术后序贯辅助放化疗的疗效并不优于单纯辅助放疗。而术后同步放化疗则能提高具有高危复发因素(术后切缘阳性和有淋巴结包膜外侵犯)头颈部鳞癌患者的疗效。目前NCCN指南推荐的术后辅助同步化疗的方案是单药顺铂,单次总剂量100 mg/m2,每3周重复1次[4]。
同时,也有研究尝试采用每周小剂量顺铂(25~50 mg/m2)同步联合放疗。Oosting等[26]和Tsan等[27]的研究均显示,术后放疗同步联合每周小剂量顺铂的治疗方案所致的不良反应(特别是口腔黏膜炎)发生率和严重程度要高于放疗同步联合每3周应用顺铂的方案。其主要原因之一可能是每周应用较每3周应用时,整个疗程所用顺铂的总累积剂量更高。目前仍不清楚哪种放疗同步联合顺铂的治疗方案更优。Geiger等[28]的回顾性研究显示,术后放疗同步联合每3周应用顺铂的方案较每周应用顺铂的方案对Ⅲ~Ⅳ期头颈部鳞癌的3年总生存率有提高的趋势(84.0% vs 75%)。但每周应用顺铂组的患者年龄大、HPV阳性率低和吸烟者多,这可能是导致这部分患者预后差的主要原因。Espeli等[29]的研究发现,顺铂的总累积剂量大于等于240 mg/m2则有更好的总生存期。自2012年日本启动了具有高危因素的头颈部鳞癌术后放疗同步联合每周应用顺铂(40 mg/m2,共用7次)对比每3周应用顺铂(100 mg/m2,共用3次)的非劣效性Ⅱ/Ⅲ期随机临床试验,主要观察终点是治疗的完成率和总生存率[30]。未来这个研究结果将会给我们一个比较明确的答案,究竟放疗同步联合顺铂的方案哪一种更优。
也有研究试图采用卡铂同步联合放疗。Argiris等[31]主持的一项Ⅲ期随机临床试验比较了对具有高危病理特点(大于等于3个转移淋巴结、淋巴结包膜外侵犯、神经和脉管侵犯、切缘阳性)的Ⅲ~Ⅳ期头颈部鳞癌分别采用术后单纯放疗和放疗同步联合卡铂(每周剂量100 mg/m2)治疗的疗效,结果发现,两组的5年无疾病生存率和总生存率差异均无统计学意义(53% vs 49%,P=0.72;47% vs 41%,P=0.61)。但由于该试验的入组患者太慢,仅入组72例后试验就关闭了,因此本临床试验得出的结论并不可靠。另外,Smid等[32]比较了114例具有术后高危因素(淋巴结包膜外侵犯、神经和脉管侵犯、切缘阳性)的头颈部鳞癌分别采用术后单纯放疗和放疗同步联合丝裂霉素和博来霉素(每周剂量100 mg/m2)治疗的疗效,结果同步放化疗组的2年总生存率显著优于单纯放疗组(74% vs 64%,P=0.036)。
近10余年来,以西妥昔单抗为代表的表皮生长因子受体(epidermal growth factor receptor,EGFR)单抗靶向药物同步联合放疗在治疗局部晚期头颈部鳞癌中的疗效得到了肯定。在此基础上,有一些临床研究开始探讨EGFR单抗同步联合术后辅助放化疗治疗头颈部鳞癌是否能够获益。目前,已经报道的研究结果主要集中在同步放化疗的基础上加用靶向药物治疗方面。RTOG 0234 Ⅱ期临床试验观察了术后同步放化疗联合西妥昔单抗治疗头颈部鳞癌高危患者的安全性和初步疗效,同步应用的化疗药物分别是顺铂和多西他赛,结果显示,该方案的4、5级非血液学不良反应发生率为10.6%,较RTOG 9501的15%有所降低。顺铂组和多西他赛组的2年无瘤生存率分别为57%和66%,提示术后同步放化疗联合西妥昔单抗的方案安全可行[33-34]。Ferris等[35]主持的Ⅱ期临床试验对HPV阴性的Ⅲ~Ⅳ期头颈部鳞癌的高危(切缘小于1 mm、淋巴结包膜外侵犯、神经或脉管受侵、大于等于2个转移淋巴结)患者在术后放疗时每周同步应用顺铂和帕尼单抗,共有46例患者入组,其中可用于评价的有44例,2年的无进展生存率和总生存率分别为70%和72%,32%的患者出现3级或3级以上的不良反应,提示该治疗方案的耐受性较好,且有提高这部分患者疗效的趋势。而Harrington等[36]开展的Ⅲ期临床试验将手术后的Ⅱ~ⅣA期头颈部鳞癌(切缘小于等于5 mm、淋巴结包膜外侵犯)患者随机分为2组,一组放疗同步联合每3周单药顺铂化疗,另一组在同步放化疗的基础上同时每天应用针对EGFR/ErbB2的小分子酪氨酸酶抑制剂拉帕替尼,随后单药物维持治疗12个月,结果显示,两组的中位无进展生存期并无显著差异(HR=1.10,95%CI:0.85~1.43),且拉帕替尼组的严重不良反应较未用组高(48% vs 40%),提示在同步放化疗的基础上加用拉帕替尼不但不能给患者带来更多获益,反而增加了治疗相关不良反应。
至今尚无头颈部鳞癌高危患者采用术后放疗同步联合EGFR单抗与单纯放疗疗效相比较的前瞻性临床研究报告,也没有术后放疗同步联合EGFR单抗与同步放化疗头对头比较的研究报道。目前RTOG正在开展对具有中度危险因素的头颈部鳞癌患者采用术后单纯放疗和放疗同步联合西妥昔单抗的Ⅲ期临床对照试验(RTOG 0920),预计入组700例患者[37]。
4 HPV阳性头颈部鳞癌术后辅助放化疗的临床实践
近10余年来,HPV感染作为一个病源性因素在头颈部肿瘤中得到了比较深入的探讨。现认为在美国有约70%的口咽癌发病与HPV感染有关。与HPV阴性的口咽癌相比,HPV阳性的患者对放化疗的应答率更高,预后更好[38]。因此,目前正在开展一些临床研究,如RTOG 1016[39]和NRG HN-002[40]等,来探讨对这部分HPV阳性的口咽癌患者降低治疗强度的可能性。在此基础上,也有研究观察了HPV感染状态在头颈部鳞癌手术联合术后辅助放化疗患者中的预后价值。DKTK-ROG研究单因素分析结果显示,HPV阳性是预测头颈部鳞癌术后患者局部区域控制率的重要预后因子,而多因素分析结果显示,HPV感染状态的预后价值主要表现在口咽鳞癌的患者中[41]。Heiduschka等[42]的研究也发现,HPV阳性口咽癌患者的总生存率和无疾病生存率要显著于HPV阴性者。
最近有回顾性研究提示一些头颈部鳞癌的传统高危因素,如淋巴结包膜外侵犯和近切缘阳性(小于0.5 cm),在HPV阳性的口咽癌中可能并不是高危因素,因为这些因素的存在对HPV阳性口咽癌的局部复发率和生存率并无显著影响[43-47]。因此,有研究尝试对存在高危因素(淋巴结包膜外侵犯和近切缘或切缘阳性)的HPV阳性口咽癌患者降低术后放疗剂量,共有175例患者入组。结果发现,低剂量(60 Gy)和高剂量(66 Gy)放疗组的2年局部区域无复发生存率差异无统计学意义(98.5% vs 98.1%,P=0.421)[48]。另外,现在也有临床研究(如ADEPT、NCT01687413)正在探讨对这部分存在高危因素的HPV阳性口咽癌患者在术后放疗时是否可以省略同步化疗。
5 展望
对存在术后高危因素的头颈部鳞癌患者给予术后辅助放化疗已经达成共识。但仍存在一些问题值得探讨:① 通过临床因素、多模态影像学和生物分子信息进一步精准地筛选出行术后辅助放化疗和(或)分子靶向药物可能获益的患者;② 术后同步放化疗时,化疗药物和用药方式的优化选择,目前临床上推荐的放疗同步单药顺铂100 mg/m2仅有约60%的患者能顺利完成[3];③ HPV阳性口咽癌作为一种不同于其他头颈部鳞癌的肿瘤类型,它具有独特的生物学特性。其术后放疗适应证、术后辅助放化疗和(或)分子靶向药物的治疗模式至今仍不明确,值得深入研究。
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30.
[2] CHEN W, ZHENG R, BAADE P D, et al. Cancer Statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[3] KIYOTA N, TAHARA M, FUJII M. Adjuvant treatment for post-operative head and neck squamous cell carcinoma[J]. Jpn J Cin Oncol, 2015, 45(1): 2-6.
[4] National Comprehensive Cancer Network. NCCN guideline for head and neck cancer care[EB/OL]. www.nccn.org/ professional/physician_gls/PDF/head-and-neck.pdf.
[5] COOPER J S, PAJAK T F, FORASTIERE A A, et al. Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck[J]. N Engl J Med, 2004, 350(19): 1937-1944.
[6] BERNIER J, DOMENGE C, OZSAHIN M, et al. Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer[J]. N Engl J Med, 2004, 350(19): 1945-1952.
[7] BERNIER J, COOPER J S, PAJAK T F, et al. Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (#22931) and RTOG (#9501)[J]. Head Neck, 2005, 27(10): 843-850.
[8] COOPER J S, ZHANG Q, PAJAK T F, et al. Long-term follow-up of the RTOG 9501/Intergroup phase Ⅲ trial: postoperative concurrent radiation therapy and chemotherapy in high-risk squamous cell carcinoma of the head and neck[J]. Int J Radiat Oncol Biol Phys, 2012, 84(5): 1198-1205.
[9] SINHA P, PICCIRILLO J F, KALLOGJERI D, et al. The role of postoperative chemoradiation for oropharynx carcinoma: a critical appraisal of the published literature and National Comprehensive Cancer Network guidelines[J]. Cancer, 2015, 121(11): 1747-1754.
[10] HUANG J, BARBERA L, BROUWERS M, et al. Does delay in starting treatment affect the outcomes of radiotherapy? A systematic review[J]. J Clin Oncol, 2003, 21(3): 555-563.
[11] CHEN Z, KING W, PEARCEY R, et al. The relationship between waiting time for radiotherapy and clinical outcomes: a systematic review of the literature[J]. Radiother Oncol, 2008, 87(1): 3-16.
[12] ANG K K, TROTTI A, BROWN B W, et al. Randomized trial addressing risk features and time factors of surgery plus radiotherapy in advanced head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys, 2001, 51(3): 571-578.
[13] MOORE A G, SRINIVASAN A. Postoperative and postradiation head and neck: role of magnetic resonance imaging[J]. Top Magn Reson Imaging, 2015, 24(1): 3-13.
[14] ZIMMER L A, BRANSTETTER B F, NAYAK J V, et al. Current ues of 18F-fluorodeoxyglucose positron emission tomography and combined positron emission tomography and computed tomography in squamous cell carcinoma of the head and neck[J]. Laryngoscope, 2005, 115(11): 2029-2034.
[15] SHINTANI S A, FOOTE R L, LOWE V J, et al. Utility of PET/ CT imaging performed early after surgical resection in the adjuvant treatment planning for head and neck cancer[J]. Int J Radiat Oncol Biol Phys, 2008, 70(2): 322-329.
[16] LIAO C T, FAN K H, LIN C Y, et al. Impact of a second FDG PET scan before adjuvant therapy for the early detection of residual/relapsing tumours in high-risk patients with oral cavity cancer and pathological extracapsular spread[J]. Eur J Nucl Med Mol Imaging, 2012, 39(6): 944-955.
[17] DUTTA P R, RIAZ N, MCBRIDE S, et al. Postoperative PET/ CT and target delineation before adjuvant radiotherapy in patients with oral cavity squamous cell carcinoma[J]. Head Neck, 2016, 38 Suppl 1: E1285-E1293.
[18] GUTIONTOV S I, SHIN E J, LOK B, et al. Intensitymodulated radiotherapy for head and neck surgeons[J]. Head Neck, 2016, 38 Suppl 1: E2368-E2373.
[19] VERGEER M R, DOORNAERT P A H, JONKMAN A, et al. Ipsilateral irradiation for oral and oropharyngeal carcinoma treated with primary surgery and postoperative radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2010, 78(3): 682-688.
[20] RACKLEY T P, NAMELO W C, PALANIAPPAN N, et al. Unilateral radiotherapy for surgically resected lateralized squamous cell carcinoma of the tonsil[J]. Head Neck, 2017, 39(1): 17-23.
[21] NGUYEN-TAN P F, ZHANG Q, ANG K K, et al. Randomized phase Ⅲ trial to test accelerated versus standard fractionation in combination with concurrent cisplatin for head and neck carcinomas in the Radiation Therapy Oncology Group 0129 trial: long-term report of efficacy and toxicity[J]. J Clin Oncol, 2014, 32(24): 3858-3867.
[22] BITTERMANN G, WIEDENMANN N, VOSS P, et al. Marking of tumor resection borders for improved radiation planning facilitates reduction of radiation dose to free flap reconstruction in head and neck cancer surgery[J]. J Craniomaxillofac Surg, 2015, 43(4): 567-573.
[23] SCHOEN P J, RAGHOEBAR G M, VAN OORT R P, et al. Treatment outcome of bone-anchored craniofacial prostheses after tumor surgery[J]. Cancer, 2001, 92(12): 3045-3050.
[24] WANG R, PILLAI K, JONES P K, et al. Dosimetric measurement of scattered radiation from dental implants in simulated head and neck radiotherapy[J]. Int J Oral Maxillofac Implants, 1998, 13(2): 197-203.
[25] DOH R M, KIM S, KEUM K C, et al. Postoperative irradiation after implant placement: a pilot study for prosthetic reconstruction[J]. J Adv Prosthodont, 2016, 8(5): 363-371.
[26] OOSTING S F, CHEN T W W, HUANG S H, et al. A comparison of weekly versus 3-weekly cisplatin during adjuvant radiotherapy for high-risk head and neck cancer[J]. Oral Oncol, 2016, 59: 43-49.
[27] TSAN D L, LIN C Y, KANG C J, et al. The comparisonbetween weekly and three-weekly cisplatin delivered concurrently with radiotherapy for patients with postoperative high-risk squamous cell carcinoma of the oral cavity[J]. Radiat Oncol, 2012, 7: 215.
[28] GEIGER J L, LAZIM A F, WALSH F J, et al. Adjuvant chemoradiation therapy with high-dose versus weekly cisplatin for resected, locally advanced HPV/p16-positive and negative head and neck squamous cell carcinoma[J]. Oral Oncol, 2014, 50(4): 311-318.
[29] ESPELI V, ZUCCA E, GHIELMINI M, et al. Weekly and 3-weekly cisplatin concurrent with intensity-modulated radiotherapy in locally advanced head and neck cancer[J]. Oral Oncol, 2012, 48(3): 266-271.
[30] KUNIEDA F, KIYOTA N, TAHARA M, et al. Randomized phase Ⅱ/Ⅲ trial of post-operative chemoradiotherapy comparing 3-weekly cisplatin with weekly cisplatin in highrisk patients with squamous cell carcinoma of head and neck: Japan clinical oncology group study (JCOG1008) [J]. Jpn J Clin Oncol, 2014, 44(8): 770-774.
[31] ARGIRIS A, KARAMOUZIS M V, JOHNSON J T, et al. Longterm results of a phase Ⅲ randomized trial of postoperative radiotherapy with or without carboplatin in patients with highrisk head and neck cancer[J]. Laryngoscope, 2008, 118(3): 444-449.
[32] SMID L, BUDIHNA M, ZAKOTNIK B, et al. Postoperative concomitant irradiation and chemotherapy with mitomycin C and bleomycin for advanced head-and-neck carcinoma[J]. Int J Radiat Oncol Biol Phys, 2003, 56(4): 1055-1062.
[33] HARARI P M, HARRIS J, KIES M S, et al. Phase Ⅱrandomized trial of surgery followed by chemoradiation plus cetuximab for high-risk squamous cell carcinoma of the head and neck (RTOG 0234) [J]. Int J Radiat Oncol Biol Phys, 2007, 69(3): S13.
[34] KIES M S, HARRIS J, ROTMAN M Z, et al. Phase Ⅱrandomized trial of postoperative chemoradiation plus cetuximab for high-risk squamous cell carcinoma of the head and neck (RTOG 0234) [J]. Int J Radiat Oncol Biol Phys, 2009, 75(3): S14-S15.
[35] FERRIS R L, GEIGER J L, TRIVEDI S, et al. Phase Ⅱ trial of post-operative radiotherapy with concurrent cisplatin plus panitumumab in patients with high-risk, resected head and neck cancer[J]. Ann Oncol, 2016, 27(12): 2257-2262.
[36] HARRINGTON K, TEMAM S, MEHANNA H, et al. Postoperative adjuvant lapatinib and concurrent chemoradiotherapy followed by maintenance lapatinib monotherapy in high-risk patients with resected squamous cell carcinoma of the head and neck: a phase Ⅲ, randomized, double-blind, placebo-controlled study[J]. J Clin Oncol, 2015, 33(35): 4202-4209.
[37] 钱 薇, 朱国培. 局部晚期头颈部鳞癌术后辅助治疗的进展[J]. 中国癌症症状, 2012, 22(2): 149-155.
[38] BERTKE M H, SHAUGHNESSY J N, FORSTHOEFEL M K, et al. Prognostic significance of HPV status in postoperative squamous-cell carcinoma of the head and neck[J]. J Commun Support Oncol, 2016, 14(5): 215-220.
[39] Phase Ⅲ trial of radiotherapy plus cetuximab versus chemoradiotherapy in HPV-associated oropharynx cancer. NCT01302834[EB/OL]. https:// clinicaltrials.gov /ct2 / show/NCT01302834.
[40] NRG-HN002: A randomized phase Ⅱ trial for patients with p16 positive, non-smoking associated, locoregionally advanced oropharyngeal cancer. NCT02254278[EB/OL]. http://cancer.osu.edu/cancer-specialties/clinical-trials/fnda-clinical-trial/a-randomized-phase-Ⅱ-trialfor-patientswith-p16.
[41] LOHAUS F, LINGE A, TINHOFER I, et al. HPV16 DNA status is a strong prognosticator of loco-regional control after postoperative radiochemotherapy of locally advanced oropharyngeal carcinoma: Results from a multicentre explorative study of the German Cancer Consortium Radiation Oncology Group (DKTK-ROG)[J]. Radiother Oncol, 2014, 113(3): 317-323.
[42] HEIDUSCHKA G, GRAH A, OBERNDORFER F, et al. Improved survival in HPV/p16-positive oropharyngeal cancer patients treated with postoperative radiotherapy[J]. Strahlenther Onkol, 2015, 191(3): 209-216.
[43] HAUGHEY B H, SINHA P. Prognostic factors and survival unique to surgically treated p16+ oropharyngeal cancer[J]. Laryngoscope, 2012, 122 Suppl 2: S13-S33.
[44] SINHA P, LEWIS J S Jr, PICCIRILLO J F, et al. Extracapsular spread and adjuvant therapy in human papillomavirus-related, p16-positive oropharyngeal carcinoma[J]. Cancer, 2012, 118(14): 3519-3530.
[45] MAXWELL J H, FERRIS R L, GOODING W, et al. Extracapsular spread in head and neck carcinoma: impact of site and human papillomavirus status[J]. Cancer, 2013, 119(18): 3302-3308.
[46] KLOZAR J, KOSLABOVA E, KRATOCHVIL V, et al. Nodal status is not a prognostic factor in patients with HPV-positive oral/oropharyngeal tumors[J]. J Surg Oncol, 2013, 107(6): 625-633.
[47] HINNI M L, ZARKA M A, HOXWORTH J M. Margin mapping in transoral surgery for head and neck cancer[J]. Laryngoscope, 2013, 123(5): 1190-1198.
[48] CHIN R I, SPENCER C R, DE WEES T, et al. Reevaluation of postoperative radiation dose in the management of human papillomavirus-positive oropharyngeal cancer[J]. Head Neck, 2016, 38(11): 1643-1649.
Adjuvant chemoradiotherapy for postoperative head and neck squamous cell carcinoma
LU Xueguan, HU Chaosu (Department of Radiation Oncology, Fudan University Shanghai Caner Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
LU Xueguan E-mail: luxueguan@163.com
Emerging clinical evidence revealed that postoperative adjuvant chemoradiotherapy (CRT) could improve the clinical outcome for resected head and neck squamous cell carcinoma in high-risk patients. The irradiation targets and doses should be determined by the primary tumor site, clinical stage, pathology reports, and the evaluation of postoperative imaging. Adjuvant concurrent CRT with cisplatin is the current standard treatment for high-risk postoperative head and neck squamous cell carcinoma patients. However, the effect of concurrent CRT with other chemotherapeutic agents and (or) epidermal growth factor receptor (EGFR) monoclonal antibody in these patients is inconclusive. Human papillomavirus (HPV)-positive oropharyngeal cancer has the unique biological characteristics, and the indications and treatment models of postoperative adjuvant CRT for these patients are still unclear. Further study is needed.
Head and neck cancer; Squamous cell carcinoma; Radiotherapy; Chemotherapy; Molecular targeted therapy
10.19401/j.cnki.1007-3639.2017.06.011
R739.91
A
1007-3639(2017)06-0463-08
2017-03-25)
陆雪官 E-mail: luxueguan@163.com

