外源水杨酸对NaCl胁迫下紫花苜蓿幼苗生长和生理 特性的影响
逯亚玲, 王灵婧, 王 宁, 邵春来, 李志华
(南京农业大学草业学院,江苏 南京 210095)
盐分是非生物逆境胁迫中影响作物生长的重要环境因子之一[1]。紫花苜蓿(MedicagosativaL.)是多年生优质豆科牧草,随着不断的推广种植,在我国广大地区已成为重要的饲料作物,被认为具有良好的抗旱、抗寒、抗盐碱、固氮等优点[2-10],但其耐盐性不高,不耐强酸或强碱性土壤[11],且不同品种的耐盐能力存在显著差异。水杨酸(salicylic acid,SA)即邻羟基苯甲酸,是一种植物体内普遍存在的简单酚类化合物[12],又是一种内源性激素。研究发现,水杨酸可以影响植物体内多种与逆境代谢相关的生理活动,在植物生长过程中具有生长调节、促进种子萌发、成花诱导等多种生理调节作用;在植物抵抗生物和非生物胁迫反应中,作为重要的信号分子[13],通过促进胁迫下植物的生长速率、调节离子吸收与转运、提高光合作用、增强细胞膜稳定性、促进根系生长等生理过程,从而提高植物对逆境胁迫的耐受能力[14-15]。因此,水杨酸在农牧业生产中具有广阔的应用前景。关于水杨酸调节植物盐胁迫方面的研究已有一些报道,国内外学者对利用水杨酸提高植物耐盐性进行了大量研究,目前,此类研究多见于农作物、蔬菜作物等,发现水杨酸可提高盐胁迫下小麦(TriticumaestivumL.)[16-17]、水稻(Oryza.sativaL.)[18*19]、玉米(ZeamaysL.)[20-21]、花椰菜(BrassicaoleraceaL.var.botrytisL.)[22]、黑麦草(LoliumperenneL.)[23]等植物细胞相对含水量、可溶性糖和可溶性蛋白含量、体内过氧化物酶等细胞保护性酶的活性,降低膜脂过氧化产物丙二酸含量和质膜透性,缓解了盐胁迫对植物生长的抑制,进而增强了这些植物的耐盐性[24],但外源SA缓解盐胁迫对牧草伤害的研究报道尚少,且关于水杨酸对紫花苜蓿耐盐性的调控尚缺乏系统报道。
本研究采用盆栽试验的方法,在南京高温、高湿条件下进行,研究不同浓度水杨酸对NaCl胁迫下苗期紫花苜蓿生长及生理的影响,初步探讨水杨酸对紫花苜蓿耐盐性的影响,旨在为紫花苜蓿耐盐机制的深入研究提供基础数据,筛选出不同NaCl胁迫下有效提高紫花苜蓿耐盐性的适宜水杨酸浓度,并为今后紫花苜蓿应用于江苏沿海滩涂与次生盐渍化土壤改良和利用提供理论参考。
1 材料与方法
1.1 材料与处理
盆栽试验于2016年3至7月在南京农业大学牌楼实验基地(年平均气温为15.4℃,年平均降水量为1 106 mm,年平均湿度为76%,全年无霜期多达300 d)大棚内进行。供试紫花苜蓿品种为‘威斯顿’(购于百绿集团)。选取饱满、健康的种子,播种于装有5 kg河沙和50 g有机肥,并混合均匀的盆钵中(规格为20 cm×16 cm×20 cm(上径×下径×高)),为防止基质外流,盆底铺有两层纱布1层滤纸,每盆播种100粒,3叶龄间苗,每盆定苗30株,在幼苗生长期间常规水肥管理。
试验采用裂区设计,以NaCl处理为主区,SA处理为副区,共设有20个处理,每个处理4次重复,试验共80盆。在植株长到6片真叶时,用0,0.5,1.5,2.5 mmol·L-1SA每天均匀喷施叶片正、反面,每盆喷施50 mL(所有叶片湿润),连续喷施3 d,为防止光照造成较大的蒸发损失,选择傍晚或清晨进行喷施;SA处理后进行NaCl处理,用分析纯NaCl分别配制成0.0%,0.3%,0.6%,0.9%,1.2%这5种盐处理溶液,0.0%为蒸馏水对照。把同一NaCl浓度处理的4个盆钵放入同一周转箱中培养,每个周转箱中加入6 L的1/2 Hoagland营养液,将各浓度所需的NaCl溶解于营养液中。为了避免盐冲击效应(避免植物产生应激反应),各浓度处理以每天50 mmol·L-1浓度递增,记录液面高度,每日早晚观察并补营养液保持液面高度,保持盐浓度不变。处理第14 d取样测定各项指标,每盆取5个重复。
1.2 测定指标与方法
1.2.1生长指标的测定 株高、茎粗、分枝数测定采用常规法。用直尺测量株高,即从地面到主茎叶尖的拉直长度;用游标卡尺测定茎粗,即植株主茎基部的茎粗;一级分枝数即植株主茎长出的分枝数。
1.2.2生理生化指标的测定 处理后第14 d取样,用于各指标测定。采用饱和称重法[25]测定叶片相对含水量,从采集的新鲜叶片中随机选取10片,称其鲜重,然后用适当大小的滤纸将其包好浸泡在蒸馏水中静置24 h,取出擦干称其饱和鲜重,再将其装入小信封中,放入烘箱105℃杀青30 min,然后将烘箱温度调至80℃烘干至恒重,称其干重,根据公式计算得出结果,叶片相对含水量(%)=(鲜重-干重)/(饱和鲜重-干重)×100%。采用电导仪法[26]测定叶片相对电导率,将待测叶片用去离子水洗净,剪碎称取0.5 g,放入离心管中,同时加入30 mL去离子水,浸泡24 h后测定初始电导率,然后将其沸水浴30 min,冷却后测定电导率,根据计算公式得出结果,相对电导率(%)=(初始电导率-蒸馏水电导率)/(煮沸后电导率-蒸馏水电导率)×100%。超氧化物歧化酶(superoxide dismutase, SOD)活性、过氧化物酶(peroxidase, POD)活性、过氧化氢酶(catalase, CAT)活性和丙二醛(malondialdehyde, MDA)含量的测定均参照张志良等[27]的方法,取样研磨,提取酶液保存于于4℃冰箱内。抗氧化酶指标中的SOD活性采用氮蓝四唑法测定,POD活性采用愈创木酚比色法测定,CAT活性采用过氧化氢法测定;MDA含量采用硫代巴比妥酸比色法测定。
1.3 数据分析
利用软件Microsoft Excel 2003进行简单的数据整理及图表制作,采用软件SPSS 20.0进行双因素方差分析、Duncan多重比较及交互效应分析(P=0.05)。
2 结果与分析
2.1 水杨酸对NaCl胁迫下紫花苜蓿生长的影响
2.1.1株高 紫花苜蓿幼苗株高在NaCl胁迫下降低,水杨酸对NaCl胁迫下紫花苜蓿株高产生明显的影响(表1)。在同一SA浓度下(包括对照S 0.0),除S 0.5之外,随着NaCl浓度增加整体呈先增加后降低的趋势,浓度为0.3%时,株高显著增加,0.6%~1.2%范围内株高逐渐下降。S 0.5水平,4个NaCl处理均使紫花苜蓿株高显著下降,低于对照N 0.0,N 0.3和N 0.6间无显著差异,但两者均显著高于N 0.9和N 1.2;在对照S 0.0、S 1.5和S 2.5水平,N 0.3处理下紫花苜蓿株高显著高于对照N 0.0及其他3个NaCl处理;在对照S 0.0水平,N 0.6和N 0.9与对照N 0.0相比对紫花苜蓿株高影响差异不显著,但N 1.2处理下的株高显著低于对照N 0.0及其他3个NaCl处理;在S 1.5和S 2.5水平,株高变化趋势一致,N 0.3处理下的株高显著高于对照N 0.0、N 0.6、N 0.9和N 1.2,后3者无显著差异,其中N 0.6显著高于对照N 0.0。在同一NaCl浓度条件下,比较不同SA处理下紫花苜蓿的株高,在N 0.0水平,S 0.5与对照S 0.0相比使紫花苜蓿株高明显提高,其他2个SA处理与对照S 0.0相比差异不显著;N 0.3水平,SA处理组与对照S 0.0无显著差异;N 0.6水平,S 0.5和S 1.5与对照S 0.0相比差异显著,分别比对照S 0.0提高6.9%和2.9%,S 2.5与对照S 0.0相比差异不显著;N 0.9水平,与对照S 0.0相比,S 0.5、S 1.5和S 2.5分别显著提高7.1%、5.7%和4.4%;N 1.2水平,S 0.5、S 1.5和S 2.5分别比对照显著提高3.6%、8.9%和6.0%。可见,0.6%、0.9%和1.2%NaCl胁迫下,SA浓度在S 0.5和S 1.5水平时,可有效缓解紫花苜蓿株高的下降。
对主区和副区交互作用的方差分析发现,NaCl水平和S A浓度两因素对紫花苜蓿株高的影响显著(P<0.05),但两因素间影响株高的互作效应并不显著。
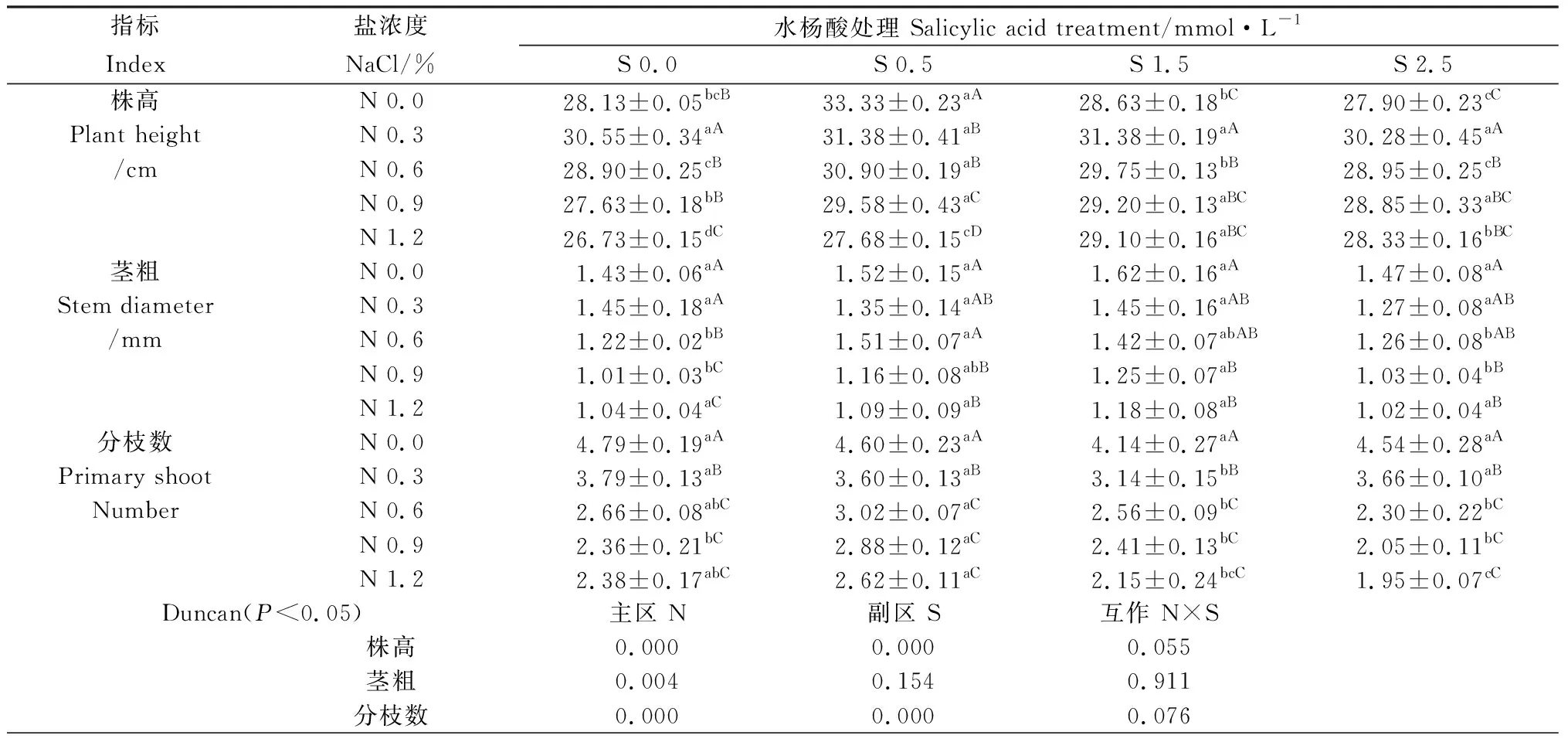
表1 水杨酸对NaCl胁迫下紫花苜蓿苗期生长的影响Table 1 Effects of SA on the growth of alfalfa seedlings under NaCl stress
注:同行不同小写字母表示同一盐浓度水平下不同水杨酸处理间差异显著(P<0.05),同列中不同大写字母表示同一水杨酸处理下不同盐浓度间差异显著(P<0.05);N,NaCl效应;S,水杨酸效应;N×S,NaCl和SA的互作效应,下同
Note: Different lowercase letters in the same row indicate significant difference among different SA treatments under the same salt concentration at the 0.05 level, different capital letters in same column indicate significant difference among different salt concentration under the same SA treatment at the 0.05 level; N, the NaCl effects; S, the salicylic acid effects; N×S, the interaction effects between NaCl and SA, the same as below
2.1.2茎粗 NaCl胁迫使紫花苜蓿茎粗下降,在同一SA浓度下(包括对照S 0.0),茎粗随着NaCl浓度的增加,整体呈现逐渐降低的趋势(表1)。在对照S 0.0水平,N 0.3处理与对照N 0.0相比对紫花苜蓿茎粗影响不显著,其他3个NaCl处理均使茎粗显著下降,N 0.6显著高于N 0.9和N 1.2,后2者无显著差异;在S 0.5、S 1.5和S 2.5水平,N 0.3和N 0.6处理下的株高与对照N 0.0相比差异不显著,而N 0.9和N 1.2处理下茎粗显著下降,低于对照N 0.0。同一NaCl浓度条件下,在对照N 0.0、N 0.3和N 1.2水平,SA处理组与对照S 0.0无显著差异;N 0.6水平,S 0.5比对照S 0.0显著提高23.8%;N 0.9水平,与对照S 0.0相比,S 1.5显著提高23.8%。可见,在0.6%、0.9%NaCl胁迫下,SA浓度在S 0.5和S 1.5水平时,与对照S 0.0相比,能够较大幅度的提高紫花苜蓿的茎粗。
经方差分析可知,NaCl水平对紫花苜蓿茎粗影响显著(P<0.05),但NaCl和SA两因素间互作效应影响不显著。
2.1.3分枝数 NaCl胁迫使紫花苜蓿分枝数减少,在同一SA浓度下(包括对照S 0.0),分枝数随着NaCl浓度的增加整体呈逐渐减少的趋势(表1)。同一SA水平,不同浓度NaCl处理紫花苜蓿分枝数变化趋势一致,NaCl处理组下的分枝数均显著低于对照N 0.0,其中N 0.3处理下的分枝数显著高于N 0.6、N 0.9和N 1.2,后3者差异不显著。同一NaCl浓度条件下,在对照N 0.0水平,SA处理组与对照S 0.0无显著差异;N 0.6水平,S 0.5与对照S 0.0无显著差异,2者均显著高于S 1.5和S 2.5;N 0.9水平,S 0.5处理紫花苜蓿分枝数显著高于对照S 0.0及其他2个SA处理,比对照S 0.0显著提高22.0%;N 1.2水平,S 0.5与对照S 0.0无显著差异,但显著高于S 1.5和S 2.5。可见,在0.6%、0.9%和1.2%N aCl胁迫下,SA在S 0.5水平时,可有效缓解NaCl胁迫对紫花苜蓿分枝数的影响。
方差分析可知,NaCl和SA处理两因素对紫花苜蓿分枝数影响显著(P<0.05),但两者的互作效应不显著。
2.2 水杨酸对NaCl胁迫下紫花苜蓿生理指标的影响
2.2.1叶片相对含水量 在NaCl胁迫下紫花苜蓿的叶片相对含水量减少,且在同一SA浓度下(包括对照S 0.0),除S 1.5水平外,相对含水量随NaCl浓度的增加呈下降趋势(图1)。对照S 0.0水平下,N 0.3处理紫花苜蓿叶片相对含水量与对照N 0.0无显著差异,其他3个NaCl处理使叶片相对含水量显著下降,低于对照;S 0.5和S 2.5水平下叶片相对含水量随NaCl浓度变化的趋势与对照S 0.0相同;在S 1.5水平下,N 0.3显著高于对照N 0.0及其他3个NaCl处理,N 0.6与对照N 0.0无显著差异,2者均显著高于N 0.9和N 1.2。比较同一浓度NaCl不同浓度SA下紫花苜蓿叶片相对含水量发现,在对照N 0.0、N 0.6和N 1.2水平下,SA处理组与对照S 0.0无显著差异;N 0.3水平下,S 1.5处理紫花苜蓿叶片相对含水量显著高于对照S 0.0,提高5.1%;N 0.9水平,S 1.5与对照S 0.0相比,显著提高10.2%。可见,在0.3%、0.9%NaCl胁迫下,SA浓度在S 0.5和S 1.5水平时,能够有效缓解紫花苜蓿叶片相对含水量的下降。
经方差分析可知,NaCl水平和SA浓度两因素对紫花苜蓿叶片相对含水量影响显著(P<0.05),但两者的互作效应不显著。
2.2.2相对电导率 同一SA浓度下(包括对照S 0.0),紫花苜蓿叶片相对电导率随着NaCl浓度的增加,整体呈逐渐增加的趋势(图2),浓度为0.6%、0.9%和1.2%时,相对电导率与对照相比均显著增大。在对照S 0.0水平,N 0.6、N 0.9和N 1.2处理使叶片相对电导率均显著高于对照N 0.0和N 0.3,且均在N 0.9、N 1.2处理时达到最大,其他3个SA水平下叶片相对电导率的变化趋势与对照S 0.0相同。同一NaCl浓度水平,比较不同SA处理下紫花苜蓿叶片相对电导率发现,在N 0.3和N 0.6水平下,SA处理组与对照S 0.0无显著差异;在对照N 0.0水平,S 0.5、S 2.5与对照S 0.0无显著差异,S 1.5显著高于对照S 0.0、S 0.5和S 2.5;N 0.9水平下,与对照S 0.0相比,S 0.5显著降低11.6%,S 1.5和S 2.5与对照S 0.0无显著差异;N 1.2水平下,S 0.5和S 1.5与对照S 0.0无显著差异,S 2.5显著高于对照S 0.0和S 0.5。可见,紫花苜蓿叶片相对电导率对高浓度NaCl处理较敏感,SA浓度为0.5%时,能有效缓解NaCl胁迫下紫花苜蓿叶片相对电导率的增大。
方差分析结果显示,NaCl水平和SA浓度两因素对紫花苜蓿叶片相对电导率影响显著(P<0.05),但两者的互作效应不显著。
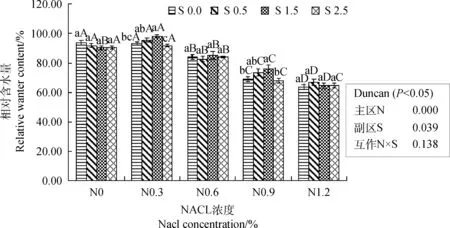
图1 水杨酸对NaCl胁迫下紫花苜蓿苗期相对含水量的影响Fig.1 Effects of SA on relative water contents of alfalfa seedlings under NaCl stress注:不同小写字母表示同一盐浓度水平下不同水杨酸处理间差异显著(P<0.05),不同大写字母 表示同一水杨酸处理下不同盐浓度间差异显著(P<0.05); N,NaCl效应;S,水杨酸效应;N×S,NaCl和SA的互作效应,下同Note: Different lowercase letters indicate significant difference among different SA treatments under the same salt concentration at the 0.05 level, different capital letters indicate significant difference among different salt concentrations under the same SA treatment at the 0.05 level; N, the NaCl effects; S, the salicylic acid effects; N×S, the interaction effects between NaCl and SA, the same as below

图2 水杨酸对NaCl胁迫下紫花苜蓿苗期相对电导率的影响Fig.2 Effects of SA on electrolyte leakage of alfalfa seedlings under NaCl stress
2.2.3丙二醛含量 MDA是细胞膜遭到破坏,发生膜脂过氧化时的主要产物之一。同一SA浓度下(包括对照S 0.0),叶片中MDA含量随NaCl浓度的增加,整体呈逐渐增加的趋势(图3),在N 0.9、N 1.2处理时丙二醛含量达到最大值,显著高于对照N 0.0及其他2个NaCl处理,N 0.6显著高于对照N 0.0和N 0.3;分别在对照S 0.0、S 0.5和S 1.5水平下,N 0.3与对照N 0.0无显著差异;S 2.5水平,4个NaCl处理使紫花苜蓿丙二醛含量显著高于对照N 0.0。比较同一NaCl浓度水平下不同SA处理紫花苜蓿丙二醛的含量发现,在对照N 0.0、N 0.9和N 1.2水平下,SA处理组与对照S 0.0无显著差异;N 0.6水平下,与对照相比,S 0.5和S 1.5分别比对照S 0.0显著降低20.8%和20.0%。可见,在0.6%NaCl胁迫下,SA浓度在S 0.5和S 1.5水平时,能够有效缓解紫花苜蓿叶片MDA含量的增加。
对主区和副区交互作用的方差分析发现,NaCl水平对紫花苜蓿MDA含量的影响显著(P<0.05),且NaCl和SA两因素对MDA含量的互作效应影响显著(P<0.05)。

图3 杨酸对NaCl胁迫下紫花苜蓿丙二醛含量的影响Fig.3 Effects of SA on MDA contents of alfalfa seedlings under NaCl stress
2.3 水杨酸对NaCl胁迫下紫花苜蓿抗氧化酶活性的影响
2.3.1SOD活性 在NaCl胁迫下,叶片的SOD活性增强,同一SA水平下(包括对照S 0.0),随着NaCl浓度的增加,SOD活性整体呈先升高后降低的趋势(表2),浓度为NaCL浓度为0.6%时活性最强,在0.9%和1.2%时开始下降。各个SA水平下,N 0.3处理与对照N 0.0无显著差异;在对照S 0.0、S 0.5和S 01.5水平下,N 0.6处理紫花苜蓿使SOD活性显著高于对照N 0.0,N 0.9和N 1.2较对照显著下降;在S 2.5水平,NaCl处理组与对照N 0.0无显著差异。比较同一浓度NaCl条件下不同浓度SA对紫花苜蓿SOD活性的影响发现,对照N 0.0、N 0.3、N 0.6水平下,SA处理组与对照S 0.0相比差异不显著;N 0.3,N 0.6水平下,S 2.5显著低于对照S 0.0;N 0.9水平下,S 0.5和S 1.5使SOD活性分别比对照S 0.0显著提高18.3%和17.4%;N 1.2水平下,分别比对照S 0.0显著提高18.2%和17.3%。可见,适宜的SA浓度,能够提高NaCl胁迫下紫花苜蓿体内SOD活性。
方差分析结果显示,NaCl水平和SA浓度两因素对紫花苜蓿叶片SOD活性的影响显著(P<0.05),但两者的互作效应不显著。
2.3.2POD活性 NaCl胁迫下叶片POD活性增强,同一SA水平下(包括对照S 0.0),POD活性随着NaCl浓度的增加整体呈逐渐升高的趋势(表2),均在N 1.2和N 0.9处理时达到最大值,显著高于对照N 0.0及其他2个NaCl处理,N 0.3与对照N 0.0无显著差异,N 0.6显著高于对照N 0.0和N 0.3。同一NaCl浓度水平下,不同SA处理对POD活性的影响不同,对照N 0.0、N 0.3水平下,SA处理组与对照S 0.0无显著差异;N 0.6水平下,S 1.5与对照S 0.0相比,使POD活性显著提高14.6%;N 0.9水平下,S 0.5和S 1.5均显著高于对照S 0.0,分别提高27.8%和32.6%;N 1.2水平下,S 0.5和S 1.5均使紫花苜蓿POD活性显著提高,分别比对照S 0.0高27.2%和34.1%。可见,在0.6%、0.9%和1.2%NaCl胁迫下,SA浓度在S 0.5和S 1.5水平时,能显著提高紫花苜蓿体内POD活性。
经方差分析可知,NaCl水平和SA浓度两因素对紫花苜蓿叶片POD活性的影响显著(P<0.05),且两者对POD活性互作效应影响显著(P<0.05)。
2.3.3CAT活性 同一SA浓度下(包括对照S0.0),随NaCl浓度的增加,叶片CAT活性变化趋势与POD相同,均呈逐渐增加的趋势(表2)。对照S 0.0和其他3个SA水平下,N 0.6、N 0.9和N 1.2处理使紫花苜蓿CAT活性均显著高于对照N 0.0与N 0.3,N 0.3与对照N 0.0差异不显著。同一NaCl浓度水平下,不同SA处理对紫花苜蓿CAT活性影响不同,对照N 0.0、N 0.3水平下,SA处理组与对照S 0.0相比差异不显著;N 0.6水平下,S 0.5、S 1.5和S 2.5分别使CAT活性比对照S 0.0显著提高29.9%、22.0%和18.9%;N 0.9水平下,S 0.5和S 1.5与对照S 0.0相比分别显著提高32.9%和26.3%;N 1.2水平下,分别比对照S 0.0显著提高32.5%和27.3%。由分析可见,不同NaCl浓度胁迫下,适宜浓度的SA可显著提高紫花苜蓿SOD、POD和CAT活性。

表2 水杨酸对NaCl胁迫下紫花苜蓿抗氧化酶活性的影响Table 2 Effects of SA on antioxidant enzyme activities of alfalfa seedlings under NaCl stress
对NaCl水平和SA浓度两因素之间交互作用的方差分析发现,两者对紫花苜蓿CAT活性的影响显著(P<0.05),但两因素对CAT活性的互作效应影响不显著。
3 讨论
植物长期生活在盐环境时,盐环境常诱导其形态、结构发生变化。有研究显示,在不同的发育时期植物的耐盐性不同,通常认为植物体在萌发及幼苗期耐盐性最差[28]。因此国内外对植物耐盐性的研究主要集中在萌发期和幼苗期。SA作为植物体内普遍存在的一种小分子酚类化合物,逆境胁迫下能够在一定程度上刺激并提高植物的抗逆性[29]。
3.1 水杨酸对NaCl下紫花苜蓿苗期生长特性的影响
抑制植物的生长发育是盐分胁迫对植物最普遍和最显著的效应[30]。本研究中,紫花苜蓿的株高、茎粗、分枝数随着盐浓度的增加均逐渐下降,在0.9%和1.2%NaCl胁迫下,外源施用0.5 mmol·L-1和1.5 mmol·L-1SA可有效有效缓解盐胁迫对紫花苜蓿株高、茎粗和分枝数的影响,与周万海等[31]关于外源SA对苜蓿幼苗盐胁迫的缓解效应研究结果相一致,与徐芬芬等[32]用0.5~1.5 mmol·L-1的SA喷洒小白菜(BrassicachinensisL.)幼苗的叶面,显著提高了小白菜幼苗在盐胁迫下的株高的研究结果一致。可见,喷施适宜浓度的SA可以缓解盐胁迫对紫花苜蓿生长的抑制作用。
3.2 盐胁迫下水杨酸对紫花苜蓿苗期叶片相对含水量、细胞膜稳定性的影响
植物组织相对含水量通常用来表示逆境胁迫下植物体内水分亏缺程度,且在一定程度上反映植物细胞活力[33]。当植物处于盐胁迫状态时,盐生境会对植物产生生理伤害,导致其吸水困难,使植物组织含水量降低,导致活性氧自由基迅速积累,发生膜质过氧化,MDA积累增加[34],从而使膜系统遭到破坏,膜透性增加,电解质外渗,引起组织相对电导率升高[35]。本研究中,在0.3%和0.9%盐浓度胁迫下,外施0.5 mol·L-1和1.5 mmol·L-1SA时,能够有效的提高紫花苜蓿叶片的相对含水量,与周旋等[36]发现盐胁迫下茶树对外源水杨酸的生理响应,1.0 mmol·L-1SA处理时,能够明显增加盐胁迫下茶苗的叶片相对含水量,并降低叶片水分饱和亏,使茶苗水分状况得以改善,从而增强了茶苗的耐盐性的研究结果相一致。本研究中,在0.3%和0.6%盐浓度胁迫下,外施0.5 mmol·L-1和1.5 mmol·L-1SA显著降低盐胁迫下MDA含量,但在高浓度2.5 mmol·L-1SA处理时,反而加剧了MDA的积累,与黄玉梅等[37]研究水杨酸对盐胁迫下百日草(Zinniaelegans)种子萌发及幼苗生理特性的影响,发现低浓度的SA处理随时间增加会对MDA含量的增加表现出一定的缓解效应,浓度为1.0和1.5 mmol·L-1时缓解效果最好,而SA浓度为2.0 mmol·L-1时反而表现出一定的胁迫效应的研究结果相一致。王玉萍等[23]的研究也发现,SA对花椰菜(BrassicaoleraceaL)幼苗盐胁迫的缓解作用与浓度有关,0.5~1.5 mmol·L-1的低浓度对MDA含量的增加缓解作用明显,超过1.5 mmol·L-1的SA对盐胁迫的缓解作用降低,甚至加剧胁迫。本研究中,在0.9%和1.2%盐浓度胁迫下,0.5 mmol·L-1SA能有效缓解紫花苜蓿叶片相对电导率的增大,与朱伟等[38]研究水杨酸对NaCl胁迫下抗虫棉幼苗生长和生理特性的影响,发现在较高盐质量分数60~90 g·kg-1NaCl下,0.2~0.6 mmol·L-1浓度SA处理时,相对电导率显著降低,能够在一定程度上解除盐分对棉花细胞膜的伤害,降低细胞膜通透性的研究结果一致。
3.3 水杨酸对NaCl胁迫下紫花苜蓿抗氧化酶活性的影响
植物在正常生长状况下,组织细胞中的自由基含量保持在对植物无害的水平,即机体自由基的产生和清除处于动态平衡状态,而当植物受到逆境胁迫时,平衡遭到破坏,自由基含量不断积累,使膜结构与功能遭到破坏,从而影响植物的正常生长。SOD、POD和CAT等作为抗氧化酶系统中主要的抗氧化酶,在保护植物体免受活性氧自由基伤害方面起着至关重要的作用。SOD作为植物抗氧化的第一道防御,植物遭受盐胁迫时,催化两个超氧自由基发生歧化反应生成O2和H2O2,再由POD和CAT将H2O2分解成无害的H2O,从而避免因自由基积累对植物造成氧化损伤[39]。本研究中,SOD活性随盐浓度的增加呈先升后降的变化趋势,盐浓度为0.6%时活性达到最大,而0.9%和1.2%时又开始下降,这与徐芬芬等[40]在研究外源水杨酸对盐胁迫下水稻(Oryza.sativaL.)幼苗生长的影响中,叶片保护酶活性的变化相一致,这种变化可能是植物在盐胁迫初期,通过提高SOD活性以适应盐分胁迫作出的反应,而随着盐胁迫程度的增强,植物体内SOD产生机制受到破坏或受阻,致使SOD活性下降。本试验发现,盐浓度在0.9%和1.2%条件下,0.5 mmol·L-1和1.5 mmol·L-1SA处理显著提高了SOD活性,这与王俊斌等[41]研究发现,0.50 mmol·L-1SA在盐胁迫下可增强SOD活性,有效降低盐胁迫下水稻萌发过程中积累的过量H2O2的研究结果一致,且与朱伟等[42]研究SA对盐胁迫下棉花种子萌发和幼苗生长的影响中发现,0.9%NaCl胁迫下,0.2~0.5 mmol·L-1对SOD活性有显著增强的效果相一致。本研究中,POD、CAT活性变化基本相似,但与SOD活性变化不同步,存在一定差异,这与宿越等[43]在研究外源水杨酸对NaCl胁迫下番茄(LycopersiconesculentumMill.)幼苗保护酶活性的影响中的结果相一致,对这三种酶的分析结果相一致。本研究发现,在0.9%和1.2%盐浓度胁迫下,POD、CAT活性随SA浓度的增加先增强后下降,0.5和1.5 mmol·L-1SA处理对POD、CAT酶活性的增强效果显著,与曾长立等[44]在外源SA对辣椒(CapsicumfrutescensL.)幼苗盐害的生理效应的研究中的结果相似,即在盐胁迫下喷施50 mg·L-1的SA并没有显著提高POD活性,当增加到100 mg·L-1以上时,则可显著提高POD活性,外源SA可显著提高盐胁迫下辣椒幼苗叶片中SOD、POD和CAT保护酶活性,但其作用效果存在差异。可见,适宜浓度的外源SA可有效提高盐分胁迫下紫花苜蓿的抗氧化酶活性,增强清除活性氧能力,对稳定细胞膜起到一定的作用。对NACl处理和SA处理间的互作效应进行分析发现,NaCl处理显著影响本研究中各项生理生化指标;同一NaCl浓度下,SA处理对除茎粗和MDA之外的各项指标影响显著;在对丙二醛和POD酶活性的影响中,NaCl水平与SA浓度之间的互作效应显著;而对其它生长生理指标,两因素的互作效应并不显著。表明NaCl胁迫下,SA对茎粗和MDA含量的影响可能是NaCl与SA发生互作产生的影响,而不是SA单独作用的结果。
4 结论
综上所述,0.6%、0.9%和1.2%浓度NaCl胁迫对紫花苜蓿生长及生理特性影响显著,外源喷施0.5、1.5 mmol·L-1SA不仅可以缓解盐胁迫对紫花苜蓿株高和茎粗的抑制作用,增加盐胁迫下紫花苜蓿相对含水量,降低相对电导率;还可提高细胞保护酶活性,减少膜脂过氧化产物MDA的积累,有利于减小盐分胁迫对紫花苜蓿造成的膜损伤。由此可见,适宜浓度的外源SA可显著促进盐胁迫下紫花苜蓿的生长和发育,在NaCl胁迫过程中参与紫花苜蓿体内抗氧化酶系统的调控,缓解胁迫对细胞结构的破坏,提高其对NaCl胁迫的耐受性,减轻盐胁迫对其生长生理的损伤。若今后将SA运用到紫花苜蓿的实际生产中,遭受盐分胁迫时可考虑选择0.5~1.5 mmol·L-1浓度的SA喷施,以降低盐害对生产造成的损失。

